Фармакология и терапевтическое применение современных препаратов для сахарного диабета 2-го типа.

Аннотация
Сахарный диабет 2 типа (СД2) — глобальная эпидемия, представляющая серьезную проблему для здравоохранения. Улучшение метаболического контроля для достижения нормальной гликемии (если возможно) является очень эффективной стратегией в долгосрочном прогнозе и оправдывает раннее, эффективное, устойчивое и безопасное вмешательство. Достижения в понимании сложного патогенеза СД2 давали основу для развития методов cнижения уровня глюкозы с дополнительными механизмами действия, которые расширили возможности терапии и способствовали индивидуализации стратегии лечения. За последнее десятилетие было лицензировано несколько новых классов гипогликемических препаратов, включая агонисты рецепторов глюкагоноподобного пептида-1 (аГПП-1), ингибиторы дипептидилпептидазы-4 (ДПП-4) и ингибиторы котранспортера натрия/глюкозы-2 (SGLT2). Эти лекарственные средства можно использовать индивидуально или в комбинации с хорошо устоявшимся препаратами, такими как бигуаниды, производные сульфонилмочевины и тиазолидиндионы. Несмотря на то, что новые агенты обладают потенциальными преимуществами, включая низкий риск гипогликемии и помощь в контроле веса, их долгосрочная безопасность еще не установлена. В этом обзоре мы оцениваем фармакокинетику, фармакодинамику и профили безопасности (в том числе для сердечно-сосудистой системы) доступных в настоящее время препаратов для лечения гипергликемии у пациентов с СД2 в контексте патогенеза заболевания. Кроме того, мы кратко описываем алгоритмы лечения пациентов с СД2 и направления развития будущих видов терапии.
Ключевые моменты
- Более глубокое понимание сложного и многофакторного патогенеза СД2 позволило разработать несколько новых классов гипогликемических препаратов
- Метформин остается препаратом первой линии для пациентов с СД2, тогда как использование других хорошо известных агентов, таких как производные сульфонилмочевины, меглитиниды, пиоглитазон и ингибиторы α-глюкозидазы сильно зависит от региона
- Препараты, повышающие активность инкретина (ингибиторы ДПП-4), усиливающие активность эндогенного ГПП-1 (аГПП-1) или увеличивающие выведение глюкозы с мочой (ингибиторы SGLT2), имеют низкий риск гипогликемии и могут помочь в контроле веса
- При лечении СД2 может потребоваться использование двух или трех препаратов с различными режимами действия, а терапия инсулином необходима, если другие препараты не могут поддерживать адекватный гликемический контроль
- Гликемические мишени и выбор препаратов, снижающих уровень глюкозы, должны подбираться под потребности и обстоятельства пациентов индивидуально, чему могут способствовать будущие разработки фармакогеномики
- Хотя баланс пользы и рисков для разных препаратов варьирует между отдельными пациентами, ранний, эффективный и продолжительный гликемический контроль задерживает начало и снижает тяжесть связанных с гипергликемией осложнений
СД2 представляет собой глобальную эпидемию с предполагаемой распространенностью в 415 миллионов человек на 2015 год, которая, согласно прогнозам, возрастет до 642 миллионов человек к 2040 году (источник 1). СД2 за счет большого медицинского, экономического и социального значения [1-3], представляет собой серьезную проблему для системы здравоохранения во всем мире.
СД2 является сложным эндокринным и метаболическим заболеванием, в котором взаимодействие между генетическими и средовыми факторами создает гетерогенную и прогрессирующую патологию с различной степенью резистентности к инсулину и дисфункцией β-клеток и α-клеток поджелудочной железы, а также других эндокринных нарушений (Рис. 1) [4–14]. Инсулинорезистентность возникает из-за нарушения работы сигнальных путей на уровне рецептора инсулина и ниже. СД2 возникает, когда β-клетки больше не могут выделять достаточное количество инсулина для преодоления резистентности к инсулину [4,15–17]. Избыточный вес и ожирение являются основными факторами риска развития резистентности к инсулину [4, 5, 16, 18–20].
Гипергликемия является основной биохимической особенностью СД2, вызывающей окислительный и нитрозативный стресс, активацию воспалительных путей и эндотелиальную дисфункцию, а также вызывает микрососудистые осложнения и способствует сосудистым заболеваниям, являющимися основными причинами заболеваемости и смертности [21]. Результаты нескольких рандомизированных контролируемых исследований (РКИ) продемонстрировали краткосрочные и долгосрочные преимущества улучшения гликемического контроля в замедлении наступления и снижении тяжести осложнений диабета, в частности ретинопатии, нефропатии, нейропатии и сердечно-сосудистых заболеваний, а также смертности [22-25]. Достижение нормального (или почти нормального) уровня глюкозы в крови является основной целью лечения СД2. Для реализации этой цели доступны несколько стратегий: изменение образа жизни, включая изменение рациона питания, снижение веса и физическая активность, которые, к слову, остаются краеугольными камнями терапии, но из-за прогрессивного характера СД2 и трудности сохранения изменений образа жизни в долгосрочной перспективе большинство пациентов требуют пероральных методов лечения и (в конечном счете) инъекционных методов лечения [26].
В течение более чем четырех десятилетий были доступны только два класса пероральных препаратов для снижения уровня глюкозы: бигуаниды и производные сульфонилмочевины. Но за последние 20 лет было введено много вариантов лечения (Таб. 1) [26, 27]. В этом обзоре мы предлагаем оценку различных методов лечения гипергликемии у пациентов с СД2.
Гликемический контроль и цели в терапии СД2
Потребности в лечении и ответ на терапию сильно варьируются у пациентов с СД2, что отражает сложность и изменчивость патогенного процесса [28, 29], поэтому для каждого пациента решение должно осуществляться индивидуально, в зависимости от выбранной терапии и целевых значений уровня глюкозы. Рассматриваемые факторы включают возраст пациента, вес, продолжительность СД2, риск гипогликемии, риск сердечно-сосудистых заболеваний, сопутствующую терапию, наличие осложнений и сопутствующие заболевания в анамнезе. Другие аспекты, которые сложнее оценить в клинической практике, включают резервные возможности секреции инсулина, генетические факторы, которые могут влиять на терапевтическую реакцию, риск развития будущих осложнений и скорость прогрессирования заболевания [30].
Хорошо известны долгосрочные преимущества интенсивного гликемического контроля в вопросе снижения риска осложнений и смертности, особенно когда он производится сразу после диагностики у молодых пациентов без сопутствующих осложнений [22-25]. Однако интенсивность гликемического контроля не лишена рисков, таких как гипогликемия, увеличение веса и возможные сердечно-сосудистые осложнения и смертность у пациентов с высоким риском. Эти риски могут частично определять выбор медикаментов [22, 31-36], поэтому предпочтительным является индивидуальный подбор терапии [36]. Трудность заключается в идентификации пациентов, у которых риски, связанные с интенсивным гликемическим контролем, перевешивают преимущества. Строгий гликемический контроль не рекомендуется пожилым пациентам или пациентам с большой продолжительностью СД2 или с сердечно-сосудистыми заболеваниями [27, 36]. В руководствах обычно указывается целевой показатель HbA1c=7%, но для молодых пациентов с СД2 и без осложнений может быть подходящим более низкое целевое значение, а более высокое — разумным для пожилых или тяжелых пациентов с длительным течением и осложнениями.
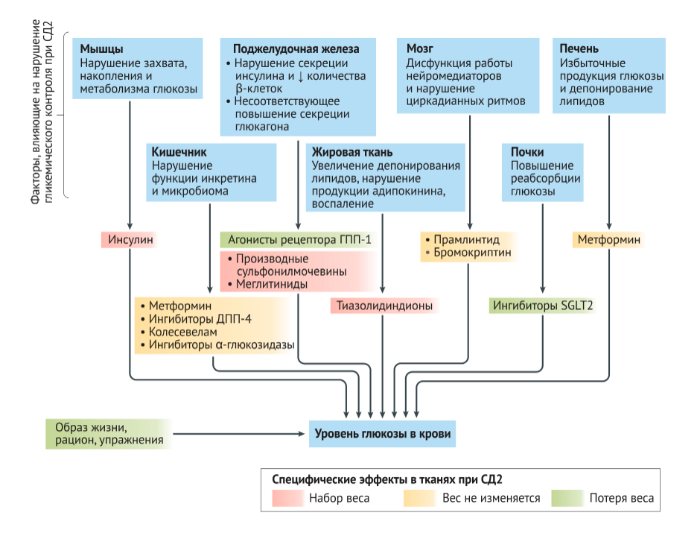
ДПП-4 — дипептидилпептидаза 4; SGLT2 — ингибиторы котранспортера натрия/глюкозы-2
Таблицы
Все таблицы переведены в PDF и откроются в новом окне.
Таблица 1 . Краткое описание доступных на данный момент гипогликемических препаратов для пациентов с СД2.
Таблица 2. Прямые сравнительные исследования с аГПП-1
Бигуаниды
Единственным бигуанидом, используемым в клинической практике, является метформин (диметилбигуанид) [37]. Другие — фенформин и буформин — были изъяты из-за риска лактацидоза [38]. Бигуаниды были получены из богатой гуанидином травы Galega officinalis (Козлятник лекарственный), которая использовалась в традиционной европейской медицине [37, 39]. Метформин был введен в клиническую практику в Европе в 1957 году и в 1995 году в США и стал самым назначаемым препаратом для лечения СД2 во всем мире [37, 39].
Механизм действия
Метформин поступает в клетки главным образом через транспортер органических катионов 1 (SLC22A1 или hOCT1) и оказывает множественные, независимые от инсулина эффекты, в зависимости от уровня препарата и метаболизма питательных веществ в разных тканях [28, 37, 40-42] (Рис. 2). При приеме препарата кишечник подвергается воздействию высоких концентраций метформина [42], который вмешивается в работу дыхательной цепи митохондрий на уровне комплекса I и тем самым увеличивает использование глюкозы в процессе гликолиза и производстве лактата; часть лактата может быть преобразована обратно в глюкозу в печени [43]. Оборот лактата-глюкозы вызывает потерю энергии, которая может способствовать эффекту нейтральности веса (отсутствие увеличения или потери веса), наблюдающегося у пациентов, получающих метформин [28, 42]. В печени метформин усиливает передачу сигналов инсулина, снижает действие глюкагона и уменьшает глюконеогенез и гликогенолиз [28]. Метформин может ингибировать митохондриальный окислительно-восстановительный челночный фермент глицерин-3-фосфатдегидрогеназу, изменяя редокс-статус гепатоцитов и приводя к снижению отношения АТФ/АМФ, печеночного глюконеогенеза, конверсии лактата и глицерина в глюкозу и активации АМФ-зависимой протеинкиназы (AMPK) [44]. Кроме того, терапия метформином приводит к сдвигу в сторону использования глюкозы относительно жирных кислот в качестве клеточного источника энергии в печени [37]. В мышцах метформин способствует инсулин-опосредствованному захвату глюкозы через транспортер глюкозы-4 (GLUT-4) [28].
Поскольку формы метформина с замедленным высвобождением имеют аналогичную эффективность при более низких дозах по сравнению с «обычными» формами, то, похоже, кишечник является основным местом действия метформина в терапевтических дозах [45]. Метформин может увеличивать уровень глюкагоноподобного пептида-1 (ГПП-1) даже при отсутствии нагрузки глюкозой и у лиц без СД2 [46-50] с помощью механизмов, которые могут включать ингибирование натрий-зависимых транспортеров желчных кислот, увеличивающих доступность желчных кислот для активации G-белок-связанных мембранных рецепторов желчных кислот (известных как TGR5), на энтероэндокринных L-клетках. По сравнению с плацебо метформин снижает активность дипептидилпептидазы 4-(ДПП-4) [46]. Метформин также увеличивает секрецию ГПП-1 в ответ на пероральную нагрузку глюкозой через пути, зависимые от мускариновых (M3) и пептидных рецепторов, высвобождающих гастрин (GRP-R) [47-51]. У мышей метформин стимулирует экспрессию рецептора ГПП-1 (РГПП-1) в β-клетках, опосредованную рецептором, активирующий пролиферацию пероксисом (PPARα) [49]. Влияние метформина на GLP-1 может способствовать его эффекту нейтральности веса и снижению выработки глюкозы в печени путем ингибирования секреции глюкагона [46-48]. Метформин также влияет на циркадный контроль метаболизма глюкозы в печени и мышцах [42]. Индуцированная метформином активация АМФ-зависимой протеинкиназы приводит к фосфорилированию казеинкиназы 1, что приводит к снижению циркадной составляющей mPer2, что увеличивает экспрессию циркадных генов CLOCK и BMAL1 и вызывает фазовый сдвиг в циркадном ритме у получавших метформин грызунов по сравнению с контрольными [52,53]. Результаты исследования с участием мышей показали, что метформин вызывает фазовый сдвиг вперед в печени, но фазовую задержку в мышцах [53], а эффекты метформина на суточный ритм у мышей блокируются выключением гена Prkaa2, кодирующего субъединицу АМФ-зависимой протеинкиназы α2 (источник 52).
Фармакокинетика
Пероральный прием метформина имеет биодоступность 40-60% и период полувыведения из плазмы 4-9 ч. Выделяется без изменений с мочой, главным образом, через канальцевую секрецию, а не посредством клубочковой фильтрации [28, 54]
Фармакодинамика
Метформин широко используется в качестве фармакотерапии первой линии у пациентов с СД2 из-за его эффективности, долговременной безопасности, низкого риска гипогликемии, эффекта нейтрального веса и благоприятного воздействия на сосудистые заболевания [36]. Лечение метформином обычно приводит к снижению уровня глюкозы в плазме натощак (ГПН) на 2-4 ммоль/л и HbA1c на 1-2% независимо от возраста, веса и продолжительности СД2 до тех пор, пока сохраняется остаточная функция β-клеток [28, 39]. В 10-летнем мониторинге, проводившимся в рамках проспективного исследования диабета в Великобритании (UKPDS) у пациентов, получавших метформин, значительно снижался риск любого осложнения, связанного с диабетом, на 21% (P=0,01), смерти от диабета на 30% (P=0,01) и инфаркта миокарда на 33% (P=0,005) по сравнению с пациентами с избыточным весом в группе традиционной терапии [23, 28, 55]. Метформин также может быть связан с уменьшением риска развития рака у пациентов с СД2, особенно рака простаты, поджелудочной железы и молочной железы [28, 42].
Прогрессивный характер СД2 может потребовать дополнительных методов, помимо метформина, снижения уровня глюкозы, включая инсулин [15, 36, 56]. Существует множество готовых комбинаций препаратов, включающих метформин.
Безопасность и побочные эффекты
Основными побочными эффектами лечения метформином являются неприятные ощущения в животе и другие желудочно-кишечные нарушения (диспептические расстройства), включая диарею [37]. При снижении дозы симптомы могут уменьшаться, но около 10% пациентов не могут переносить препарат в любой дозе [37], возможно, из-за вариантов строения hOCT1, которые приводят к повышенной концентрации метформина в кишечнике [57]. Риск непереносимости метформина (определяемой как прекращение приема метформина пациентом в течение первых 6 месяцев лечения) увеличивается за счет одновременного использования препаратов, которые ингибируют активность hOCT1 (включая трициклические антидепрессанты, циталопрам, ингибиторы протонной помпы, верапамил, дилтиазем, доксазозин, спиронолактон, клопидогрел, розиглитазон, хинин, трамадол и кодеин, (ОШ = 1,63, ДИ = 95% 1,22-2,17, P=0,001)), или наличием двух аллелей гена SLC22A1, связанных с уменьшенной функцией hOCT1, (ОШ = 2,41, ДИ = 95% 1,48-3,93, Р<0,001) [57].
Метформин противопоказан пациентам с прогрессирующей хронической болезнью почек (ХБП), с серьезными заболеваниями печени или состояниями, предрасполагающими к гипоксии или уменьшению перфузии тканей. Однако, наблюдательные исследования и исследования баз данных показывают, что некоторые преимущества метформина можно извлечь из его широкого терапевтического индекса [38, 58, 59], и тщательное внимание к дозе позволит использовать его даже у пациентов с сердечно-сосудистыми заболеваниями (включая умеренную или умеренную сердечную недостаточность [38, 60] и хроническую обструктивную болезнь легких [61]). Для обеспечения адекватного выведения необходимы корректировка дозы и мониторинг функции почек, в случае возникновения гипоксемии у пациента, терапию метформином следует прекратить [62, 63].
Результаты UKPDS показали, что, по сравнению с производными сульфонилмочевины и инсулином, у пациентов с ожирением и недавно диагностированным СД2 использование метформина было связано со значительным снижением частоты инфаркта миокарда, инсульта и смертности от других причин (на 39%, 41% и 36% соответственно) [64, 65]. UKPDS показало, что снижение частоты инфаркта миокарда и смертности также сохраняется в течение 10 лет терапии [23]. Последующий анализ баз данных привел подтверждающие доказательства этого эффекта [65]. Повышение уровня использования статинов и препаратов, защищающих почки, затрудняет оценку влияния метформина на сердечно-сосудистые заболевания [65], хотя для оценки этого эффекта на данный момент проводится несколько рандомизированных клинических исследований [65].
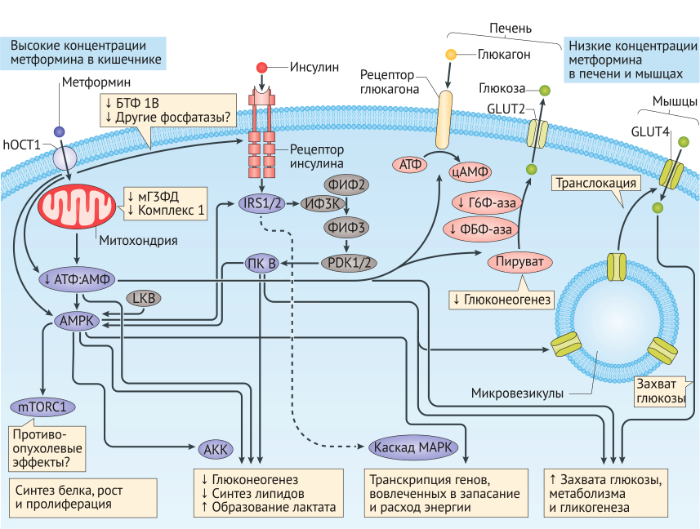
AКК, ацетил-КоА карбоксилаза;ФБФ-аза, фруктозо-1,6-бифосфатаза; Г6Ф-аза, глюкозо-6-фосфатаза; GLUT, изоформы глюкозного транспортера; hOCT1, транспортер органических катионов 1; IRS, субстрат рецептора инсулина; LKB1, серин/треониновая протеинкиназа STK11; MAPK, митоген-активируемая протеинкиназа; mTOR, мишень рапамицина у млекопитающих; PDK, 3-фосфоинозитид-зависимая протеинкиназа; PI3K, фосфатидилинозитол-3-киназа; ФИФ2, фосфатидилинозитол-3,4-бифосфат; ФИФ3, фосфатидилинозитол-3,4,5-трифосфат; ПК B, протеинкиназа B; мГ3ФД, митохондриальная глицерол-3-фосфат дегидрогеназа.
Производные сульфонилмочевины
Производные сульфонилмочевины рассматривались в качестве замены сульфаниламидам после сообщений о том, что последние могут стать причиной развития гипогликемии [37, 66]. Среди производных сульфонилмочевины можно выделить два поколения: к препаратам первого поколения относятся толбутамид и хлорпропамид, второе поколение представляют глибенкламид (глибурид), гликлазид, глипизид и глимепирид [37]; препараты второго поколения более эффективны, что позволяет достичь терапевтического эффекта при меньших дозах.
Механизм действия
Производные сульфонилмочевины воздействуют непосредственно на β-клетки поджелудочной железы, связываясь с цитозольным участком АТФ-связанной кассеты белка 8 подсемейства С (также данный белок известен как рецептор сульфонилмочевины типа 1 (SUR1)), который является частью АТФ-чувствительного калиевого канала Kir6.2 [37, 67]. Связывание рецептора приводит к закрытию данного канала, задержке оттока ионов калия и деполяризации плазматической мембраны. В результате открываются локальные потенциал-зависимые кальциевые каналы, повышающийся входящий ток ионов кальция активирует кальций-зависимые сигнальные белки, приводя к экзоцитозу инсулина. Исследования in vitro указывают на то, что постоянное воздействие производных сульфонилмочевины в течение нескольких дней может вызвать десенсибилизацию β-клеток, следствием которой является снижение секреции инсулина под действием препаратов. Тем не менее, по результатам исследований среди пациентов с диагнозом СД2, достигнутое с помощью приема глибенкламида 25% повышение дневной секреции инсулина сохранялось в течение 6-10 недель, однако эффективность обычно ухудшается по прошествии 6-12 месяцев с момента начала терапии [68].
Фармакокинетика
Производные сульфонилмочевины крайне разнообразны по своим фармакокинетическим свойствам [37, 68-70] (см. в разделе доп. информации S1 (таблица)). Они обладают высокой биодоступностью и достигают максимальной концентрации в плазме крови в течение 1,5-4,0 часов [68]. В различной степени (в зависимости от препарата) метаболизируются в печени с образованием ряда активных и неактивных метаболитов, которые выводятся вместе с неметаболизированным препаратом в составе желчи и мочи; поэтому их необходимо назначать с осторожностью пациентам с печеночной и/или почечной недостаточностью [37]. Период полувыведения среди представителей производных сульфонилмочевины варьирует: для одних он составляет менее 10 часов, тогда как для других — 24 часа и более. В случае образования активных метаболитов (в качестве примера таких препаратов можно привести глимепирид, глибенкламид и хлорпропамид) проявления терапевтических эффектов препаратов сохраняются на протяжении куда более длительного времени, чем можно предположить, исходя из периода полувыведения [68]. Как правило, пациентам с ХБП 3-4 стадий или тем, кто проходит процедуру диализа, избегают назначать производные сульфонилмочевины первого поколения, при этом гликлазид и глипизид вполне применимы и без существенной корректировки дозы [71–73]. Глимепирид может рассматриваться как препарат выбора для пациентов с ХБП (но не для получающих диализную терапию) при условии назначения низкой начальной дозы и аккуратного ее увеличения [71, 73].
Более 90% производных сульфонилмочевины связываются в кровеносном русле с белками плазмы, что может стать причиной их конкуренции с другими лекарственными соединениями, как, например, салицилаты, сульфаниламиды и варфарин [37, 68]. Также некоторые препараты способны потенцировать гипогликемический эффект производных сульфонилмочевины, препятствуя их метаболизму в печени (например, некоторые противогрибковые средства и ингибиторы МАО), вытесняя их из связи с белками плазмы (например, кумарины, НПВС, сульфаниламиды) или задерживая их экскрецию (пробенецид). Но есть и препараты-антагонисты, среди которых можно назвать диазоксид и другие активаторы К+-АТФ-каналов [37]. Препараты вроде рифампицина, индуцирующие метаболизм производных сульфонилмочевины, также ингибируют гипогликемическое действие препаратов данной группы [37].
Модифицированные препараты сульфонилмочевины приобретают такие характеристики, как ускоренное наступление эффекта (например, мелкодисперсная форма глибенкламида) или пролонгированное действие (глипизид замедленного действия, гликлазид с модифицированным высвобождением), сохраняя при этом достаточную эффективность в плане снижения уровня глюкозы [37, 74-76].
Фармакодинамика
Препараты сульфонилмочевины, используемые в рамках монотерапии, ведут к снижению уровня ГПН на 2-4 ммоль/л и показателя HbA1c на 1-2% [28, 37, 68, 70]. Однако частота неэффективности применения производных сульфонилмочевины в качестве препаратов монотерапии выше, чем у метформина или розиглитазона [15]. Производные сульфонилмочевины могут претендовать на роль препаратов первой линии у пациентов с непереносимостью метформина, а также могут назначаться в комбинации с большинством других гипогликемических препаратов, за исключением меглитинидов, имеющих сходный механизм действия [28, 37]. Объем и продолжительность реакции организма на препараты сульфонилмочевины положительно коррелируют с функциональным резервом β-клеток [37].
Безопасность и побочные эффекты
Основными побочными эффектами, связанными с приемом производных сульфонилмочевины, являются гипогликемия и увеличение массы тела. Начальная прибавка веса составляет около 1-4 кг, через 6 месяцев после начала приема препарата вес, как правило, стабилизируется [28]. Предполагается, что увеличение веса связано с анаболическим эффектом, являющимся следствием подъема уровня инсулина и снижения глюкозурии [27, 28, 56].
У 20-40% пациентов, получавших препараты сульфонилмочевины, выявляется гипогликемия, тяжелые случаи гипогликемии (требующие вмешательства врачей) имели место у 1-7% пациентов [28, 37, 77] в зависимости от популяции, границ определения гипогликемии, а также типа и фармакокинетики принимаемых препаратов [74]. По результатам исследования, охватывавшего 6 центров специализированной медицинской помощи Великобритании, количество случаев обращения пациентов по поводу гипогликемии составило 39% (ДИ = 95%, 30-49%), равно как и среди пациентов с диагнозом СД2, получавших инсулинотерапию в течение не более 2 лет [77]. Частота обращения пациентов с тяжелой гипогликемией составила 7% (ДИ = 95%, 3-13%) [77]. С помощью постоянного контроля глюкозы (CGM) было установлено, что у 22% пациентов (ДИ = 95%, 15-31%) уровень глюкозы в интерстициальной жидкости, по крайней мере единожды, опускался до значений ниже 2,2 ммоль/л [77]. Сходный результат получен также по итогу постоянного мониторинга глюкозы среди пациентов с СД2, принимающих инсулин сроком <2 лет [77]. Кроме того, с риском развития гипогликемии особенно связан прием препаратов сульфонилмочевины пролонгированного действия, что подкреплено результатами исследований [28, 37]. Пожилые пациенты, проживающие одни, без посторонней помощи, пациенты с почечной/печеночной недостаточностью, а также постоянно управляющие транспортными средствами должны проявлять предельную осторожность при приеме производных сульфонилмочевины, как и врачи, назначающие эти препараты данной категории людей [28, 37]. Пациентов, получающих препараты сульфонилмочевины, необходимо непременно консультировать и учить самостоятельному контролю уровня глюкозы; результаты РКИ [78], проведенного среди пациентов, принимавших гликлазид с модифицированным высвобождением, говорят о том, что контроль уровня глюкозы в крови снижает риск как симптоматической гипогликемии, так и повышения уровня HbA1c, в сравнении с отсутствием мониторинга.
Данные о безопасности производных сульфонилмочевины, касаемые воздействия на сердечно-сосудистую систему, неоднозначны. Предположение о том, что прием толбутамида повышает риск развития сердечно-сосудистых заболеваний, высказанное еще в 1970-е годы членами университетской группы в рамках диабетической программы [79], повлекло за собой множество исследований, по большей части ретроспективных исследований баз данных, опираясь на которые можно предположить, что препараты сульфонилмочевины (в частности, глибенкламид) уступают метформину в безопасности касательно развития сердечно-сосудистых заболеваний у пациентов с СД2 [65]. Однако, по результатам таких РКИ, как UKPDS, ADVANCE и ACCORD, среди пациентов, получавших препараты сульфонилмочевины, не было выявлено повышения смертности или заболеваемости сердечно-сосудистыми заболеваниями [65]. Возможно, определить безопасность данных препаратов для сердечно-сосудистой системы позволит проходящее на момент публикации исследование CAROLINA [80], цель которого заключается в сравнительном анализе линаглиптина и глимепирида у пациентов с СД2.
Меглитиниды
Натеглинид и репаглинид являются двумя основными меглитинидами (или глинидами). Этот класс получил своё название от меглитинидной части глибенкламида, которая стимулирует высвобождение инсулина независимо от сульфонильной части [26, 28, 81].
Механизм действия
Меглитиниды связываются с бензамидным сайт SUR1 β-клеток. Этот сайт отделен от сульфонил-связывающего участка, но связывание меглитинидов имеет эффект, аналогичный связыванию производных сульфонилмочевины с субъединицей Kir6.2 калиевых каналов (Рис. 3) [37]. Относительно быстрое начало и короткая продолжительность действия меглитинидов больше подходит для применения их в качестве агентов, снижающих прандиальный уровень глюкозы [37].
Фармакокинетика
Репаглинид абсорбируется почти полностью, достигая пиковой концентрации в плазме через час после приема.Он связывается с белками крови и быстро метаболизируется в печени (преимущественно цитохромом P450 3A4 (CYP3A4)), с образованием неактивных метаболитов, которые секретируются с желчью. Период полувыведения из плазмы находится в пределах одного часа [37, 82, 83], делая препарат подходящим для пациентов с нарушением функции почек. При приеме за 15 минут до еды репаглинид вызывает выраженную секрецию инсулина на протяжении 4-6 часов [37]. Биодоступность препарата не зависит от приема пищи. Концентрация репаглинида увеличивается при применении с ингибиторами цитохрома CYP3A4 (такими как кетоконазол, антибиотики, стероиды и циклоспорины) и снижается при приеме вместе с индукторами фермента CYP3A4 (рифампицин, карбамазепин и барбитураты) [83, 84].
Действие натеглинида наступает немного быстрее и длится короче (3-5 ч), чем у репаглинида, но он также связывается с белками крови и метаболизируется ферментом CYP3A4 с образованием метаболитов, экскретирующихся преимущественно с мочой [37, 83].
Фармакодинамика
Репаглинид (0,5-4,0 мг) или натеглинид (60-180 мг) при приеме до еды дозозависимо повышают уровень инсулина и снижают ГПН и постпрандиальную гипергликемию [17]. Меглитиниды хорошо подходят для пациентов с нерегулярным приемом пищи и для пожилых пациентов с высоким риском гипогликемии [37]. Хотя меглитиниды могут применяться в качестве монотерапии, обычно они назначаются в комбинации с метформином, тиазолидиндионами или инсулином. Результаты РКИ показали, что при использовании меглитинидов в качестве монотерапии или дополнительной терапии к метформину происходит аналогичное или немного меньшее снижение уровня HbA1c по сравнению с применением производных сульфонилмочевины [17, 83]. Репаглинид может эффективно применяться вместе с базальным и двухфазным инсулином [85, 86]. Было проведено РКИ, в котором пациентам без ожирения, но с большим стажем СД2 (n=102) на протяжении 12 месяцев была случайным образом назначена терапия комбинацией двухфазного инсулина аспарт 30/70 (30% растворимого инсулина аспарт и 70% инсулина аспарт средней длительности действия) с репаглинидом или метформином, и оттитрована дозировка по достижению уровня HbA1c<6,5%. К концу лечения снижение уровня HbA1c было одинаковым в обеих группах (исходный уровень HbA1c против уровня к концу исследования 8,15±1,32 против 6,72±0,66% с метформином и 8,07±1,49% против 6,90±0,68% с репаглинидом, P=0,2 для разницы между группами) [86]. В сравнительном РКИ [87] со 150 пациентами, не получавших до этого лечения, была случайным образом назначена терапия репаглинидом (0,5 мг на прием пищи, максимальная доза 4 мг на прием пищи) или натеглинидом (от 60 до 120 мг на 1 прием пищи) на протяжении 16 недель. В результате снижение уровня HbA1c от исходного среднего значения 8,9% при использовании репаглинида было более выражено, чем при приеме натеглинида (-1,57% против -1,04%, P = 0,002). Репаглинид также вызывал большее снижение уровня ГПН, чем натеглинид (-57 мг/дл против -18 мг/дл, P<0,001) [87].
Безопасность и побочные эффекты
Результаты исследований с репаглинидом и натеглинидом показывают различную частоту гипогликемии и меньшую потерю веса, чем при применении производных сульфонилмочевины [83, 88-92]. В сравнительном РКИ было показано, что гипогликемия (уровень глюкозы в крови <50 мг/дл) была сильней связана с приемом репаглинида. нежели натеглинида (7% против 0%). В группе с приемом репаглинида также наблюдалась большая потеря веса (1,8 кг против 0,7 кг) [87]. В качестве дополнительной терапии к двухфазному инсулину репаглинид и метформин вызывали одинаковую частоту гипогликемии, однако метформин сильнее останавливал набор веса (разница в средней массе тела = -2,51 кг, ДИ 95% от -4,07 кг до -0,95 кг) [86]. Меглитиниды могут связываться с рецепторами сульфонилмочевины двух вариантов сплайсинга — SUR2A и SUR2B, экспрессирующихся в тканях сердечно-сосудистой системы [83, 93]. В большом РКИ NAVIGATOR [94] натеглинид не изменял сердечно-сосудистый исход у людей с ослабленной толерантностью к глюкозе, с высоким риском или уже имеющимися сердечно-сосудистыми заболеваниями. Связи между приемом репаглинида и сердечно-сосудистыми заболеваниями или их риском обнаружено не было [65, 83, 95].
Ингибиторы α-глюкозидазы (ИАГ)
Акарбоза была первым ИАГ, введенным в практику в 1990-х, после этого в некоторых странах вошли в применение миглитол и воглибоза. ИАГ широко используются в азиатских странах, где преобладает диета с высоким содержанием сложных углеводов [37].
Механизм действия
ИАГ конкурентно ингибируют фермент α-глюкозидазу в щеточной каемке энтероцитов,выстилающих ворсинки кишечника, предотвращая таким образом расщепление олигосахаридов и дисахаридов на моносахариды [37, 96]. Это замедляет усвоение углеводов и сдвигает их абсорбцию дистальней по кишечному тракту, предотвращая таким образом резкие колебания уровня глюкозы в крови и снижая прандиальный уровень инсулина [37]. Лечение ИАГ также может повышать постпрандиальную секрецию ГПП-1 и снижать секрецию глюкозозависимого инсулинотропного полипептида (ГИП) по сравнению с контрольными значениями [97, 98]. Аффинитет ИАГ варьирует в зависимости от различных α-глюкозидаз, приводя к специфичными профилям активности (например, акарбоза имеет большее сродство к глюкоамилазе, чем к другим глюкозидазам, в то время как миглитол наиболее сильно подавляет сукразу) [37].
Фармакокинетика
Акарбоза разрушается амилазами и бактериями в тонком кишечнике; <2% неизмененного препарата абсорбируется (наряду с некоторыми другими продуктами ферментативного разрушения). После всасывания акарбоза выводится по большей части с мочой в пределах 24 ч [37]. Миглитол абсорбируется практически полностью и неизмененным выводится через почки [37].
Фармакодинамика
Обычно лечение ИАГ вызывает снижение уровня HbA1c на ~0,5%, по большей части, благодаря снижению постпрандиальной гликемии, что, в свою очередь, зависит от содержания сложных углеводов в рационе [28]. В РКИ по дизайну не меньшей эффективности [99] в Китае (n=784) у пациентов с впервые диагностированными СД2 и средним уровнем HbA1c=7,5% применение акарбозы вызывало эффекты, аналогичные метформину (-1,1%, разница в пределах групп 0,01%, ДИ 95% от -0,12% до 0,14%). Однако у пациентов с впервые диагностированным СД2 (n=96, средний исходный уровень HbA1c ~8%) [100] производное сульфонилмочевины толбутамид вызывал большее снижение уровня HbA1c, чем акарбоза (-1,8% против -1,1%; разность средних 0,6%, ДИ 95%, 0,2-1,0%). Толбутамид также имел более выраженное влияние на ГПН чем акарбоза, в то время как их эффекты на постпрандиальный уровень глюкозы были аналогичны [100].
Безопасность и побочные эффекты
Обычно при приеме ИАГ наблюдаются побочные эффекты со стороны ЖКТ (метеоризм, дискомфорт и диарея), что может привести к остановке лечения. Гипогликемия встречается редко. ИАГ не влияют на вес и не имеют клинически значимых взаимодействий с другими препаратами. Результаты РКИ STOP–NIDDM показали что акарбоза снижает риск развития СД2, замедляет наступление гипертензии и уменьшает микроваскулярные нарушения на 49% по сравнению с плацебо, однако общее количество случаев было слишком маленьким (n=47), чтобы делать твердые выводы [65, 101, 102]. На данный момент проводится большое РКИ [103], оценивающее влияние акарбозы на сердечно-сосудистые заболевания.
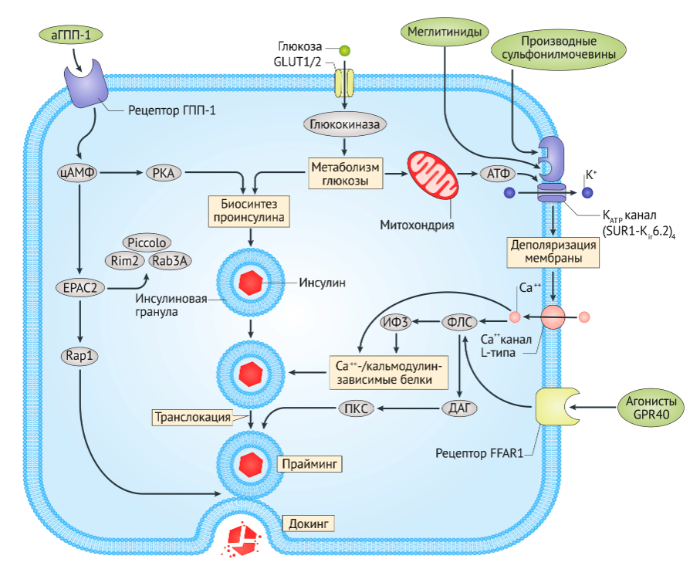
ДАГ — диацилглицерол; EPAC2 (RAPGEF4), фактор обмена нуклеотида гуанина Rap (GEF) 4; GLUT, изоформа транспортера глюкозы; IP3, инозитол-1,4,5-трифосфат; Rap1, белок 1 семейства Ras; PKA, протеинкиназа A; PKC, протеинкиназа C; PLC, фосфолипаза C.
Тиазолидиндионы
Производные тиазолидона включают пиоглитазон, розиглитазон и троглитазон. Троглитазон был включен в практику в 1997 году и и был вскоре выведен из применения из-за гепатотоксичности [28]. Розиглитазон и пиоглитазон были введены в 1999-м. Использование розиглитазона было прекращено в Европе и ограничено в США после сообщений о связи его применения с риском сердечно-сосудистых заболеваний; FDA в 2013-м усилила ограничения. Пиоглитазон был снят с продажи в 2011 в некоторых европейских странах и ожидает рассмотрения на предмет возможного риска рака мочевого пузыря.
Механизм действия
Тиазолидиндионы являются агонистами рецептора-активатора пролиферации пероксисом γ (PPAR-γ) — ядерного рецептора, высоко экспрессирующегося в жировой ткани, и в меньшей степени в мышцах, печени, β-клетках, эндотелии сосудов и макрофагах [37, 104]. Активация PPAR-γ изменяет экспрессию генов, приводя к адипогенезу, повышая чувствительность к инсулину и поступление глюкозы в ткани, подавляет воспаление и изменяет энергетический баланс [104, 105]. Дифференцировка преадипоцитов в новые малые инсулин-чувствительные адипоциты под воздействием активации PPAR-γ снижает уровень циркулирующих жирных кислот, что уменьшает эктопическое отложение липидов в скелетных мышцах и печени, а также изменяет баланс цикла Рендла (глюкоза-жирные кислоты) в сторону утилизации глюкозы путем ограничения доступности свободных жирных кислот как источника энергии для печеночного глюконеогенеза [28].
Фармакокинетика
Тиазолидиндионы достигают пиковой концентрации в плазме в течение 1-2 часов [37]. В крови тиазолидиндионы почти полностью связываются с белками плазмы, но их концентрация оказывается недостаточной для того, чтобы влиять на другие препараты, также связывающиеся с белками плазмы [37]. Пиоглитазон метаболизируется цитохромами P450 2C8 (CYP2C8) и CYP3A4 в малоактивные метаболиты, которые экскретируются с желчью, тогда как розиглитазон проходит биотрансформацию при участии CYP2C9 и CYP2C8, образуя малоактивные метаболиты, выводящиеся с мочой [37, 106]. Рифампицин повышает экспрессию CYP3A4, приводя к снижению уровней пиоглитазона и розиглитазона, в то время как фибрат гемфиброзил (гиполипидемический препарат) ингибирует CYP2C8, приводя к накоплению пиоглитазона и розиглитазона [106].
Фармакодинамика
Максимальные дозы тиазолидиндонов в монотерапии или в комбинации с метформином, производными сульфонилмочевины или инсулином могут снижать HbA1c до 0,7-1,6% [104, 107]. В РКИ [108] пациенты с СД2, получавшие метформин (n= 630, средний возраст ~56 лет, средняя продолжительность диабета ~5,5 года, среднее значение HbA1c 8,5-8,7%) были случайным образом разделены на группы, получавшие в качестве дополнительной терапии пиоглитазон или гликлазид. После 2 лет испытания изменения HbA1c были сходжими в обеих комбинациях (−0,89% с пиоглитазоном и −0,77% с гликлазидом, P=0,2 для различий между группами), в то время как пиоглитазон приводил к большему снижению уровня ГПН (−1,8 ммоль/л против −1,1 ммоль/л, P<0,001) [108].
В другом РКИ пациенты с СД2, получавшие производные сульфонилмочевины (n=639, средний возраст ~60 лет,средняя продолжительность СД2 ~7 лет, средний уровень HbA1c=8,8%) были случайно распределены на группы с пиоглитазоном и метформином в качестве дополнительной терапии. После 2 лет наблюдались сходные изменения HbA1c (−1,03% с пиоглитазоном против −1,16%с гликлазидом, P=0,17 для разницы между группами); снижение уровня глюкозы натощак также было одинаковым в двух группах (около ~2 ммоль/л) [108]. Гипогликемический эффект тиазолидиндонов развивается постепенно, достигая максимума через 2-3 месяца [37]. Исследование ADOPT [15], в котором 4360 пациентов с СД2 (средний возраст 56-58 лет, исходный уровень HbA1c 7,4%, у большинства продолжительность СД2 <2 лет) получали глибурид, метформин или розиглитазон, показало, что розиглитазон оказывает более длительный эффект в плане улучшения контроля гликемии (оцениваемый по HbA1c и ГПН), чем метформин или глибурид на протяжении 5 лет. Гипогликемическая эффективность тиазолидиндионов, как правило, постепенно возрастает на протяжении нескольких недель, сильно варьирует между пациентами, но какие-либо определенные предикторы, которые бы позволили заранее определить ответ на терапию, на данный момент неизвестны.
Безопасность и побочные эффекты
Тиазолидиндионы не влияют на риск гипогликемии как в монотерапии, так и в комбинации с метформином. Отеки (часто определяемые как быстрый набор веса) обнаруживаются у 4-6% пациентов, получавших тиазолидиндионы [104]; наблюдаемая задержка жидкости является результатом почечной реабсорбции натрия, вызванная повышением экспрессии натриевых каналов в эпителии собирательных трубочек [28]. Прием тиазолидиндионов сопровождается набором 2-3 кг веса на каждый 1% снижения HbA1c, даже при комбинации с метформином и инсулином [104]. Набор веса обычно происходит за счет подкожной жировой клетчатки, в то время как содержание висцерального жира уменьшается или не изменяется [104, 109]. В исследовании ADOPT [15] набор веса при приеме пиоглитазона на протяжении 5 лет был больше, чем при приеме глибенкламида (глибурида; разница между препаратами 2,5 кг, ДИ 95% 2,0-3,1 кг, P <0,001), в то время как не наблюдалось разницы в окружности талии (разница между видами лечения 0,77 см, 95% CI от −0,21 до1,76 см, P = 0,12). Результаты РКИ и наблюдений показали, что по сравнению с контрольными группами долговременное лечение тиазолидиндионами уменьшает плотность костной ткани и удваивает риск переломов у пациентов с СД2, особенно у женщин [110]. В исследовании ACCORD [111] женщины, получавшие тиазолидиндионы имели в 2 раза более высокий риск неспинальных переломов по сравнению с теми, кто не принимал тиазолидиндионы. Мета-анализ РКИ показал, что по сравнению с метформином, производными сульфонилмочевины или плацебо, тиазолидиндионы снижали минеральную плотность костной ткани в поясничном отделе позвоночника (разница −1,1%, ДИ 95% от −1,6% до −0,7%, P <0,0001), в бедре (−1,0%, ДИ 95% от −1,4% до −0,6%, P <0,0001), предплечье (−0,9%, ДИ 95% от −1,6% до −0,3%, P = 0,007) и в шейке бедра (−0,7% ДИ, 95% от −1,4% до 0,0%, P = 0,06), в некоторых исследованиях эффекты сохранялись на протяжении года после прекращения приема препарата [112].
Безопасность в отношении сердечно-сосудистой системы была оценена в противоречивом мета-анализе, который показал повышенный риск неблагоприятного сердечно-сосудистого исхода у пациентов, принимающих розиглитазон в сравнении с контролем без розиглитазона, что привело к изъятию препарата из продажи в Европе и ограничению использования в США [65, 113]. Однако, когда FDA провело повторную оценку данных исследования RECORD, не было обнаружено никаких значительных рисков сердечно-сосудистых осложнений [65, 114].
Пиоглитазон является лигандом PPAR-α (также, как и PPAR-γ), и считается, что, действуя через PPAR-α, он снижает риск сердечнососудистых заболеваний путем повышения уровня холестерина ЛПВП в плазме крови, уменьшения уровня триглицеридов и малых плотных частиц ЛПНП в плазме крови с увеличением синтеза больших, более плавучих частиц [115]. Тиазолидиндионы могут также оказывать положительное влияние на артериальное давление и функцию эндотелия [65], но по сравнению с пиоглитазоном, розиглитазон может повышать уровень триглицеридов и холестерина ЛПНП в плазме крови [65].
В исследовании PROACTIVE [32] применение пиоглитазона ассоциировалось с количественным, но незначительным снижением комбинированной конечной точки из смертности от всех причин, частоты нефатального инфаркта миокарда, инсульта, острого коронарного синдрома, эндоваскулярного или хирургического вмешательства на артериях ног или коронарных артериях и ампутацией выше лодыжки (ОР 0,90, ДИ 95% 0,80-1,02, P=0,095). Однако пиоглитазон значительно снижал вероятность наступления вторичной конечной точки, скомбинированной из смертности от всех причин, нефатального инфаркта миокарда и инсульта (ОР 0,84, ДИ 95% 0,72-0,98, P=0,027) [32]. Кроме того, пиоглитазон снижал риск последующего инфаркта миокарда и повторного инсульта на 16% и 47% соответственно [65, 116, 117].
Тем не менее, в исследовании PROACTIVE риск остановки сердца был выше в группе с приемом пиоглитазона по сравнению с плацебо, хотя этот риск не был связан с повышенной смертностью [65].Однако, пиоглитазон и розиглитазон могли вызывать хроническую сердечную недостаточность у пациентов, кто уже имел диастолическую дисфункцию из-за склонности к отекам [65]. Влияние розиглитазона на заболевания коронарных артерий пока не ясно, но пиоглитазон может оказывать благоприятный эффект [65, 118-122].
Ингибиторы дипептидилпептидазы-4
Доступные на данный момент ингибиторы ДПП-4 (ситаглиптин, видаглиптин, саксаглиптин, линаглиптин и алоглиптин) [123] запатентованы для монотерапии, двойной, тройной терапии и в комбинации с инсулином, но есть некоторые различия в лицензировании между отдельными препаратами. Кроме того, в Японии зарегистрированы ингибиторы ДПП-4 для приема 1 раз в неделю (омариглиптин и трелаглиптин) [124, 125].
Механизм действия
Действие ингибиторов ДПП-4 приводит к увеличению уровня инкретинов в кровотоке, особенно ГПП-1 и глюкозозависимого инсулинотропного полипептида (ГИП). Эффекты инкретинов как кишечных факторов заключаются в повышении секреции инсулина на 50-70% в ответ на прием пищи у здоровых индивидов [126, 127]; этот эффект может быть ослаблен у больных СД2.
ГИП секретируется К-клетками двенадцатиперстной кишки и тонкого кишечника в ответ на поступление углеводов и жиров [128, 130]. Кроме инкретинового эффекта, ГИП снижает секрецию соляной кислоты в желудке и принимает участие в адипогенезе и возможно, в пролиферации β-клеток [128,130-133]. ГПП-1 секретируется L-клетками преимущественно в дистальной части подвздошной кишки и толстом кишечнике [128, 130] и отвечает за основную часть инкретиновых эффектов [128,134]. Кроме того, ГПП-1 вызывает снижение секреции глюкагона и имеет экстрапанкреатическое действие — усиливает ощущение сытости и замедляет опорожнение желудка (смотрите дополнительную информацию S2 (вставка)) [127,134,137-139]. ГИП и ГПП-1 быстро разрушаются ДПП-4 [источник 128], которая отщепляет N-концевой дипептид с аланином (как у инкретинов) или пролином в положении N2 [источник 130].
ДПП-4 находятся в кровотоке в виде свободной и прикрепленной к эндотелию формах [130, 140] и широко экспрессируется в тканях человека, включая кишечник и портальную систему [130]. ГПП-1 и ГИП обычно инактивируются почти сразу же после секреции и имеют период полураспада <2 и 5-7 минут соответственно [18, 130, 141, 142]. По сравнению с плацебо, ингибирование ДПП-4 приводит к повышению постпрандиального уровня активного ГПП-1 в 2-3 раза [143, 144]. В отличие от агонистов рецепторов ГПП-1 (аГПП-1), эффект которых эквивалентен более чем 10-кратному увеличению уровня ГПП-1, ингибиторы ДПП-4 не задерживают опорожнение желудка, не повышают чувство сытости и не вызывают снижение веса, но позволяют избежать тошноты и рвоты [145, 146].
Фармакокинетика
Доступные на данный момент ингибиторы ДПП-4 способны вызывать снижение активности ДПП-4 на 77-99% и они подходят для приема один раз в сутки, за исключением видаглиптина (2 раза в день) и омариглиптина и трелаглиптина (1 раз в неделю). Они выводятся преимущественно с мочой, кроме линаглиптина, который не требует коррекции дозы у пациентов с ХБП (смотрите дополнительную информацию S3 (таблица)) [123, 147-151]. Ингибиторы ДПП-4 не взаимодействуют или слабо взаимодействуют с другими гипогликемическими препаратами, обычно используемыми пациентами с СД2 [123, 152], возможно, из-за того, что ингибиторы ДПП-4 не являются ни индукторами, ни ингибиторами ферментов печени и незначительно связываются с белками плазмы [152]. Однако саксаглиптин биотрансформируется в активные метаболиты при участии CYP3A4 и CYP3A5 [источники 123,152].
Фармакодинамика
В среднем, ингибиторы ДПП-4 снижают постпрандиальный подъем уровня глюкозы на ~3 ммоль/л и ГПН на ~1,0-1,5 ммоль/л [28, 123]. В мета-анализе [153] была изучена эффективность ингибиторов ДПП-4 как в монотерапии, так и в качестве дополнительной терапии к другим препаратам для орального применения, включая плацебо-контролируемые РКИ и РКИ с активным контролем (n=98 испытаний, 24163 пациентов) на протяжении 12-54 недель с ≥30 пациентов в каждой исследуемой группе. Средний возраст пациентов во всех, кроме двух исследований, был 52-60 лет; 88 из 98 включенных исследований были двойными слепыми и 10 были открытыми [153]. Результаты показали что ингибиторы ДПП-4 снижают уровень HbA1c на -0,77% ( ДИ 95% от -0,82% до -0,72%) от среднего исходного уровня 8,05% [153]. В 18 РКИ, с продолжительностью 52-54 недели, ингибиторы ДПП-4 снижали HbA1c на -0,84% ( ДИ 95% от -0,99% до -0,68%, P<0,0001), в то время как в 26 РКИ, продолжительностью 12-18 недель, наблюдалось снижение HbA1c на -0,68% (ДИ 95% от -0,75% до -0,61%, P <0,0001) [153]. Снижение уровней HbA1c было очень близким внутри класса препаратов, но результаты прямых сравнительных исследований ограничены. В этом мета-анализе снижение уровня HbA1c при применение ингибиторы ДПП-4 было следующим:
- видаглиптин 50 мг (n=26, возраст 56,3 года, исходный уровень HbA1c 8,06%) -0,88% (ДИ 95% от -1,00% до -0,75%, P<0,0001);
- ситаглиптин 100 мг (n=37, возраст 55.2 года, исходный уровень HbA1c 8,05%) -0.79% (ДИ 95% от -0,87% до -0,71%, P<0,0001);
- саксаглиптин 5 мг (n=13, возраст 55,4 года, исходный уровень HbA1c 8,01%) -0,70% (ДИ 95% от -0,79% до -0,62%, P<0,0001);
- линаглиптин 5 мг (n=13, возраст 59.0 лет, исходный уровень HbA1c 8,05%) -0,55% (ДИ 95% от -0,65% до -0,45%, P<0,0001);
- алоглиптин 25 мг (n=11, возраст 55.2 года, исходный уровень HbA1c 8,14%) -0,76% (ДИ 95% от -0,86% до -0,66%, P<0,0001) [153].
Снижение уровня HbA1c было более выраженным у пациентов с исходным уровнем HbA1c >9,0%, по сравнению с HbA1c ≤9,0% [153]. В РКИ с исходными значениями HbA1c <7,5% (n=8, возраст 57,4 года, исходный уровень HbA1c 7,32%) наблюдалось снижение HbA1c на -0,63% (ДИ=95% от -0,78% до -0,48%, P <0,0001); для исходных значений HbA1c 7,5-8,0% (n=28, возраст 57,6 года, исходный уровень HbA1c 7,82%) снижение было на −0,70% (ДИ 95% от -0,76 до -0,63, P<0,0001); для исходных значений HbA1c 8,0-8,5% (n=34, возраст 55,9 года, исходный уровень HbA1c 8,15%) снижение было на -0,72% (ДИ 95% от -0,79% до -0,64%, P<0,0001); для исходных значений HbA1c >9,0% (n=30, возраст 54,2 года, исходный уровень HbA1c 8,63%) снижение было на -0,93% (ДИ 95% от -1,02% до -0,84%, P<0,0001) [153].
Мета-анализ 27 отчетов из 19 исследований, включающий 7136 пациентов показал, что монотерапия ингибиторами ДПП-4 вызывала меньшее снижение HbA1c, чем монотерапия метформином (взвешенная разность средних (ВРС)=0,20%, ДИ 95% 0,08-0,32%, Pсуммарного эффекта=0,001). Ингибиторы ДПП-4 в комбинации с метформином имели меньший эффект, чем агонисты рецепторов ГПП-1 в комбинации с метформином (ВРС=0,49%, ДИ 95% 0,31-0,67%, Pсуммарного эффекта<0,001) и производные сульфонилмочевины в комбинации с метформином (ВРС 0,07%, ДИ 95% 0,03-0,11%, Pсуммарного эффекта<0,001), но аналогичный эффект с комбинацией пиоглитазона и метформина (ВРС 0,09%, ДИ 95% от −0,07% до 0,24%, Pсуммарного эффекта = 0,28) [154].
В исследованиях, сравнивающих монотерапию, продолжительность испытаний составляла 24-206 недель, средней продолжительностью СД2 у пациентов была 1,0-4,4 года а средний уровень HbA1c был 7,2-9,6%. В исследованиях, сравнивающих комбинированную терапию, средняя продолжительность СД2 у пациентов составляла 5,0-7,3 года и средний уровень HbA1c был 7,3-8,5% [154]. Сравнение эффективности ингибиторов ДПП-4 с производными сульфонилмочевины осложняется многими факторами, включая продолжительность исследования, сохранность функции почек и выбор конкретного производного сульфонилмочевины в качестве препарата сравнения [155]. В мета-анализе [155] 12 РКИ с продолжительностью ≥18 недель, который прямо (head-to-head) сравнивал производные сульфонилмочевины с ингибиторами ДПП-4, прием ингибиторов ДПП-4 незначительно изменял среднее значение HbA1c от начального уровня, но этот эффект был значимо сильней по сравнению с производными сульфонилмочевины (разница средних изменений уровня HbA1c 0,105, ДИ 95% 0,103-0,107, P <0,0001). Однако, несколько РКИ продолжительностью 1-3 года показали сходное снижение уровня HbA1c при использовании ингибиторов ДПП-4 и производных сульфонилмочевины [150,155–164]. Гипогликемическая активность ингибиторов ДПП-4 у пациентов-азиатов с СД2 выше, чем у других этнических групп (разница в уровне HbA1c между группами −0,26%, ДИ 95% от −0,36% до −0,17%, P <0,001), и может быть объяснена генетическими факторами, такими как варианты гена TCF7L2 [165,166]. Мета-анализ РКИ продолжительностью ≥76 недель подтвердил, что эффекты ингибиторов ДПП-4 не является долговечными и уменьшается в течение второго года лечения [167].
Прямые сравнительные исследования ингибиторов ДПП‑4
Число прямых исследований, сравнивающих эффективность ингибиторов ДПП‑4, недостаточно. Результаты рандомизированного контролируемого сравнения [168] саксаглиптина и ситаглиптина как дополнительного препарата к метформину у 810 пациентов (средний возраст 58,4 года, продолжительность диабета 6,3 года, исходный уровень HbA1c 7,7%) показали, что оба препарата аналогично снижали уровень HbA1c после 18 недель (скорректированное среднее изменение уровня HbA1c −0,52 и −0,62%, соответственно; различие между группами 0,09%, ДИ 95% от −0,01% до 0,20%). Однако, ситаглиптин сильней снижал ГПН (−0,60 ммоль/л для саксаглиптина против −0,90 ммоль/л для ситаглиптина; разница 0,30 ммоль/л, ДИ 95% 0,08-0,53 ммоль/л) [168].
В другом РКИ [169] 148 пациентов с СД2 и расчетной скоростью клубочковой фильтрации (рСКФ) <30 мл/мин/1,73м2, которые не получали медикаментозного лечения или принимали любой гипогликемический препарат,. были случайно разделены на группы с приемом 1 раз в день видаглиптина 50 мг или ситаглиптина 25 мг также 1 раз в день. Результаты лечения показали сходное снижение уровня HbA1c на протяжении 24 недель (скорректированное среднее изменение уровня HbA1c −0,54% от исходного уровня 7,52% для видаглиптина против −0,56% от исходного уровня 7,80% для ситаглиптина, P = 0,874). Видаглиптин снижал ГПН на 0,47 ± 0,37 ммоль/л в то время как ситаглиптин повышал ГПН на 0,16 ± 0,43 ммоль/л, однако разница между группами не была значимой (P = 0,185) [169].
В III фазе РКИ с дизайном не меньшей эффективности (non-inferiority) 243 пациента с СД2, без соблюдения диеты и регулярных физических нагрузок были случайно разделены на группы с примемом трелаглиптина (100 мг 1 раз в неделю), алоглиптина (25 мг 1 раз в день) или плацебо на протяжении 24 недель. Трелаглиптин не хуже алоглиптина снижал уровень HbA1c (−0,33% против −0,45%, соответственно; разница средних наименьших квадратов 0,11%, ДИ 95% от −0,054% до 0,281%). Трегалгиптин и алоглиптин значимо снижали уровень HbA1c по сравнению с плацебо (P <0,0001) [170].
В другом РКИ [171] 412 пациентов, не получавших лечение или принимающих оральные гипогликемические препараты, были случайно распределены на группы с приемом омариглиптина 25 мг 1 раз в неделю, ситаглиптина 50 мг 1 раз в день или плацебо на протяжении 24 недель. Исходный уровень HbA1c в группах был 7,9%, 8,0% и 8,1% соответственно [171]. Лечение омариглиптином снижало уровень HbA1c на −0,66% (ДИ 95% от −0,76% до −0,57%), что значительно отличалось от плацебо (P <0,001) и не отличалось от ситаглиптина (разница средних наименьших квадратов −0,02%, ДИ 95% от −0,15% до 0,12%) и таким образом соответствовало критерию не меньшей эффективности [171].
Безопасность и побочные эффекты
Ингибиторы ДПП-4 обычно хорошо переносятся, частота побочных эффектов сравнима с плацебо и ниже, чем у других гипогликемических препаратов [154, 172]. Со стороны ЖКТ частота побочных эффектов при приеме ингибиторов ДПП-4 ниже, чем у метформина или аГПП-1 [154]. У пациентов, принимающих ингибиторы ДПП-4, очень низкий риск гипогликемии за исключением случаев совместного приема их с производными сульфонилмочевины или инсулином [123, 154, 172].
ДПП-4 имеет много других субстратов, помимо инкретинов: брадикинины, энкефалины, нейропептид Y, пептид YY1-36, гастрин-рилизинг пептид, вещество P, инсулиноподобный фактор роста 1, вазостатин 1, α-цепи тиротропина, лютеинизирующий гормон, хорионический гонадотропин и некоторые хемокины, такие как C-C мотив хемокин 2 (моноцитарный хемотаксический протеин-1) [173]; однако в клинических испытаниях не наблюдалось побочных эффектов, связанных с этими субстратами [28, 123, 148]. Кроме того, ДПП-4 является антигеном активации CD26 Т-лимфоцитов, однако не было обнаружено каких-либо неблагоприятных эффектов, связанных с иммунитетом, как у мышей с нокаутом Dpp4 так и при использовании ингибиторов ДПП-4 у людей и животных [28].
Несколько мета-анализов и анализов объединенного массива данных показали, что применение ингибиторов ДПП-4 (как отдельных соединений, так и всего класса препаратов) связано со снижением риска сердечно-сосудистых осложнений [65, 174]. Однако эти исследования были ретроспективными и их дизайн не был подстроен под оценку влияния ингибиторов ДПП-4 на частоту сердечно-сосудистых заболеваний [65]. Результаты трех РКИ (SAVOR–TIMI [175,176], EXAMINE [177] и TECOS [178]) продемонстрировали, что саксаглиптин, алоглиптин и ситаглиптин не связаны с риском неблагоприятных сердечно-сосудистых исходов 65, [175-178]. Популяция пациентов в этих испытаниях немного различалась. РКИ SAVOR–TIMI [175,176] включало больных СД2 пациентов с историей или риском сердечно-сосудистых осложнений. РКИ EXAMINE [177] включало пациентов с СД2 и острым инфарктом миокарда или госпитализацией по причине нестабильной стенокардии в предшествующие 15-90 дней. РКИ TECOS [178] включало пациентов с СД2 старше 50 лет, имевших установленное сердечно-сосудистое заболевание.
Эти исследования были специально построены для изучения безопасности ингибиторов ДПП-4 для сердечно-сосудистой системы, поэтому пациенты в группах плацебо получали другие гипогликемические препараты для устранения любых различий в уровне HbA1c между группами. В исследовании SAVOR–TIMI [175, 176] прием саксаглиптина был связан с 3,5% частотой госпитализаций из-за острой сердечной недостаточности по сравнению с 2,8% в группе плацебо (P=0,007) без увеличения смертности, и это различие не зависело от исходной функции почек, хотя по сравнению с плацебо саксаглиптин откладывал начало развития и прогрессию микроальбуминурии [65, 175, 176]. В исследованиях EXAMINE [177] и TECOS [178] не было обнаружено влияния на риск остановки сердца, а механизм, лежащий в основе этого эффекта у саксаглиптина, остается неясным. Текущее исследование CAROLIN [80] проводится с целью оценки эффекта линаглиптина на сердечно-сосудистые исходы преимущественно по сравнению с активным контролем (глимепирид), чем с плацебо. Конкретные результаты испытаний SAVOR–TIMI, EXAMINE и TECOS не показали какого-либо повышения рисков острого панкреатита или рака поджелудочной железы при использовании ингибиторов ДПП-4 по сравнению с теми, кто получал стандартное лечение (ОШ 1,82, ДИ 95% 1,17-2,82, P=0,008) [180].
Агонисты рецепторов глюкагоноподобного пептида-1
Производство первого препарата из группы аГПП-1 — эксенатида, — было запущено в 2005 году. Тогда его нужно было принимать дважды в день. Сегодня помимо него также доступны два аГПП-1, принимаемых один раз в сутки (лираглутид и ликсисенатид), и три аГПП-1, прием которых ограничивается одним разом в неделю (эксенатид пролонгированного действия, албиглутид и дулаглутид), которые могут быть использованы для комбинированной терапии вместе с пероральными гипогликемическими препаратами и базальной инсулинотерапией (кроме эксенатида, принимаемого один раз в неделю — его не разрешено комбинировать с базальным инсулином). Дулаглутид и албиглутид разрешены в качестве монотерапии для пациентов, не переносящих метформин.
Эксенатид (синтетический эксендин-4) — это белок, изначально полученный из слюны ящерицы Heloderma suspectum (Аризонского ядозуба) [128, 181]. Он на 53% гомологичен человеческому ГПП-1 и содержит аминокислотную замену аланина на глицин в 8 положении (Ala8Gly), что обеспечивает устойчивость к воздействию ДПП-4 (источники 128,182). Эксенатид, принимаемый раз в неделю, имеет лекарственную форму с замедленным высвобождением, которая состоит из самого эксенатида и оболочки из биоразлагаемых полимерных микросфер поли-(DL-лактид-ко-гликолиевой кислоты) [183].
Лираглутид — это аналог ГПП-1 с присоединенной 16-углеродной цепочкой жирной кислоты, которая соединяет лизин в 26-м положении с альбумином, благодаря чему скрывается участок разрезания ДПП-4 [184]. Албиглутид представляет собой две копии ГПП-1, идущие друг за другом, при этом каждая содержит аминокислотную замену аланина на глицин в 8 положении. Данная молекула также связана с альбумином [185]. Ликсисенатид — аналог эксендина-4 с шестью остатками лизина, присоединенными к С-концу для придания молекуле устойчивости к ДПП-4 (источник 186). Дилаглутид содержит две копии аналога ГПП-1 (с аминокислотными заменами аланина на глицин в 8, глицина на глутамат в 22 и аргинина на глицин в 36 положении), ковалентно связанные с Fc-фрагментом человеческого IgG4 (источник 187).
Механизм действия
аГПП-1 имитируют действие ГПП-1, активируя рецепторы к нему и таким образом стимулируя нутриент-индуцированную секрецию инсулина (Рис. 3), что приводит к снижению показателей гликемии натощак и постпрандиальной гликемии, а также к потере веса [188] (см. дополнительную информацию S2, S4, S5 (вставка, таблица, таблица)). Терапевтические дозы аГПП-1 гораздо выше, чем физиологические уровни ГПП-1, и, хотя у пациентов с СД2 был описан дефицит ГПП-1, этот дефицит не является универсальным показателем данного заболевания [188].
Фармакокинетика
аГПП-1 вводят подкожно. Эксенатид всасывается очень быстро [189]. Tmax равна приблизительно 2 часам, период полувыведения составляет 3-4 часа [189], элиминация осуществляется преимущественно через почки путем клубочковой фильтрации и протеолитического распада [190-192] (см. дополнительную информацию S6 (таблица)). По сравнению с пациентами с нормальной функцией почек, клиренс эксенатида у пациентов с умеренной болезнью почек (которым он должен назначаться с осторожностью) снижен на 36%, а у пациентов с тяжелой болезнью почек (которым не следует принимать этот препарат) [193] — на 84%. Эксенатид, принимаемый один раз в неделю, достигает терапевтической концентрации в течение 2 недель и максимальной концентрации за 6 недель [194]. Период полувыведения лираглутида составляет 10-15 часов, Tmax = 9-12 часов [195–197]. Период полувыведения ликсисенатида равен 2-4 часам и Tmax = 1-2 часа [198]. При этом основной эффект, влияющий на усвоение пищи, проявляется сразу же после инъекции. Албигутид обладает Tmax = 3-5 дней и периодом полувыведения равным 6-7 дней [199]. Дулаглутид имеет Tmax = 12-72 часа и период полувыведения равный приблизительно 4 дням. Препарат достигает устойчивого уровня в крови спустя 2 недели приема [200] (см. дополнительную информацию S6 (таблица)).
аГПП-1 не рекомендуются при ряде заболеваний почек; они взаимодействуют с небольшим количеством лекарств, но могут влиять на биодоступность других препаратов, таких как ацетаминофен (парацетамол) и статины. Это происходит из-за задержки эвакуации пищи из желудка (что не свойственно эксенатиду, принимаемому раз в неделю — он оказывает минимальный эффект на опорожнение желудка) [27, 201].
Фармакодинамика
Эффективность аГПП-1 была изучена в обширных плацебо-контролируемых РКИ [202-238] (см. дополнительную информацию S4, S5 (таблицы)) с использованием активного препарата в качестве контроля.
Влияние на показатели гликемии. Эксенатид (принимаемый дважды в день) значительно снижает потребность в контроле гликемии при использовании в качестве монотерапии или дополнительной терапии (см. дополнительную информацию S4 (таблица)) [239-243]. Мета-анализ [244] РКИ, в которых эксенатид на протяжении 16-30 недель применялся в качестве дополнительной терапии к имеющемуся лечению метформином, показал, что эксенатид снижает HbA1c на 0,8% от среднего исходного уровня 8,1±0,6%. Снижение HbA1c в ответ на прием эксенатида проявилось сильнее у пациентов с базовым уровнем HbA1c > 9%, чем у пациентов с HbA1c ≤9%. Эффект сохранялся на протяжении 3 лет [240] и незначительно ослаблялся спустя 6 лет [245, 246].
Лираглутид улучшает гликемические показатели при использовании в качестве монотерапии или дополнительной терапии [239, 241, 247, 248] (см. дополнительную информацию S4 (таблица)). По сравнению с глимепиридом (прием 8 мг раз в сутки), лираглутид при ежедневном приеме в меньшем объёме (1,2-1,8 мг) в качестве монотерапии приводит к большему снижению HbA1c по сравнению со средним исходным уровнем 8,3% (глимепирид — 0,6%; лираглутид 1,2 мг — 0,9% и лираглутид 1,8 мг — 1,1%; различие между видами терапии для лираглутида 1,2 мг −0,31%, ДИ 95% от −0,54% до −0,08%, P=0,008; для лираглутида 1,8 мг −0,60%, ДИ 95% от −0,83% до −0,38%, P<0,0001). Похожий эффект был установлен относительно снижения ГПН (разница между видами терапии для лираглутида 1,2 мг −0,63 ммоль/л, ДИ 95% от −1,17 ммоль/л до −0,09 ммоль/л, P=0,02; разница между видами терапии для лираглутида 1,8 мг — 0,99 ммоль/л, ДИ 95% от -1,53 ммоль/л до −0,45 ммоль/л, P<0,001), а также для уровня постпрандиальной гликемии на протяжении более 104 недель [247]. В объединенных данных о пациентах из семи РКИ III фазы по изучению эффектов лираглутида на протяжении 26 недель с приемом 1,8 мг препарата снижение HbA1c у пациентов с исходным уровнем HbA1c ≤7,5%, было меньше, чем у пациентов с HbA1c >9,0% (−0,7% против −1,8%) [249].
Ликсисенатид при приеме в качестве монотерапии или добавочной терапии значительно снижает HbA1c и уровень постпрандиальной гликемии [210-215, 250-257]. В мета-анализе РКИ по сравнению с плацебо лечение ликсисенатидом привело к снижению постпрандиальной гликемии в течение 2 часов по сравнению с исходным уровнем (разница средних наименьших квадратов −4,9 ммоль/л, P <0,001), колебания уровня глюкозы (разница средних наименьших квадратов −4,5 ммоль/л, P<0,001) и уровня глюкагона после приема пищи (разница средних наименьших квадратов −19,0 нг/л, P<0,001) [256]. По сравнению с плацебо, ликсисенатид совместно с базальной инсулинотерапией [257] также снижал уровень HbA1c и постпрандиальной гликемии, но не ГПН.
Эксенатид, принимаемый один раз в неделю, снижает HbA1c, ГПН и постпрандиальную гликемию при приеме как в качестве монотерапии, так и дополнительной терапии [218, 239, 241, 258]. При монотерапии данный препарат в испытаниях не уступал метформину, был эффективнее ситаглиптина и в РКИ длительностью 26 недель показал одинаковый результат с пиоглитазоном относительно снижения HbA1c [239, 258].
При добавлении эксенатида, принимаемого один раз в неделю, к метформину наблюдался более эффективный контроль уровня глюкозы, чем при добавлении ситаглиптина или пиоглитазона к метформину [218, 239]. В исследовании, в котором приняли участие 456 пациентов, имеющих СД2 и проходящих монотерапию с использованием метформина или совместно с производными сульфонилмочевины, добавление эксенатида (при приеме 1 раз в неделю) привело к такому же снижению HbA1c, как и при добавлении инсулина гларгина; эффект эксенатида, принимаемого 1 раз в неделю, сохраняется на протяжении 3 лет [222, 236, 239].
Аналогично, добавление еженедельного приема эксенатида к терапии пероральными гипогликемическими препаратами приводило к более выраженным снижениям HbA1c на протяжении 26 недель по сравнению с одно- или двухкратным приемом инсулина детемир [239, 259]. В дополнительной фазе испытания DURATION-1 [260], пациенты получали эксенатид один раз в неделю на протяжении 5 лет, и на протяжении этого периода сохранялись положительные сдвиги уровней ГПН и HbA1c. Однако, 40% пациентов ушли из исследования до его окончания. Большинство покинувших исследование отозвали информированное согласие, и только восемь пациентов ушли из-за “потери контроля над уровнем глюкозы”. Не было зарегистрировано никаких отличий в исходных характеристиках между теми, кто завершил и не завершил исследование, и из анализа по назначенному лечению было очевидно снижение HbA1c на протяжении пяти лет у всех пациентов (−1,2%±0,1%), также как и из анализа показателей пациентов, завершивших исследование (−1,6%±0,1%).
Албиглутид оказывал благоприятное воздействие на гликемический контроль при использовании его в качестве монотерапии или добавочной терапии в III фазе исследований [250, 261, 262]. В РКИ, продолжавшемся 104 недели, исследовались препараты при добавлении к лечению метформином и албиглутид показал значительно большее снижение показателей HbA1c и ГПН, чем плацебо, ситаглиптин и глимепирид [226]. В качестве добавочной терапии к метформину и производным сульфонилмочевины, албиглутид в течение более 52 недель [223] не достигал предварительно установленного предела не меньшей эффективности (noninferiority margin), который составлял изменение уровня HbA1c на 0,3% по сравнению пиоглитазоном. При использовании совместно с метформином (с или без добавления производных сульфонилмочевины) албиглутид на протяжении более 52 недель показал такое же снижение HbA1c, как и инсулин гларгин [224]. В качестве дополнительной терапии с инсулином гларгином албиглутид не уступал инсулину лиспро на протяжении 26 недель, но не достиг предела не меньшей эффективности на 52 неделе [250, 263].
Препараты дилаглутида 0,75 мг и 1,5 мг (при приеме раз в неделю) на протяжении 52 недель в качестве монотерапии или в комбинации с другими оральными гипогликемическими препаратами оказались более эффективны [232, 234, 250], чем метформин и ситаглиптин. Совместный прием дулаглутида 1,5 мг (еженедельно) с метформином и производными сульфонилмочевины на протяжении более 52 недель оказался более эффективным по сравнению с ежедневным инсулином гларгином, дулаглутид 0,75 мг не уступал в снижении HbA1c от исходных значений [237].
Метаанализ РКИ длительностью более 12 недель с открытой информацией об этнической составляющей показал, что ВРС значений HbA1c при лечении аГПП-1 по сравнению с плацебо составила −1,16% (ДИ 95% от −1,48% до −0,85%) в исследуемой группе с ≥50% пациентов-азиатов, и −0,83% (ДИ 95% от −0,97% до −0,70%) в исследованиях с <50% пациентов-азиатов (межгрупповое различие −0,32%, ДИ 95% от −0,64% до −0,01%, P=0,04) [264].
Влияние на вес. Прием аГПП-1 связан со снижением массы тела и окружности талии, но эти признаки обладают значительной индивидуальной вариабельностью и внутриклассовыми различиями [250, 265–268] (см. дополнительную информацию S5 (таблица)). В мета-анализе [266] 15 РКИ применение комбинации аГПП-1 с базальной инсулинотерапией приводило к снижению веса в среднем на -3,22 кг (ДИ 95% от -4,90 кг до -1,54 кг).
Влияние на артериальное давление. Результаты отдельных РКИ и метаанализов показали, что прием аГПП-1 приводит к умеренному, но значимому снижению систолического кровяного давления по сравнению с плацебо или инсулином [269-271] (см. дополнительную информацию S5(таблица)). Этот эффект не зависит от исходных значений артериального давления и влияния аГПП-1 на HbA1c или массу тела [269]. При приеме эксенатида дважды в день также наблюдалось снижение диастолического давления по сравнению с плацебо (−1,08 мм рт. ст., ДИ 95% от −1,78 мм рт. ст до −0,33 мм рт. ст.) [270].
Другие эффекты
Другой мета-анализ показал, что аГПП-1 умеренно снижают уровень общего холестерина, ЛПНП и триглицеридов, но не повышают ЛПВП по сравнению с плацебо или активным контролем [272].
Безопасность и побочные эффекты
аГПП-1 в основном хорошо переносятся; наиболее распространенный побочный эффект — кратковременная тошнота, прекращающаяся примерно после 4-8 недели приема препарата. Снизить проявление этого побочного эффекта можно путем постепенного увеличения дозы [27, 28, 239, 250]. Риск гипогликемии у пациентов, получающих аГПП-1, довольно низок, кроме случаев комбинированной терапии с инсулином или производными сульфонилмочевины [27, 28, 239, 250]. При введении некоторых аГПП-1, включая эксенатид, принимаемый один раз в неделю (≤17,6%) и албиглутид (≤22%) часто возникают местные реакции в месте укола [250]. Также часто с приемом аГПП-1 связывают появление антител, но с небольшой клинически выраженной значимостью и в основном без влияния на гликемический контроль, кроме крайне редких случаев у пациентов с высоким уровнем титра антител, получавших эксенатид один раз в неделю [28, 194, 239, 250].
Огромное внимание было уделено возможной зависимости между приемом аГПП-1 и риском развития панкреатита или рака поджелудочной железы, однако не было обнаружено никаких признаков причинно-следственной связи [273]. Мета-анализы не показали значительного повышения частоты возникновения острого панкреатита при приеме аГПП-1 у пациентов с СД 2 типа [179, 274, 275]. В дополнение к этому, результаты исследований безопасности препарата для сердечно-сосудистой системы не выявили значительного повышения риска развития панкреатита при приеме аГПП-1 [276] (в исследовании оценивались и другие риски — прим. переводчика). Рекомендации по маркировке препаратов аГПП-1 включают в себя обязательное указание к избеганию подобной терапии у пациентов, имеющих в анамнезе панкреатит, и прекращение терапии в случае начала развития панкреатита [28]. Гиперплазия С-клеток щитовидной железы и медуллярная карцинома также рассматривались как возможные факторы риска в доклинических испытаниях на грызунах, но клинические исследования не выявили каких либо существенных проблем, вызванных лечением аГПП-1 [28, 239, 250].
Результаты доклинических исследований показали, что аГПП-1 обладает кардиопротективными эффектами при сердечной недостаточности и последующей ишемии миокарда [65]. аГПП-1 могут положительно влиять на многие сердечно-сосудистые факторы риска, такие как масса тела, артериальное давление, эндотелиальная функция, воспаление, ингибитор активатора плазминогена-1, постпрандиальная липоемия иЛПНП [65]. Результаты исследований на здоровых пациентах и больных СД2 показали положительное влияние аГПП-1 на функцию левого желудочка у пациентов с сердечной недостаточностью и на коэффициент сохранности миокарда при последующей ишемии [65, 277]. Однако, аГПП-1 часто учащают сердцебиение в покое примерно на 3 удара в минуту, что, вероятно, опосредовано активацией рецепторов к ГПП-1 в синоатриальном узле [65]. В РКИ с 24-часовым амбулаторным наблюдением за частотой сердечных сокращений, прием дулаглутида 1,5 мг был связан с повышением ЧСС по сравнению с плацебо (разница средних наименьших квадратов — 2,8 удара в минуту, ДИ 95% от 1,5 до 4,2 удара в минуту), что не наблюдалось при приеме дулаглутида 0,75 мг и эксенатида [271, 278]. Проводятся обширные РКИ, в которых оценивается безопасность лираглутида, семаглутида, эксенатида при приеме раз в неделю и дулаглутида для сердечно-сосудистой системы [65]. У пациентов с СД2, принимающих ликсенатид, не было обнаружено никаких побочных эффектов со стороны сердечно-сосудистой системы [276].
Прямое сравнительное исследование аГПП-1
На сегодняшний день доступно сразу несколько препаратов аГПП-1, имеющих различную химическую структуру и лекарственную форму, и их различная фармакокинетика и фармакодинамика, показанная в прямых сравнительных исследованиях, влияет на принятие решения в клинической практике [205, 216, 219-221, 227, 230, 231, 238, 279] (Таб. 2). Лираглутид 1,8 мг и дулаглутид 1,5 мг оказывают наибольшее влияние на уровень HbA1c, а лираглутид 1,8 мг и эксенатид, принимаемые раз в неделю, сильнее влияют на потерю веса. Албиглутид оказывает меньший эффект на HbA1c и снижение веса по сравнению с другими аГПП-1, но его прием оказывает меньше побочных эффектов на желудочно-кишечный тракт. Препараты, принимаемые один раз в неделю, по сравнению с ежедневными или принимаемыми дважды в день препаратами в основном вызывают местные осложнения, связанные с инъекцией препарата под кожу.
В целом, длительно действующие аГПП-1 вызывают более сильное снижение ГПН, но меньше влияют на постпрандиальную гликемию по сравнению с аГПП-1 кратковременного действия [280, 281]. Эффект на постпрандиальную гликемию отчасти опосредован отсроченной эвакуацией пищи из желудка и чаще проявляется при приеме аГПП-1 короткого действия, чем при приеме длительно действующих аГПП-1, которые являются причиной возникновения тахифилаксии в связи с хроническим повышением уровня ГПП-1 в плазме (источник 280). Помимо этого, ликсисенатид, по сравнению с лираглутидом, выраженно снижает постпрандиальную секрецию глюкагона [280]. Пациенты, получающие эксенатид раз в неделю или лираглутид, более удовлетворены терапией, чем больные, получающие эксенатид дважды в день [279].
аГПП-1 против инсулина
В мета-анализе [282] РКИ, в которых сравнивались аГПП-1 с последовательно титруемым базальным инсулином для достижения целевого ГПН у пациентов с СД2, аГПП-1 показали значительное снижение HbA1c (средняя величина отклонения −0,14%, ДИ 95% от −0,27% до −0,02%, P=0,03) и веса (−4,40 кг, ДИ 95% от −5,23 кг до −3,56 кг, P<0,01), но меньшее снижение уровней ГПН (1,18 ммоль/л, ДИ 95% 0,43–1,93 ммоль/л, P<0.01) [282]. В отдельном РКИ [238] дулаглутид в комбинации с инсулином лиспро привел к большему снижению HbA1c, чем инсулин гларгин.
Комбинация инсулина с аГПП-1
Чтобы упростить совместный прием базального инсулина и аГПП-1, эти два препарата могут вводиться совместно в одной инъекции в комбинации с фиксированным соотношением (IDegLira), производство которой было запущено в Великобритании в 2014 году (источник 147). IDegLira включает в себя 50 Ед инсулина деглудека с 1,8 мг лираглутида [147]; комбинация титруется тем же способом, как и инсулин в монотерапии [147].
В РКИ длительностью 26 недель [284], включающих пациентов, никогда не принимавших инсулин, уровень HbA1c снизился на 1,9%±1,1% при приеме IDegLira по сравнению с 1,4%±1,0% при приеме лираглутида. Группа, принимавшая IDegLira, реже сообщала о тошноте и гипогликемии по сравнению с группой, принимавшей лираглутид, и в ней реже встречалась гипогликемия по сравнению с группой, принимавшей инсулин деглудек [284]. Эти положительные эффекты сохранялись на протяжении 55 недель — снижение HbA1c составило 1,84%, 1,40% и 1,21% для IDegLira, инсулина деглудека и лираглутида соответственно [285]. Уровни ГПН к концу исследования были одинаковы как при приеме IDegLira (5,7 ммоль/л), так и при приеме инсулина деглудека (6,0 ммоль/л), но выше с лираглутидом (7,3 ммоль/л) [285]. При приеме IDegLira улучшение гликемического контроля было достигнуто с дозой инсулина на 37% меньшей по сравнению с инсулином деглудеком [285]. Прием IDegLira связывают со значительно большим снижением массы тела (расчетная терапевтическая разница -2,80 кг, P <0,0001) и на 37% меньшим уровнем гипогликемии в сравнении с инсулином деглудеком [285]. У пациентов, уже получавших базальный инсулин, уровень HbA1c снизился на 1,9% при приеме IDegLira против 0,9% при приеме инсулина деглудека (разница между видами -1,1%, ДИ 95% от -1,3% до -0,8%, P <0,0001). Средний показатель снижения веса с IDegLira был 2,7 кг, при приеме инсулина деглудека изменений в весе обнаружено не было. Частота возникновения гипогликемии была на одном уровне (24% для IDegLira против 25% для инсулина деглудека) [286]. Другая фиксированная комбинация ликсисенатида и инсулина гларгина завершила III фазу испытаний и уже подана заявка на регистрацию в FDA [287, 288].
Ингибиторы SGLT2
К ингибиторам SGLT2, доступным в клинической практике в Европе и Северной Америке, относятся дапаглифлозин, канаглифлозин и эмпаглифлозин. В тех случаях, когда диеты и физических упражнений недостаточно, а также при плохой переносимости метформина данные препараты могут быть назначены в рамках монотерапии или дополнительной терапии к другим гипогликемическим средствам, в том числе к инсулину [289]. Поскольку эффективность перечисленных препаратов находится в непосредственной зависимости от почечной фильтрации глюкозы, ингибиторы SGLT2 не стоит начинать принимать пациентам с показателем рСКФ <60 мл/мин/1,73 м2. Однако, если пациент уже проходит терапию одним из препаратов данной группы (например, канаглифлозин или эмпаглифлозин) и хорошо его переносит, тогда лечение можно продолжать и при более низких показателях рСКФ, но не ниже, чем 45 мл/мин/1,73 м2 (источник 290).
Механизм действия
SGLT работают по принципу вторично активного котранспорта, а именно, переносят ионы натрия по градиенту концентрации внутрь клетки, что сопряжено с транспортом определенных гексоз или других молекул против градиента их концентрации [291]. В кишечнике и почках SGLT осуществляют транспорт глюкозы через апикальную мембрану внутрь энтероцитов/проточных эпителиоцитов; GLUT обеспечивают пассивный транспорт глюкозы через базолатеральную мембрану по градиенту концентрации [289, 292, 293].
Основными представителями натрий-глюкозных котранспортеров являются SGLT1 и SGLT2, которые главным образом ответственны за поглощение глюкозы в кишечнике (SGLT1) и реабсорбцию основной части отфильтрованной глюкозы в почках (SGLT2) [291, 294]. SGLT2 обладает низкой аффинностью, но высокой активностью, реабсорбируя большие количества глюкозы в сегменте S1 проксимальных канальцев. Также синтезируемый в почках SGLT1, напротив, является высокоаффинным транспортером глюкозы с низкой активностью и потому он подходит для работы при низких концентрациях глюкозы, тоже в проксимальных канальцах, но уже в сегменте S3 [294–296].
Конкурентное ингибирование SGLT2 позволяет выводить из организма 60-90 грамм глюкозы в сутки [297], однако данное количество может существенно варьировать в зависимости от состояния почечной функции и степени гипергликемии [289]. Эффекты ингибиторов SGLT2 ослабевают по мере устранения гипергликемии (меньшее количество глюкозы фильтруется в почках), так как процесс ингибирования SGLT2 является самолимитирующим. Ингибирование SGLT2 не зависит от инсулина и потому сниженная функциональная активность β-клеток поджелудочной железы или инсулинорезистентность не влияют на эффективность данного процесса [28, 289]. Тем не менее, этот факт не отменяет важной роли инсулина, поскольку ингибирование SGLT2 не затрагивает эндокринопатии, лежащие в основе патогенеза СД2, за исключением снижения эффектов глюкозотоксичности [28, 289]. Подавление активности SGLT2 и закономерно следующая за этим глюкозурия обуславливают умеренное диуретическое действие и потерю калорий, в результате чего несколько снижается артериальное давление и вес [28, 289]. Однако потеря веса, вызванная ингибиторами SGLT2, ниже, чем можно предположить, исходя из степени глюкозурии; обычно снижение массы тела составляет ¼-⅓ от потерь, рассчитанных по глюкозурии. Причины данного эффекта частично кроются в увеличении количества потребляемых калорий, что отрицательно коррелирует с исходным показателем ИМТ и положительно — с исходным показателем рСКФ [298]. По результатам РКИ [299] с участием 95-ти пациентов, прием аГПП-1 (препятствуют повышенному потреблению пищи) в дополнение к терапии канаглифлозином в дозировке 300 мг/сут приводил к значительному снижению веса в течение 18-ти недель по сравнению с группой пациентов, принимавших плацебо (разница средних наименьших квадратов для изменений веса составила 3,2%, ДИ 95% от -4,5% до -2,0%).
Фармакокинетика
Период полувыведения имеющихся ингибиторов SGLT2 находится в пределах от 10,6 до 13,3 часов [289, 300–304] (см. дополнительную информацию, S7 (вставка)). Наиболее специфичным является эмпаглифлозин. Ингибирование SGLT2 за счет приема дапаглифлозина (10 мг/сут), канаглифлозина (300 мг/сут) или эмпаглифлозина (25 мг/сут) ведет к повышению выведения глюкозы с мочой до 60-90 г/сут [289, 302, 303]. Метаболизм ингибиторов SGLT2 осуществляется при помощи уридиндифосфат-глюкуронилтрансферазы, никаких существенных взаимодействий с другими лекарственными препаратами пока не выявлено [289, 305, 306].
Фармакодинамика
Период полувыведения имеющихся ингибиторов SGLT2 находится в пределах от 10,6 до 13,3 часов [289, 300–304] (см. дополнительную информацию, S7 (вставка)). Наиболее специфичным является эмпаглифлозин. Ингибирование SGLT2 за счет приема дапаглифлозина (10 мг/сут), канаглифлозина (300 мг/сут) или эмпаглифлозина (25 мг/сут) ведет к повышению выведения глюкозы с мочой до 60-90 г/сут [289, 302, 303]. Метаболизм ингибиторов SGLT2 осуществляется при помощи уридиндифосфат-глюкуронилтрансферазы, никаких существенных взаимодействий с другими лекарственными препаратами пока не выявлено [289, 305, 306].
Дапаглифлозин. В ходе 24-недельного РКИ [307] при сравнении группы пациентов с СД2, не получавших ранее медикаментозного лечения, и группы плацебо было зафиксировано, что прием дапаглифлозина в дозировке 5-10 мг/сут ведет к снижению уровня HbA1c на 0,8-0,9% и снижению массы тела на 2,8-3,2 кг. Мета-анализ нескольких РКИ [308] продолжительностью от 12 до 104 недель показал, что дапаглифлозин (2,5-10,0 мг/сут), принимаемый в сочетании с метформином, инсулином, тиазолидиндионами, препаратами сульфонилмочевины, метформином в комбинации с ситаглипином или без него улучшает показатели уровня HbA1c и глюкозы крови натощак, а также ведет к снижению веса по сравнению с контрольной группой (разность средних между группами составила -0,52%, ДИ 95% от -0,60% до -0,45%, -1,52 ммоль/л, ДИ 95% от -1,75 ммоль/л до -1,29 ммоль/л, и -1,61 кг, ДИ 95% от -1,97 кг до -1,26 кг соответственно). Снижение уровня HbA1c и концентрации глюкозы в крови натощак относительно группы, получающей плацебо, было, в целом, сходным при различных видах стандартной терапии, однако наибольшего снижения показателя удалось достичь при комбинировании дапаглифлозина с производными сульфонилмочевины (-0,96%, ДИ 95% от -0,86% до -0,52%, и -1,47 ммоль/л, ДИ 95% от -1,86 ммоль/л до -1,08 ммоль/л) [308]. Наибольшая разница между испытуемыми группами относительно изменения веса была отмечена при комбинации инсулина с дапаглифлозином (-2,45 кг, ДИ 95% от -2,99 кг до -1,92 кг) [308].
Результаты сравнения дапаглифлозина и глипизида (52-недельное РКИ, продленное до 156 недель) [309] свидетельствуют о том, что дапаглифлозин приводит к меньшему снижению уровня HbA1c в ходе начального периода титрации (18 недель), однако в период с 18 по 104 неделю коэффициент отказов при приеме дапаглифлозина был ниже (0,13% в год), чем при приеме глипизида (0,59% в год). Кроме того прием дапаглилозина к 104-й неделе вызывал более выраженное снижение уровня HbA1c (разница с глипизидом составила -0,18%, ДИ 95% от -0,33% до -0,03%, Р=0,021) [309]. Также приемом дапаглифлозина были обусловлены устойчивое снижение массы тела и систолического давления (104-недельные различия с глипизидом составили -5,1 кг, ДИ 95% от -5,7 кг до -4,4 кг, и -3,9 мм рт. ст., ДИ 95% от -6,1 мм рт. ст. до -1,7 мм рт. ст. соответственно) [309]. По итогам РКИ [310] с участием 180 пациентов с СД2, получавших метформин (которого, однако, было недостаточно в качестве единственного терапевтического средства для адекватной коррекции патологического состояния), умеренное снижение веса при добавлении к имеющейся терапии дапаглифлозина существенно улучшило качество жизни пациентов по сравнению с плацебо на протяжении 102-х недель. РКИ [311], проведенное среди 18-ти мужчин с диагнозом СД2, показало, что в сравнении с плацебо дапаглифлозин повышает секрецию глюкагона уже через час после приема, с пиком через 4 часа. Через 3 дня применения дапаглифлозина концентрация глюкагона в плазме крови натощак была на 32% выше, чем в первый день, при этом в группе плацебо значения данного показателя остались без изменений [311]. Подъем уровня глюкагона сопровождался и повышением образования эндогенной глюкозы [311]. Механизмы, лежащие в основе данного, по-видимому, компенсаторно развивающегося процесса, неизвестны, но в α-клетках поджелудочной железы была зафиксирована экспрессия SGLT2 [312].
Канаглифлозин. Согласно мета-анализу РКИ, канаглифлозин снижает уровень HbA1c в монотерапии (ВРС -1,08%, ДИ 95% от -1,25% до -0,90%, P <0,00001) и в качестве дополнительного препарата (-0,73%, ДИ 95% от -0,84% до -0,61%, P<0,00001) по сравнению с плацебо [313]. Сравнение с активным контролем показало, что снижение уровня HbA1c, связанное с приемом канаглифлозина, составляет -0,21% (ДИ 95% от -0,33% до -0,08%, P = 0,001) [313]. Канаглифлозин вызывает более существенное снижение уровня HbA1c при сопоставлении значений данного показателя с ситаглипином (-0,24%, ДИ 95% от -0,40% до -0,09%, P = 0,002) и глимепиридом (-0,12%, ДИ 95% от -0,23% до -0,01%, P=0,03) [313], и снижает показатель ГПН по сравнению как с плацебо (-33,50 мг/дл, ДИ 95% от -39,22 мг/дл до -27,78 мг/дл, P <0,00001), так и с активным контролем (-15,86 мг/дл, ДИ 95% от -23,17 мг/дл до -8,56 мг/дл, P <0,00001) [313]. Потеря веса при приеме канаглифлозина была более значительной, чем в группе плацебо (-2,81 кг, ДИ 95% от -3,26 кг до -2,37 кг), то же справедливо и относительно активного контроля (-3,49 кг, ДИ 95% от -4,86 кг до -2,12 кг), при этом в сравнении с глимепиридом разница значений была особенно высока (-5,40 кг, ДИ 95% от -5,95 кг до -4,85 кг, P <0,00001) [313].
Канаглифлозин в качестве дополнительной терапии к инсулину (базально-болюсный режим) приводил к значительному снижению уровня HbA1c (исходное значение 8,3%) по прошествии 18-ти недель (достигнутое значение сохранялось до 52-х недель), относительно плацебо (-0,62%, ДИ 95% от -0,69% до -0,54%, P<0,001 при приеме 100 мг канаглифлозина, и -0,73%, ДИ 95% от -0,81% до -0,65%, P <0,001 при приеме 300 мг канаглифлозина) [314]. В ходе РКИ с участием 37 пациентов испытуемые получали 2 дозы канаглифлозина, при этом вторая доза составляла 300 мг и вводилась непосредственно перед проведением теста толерантности к смешанной пище; постпрандиальная концентрация глюкозы была ниже (по сравнению с плацебо), однако не было отмечено дальнейшего увеличения экскреции глюкозы с мочой, что может указывать на запуск таких механизмов, как ингибирование SGLT1 в кишечнике [315]. Снижение концентрации глюкозы и веса оказалось более стабильным при приеме канаглифлозина, чем препаратов сульфонилмочевины, что было отмечено по итогам 104-недельного наблюдения [316].
Влияние канаглифлозина на артериальное давление выражается в снижении систолического и диастолического давления, что было зафиксировано при сравнительном анализе с плацебо (САД −5,05 мм рт. ст., ДИ 95% от −6,81 мм рт. ст. до −3,28 мм рт. ст., P<0,00001, ДАД −2,43 мм рт. ст., ДИ 95% от −3,29 мм рт. ст. до −1,57 мм рт. ст., P<0,0001) и с активным контролем (САД −4,34 мм рт. ст., ДИ 95% от −5,31 мм рт. ст. до −3,36 мм рт. ст., P <0,00001, ДАД −2,17 мм рт. ст., ДИ 95% от −2,79 мм рт. ст. до −1,54 мм рт. ст., P <0,00001) [313].
Эмпаглифлозин. По данным, полученным в ходе 24-недельного РКИ [317–320], прием эмпаглифлозина как в монотерапии, так и в комбинации с метформином или с метформином и препаратами сульфонилмочевины или же с пиоглитазоном с метформином и без него, позволил добиться снижения уровня HbA1c, массы тела и САД на 0,7–0,8%, 1,5–2,5 кг и 2,9–4,1 мм рт.ст. соответственно, что значимо отличалось от показателей группы с плацебо. Достигнутые приемом эмпаглифлозина снижение уровня HbA1c и потеря веса сохранялись также в дополнительном РКИ, продленном до 76-ти недель [321–324].
По результатам сравнения эмпаглифлозина и ситаглипина в качестве средств монотерапии на протяжении 24-х недель, оба препарата снижали уровень HbA1c в равной степени, но большее снижение концентрации глюкозы крови натощак, массы тела и САД было отмечено при приеме эмпаглифлозина [317]. В качестве дополнительного средства в комбинации с метформином эмпаглифлозин не уступал глимепириду, и на протяжении 104-х недель было зафиксировано меньше случаев гипогликемии [325].
Прием эмпаглифлозина пациентами, получающими базальный инсулин (совместно или без добавочного приема метформина с препаратами сульфонилмочевины или же без них) за 78 недель привел к снижению уровня HbA1c на 2,0-2,5%, а также к снижению веса на 2,4-4,1 кг по сравнению с приемом плацебо [326]. Дополнение множественных суточных инъекций инсулина эмпаглифлозином в различных дозах (10 мг и 25 мг) и плацебо отразилось на уровне HbA1c, понизив его в разной степени (−1,18±0,08%, −1,27±0,08%, −0,81±0,08% соответственно), через 52 недели [327]. Также дополнение терапии эмпаглифлозином позволяет снижать дозу вводимого инсулина (на 9-11 МЕ в сутки) и обеспечивает снижение массы тела (от -2,4 до -2,5 кг), не повышая риск развития гипогликемии [327].
По данным 12-недельного РКИ [328], проведенного среди пациентов с СД2, исходные значения САД и ДАД которых находились в пределах 130–159 мм рт. ст. и 80–99 мм рт. ст. соответственно, скорректированная разность средних между исходным значением САД и средним значением САД за 24 часа при сравнении с плацебо составила -4,16 мм рт.ст. (ДИ 95% от −5,50 мм рт.ст. до −2,83 мм рт.ст.), для ДАД данный показатель был равен −1,72 мм рт. ст. (ДИ 95% от −2,51 мм рт. ст. до−0,93 мм рт. ст.), доза получаемого пациентами эмпаглифлозина составляла 25 мг (в обоих случаях P <0,001).
Скорректированная разность среднего снижения уровня HbA1c, подсчитанная при сравнении эмпаглифлозина с плацебо, была равна −0,68% (ДИ 95% от −0,88% до −0,49%), среди пациентов с рСКФ в пределах от 60 до 90 мл/мин/1,73 м2, и −0,42% (ДИ 95% от −0,56% до −0,28%), у пациентов с рСКФ в пределах от 30 до 60 мл/мин/1,73 м2 [329]. Наблюдение обеих групп осуществлялось в течение 24-х недель, была отмечена хорошая переносимость терапии [329].
Безопасность и побочные эффекты
Риск развития гипогликемии при приеме ингибиторов SGLT2 невелик, за исключением комбинирования с инсулином или производными сульфонилмочевины [289]. Низкий риск гипогликемии тесно связан со способностью неингибированного SGLT2 (и SGLT1) реабсорбировать все то небольшое количество глюкозы, прошедшей фильтрацию, когда уровень глюкозы в крови понижен, что подчеркивает самолимитирующую природу данного механизма [289]. По сравнению с производным сульфонилмочевины глипизидом,прием дапаглифлозина ассоциирован со значительно меньшим риском гипогликемии (4,2% против 45,8%), что подтверждено результатами РКИ длительностью 104 недели с участием 814 пациентов с СД2 [309]. Как монотерапия канаглифлозином, так и использование его в комбинациях, были сопряжены со сходным риском гипогликемии по сравнению с плацебо, за исключением одновременного приема с производными сульфонилмочевины (относительный риск 1,49, ДИ 95% 1,14–1,95, P = 0,004) [313]. Процент пациентов с зафиксированными случаями гипогликемии во время приема эмпаглифлозина составил менее 1% среди пациентов, получавших препарат в качестве монотерапии, 1,4-2,4% — при приеме комбинации эмпаглифлозина с метформином или пиоглитазоном, 11,5-16,1% — при сочетании с производными сульфонилмочевины, и 35-58% — в комбинации с инсулином [28, 239, 305].
Прием ингибиторов SGLT2 связан с повышенным риском генитальных инфекций, однако данные относительно увеличения частоты случаев мочеполовых инфекций значительно разнятся [289]. Сравнение дапаглифлозина с препаратами сульфонилмочевины указало на взаимосвязь с повышенным риском как генитальных инфекций, так и инфекций мочевыводящих путей (для дапаглифлозина риск составил 14,8% и 13,5% соответственно, для глипизида — 2,9% и 9,1% соответственно) [309]. При использовании канаглифлозина не было отмечено увеличения риска развития инфекций мочевыводящих путей, тем не менее, риск инфекций половых путей оказался повышен (относительный риск 3,76, ДИ 95% 2,23-6,35, P<0,00001 против плацебо, относительный риск 4,95, ДИ 95% 3,25-7,52, P <0,00001 против активного контроля); при этом наибольший риск развития указанных инфекций был отмечен у женщин, но ни один из зарегистрированных случаев не был тяжелым, и инфекции поддавались простейшим методам лечения [313]. По результатам сводного анализа РКИ [330] генитальные грибковые инфекции наиболее часто развивались в ходе терапии канаглифлозином в дозе 100 мг и 300 мг по сравнению с плацебо; среди женщин частота развития инфекций составила 10,4%, 11,4% и 3,2% соответственно, среди мужчин – 4,2%, 3,7% и 0,6% соответственно. Сходные результаты получены и при сравнении канаглифлозина с активным контролем: 14,7%, 13,9% и 3,1% у женщин, 7,3%, 9,3% и 1,6% у мужчин [330]. Как правило, инфекции протекали в легкой форме и не составляли труда в лечении, но для большинства зарегистрированных случаев отсутствуют заключения лабораторных исследований [330]. Точно так же по результатам одних исследований анализ свойств канаглифлозина обнаруживает взаимосвязь между его приемом и развитием инфекций мочевыводящих путей, однако в других исследованиях эта связь уже не подтверждается, тогда как абсолютно все исследования свидетельствуют о наличии повышенного риска генитальных инфекций [305].
Также прием ингибиторов SGLT2 ассоциирован с некоторым повышением как уровня холестерина ЛПНП, так и ЛПВП; данный эффект может быть более выражен при приеме канаглифлозина, чем других ингибиторов SGLT2 [313, 331]. Результаты различаются относительно риска осмотической полиурии и гиповолемии [289, 332]. По данным мета-анализа [313], риск различных побочных эффектов, опосредованных осмотическим диурезом, возрастает при использовании канаглифлозина по сравнению с плацебо (относительный риск 3,93, ДИ 95% 2,25–6,86, P<0,00001) или с активным контролем (относительный риск 2,57, ДИ 95% 1,26-5,25, P=0,009), тогда как объем-зависимые эффекты были сходными во всех исследуемых группах. В рамках 12-недельного РКИ [333] у пациентов, принимавших канаглифлозин в дозе 300 мг, было отмечено уменьшение объема плазмы в первую неделю исследования (−5,4% против 4,3% в группе плацебо, P=0,02) в сочетании с увеличением объема мочи, к 12-ой неделе оба эффекта затухали. Сводный анализ данных более 11000 пациентов с СД2 [334] не выявил зависимости между приемом канаглифлозина и частотой развития реакций, вызванных уменьшением внутрисосудистого объема, однако наиболее часто подобные эффекты были характерны для пациентов старше 75 лет, принимавших канаглифлозин в дозе 25 мг, а также для пациентов, терапия которых предусматривала прием петлевых диуретиков в сочетании с канаглифлозином в дозе 10 мг.
Ингибиторы SGLT2, особенно канаглифлозин, могут вызывать такие побочные эффекты, как повышение риска переломов. Результаты РКИ [335] дапаглифлозина показали отсутствие влияния на маркеры формирования и резорбции костей, а также на минеральную плотность костей после 50 недель терапии больных СД2 (как у мужчин, так и у женщин после менопаузы) с неадекватным контролем заболевания метформином [334, 335]. Однако в некоторых иследованиях было показано влияние канаглифлозина на содержание кальция в моче и на содержание фосфатов и 1,25-дигидроксивитамина D в плазме крови [336]. В 26-недельном РКИ [336] (продленным до 78 недель), включавшем 716 больных СД2 возрастом 55-80 лет, прием канаглифлозина вызывал снижение общей минеральной плотности тазовых костей на протяжении 104 недель (изменения по разнице от плацебо −0,9% и −1,2% для 100 мг и 300 мг канаглифлозина соответственно), но этот эффект не наблюдался в других костях. В анализе объединенных данных восьми исследований (n=5867) была отмечена схожая частота переломов как при приеме канаглифлозина (1,7%), так и без него (1,5%) (ОР 1,09, ДИ 95% 0,71–1,66) [337]. Отдельный анализ результатов исследования CANVAS (n=4327) показал такие побочные эффекты канаглифлозина, как значительное повышение частоты переломов при приеме (4,0%) по сравнению с плацебо (2,6%; ОР 1,51, ДИ 95% 1,04–2,19) и учащение падений [337]. Однако пациенты в CANVAS были старше, чем в других аналогичных исследованиях (62,4±8,0 лет против 57,6±9,8 лет), имели повышенный риск заболеваний сердечно-сосудистой системы, более низкую исходную рСКФ и более часто принимали диуретики [337]. Также описано несколько случаев эугликемического и гипергликемического диабетического кетоацидоза при приеме ингибиторов SGLT2 больными СД2 [338-341]. Распространенноть диабетического кетоацидоза при приеме канаглифлозина среди 17596 пациентов, участвовавших в рандомизированных исследованиях (n=12), составила 0,07% [341]. Многие из больных СД2, у которых развился кетоацидоз, находились на лечении инсулином и во время развития кетоацидоза принимали пониженную дозу инсулина, останавливали его прием или же страдали каким-либо присоединившимся заболеванием, которое могло повысить потребность тканей в глюкозе [342]. Дефицит инсулина приводил к активации липолиза и превращению избытка жирных кислот в кетоновые тела, однако гипергликемия, связанная с приемом ингибиторов SGLT2, была средней выраженности, возможно, благодаря тому, что они снижают уровень глюкозы в крови [338, 339, 342]. Поэтому пациентам, проходящим лечение инсулином и ведущим самомониторинг гликемии, не следует прекращать прием инсулина, когда они обнаруживают снижение гликемии после приема ингибиторов SGLT2. Терапия этими препаратами может улучшить контроль гликемии, но не устраняет потребность в инсулине.
Анализ объединенных данных II и III фаз испытаний подтвердил положительные эффекты дапаглифлозина относительно сердечно-сосудистых заболеваний [65]. Осложнения со стороны сердечно-сосудистой системы у пациентов, принимавших ингибиторы SGLT2, были изучены в нескольких РКИ. В исследовании, проведенном с участием 7200 больных СД2 с высоким риском сердечно-сосудистых осложнений, частота наступления составной конечной точки из нефатального ИМ, нефатального инсульта и смерти от сердечно-сосудистых осложнений при приеме эмпаглифлозина (в дополнение к стандартной терапии) была ниже по сравнению с плацебо (ОР 0,86, ДИ 95%, 0,74-0,99, P=0,04 для сравнения по превосходству) [343]. Прием эмпаглифлозина снижал риск смерти от сердечно-сосудистых (ОР 0,62, ДИ 95%, 0,49–0,77, P<0,001) и любых других причин (ОР 0,68, ДИ 95%, 0,57–0,82, P<0,001), а также госпитализации из-за сердечной недостаточности (ОР 0,65, 95% CI, 0,50–0,85, P=0,002) [343]. Анализ подгрупп показал гетерогенность первичного результата; положительный эффект эмпаглифлозина был более выражен среди азиатской популяции, у пациентов с ИМТ<30 кг/м2 и уровнем HbA1c<8,5%, а также у пациентов без нефропатии и у пациентов, не находившихся на лечении инсулином [343]. С интересом ожидаются результаты других исследований влияния дапаглифлозина и канаглифлозина на сердечно-осудистые заболевания.
Другие соединения
Агонисты D2 рецепторов дофамина
Бромокриптин быстрого высвобождения (бромокриптин QR – quick release) представляет собой агонист D2-рецепторов, зарегистрированный для лечения СД2 в некоторых странах за пределами Европы в качестве дополнения к мерам по изменению образа жизни [344, 345]. Влияние бромокриптина на параметры гликемии начали замечать с 1980 г. [346]. Препарат обеспечивает утренний подъем уровня дофамина в гипоталамусе совместно с нормальной регуляцией гликемии на протяжении дня и способствует снижению симпатического тонуса, нейрональной супрессии синтеза глюкозы в печени и улучшению усвоения глюкозы на периферии, при этом не влияя на уровень инсулина [28, 344, 346, 347]. В мета-анализе было показано, что дополнительная терапия бромокриптином QR по сравнению с плацебо снижала уровень HbA1c (-6,52 ммоль/моль, ДИ 95% от -8,07 ммоль/моль до -4,97 ммоль/моль) и ГПН (-1,04 ммоль/л, ДИ 95% от -1,49 ммоль/л до -0,59 ммоль/л), но не оказывала эффект на постпрандиальный уровень глюкозы [346]. Прием бромокриптина QR не оказывал влияния на вес, не повышал риска гипогликемии и гипотензии и не влиял на сердечно-сосудистую систему [346]. Однако бромокриптин QR гораздо чаще (по сравнению с плацебо) вызывает побочные эффекты со стороны ЖКТ, такие как тошнота и рвота [346]. В РКИ, охватывавшем 3095 пациентов, было показано, что бромокриптин (как в монотерапии, так и дополнительно к гипогликемическим препаратам, включая инсулин) снижал риск заболеваний сердечно-сосудистой системы на протяжении 52 недель (ОР 0,60 ДИ 95% 0,35-0,96, по сравнению с плацебо).
Секвестранты желчных кислот
Секвестранты желчных кислот используются для лечения дислипидемии и их прием связан со снижением риска сердечно-сосудистых заболеваний [350]. В 2008 году FDA одобрило применение колесевелама в качестве дополнительной меры к изменению образа жизни для улучшения контроля гликемии у пациентов с СД2. Механизм действия препаратов может включать связывание и перенос желчных кислот по кишечнику с возможной активацией рецепторов желчных кислот на L-клетках, стимулируя таким образом секрецию ГПП-1. Ингибирование возврата желчных кислот в печень также может влиять на метаболизм глюкозы путем препятствия активации фарнезоидных рецепторов печени [28]. В сравнении с плацебо колесевелам снижал уровень HbA1с на 0,30-0,54% и не повышал риск гипогликемии или набора веса в комбинации с метформином, производными сульфонилмочевины, пиоглитазоном или инулином [350, 351]. Несмотря на его благоприятное влияние на уровень холестерина ЛПНП и ЛПВП, колесевелам повышает в крови уровень триглицеридов на 11-22% [350].
Прамлинтид
Прамлинтид, растворимый аналог островкового амилоидного полипептида, был введен в практику в 2005-м как инъекционная добавка к базально-болюсному инсулину, вводимая во время приема пищи [352]. Он улучшает контроль гликемии и веса путем центрального влияния на область, называемую “самое заднее поле” (area postrema, участок ромбовидной ямки), которая активирует нейрональные цепи, усиливающие чувство насыщения, вызывающие снижение секреции глюкагона в поджелудочной железе и замедляющие опорожнение желудка [352]. Умеренное снижение HbA1с на 0,3-0,6% обычно сопровождается снижением массы тела на 1-2 кг и снижением потребности в болюсном инсулине [352]. Добавление прамлинтида в инъекциях усложняет прием пищи и требует контроля дозы для минимизации риска тошноты и гипогликемии [352].
Алгоритм лечения
Арсенал способов лечения пациентов с СД2 на сегодняшний день расширен за счет новых классов препаратов с различными механизмами действия, низким риском гипогликемии и благоприятным влиянием на массу тела. Наличие нескольких препаратов в пределах одного класса предоставляет выбор относительно фармакокинетики, фармакодинамики, времени и способа доставки действующего вещества к мишени. Тем не менее, сравнения отдельных препаратов могут быть затруднены отсутствием долговременных прямых сравнительных исследований, а определение удобства препарата для конкретного пациента осложнено отсутствием исследований конкретного препарата на различных подгруппах испытуемых. Таким образом, стратегия выбора препарата заключается в соблюдении баланса между эффективностью и безопасностью, переносимостью и соблюдением режимом приема, расходами и имеющимися средствами, а также в учете практических проблем относительно реальных мишеней, мониторинга показателей и жизненных ситуаций [36]. Метформин всесторонне изучен и является препаратом терапии первой линии для пациентов с СД2. Растут ожидания относительно ингибиторов SGLT2, и определить место этого класса препаратов в алгоритме лечения помогут результаты проходящих РКИ.
Стоит отметить, что выбор метформина в качестве терапии первой линии основан преимущественно на результатах исследования UKPDS, которое включало 342 пациента, получавших метформин, в то время как эффетивность эмпаглифлозина была показана на 4687 пациентах в исследовании EMPA–REG [343]. Оно включало пациентов с дополнительным заболеваниями и высоким риском сердечно-сосудистых заболеваний, в то время как популяция UKPDS состояла из пациентов с недавно диагностированным СД2. Если целевое значение HbA1с не достигается при приеме метформина на протяжении 3 месяцев, согласно рекомендациям Американской Ассоциации Диабета и Европейской Ассоциации за Изучение Диабета к лечению надо добавить препарат с другим механизмом действия [36].
Хотя перооральные препараты часто будут иметь похожую эффективность, инъекционные (аГПП-1 и инсулин) могут существенней влиять на показатели HbA1с [241]. Однако эффективность оценивают не только по изменению значений HbA1с, она также учитывает целый “набор” эффектов, таких как риск гипогликемии, набор веса, общая переносимость и долговременная безопасность. Например, риск набора веса и гипогликемии при приеме производных сульфонилмочевины и инсулина выше, чем при использовании ингибиторов ДПП-1 и SGLT2 [36]. Тиазолидиндионы вызывают меньший риск гипогликемии, но повышают массу тела и увеличивают риск остановки сердца и переломов по сравнению с плацебо [36].
В лечении очень важен индивидуализированный подход, который учитывает обстоятельства и потребности пациента. Терапевтический арсенал ограничивается, если пациент является водителем, пожилым или же ослаблен, а также у пациентов с заболеваниями почек, нервной системы и иными коморбидностями. Если же добавление второго препарата не приносит успеха в достижении контроля гликемии, может быть назначено введение в терапию третьего лекарственного средства [36]. Большинство классов препаратов могут комбинироваться с увеличением эффективности, хотя добавление ингибиторов ДПП-1 к аГПП-1 нежелательно. При невозможности комбинации трех препаратов требуется назначение инсулина (обычно базальный инсулин плюс метформин). При неэффективности базального инсулина добавляют введение инсулина во время приема пищи, аГПП-1 или, возможно, ингибитора SGLT2 [36]. В этой ситуации добавление аГПП-1 может быть эффективной стратегией, так как они вызывают меньший риск гипогликемии, чем введение инсулина при приеме пищи, и лучше влияют на массу тела. Повышение доступности увеличивающегося числа препаратов, принимаемых реже одного раза в день, может быть привлекательным для многих пациентов и повысить качество жизни. Выводы исследований безопасности препаратов для сердечно-сосудистой системы могут в дальнейшем прояснить алгоритм лечения СД2, также как и введение дополнительных аГПП-1, ингибиторов ДПП-1 и ингибиторов SGLT2, которые пока находятся находятся в разработке [18, 26, 353-357].
Уроки на будущее
Улучшение понимания патогенеза СД2 способствовало разработке новых классов препаратов [358]. Тем не менее, все еще требуются новые соединения с более длительным действием, чем у имеющихся, а также соединения, способные улучшать или препятствовать снижению функции β-клеток. Очевидно, первостепенное значение имеет безопасность препарата. Побочные эффекты, обнаруженные у ряда препаратов, привели к остановке их разработки, что подчеркивает важность ведения фармакологического надзора. Также критически важным для новых подходов лечения является минимизация гипогликемии, набора веса и осложнений со стороны сердечно-сосудистой системы, при этом необходимо избегать любого повышения риска онкологии, особенно если препарат требуется принимать на протяжении многих лет. В реальных условиях препараты назначаются гораздо более широкому спектру пациентов, чем это происходит в клинических испытаниях, кроме того, они могут назначаться низкоквалифицированными врачами, а пациенты могут не проходить такого тщательного контроля и мониторинга, как в РКИ [359]. При рассмотрении вопросов безопасности может оказаться очень трудным интерпретировать результаты доклинических исследований или же иметь наиболее подходящие модели для решения вопроса о продолжении разработки препарата. Другой сложностью является определение, интерпретация и экстраполяция в реальную жизнь побочных эффектов, наблюдаемых в клинических исследованиях [359].
Могут пройти десятилетия и более, прежде чем будет выявлена клиническая важность слабых факторов, обнаруженных в дорегистрационных испытаниях, к тому же это часто осложняется рядом предубеждений, включая назначение лечения и регистрация осложнений. Давление со стороны регуляторных органов, оказываемое ради обеспечения безопасности, увеличивается, но они выполняют сложную задачу по достижению баланса между предостережениями и гарантированием уверенности, что новые подходы будут предоставляться в безопасном, но своевременном порядке [359]. Понимание факторов, ответственных за индивидуальный ответ пациентов на лечение и влияние фармакогенетики на фармакокинетику и эффективность препарата, будет способствовать развитию персонализированных и пациент-ориентированных способов лечения [29].
Заключение
На данный момент доступен широкий спектр гипогликемических препаратов, различными способами влияющих на аспекты патогенеза СД2; все эти подходы различаются по эффективности, удобству использования, побочным эффектам и стоимости. Потенциальная “цена” лечения состоит не только из анализа затраты-выгода, она также основана на “наборе” характеристик, учитывающих долговременную безопасность, переносимость, риск гипогликемии и набора веса, возможность применения при наличии сопутствующих заболеваний и совместимость с другими препаратами. Индивидуализированная терапия может разрабатываться с учетом потребностей и особенностей каждого отдельного пациента и принимать во внимание сложившиеся обстоятельства, доступную информацию и выполняемые задачи.
На данный момент ингибиторы ДПП-4, аГПП-1 и ингибиторы SGLT2 являются препаратами с низким риском гипогликемии (если они не назначаются в комбинации с производными сульфонилмочевины) и набора веса (могут даже способствовать снижению массы тела), однако они дороже других препаратов, таких как производные сульфонилмочевины и меглитиниды. Данные о безопасности этих новых групп воодушевляют и подтверждают необходимость в обеспечении раннего, эффективного и продолжительного контроля СД2. Хотя метформин остается предпочтительным средством начальной терапии (если хорошо переносится), для определения целей терапии и достижения их наиболее безопасным способом требуется персонализированный подход.
