Быстрая последовательная индукция и интубация
Быстрая последовательная индукция (БПИ, англ. «rapid sequential induction» — RSI) и интубация — анестезиологическая техника, которая применяется у пациентов с высоким риском аспирации желудочного содержимого. Цель данной техники — снижение риска аспирации путем максимального уменьшения времени манипуляции, когда дыхательные пути не защищены (от начала индукции до постановки эндотрахеальной трубки (ЭТТ)). Сама концепция БПИ родилась после введения в клиническую практику сукцинилхолина в 1951 году и приема Селлика в 1961 году. Первая публикация, включающая все основные приемы техники БПИ, появилась в 1970 году.
Традиционные компоненты БПИ:
- преоксигенация;
- быстрое введение начальной дозы тиопентала натрия;
- введение сукцинилхолина;
- осуществление давления на перстневидный хрящ (прием Селлика);
- отказ от вентиляции с положительным давлением до постановки ЭТТ.
После появления новых лекарственных средств и улучшения технического обеспечения современная техника БПИ в анестезиологии претерпела некоторые изменения. Стоит отметить, что у новорожденных данная техника не применяется, т. к. для подготовки к оперативному вмешательству данного контингента пациентов используется совершенно иной подход (концепция мультимодальной анальгезии). Современная БПИ проводится по схеме-правилу «7П»: подготовка, преоксигенация, премедикация, плегия, протекция, положение трубки, постинтубационное ведение (рис. 1).
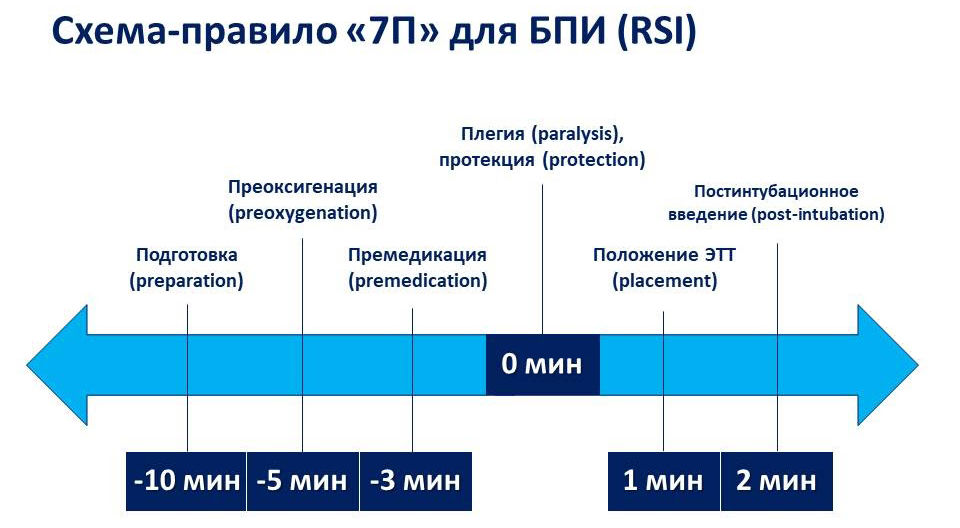
Рисунок 1 | Правило «7П»
Преоксигенация
Первым этапом БПИ является преоксигенация пациента. Целью данного этапа является удаление азота из функционально мертвого пространства и замещение его кислородом, что увеличивает кислородный резерв пациента на период апноэ. Беременные, тучные пациенты, дети, а также пациенты с заболеваниями, вызывающими растяжение кишечника, имеют меньший кислородный резерв, в результате чего снижение SpO2 протекает быстрее.
Варианты преоксигенации:
А. 3–5 минут дыхания 100 % кислородом;
Б. 4 максимально глубоких вдоха в течение 30 секунд;
В. 8 максимально глубоких вдоха в течение 60 секунд.
По возможности должен использоваться вариант А, но при необходимости сокращения времени до интубации возможно использование вариантов Б и В (данные режимы менее эффективны у пожилых пациентов).
Стоит отметить, что в последние годы появилось несколько новых способов преоксигенации, которые проводятся с помощью носовых или носоглоточных канюль, один из них — трансназальная быстрая инсуфляция увлажненным кислородом (THRIVE).
Давление на перстневидный хрящ
Барри Селлик в 1961 году предложил применять давление на перстневидный хрящ для уменьшения риска аспирации желудочного содержимого. Данная техника сразу же была принята, т. к. другой альтернативы на тот момент не было. Селлик предлагал использовать давление силой около 44 Ньютонов (Н), или 4,45 кг. Однако оказалось, что правильное анатомическое использование перстневидного давления выполнить намного сложнее, чем ожидалось. После проведения ряда исследований данные об эффективности и целесообразности данного маневра остаются противоречивыми.
На данный момент рекомендуется давление 10 Н/1 кг для пациентов в сознании и 30 Н/3 кг для пациентов без сознания. Но такое действие указано не как способ защиты от аспирации, а в качестве внешнего воздействия на гортань при трудной интубации трахеи для облегчения визуализации — «BURP»-прием (англ. «back, upward, right lateral, pressure» — назад, вверх, вправо, надавите).
В период апноэ желательно использование мягкой масочной вентиляции: данная манипуляция вряд ли повысит риск аспирации, именно поэтому она была рекомендована в недавних гайдлайнах Общества трудных дыхательных путей (DAS). При адекватном давлении на перстневидный хрящ и использовании низких значений положительного давления на вдохе (PIP) раздувания желудка не произойдет. По сравнению с описанной выше техникой, использование масочной вентиляции только после снижения сатурации увеличивает риск раздувания желудка и предикторов срыгивания. Некоторое количество исследований продемонстрировало успешное использование разных типов ларингеальных масок, таких как LMA Classic. Также по результатам исследований рекомендуется вентиляция маской с ограничением по давлению на вдохе Pmax 20 см вод. ст.; интубация должна проводится оротрахеально (ЭТТ № 7,0–8,0). Однако не упоминалось, что желательно использовать ларингеальные маски второго поколения, с портом для желудочного зонда.
Премедикация
Премедикация проводится с целью предотвращения рефлекторной симпатической реакции на ларингоскопию (RSRL), проявляющейся повышением внутричерепного давления (ВЧД), внутриглазного давления (ВГД), развитием кашля и ларингоспазма, тахикардии и артериальной гипертензии. Ларингоскопия и интубация трахеи вызывают рефлекторную симпатическую стимуляцию и связаны с повышенным уровнем катехоламинов.
Есть некоторые анатомо-физиологические особенности, о которых хотелось бы напомнить. Учитывая сложную иннервацию гортани, рефлекторная вегетативная реакция на интубацию у взрослых и детей может различаться. Подробно процесс интубации трахеи будет описан ниже. У взрослых интубация трахеи изогнутым клинком Макинтоша часто сопровождается активацией симпатической ВНС. Связано это с тем, что фарингеальная часть надгортанника, включая грушевидную ямку, иннервируется ветвями языкоглоточного нерва. У детей интубация трахеи прямым клинком Миллера чаще всего сопровождается активацией парасимпатического отдела ВНС, что связано с непосредственным соприкосновением клинка с надгортанником, иннервирующимся ветвями блуждающего нерва. Поэтому в педиатрической практике частым осложнением интубации трахеи является рефлекторная остановка сердца или бронхоспазм. Во избежание RSRL возможно применение следующих лекарственных средств (общепринятый акроним LOAD претерпел некоторые изменения, лидокаин уступил лидирующее место фентанилу):
- фентанил — 2–5 мкг/кг — улучшает условия для интубации, предотвращая выброс катехоламинов в кровь, также можно использовать ремифентанил и альфентанил;
- атропин — 0,02 мг/кг в/в (минимально 0,1 мг), гликопирролат — 0,005 мг/кг в/в для детей и 0,2–0,4 мг в/в для взрослых (прим. редактора — в отличие от детей, у взрослых атропин не является неотъемлемой частью премедикации; абсолютным показанием для назначения на данный момент остается гемодинамически значимая брадикардия, относительным показанием может, например, быть использование кетамина в качестве гипнотика);
- лидокаин — 1,5 мг/кг в/в — уменьшает бронхоспазм и препятствует быстрому повышению ВЧД;
- прекураризация — введение дефасцикуляционной дозы недеполяризующих миорелаксантов (1/20 дозы для интубации или 1/10 ЕД95*).
*ЕД95 — «эффективная доза» — доза МР, которая необходима для 95 % подавления сократительной реакции отводящей мышцы большого пальца в ответ на раздражение локтевого нерва.
У новорожденных детей премедикация может не выполняться, т. к. часто такие пациенты уже находятся на ИВЛ (возможно с рождения) и медикаментозно седатированы. В случае необходимости премедикация может включать в себя в/в введение опиоидов (1–5 мкг/кг), атропина (0,01 мг/кг) для снижения длительности и количества попыток интубации трахеи.
Внутривенные анестетики для БПИ
Следующим этапом является введение внутривенных анестетиков. После введения индукционного агента необходимо осуществлять непрерывное давление на перстневидный хрящ до постановки эндотрахеальной трубки.
На сегодняшний момент для БПИ применяются следующие внутривенные анестетики:
- Пропофол (1,5–2,5 мг/кг в/в у взрослых; 2,5–3,5 мг/кг в/в у детей; 1–1,5 мг/кг в/в у пожилых пациентов). Пропофол — быстродействующий препарат. Может вызывать боль в месте введения. Противопоказан при гемодинамической нестабильности, т. к. вызывает падение артериального давления и снижение общего периферического сопротивления сосудов (ОПСС). Не рекомендуется применять у пациентов с аллергией на сою/яичный белок.
- Тиопентал натрия (2–5 мг/кг в/в). Тиопентал натрия — быстродействующий препарат с короткой продолжительностью действия. Может использоваться у пациентов с черепно-мозговой травмой, эпистатусом. Противопоказан при гемодинамической нестабильности в результате гиповолемии любого генеза, порфирии.
- Мидазолам (0,1–0,3 мг/кг в/в). У нестабильных пациентов необходимо титрование препарата до достижения эффекта. Мидазолам не часто используется при выполнении БПИ из-за относительно позднего начала и меньшей предсказуемости действия. Усиливает гипотензию при использовании с опиатами и барбитуратами. Обладает хорошим амнестическим эффектом.
- Кетамин (1–2 мг/кг в/в). Кетамин вызывает «диссоциативную анестезию», провоцирует повышение АД, тахикардию (противопоказан при ОИМ, аневризме аорты; может быть использован у гемодинамически нестабильных пациентов на фоне гиповолемии любого генеза), вызывает бронходилатацию (препарат выбора у больных с астмой, астматическим статусом). Существующая на данный момент стигма о повышении ВЧД на фоне применения кетамина уходит в прошлое, имеется множество данных о том, что помимо собственного нейропротекторного действия, кетамин за счет стабилизации гемодинамики может улучшать церебральное перфузионное давление (ЦПД), тем самым уменьшая зону вторичного ишемического поражения головного мозга.
- Этомидат (0,2–0,3 мг/кг в/в). Быстродействующий индукционный агент (самый распространенный на территории США). Может вызывать боль в месте введения, тошноту, рвоту, икоту, кашель, непроизвольные движения. Ингибирует синтез кортизола на 12 часов, угнетая функцию надпочечников. Имеет наименее выраженный депрессивный эффект на сердечно-сосудистую систему по сравнению с другими индукционными агентами. На территории РФ не зарегистрирован с 2002 года.
Индукция с помощью ингаляционных анестетиков
Индукция ингаляционными препаратами чаще всего проводится у детей. Одним из наилучших средств является севофлуран. Также существуют показания для проведения последовательной индукции ингаляционными анестетиками и во взрослой практике:
- трахеостомическая или эндотрахеальная канюли;
- тяжелая дисфункция печени и/или почек;
- деформация верхних дыхательных путей;
- короткая шея;
- морбидное ожирение.
Одним из основных параметров при проведении индукции ингаляционными препаратами является минимальная альвеолярная концентрация (МАК) — концентрация анестетика, при которой 50 % пациентов не реагируют на разрез кожи.
Таблица 1 | Значения МАК севофлурана для взрослых и детей с учетом возраста
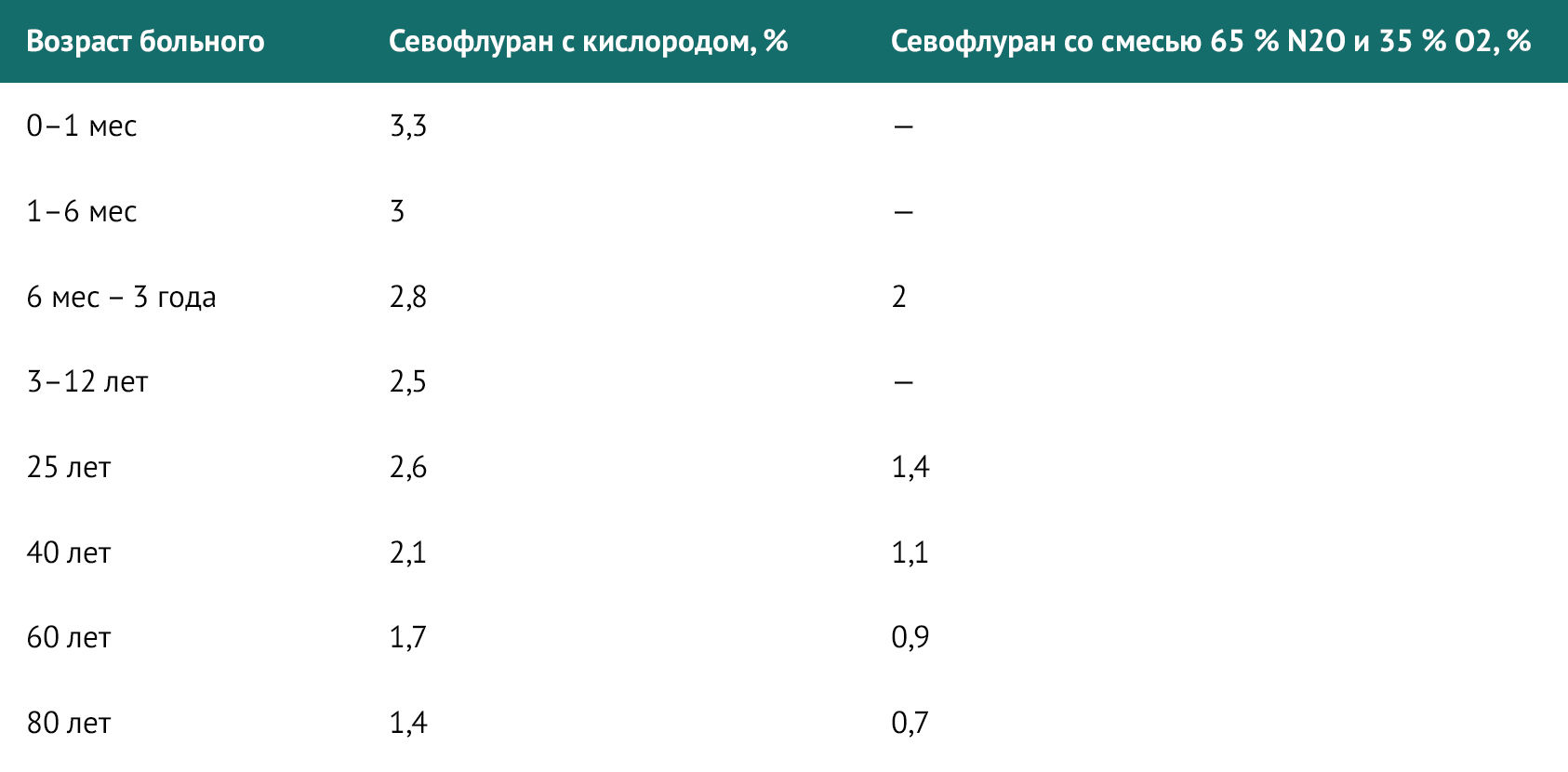
С возрастом МАК снижается. Средняя концентрация севофлурана, обеспечивающая МАК для пациента в возрасте 80 лет, составляет примерно 50 % от таковой у 20-летнего пациента.
У новорожденных для индукции, как правило, используется диазепам 0,5 мг/кг в/в; фентанил 5 мкг/кг; атракурия безилат 0,6 мг/кг.
Нейромышечная блокада
Наиболее часто для нейромышечной блокады используется деполяризующий миорелаксант короткого действия суксаметоний, однако при наличии противопоказаний к нему могут использоваться недеполяризующие миорелаксанты. В последнее время в качестве альтернативы рассматривается недеполяризующий миорелаксант — рокуроний, который в высоких дозах показал такое же время до начала действия и условия интубации, как и суксаметоний.
Суксаметония хлорид (Листенон®) или суксаметония йодид (Дитилин®)
Стандартная доза суксаметония для интубации — 1 мг/кг в/в, при проведении прекураризации доза суксаметония увеличивается до 1,5 мг/кг в/в.
Суксаметоний имеет ряд побочных эффектов, вот некоторые из них:
- Аритмии: суксаметоний может вызывать синусовую брадикардию, АВ-узловые ритмы, в редких случаях — асистолию, а также катехоламин-индуцированные аритмии.
- Гиперкалиемия: введение суксаметония в стандартных дозах вызывает увеличение уровня калия в плазме на 0,5 ммоль/л.
- Повышение ВГД.
- Повышение ВЧД.
- Повышение внутрижелудочного давления и давления нижнего пищеводного сфинктера — в совокупности риск регургитации не увеличивается.
- Злокачественная гипертермия.
Ввиду вышеперечисленных побочных реакций суксаметоний противопоказан при:
- гиперкалиемии;
- ожогах более 10 % поверхности тела;
- массивных повреждениях мягких тканей;
- повреждениях спинного мозга и черепно-мозговых травмах (ЧМТ);
- повреждениях периферических нервов;
- нейромышечных заболеваниях;
- абдоминальном сепсисе;
- злокачественной гипертермии.
Частота некоторых побочных эффектов может быть снижена проведением премедикации и прекураризации. У детей применение суксаметония ограничено ввиду быстрого развития гиперкалиемии, ацидоза, возможности наличия нераспознанного нейромышечного заболевания и, крайне редко, рабдомиолиза.
Проблемы, наиболее часто ассоциированные с применением лекарственных средств данной группы:
- влияние на гемодинамику (снижение артериального давления);
- стимуляция высвобождения гистамина;
- аккумуляция препарата в организме у пациентов с нарушениями функции почек и/или печени.
Рокурония бромид (Эсмерон®)
Доза для интубации — 0,6 мг/кг в/в, при применении для БПИ — 1,2 мг/кг в/в. Начало действия 60–90 секунд, длительность 30–40 минут.
Атракурия безилат (Тракриум®)
Доза для интубации — 0,5–0,6 мг/кг в/в. Начало действия 60–90 секунд, длительность 15–35 минут.
У новорожденных детей используются: пипекурония бромид 10–20 мкг/кг/час; атракурия безилат 0,3–0,6 мг/кг/час; рокурония бромид 0,3–0,6 мг/кг/час.
Интубация трахеи
Стандартной техникой, рекомендованной для интубации, является прямая ларингоскопия. Во взрослой практике для интубации чаще всего используется ларингоскопы с клинками Макинтоша (изогнутые), в неонатальной практике пользуются клинками Миллера (прямые), в педиатрической практике используют и те, и другие в зависимости от возраста и предпочтений врача. У взрослых и новорожденных практически всегда используется оротрахеальная интубация. В педиатрической практике предпочитают назотрахеальную интубацию, для которой дополнительно необходимо использование щипцов Мейнджила.
ЭТТ тоже различаются по своей форме и структуре. Существуют армированные ЭТТ (не изменяет внутреннего просвета при любом сгибании), с заранее сформированным полярным изгибом (так называемые «северные» и «южные»), двухпросветные интубационные трубки (Карленса для левого бронха, Уайта для правого бронха) и т. п. Взрослые и педиатрические ЭТТ имеют на дистальном конце манжету для раздувания, для новорожденных следует применять ЭТТ без манжеты (т. к. при раздувании манжеты чрезвычайно большой риск повреждения трахеи).
Размеры эндотрахеальной трубки для взрослых пациентов варьируют от 6,5 до 9,5; для детей рассчитывается по формуле:
- диаметр ЭТТ = 4 + возраст (в годах)/4
Глубина постановки ЭТТ у мужчин — 22–24 см, у женщин — 20–22 см, для детей рассчитывается по формуле: глубина (см) = 12 + возраст (в годах)/2. Для назотрахеальной интубации глубина постановки ЭТТ (см) = 15 + возраст (в годах)/2.
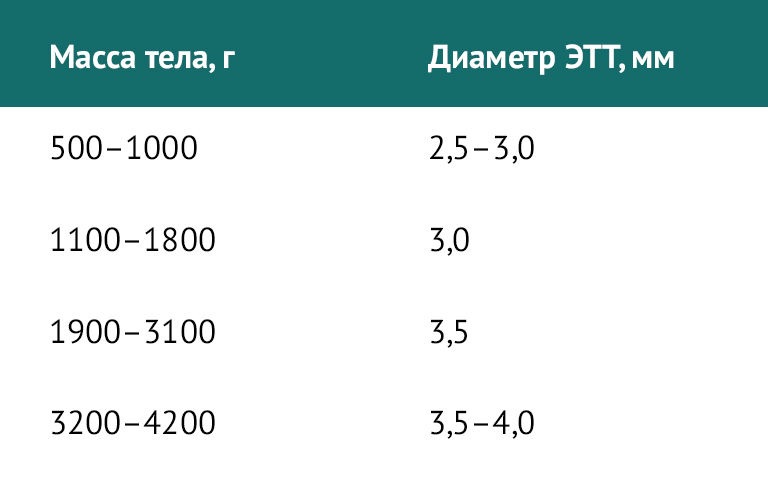
Для новорожденных детей существуют отдельные требования. Диаметр ЭТТ в зависимости от массы тела при рождении представлен в таблице 2.
Таблица 2 | Диаметр ЭТТ у новорожденных детей в зависимости от массы тела
Глубина постановки ЭТТ у новорожденных вычисляется по формуле: масса тела (кг) + 6 см.
Перед интубацией рекомендуется привести пациента в положение «принюхивания» (кроме того существуют классическое джексоновское положение, улучшенное положение Джексона и т. п. при отсутствии признаков повреждения шейного отдела позвоночника). Интубация должна быть проведена максимально быстро.
Верификация положения ЭТТ
Важно убедиться, что ЭТТ не находится в пищеводе и не опустилась в один из главных бронхов. С этой целью возможно использования правила DOPE:
- Displaced in Right mainstem bronchus or esophageus (смещение ЭТТ в правый главный бронх или пищевод);
- Obstruction (обструкция ЭТТ — перекручивание, закусывание);
- Pneumothorax (пневмоторакс);
- Equipment problem or in Esophagus (проблемы с оборудованием или ЭТТ в пищеводе).
Существует множество методов, которыми необходимо пользоваться для верификации положения ЭТТ.
Надежные:
- Прямое визуальное подтверждение нахождения ЭТТ за голосовыми связками.
- Использование фиброоптического ларингоскопа и бронхоскопа для интубации.
- Ультразвук-ассистированная интубация трахеи.
Практически надежные:
- Определение СО2 (количественное и качественное) в выдыхаемом газе (капнография не всегда позволяет точно диагностировать дислокацию ЭТТ, например, при остановке сердечной деятельности).
- Эзофагеальный датчик.
Ненадежные:
- Определение движения грудной клетки и аускультация.
- Аускультация шумов в эпигастральной области.
- Конденсация влаги в ЭТТ.
- Использование назогастральных зондов, желудочных аспираторов и других приспособлений.
- Пульсоксиметрия и определение цвета кожных покровов.
- Рентгенография органов грудной клетки.
Источники:
- Анестезиология: национальное руководство / под ред. А.А. Бунятяна, В.М. Мизикова. – М.: ГЭОТАР-Медиа, 2017. – 1104 с.
- Реанимация и стабилизация состояния новорождённых детей в родильном зале. Методическое письмо под ред. Байбариной Е.Н. 2019. М.: Москва. – 64 с.
- Hazinski M. F., Field J. M. 2010 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care science //Circulation. – 2010. – Т. 122. – №. Suppl. – С. S639-S946.
- El-Orbany M., Connolly L. A. Rapid sequence induction and intubation: current controversy // Anesthesia & Analgesia. – 2010. – Т. 110. – №. 5. – С. 1318-1325.
- Morris J., Cook T. M. Rapid sequence induction: a national survey of practice // Anaesthesia. – 2001. – Т. 56. – №. 11. – С. 1090-1115.
