Пародонтит
Абстракт | К заболеваниям пародонта относят спектр воспалительных состояний, затрагивающих опорный аппарат зуба (десну, альвеолярную кость и периодонтальные связки), которые могут привести к потере зуба и внести свой вклад в развитие системного воспаления. Хронический пародонтит встречается преимущественно у взрослых пациентов, но агрессивные (острые) формы пародонтита могут изредка возникать и у детей. Механизмом начала и развития заболеваний пародонта является дисбиоз комменсальной микрофлоры полости рта (отложение зубного налета), которая взаимодействует с механизмами иммунной защиты хозяина, что приводит к воспалению и развитию заболевания. Эти патофизиологические механизмы наблюдаются вне зависимости от степени активности заболевания до момента устранения его причины (либо удаление зуба, либо удаление микробной биопленки и ликвидация воспаления). Тяжесть пародонтита зависит от средовых и индивидуальных факторов риска: как управляемых (например, курение), так и тех, на которые повлиять нельзя (например, генетическая предрасположенность). Профилактика заключается в ежедневной индивидуальной гигиене полости рта и профессиональной чистке с удалением микробной биопленки раз в 3–6 месяцев. К новым активно развивающимся вариантам лечения относятся антимикробная, иммуномодулирующая, лазерная терапия и восстановление тканей с помощью тканевой инженерии.
Введение
Термин «заболевания пародонта» объединяет широкий спектр хронических воспалительных состояний десны, альвеолярной кости и периодонтальных связок, удерживающих зуб (В зарубежной стоматологии не существует понятия «пародонт» — комплекса, включающего в себя десну, альвеолярную кость, связки периодонта и цемент корня зуба. На западе все это обозначается термином «периодонт». Соответственно, термин «periodontal disease» наиболее точно переводится как «пародонтит». — прим. перев.) (Вставка 1). Начальной фазой пародонтита является гингивит — локализованное воспаление десны, вызванное бактериями зубного налета, представляющего собой микробную биопленку, которая формируется на поверхности зуба и десны (Рис. 1). В данном обзоре под гингивитом подразумевается именно воспаление, вызванное зубным налетом. В тех случаях, когда нелеченый гингивит приводит к потере тканей десны, кости и периодонтальных связок, говорят о хроническом пародонтите. Ключевым признаком этого состояния являются глубокие пародонтальные «карманы», способные в конечном итоге привести к потере зуба. Заболевания пародонта могут вносить вклад в общую воспалительную нагрузку организма, ухудшая такие состояния, как сахарный диабет и атеросклероз [1–3].
Хронический пародонтит считают генерализованным, когда в патологический процесс вовлечено более 10 из 32 зубов человека; при меньшем количестве вовлеченных зубов процесс называют локализованным [4]. Хотя гингивит и хронический пародонтит поддерживаются микробной биопленкой зубного налета, генетические и средовые факторы также влияют на интенсивность заболевания. На данный момент считается, что все заболевания пародонта имеют схожий этиопатогенез. В данном обзоре мы обращаем внимание на патогенез, диагностику, профилактику и ведение пациентов с гингивитом и хроническим пародонтитом — наиболее частыми формами заболеваний пародонта. Аспекты развивающихся вокруг имплантата заболеваний (периимлантантного мукозита и периимплантита; Вставка 1) не отличаются от таковых для заболеваний пародонта, если не указано иного. Кроме того, авторы акцентируют внимание на различиях между гингивитом и хроническим пародонтитом и острыми и некротизирующими формами заболеваний пародонта.
- Гингивит: обратимое воспаление, ограниченное десной.
- Периимплантантный мукозит: гингивит, возникающий вокруг дентальных имплантатов.
- Хронический пародонтит: хроническое воспаление, чаще приводящее к необратимой потере эпителиальной ткани десен, кости и связок.
- Периимплантит: хроническое воспаление, возникающее вокруг дентальных имплантатов и приводящее к потере костной ткани.
- Агрессивный пародонтит: возникает в локализованной и генерализованной форме, обе являются формами хронического воспаления пародонта с ранним началом, проявляющегося, как правило, в период между половым созреванием и третьем десятилетием жизни [165]. Не существует специфических биомаркеров, позволяющих отличить хронический пародонтит от агрессивного пародонтита. Хотя имеющиеся данные позволяют предположить, что обе формы имеют схожую этиологию и гистопатологическую картину и, вероятно, являются двумя точками одного спектра заболевания, в случае с агрессивными пародонтитами наследственный компонент выражен более явно.
- Некротизирующий язвенный гингивит и пародонтит: острые формы заболеваний пародонта, характеризующиеся быстрым течением и связанные с фузиформными бациллами, спирохетами или вирусами, входящими в анаэробную микробную биопленку [166]. Некротизирующие формы встречаются все реже, обычно у ослабленных пациентов.
- Синдромные хронические пародонтиты: форма хронической деструкции пародонта, которую рассматривают как проявление системных заболеваний (например, синдрома Чедиака-Хигаси, дефицита адгезии лейкоцитов и синдрома Папийона-Лефевра). Обычно эти формы связаны с серьезными генетическими нарушениями, влияющими на важные элементы структуры пародонта или на иммунитет организма.
Эпидемиология
Распространенность
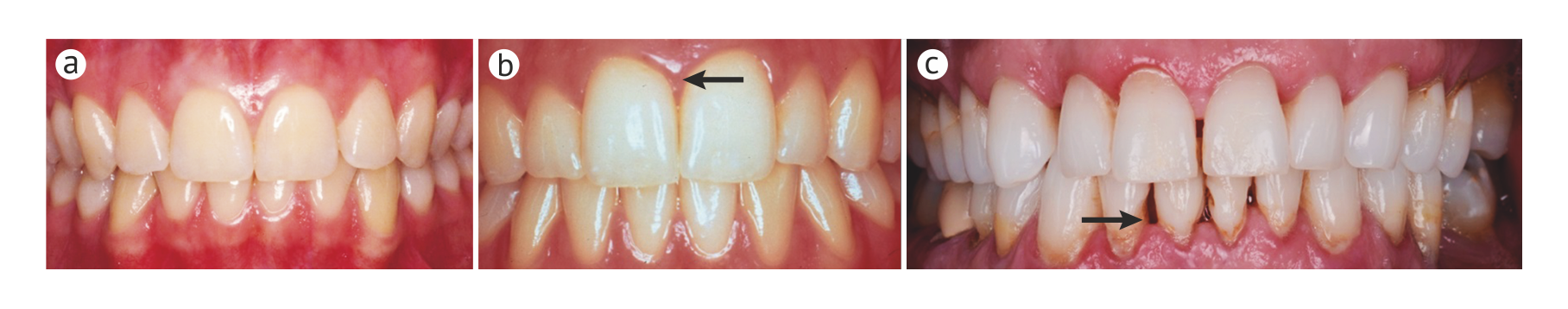
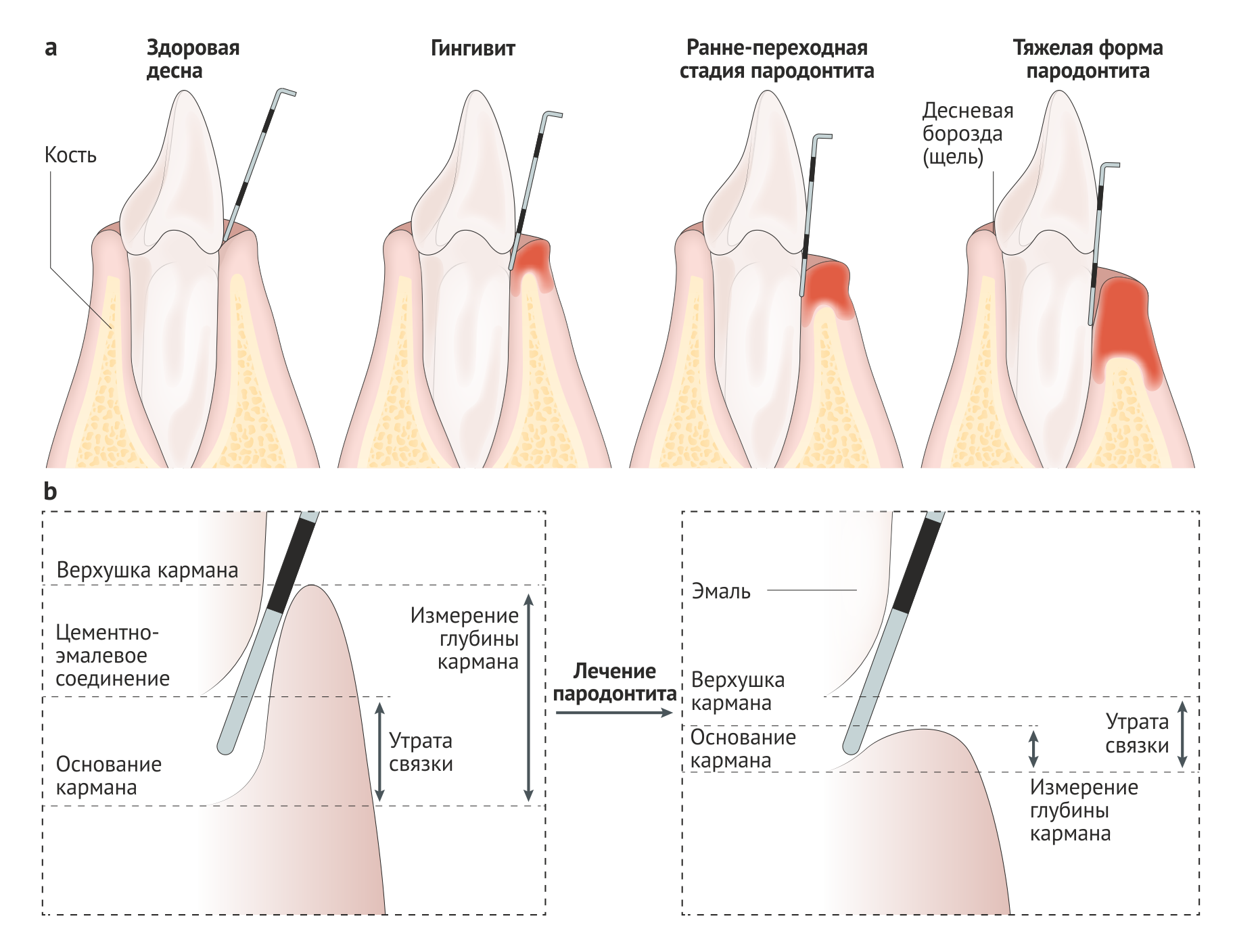
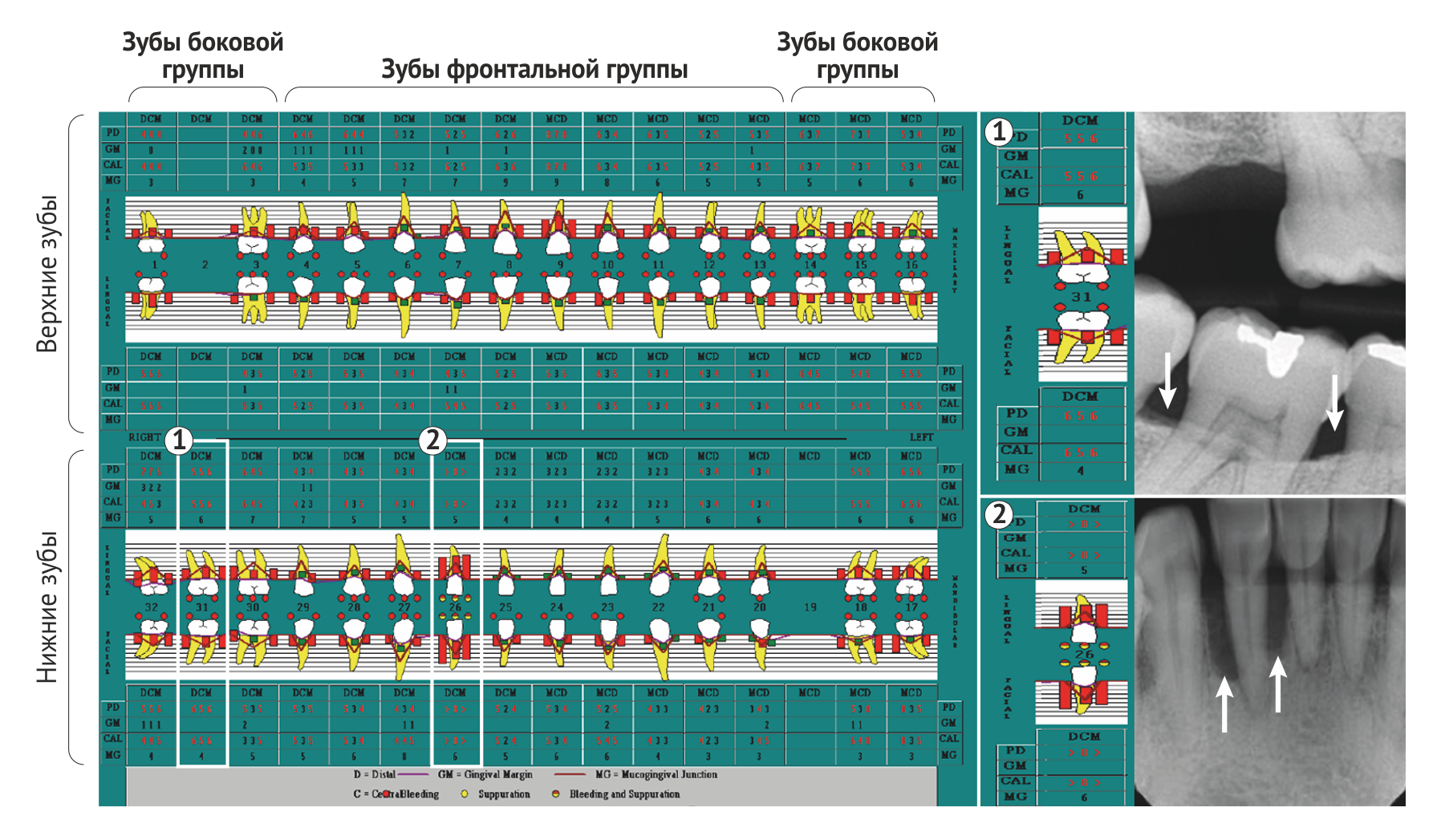
Пародонтит особенно распространен у взрослых, но может также возникать у детей и подростков; объем разрушения тканей, как правило, соизмерим с объемом зубного налета, реактивностью организма и связанными факторами риска. Ключевой особенностью как хронического, так и острого пародонтитов является специфичность локализации: характерное углубление пародонтальных карманов, утрата зубодесневого прикрепления и потеря альвеолярной кости происходят неравномерно в пределах зубного ряда (Рис. 2). Следовательно, отнесение случая пародонтита к той или иной категории зависит в большей степени от того, какие критерии распространенности (число пораженных зубов) и тяжести заболевания (глубина карманов, клиническая потеря зубодесневого прикрепления и альвеолярной кости вокруг пораженных зубов) использовались. Поскольку нет определенных постоянных критериев, которые использовались бы во всех эпидемиологических исследованиях, оценки превалентности пародонтита в различных популяциях значительно различаются. Если воспользоваться достаточно популярными комплексными критериями пародонтита, основанными на измерении потери зубодесневого прикрепления и глубины зондирования пародонтальных карманов (Рис. 2), которые были предложены центрами США по контролю и профилактике заболеваний и Американской академией пародонтологии, то превалентность этого заболевания в США превышает 50 % во всех возрастных группах и составляет практически 100 % среди пожилых людей [5]. Подобные результаты вызвали обсуждение того, допустимо ли использовать такие критерии для оценки превалентности пародонтита во всех возрастных группах [6].
Напротив, эпидемиологические исследования, в которых использовались более гибкие критерии глубины зондирования и потери зубодесневого прикрепления (учитывалась доля зубов в зубном ряду, у которых глубина карманов или клиническая потеря зубодесневого прикрепления превышали определенные пределы в миллиметрах) показали, что тяжелые формы пародонтита, приводящие к ощутимой убыли удерживающих структур и значительной потере зубов, поражают 10–15 % населения [7]. Полученная оценка превалентности включает тяжелые формы как острого (которым болеют преимущественно подростки и молодые взрослые [8, 9]), так и хронического пародонтита (поражающего преимущественно взрослых, превалентность повышается с возрастом во всех популяциях [10, 11]).
Были определены несколько факторов риска пародонтита, некоторые из которых относятся к управляемым [12]. Курение сигарет является основным управляемым фактором риска хронического пародонтита. Как было показано в исследованиях, выявляющих связь, изучающих прогрессирование и методы вмешательства, атрибутивный риск колеблется от 2,5 до 7,0 [13, 14]. Состояние пародонта курильщиков хуже, они теряют больше зубов, чем некурящие, даже после коррекции ковариант; в проспективных исследованиях показана более высокая скорость прогрессии хронического пародонтита и выпадения зубов, а в исследованиях лечения показано, что исход у курящих пациентов в сравнении с некурящими был хуже как при хирургических, так и при консервативных методах лечения пародонтита. Стоит отметить, что признаки воспаления десны могут быть менее выражены у курящих по сравнению с некурящими в связи с вазоконстрикцией и повышенной кератинизацией слизистой оболочки десны [12].
Сахарный диабет — наиболее часто встречающееся и изученное системное заболевание, являющееся фактором риска развития пародонтита. Распространенность и тяжесть пародонтита повышаются у пациентов с сахарным диабетом в анамнезе, и, в частности, у пациентов с плохо контролируемым сахарным диабетом. Более того, хронический пародонтит может отрицательно влиять на метаболический контроль у пациентов с сахарным диабетом, поскольку происходит увеличение воспалительной нагрузки и резистентности к инсулину [15, 16]. Стоит отметить, что отрицательное влияние сахарного диабета на пародонт проявляется в молодом возрасте, затрагивая детей и взрослых с 1 и 2 типами сахарного диабета [16, 17].
Эпидемиологические исследования с многовариантным анализом в Соединенных Штатах показали, что низкий уровень образования, бедность, мексиканская и афроамериканская этнические группы связаны с неудовлетворительным пародонтальным статусом [5, 18]. Связь между определенными социально-экономическими и демографическими переменными и хроническим пародонтитом была подтверждена и в систематическом обзоре [10]. Наконец, с различными формами заболеваний пародонта также связывали психологическое состояние, однако большая часть работ, касающихся взаимосвязи стресса и состояния пародонта, устарела. Примерами таких работ являются сообщения об остром некротизирующем язвенном гингивите, который наблюдали у солдат линии фронта во время Первой мировой войны. Считается, что стресс подавляет иммунный ответ, а острый некротизирующий язвенный гингивит встречается у пациентов с ослабленным иммунитетом (например, пациентов с ВИЧ-инфекцией), но для точного определения роли психологических факторов в развитии пародонтитов все же недостаточно данных [19].
Считается, что генетическая предрасположенность играет важную роль как в начальной стадии заболевания, так и в последующем развитии пародонтита [20], до 50 % случаев пародонтита связывают с наследственностью [21]. Тем не менее, попытки определить конкретные однонуклеотидные полиморфизмы в различных популяциях провалились в девяти геномных исследованиях, доступных на данный момент [22–31]. В противовес менделевским заболеваниям, при которых патологический фенотип обычно является результатом нарушения работы одного гена, генетическая предрасположенность к хроническому пародонтиту, вероятно, определяется сотнями или тысячами генов, а клинические проявления зависят от взаимодействия между средовыми, генетическими и эпигенетическими факторами. Ученые обратили внимание на эпигенетические факторы сравнительно недавно, ожидается проведение дополнительных исследований для выяснения их роли [32].
Зубной налет
Хронический гингивит и хронический пародонтит начинаются и поддерживаются благодаря микроорганизмам зубной бляшки [33]. Микробная биопленка была детально изучена и может включать до 150 видов бактерий у одного человека, а всего в зубных бляшках человека на данный момент было выделено около 800 видов [34]. Споры касательно вирулентности отдельных видов и их способности вызывать заболевания длятся десятилетиями, но до сих пор не было получено однозначного ответа. Среди предполагаемых возбудителей — грамотрицательные анаэробные бактерии, спирохеты и даже вирусы, но, скорее всего, нет конкретного патогена, который сам по себе приводил бы к заболеванию, и причина кроется в дисбиозе (дисбалансе состава микробных биопленок) (Ссылка 37). Если заболевание пародонта вызвано одним или несколькими специфическими патогенами, рекомендуемое лечение сводится к прицельной эрадикации патогенных бактерий, а не полному удалению биопленки [36].
Микробная биопленка. В проспективных когортных исследованиях [38] возникновение агрессивных форм пародонтита связывают с колонизацией поверхности зуба специфическими формами Aggregatibacter actinomycetemcomitans. Другие виды, включая Porphyromonas gingivalis, также связывают с тяжелыми или прогрессивными формами пародонтита [39], но причина изменения микробной биопленки во времени и связь этого изменения с течением пародонтита неясны. В систематическом обзоре [40] сделали вывод о том, что агрессивный и хронический пародонтиты не могут быть дифференцированы по специфическим пародонтальным патогенам. Это говорит о том, что причинная микробная биопленка схожа при обоих заболеваниях. С помощью технологий секвенирования нового поколения (NGS) можно полностью описать состав пародонтальной биопленки, что, вероятно, позволит расширить наши знания о микробных детерминантах хронического пародонтита на уровне популяции.
За всю жизнь в организм человека может попасть большое количество различных вирусов, и их ДНК или РНК могут оставаться в тканях долгое время после того, как последние признаки инфицирования исчезнут. Такие спящие вирусы могут очнуться во время воспалительной «вспышки» [41]. Однако довольно сложно установить причинно-следственную связь между повышенным содержанием вирусов и заболеваниями пародонта. Например, наличие корреляции между заболеванием пародонта и наличием герпесвируса может быть просто совпадением [42]. Таким образом, роль вирусов в этиопатологии заболевания пародонта сомнительна. Тем не менее, антивирусная терапия уменьшает глубину кармана и воспаление у пациентов с пародонтитом при использовании в дополнение к основной терапии [43] и рекомендуется в качестве лечения пародонтита некоторыми клиницистами [44].
Кальцификация. Зубной налет представлен и в мягкой, и в обызвествленной (зубной камень) форме: наддесневой (на поверхности зуба) налет обычно мягкий, в то время как поддесневой (в десневой борозде между десневым краем и шейкой или корнем зуба) налет обычно бывает темного цвета и обызвествленный. Поддесневой камень сложнее удалить. Кальцификация поддесневого налета происходит в присутствии ионов транссудата, попадающего в десневой карман при воспалении тканей пародонта, в то время как наддесневой камень возникает благодаря кальцию слюны и фосфат-ионам, концентрирующимся рядом с налетом [45].
Иммунопатогенез
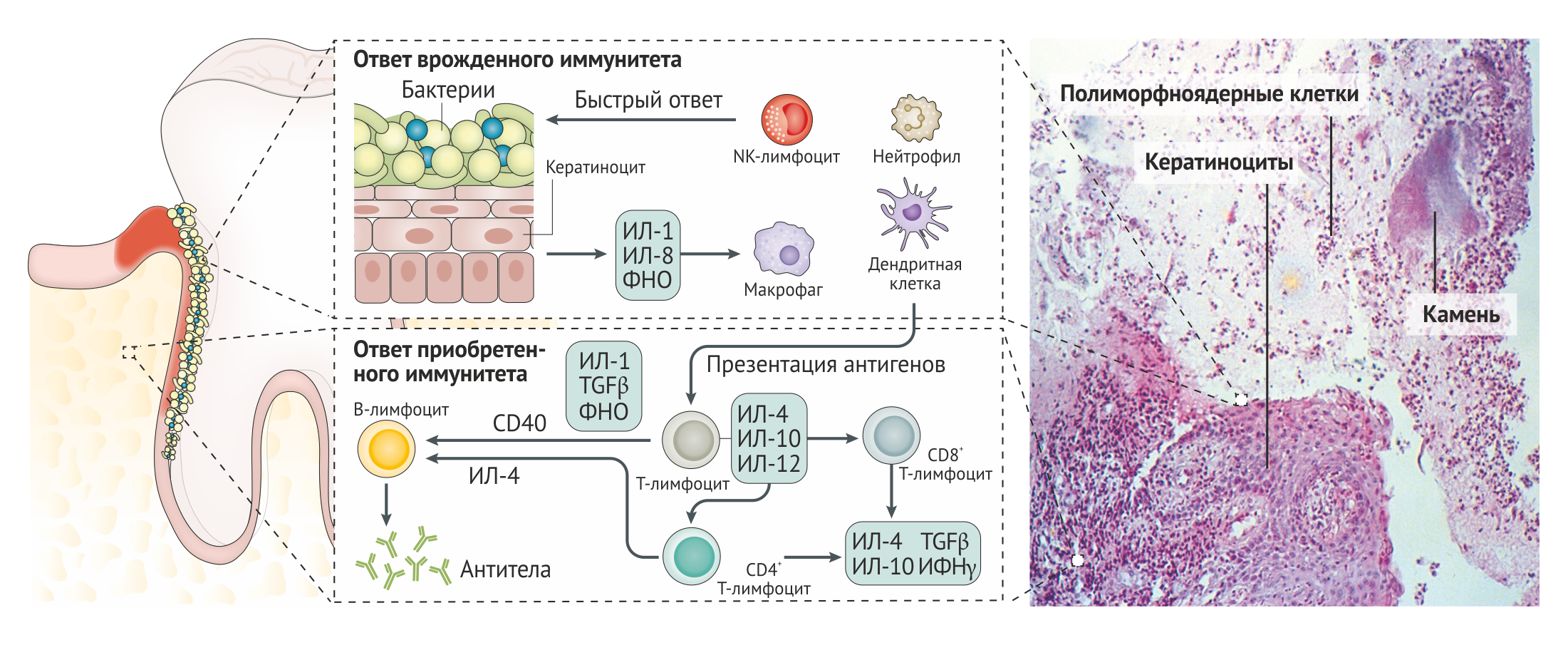
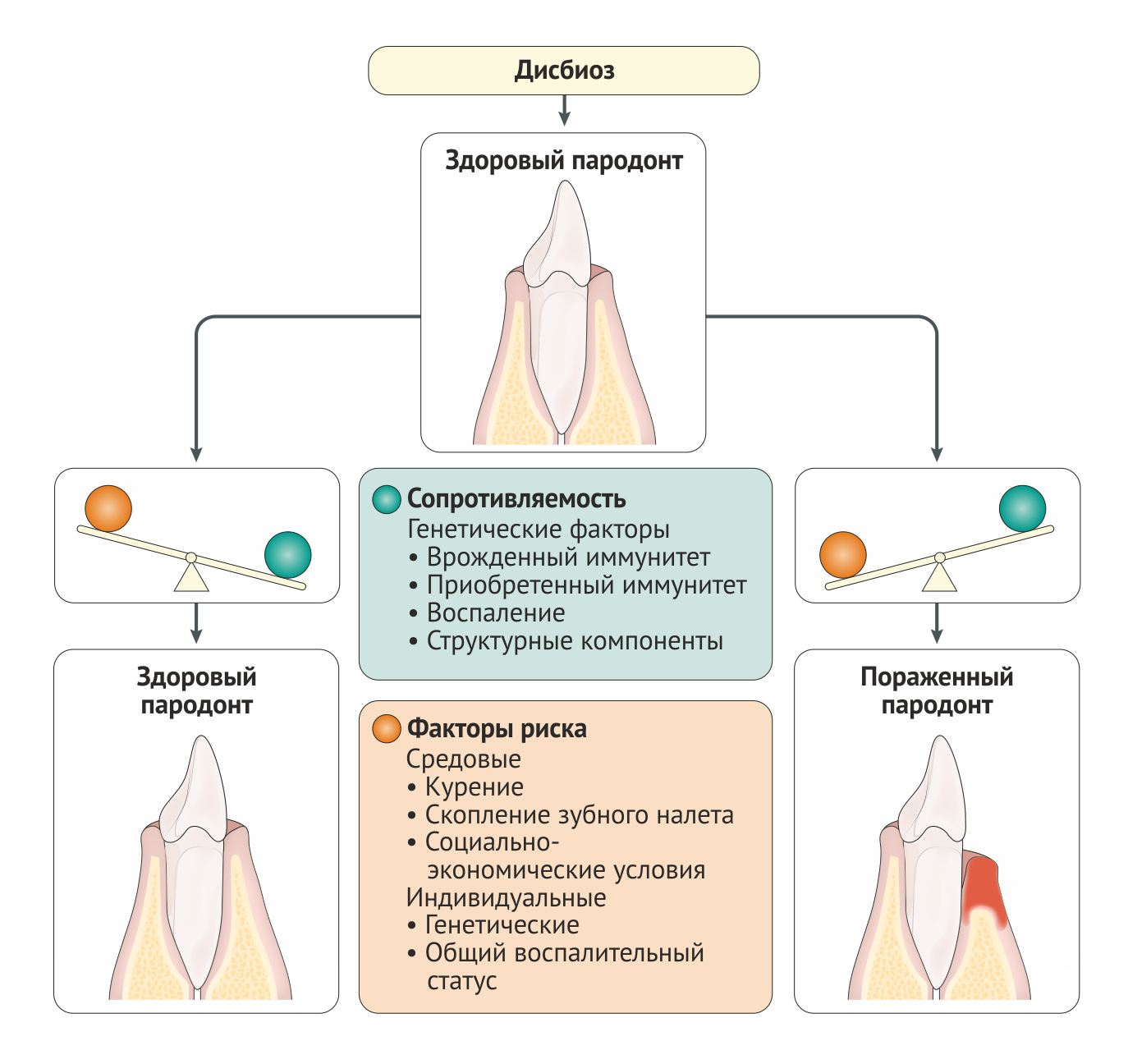
Одного только наличия микробной биопленки может быть недостаточно для развития пародонтального заболевания. Заболевание возникает, когда из-за дисбиоза или иммунной гиперреакции хозяина нарушается баланс состава биопленки [46–48]. Этот дисбаланс сложно исправить, так как есть значительные различия в генетических и иммунных профилях носителя и зубного налета [37, 49], что приводит к усиленной воспалительной реакции, которая, в свою очередь, приводит к заметному повреждению тканей при заболеваниях пародонта [50] (Рис. 3).
Эпителиальные клетки играют роль физического барьера и способствуют активации как врожденного, так и приобретенного иммунитета [49]. Находящиеся в толще эпителия дендритные клетки Лангерганса собирают микробный антигенный материал, перерабатывают и доставляют его в лимфоидные ткани для презентации лимфоцитам. Гранулоцитарная и лимфоцитарная инфильтрация очагов пародонтита приводит к тому, что нейтрофилы пытаются поглотить и уничтожить бактерии, но они перегружены количеством и устойчивостью микробной биопленки. Этот тяжелый хронический воспалительный ответ приводит к резорбции альвеолярной кости остеокластами, разрушению волокон связочного аппарата металлопротеиназами межклеточного вещества и формированию грануляционной ткани [51, 52]. Это патофизиологическое состояние сохраняется до тех пор, пока зуб не выпадает или микробная биопленка и грануляционная ткань не будут удалены стоматологом.
Роль Т-лимфоцитов. По мере того, как лимфоциты достигают очага поражения, B-лимфоциты трансформируются в продуцирующие антитела плазматические клетки. Наиболее важными параметрами антител, определяющими их способность защитить от развития пародонтита, являются их количество и авидность. В дополнение к гуморальному ответу развивается и опосредованный различными типами Т-хелперов (Th1, Th2 и Th17) клеточный иммунный ответ, но их относительная роль и сроки их вовлечения до сих пор не выяснены. Th1 могут играть важную роль на ранних стадиях хронического пародонтита, в то время как Th2 подключаются на более поздних стадиях.
Тем не менее, современные исследования цитокиновых профилей позволили выявить тот факт, что Th9, Th17, Th22, регуляторные T-клетки (Treg) и другие субпопуляции Th клеток, а также различные цитокины (например, ИЛ-17) играют важную роль в иммунопатологии заболеваний пародонта. Несбалансированная реакция этих видов лимфоцитов может быть связана с функциями белка Del-1 (белка, содержащего EGF-подобные повторы и дискоидин I-подобные домены, который является эндогенным ингибитором адгезии нейтрофилов) [55]. Del-1 ингибирует вызванную ИЛ-17 утрату костной ткани челюстей у мышей, однако применение полученных результатов по отношению к людям должно проводиться с осторожностью.
Восприимчивость
Гингивит обратим, но у восприимчивых людей он прогрессирует в хронический пародонтит [56]. Восприимчивость к гингивиту может отражать восприимчивость к хроническому пародонтиту [57, 58], и результаты эпидемиологических исследований указывают на то, что гингивит предшествует началу хронического пародонтита [59]. Кроме того, отсутствие гингивита является хорошим предиктором долгосрочного поддержания здоровья пародонта как на организменном уровне [60], так и применительно к конкретным зубам [61].
Ранние исследования «экспериментального гингивита у человека» (модель, в которой люди прекращали чистить зубы щеткой, как правило, в течение 21 дня, таким образом накапливая зубной налет. Это приводило к развитию воспаления десны до возобновления чистки зубов. Ссылки 62, 63) предоставили доказательства того, что начало и выраженность воспаления десны в ответ на накопление зубного налета значительно менялась от участника к участнику. Тогда ученые связали различия с индивидуальной скоростью накопления налета (количественные различия налета) или индивидуальным видовым составом биопленки (качественные различия налета). Однако в процессе более поздних исследований, использовавших ту же модель, было показано, что лица с качественно и количественно схожим зубным налетом могли иметь значительные различия в выраженности воспаления [64, 65]. Таким образом, интенсивность воспалительного ответа, вероятно, представляет собой индивидуальную особенность, а восприимчивость человека к заболеваниям пародонта может зависеть от генетических факторов [67–71].
Специфических факторов, являющихся основной причиной восприимчивости пациента к заболеваниям пародонта, до сих пор не выявлено. Но основе наблюдений, в ходе которых выявлено, что концентрации таких провоспалительных медиаторов, как ИЛ-1, фактор некроза опухоли (ФНО) и простагландин Е2 (ПГЕ2), коррелируют с масштабом поражения пародонта [72, 73] и могут стимулировать воспалительный ответ [53], построено предположение, что лица с высокой продукцией данных медиаторов в ответ на дисбиоз испытывают более интенсивную потерю тканей. Снижение количества или активности нейтрофилов также может повышать объем разрушения тканей [74]. Многие лекарственные препараты, такие как фенитоин, нифедипин и циклоспорин, стимулируют разрастание десны и, таким образом, понижают активность хронического пародонтита [75]. Течение гингивита может усугубляться при повышении концентрации эстрогена, однако восприимчивость к хроническому периодонтиту при этом не повышается [76]. Хорошо известно о связи между гормональными изменениями при менопаузе и остеопорозом, но неизвестна корреляция между этим заболеванием или недостатком эстрогена и восприимчивостью к заболеваниям пародонта. Наконец, к выраженной потере тканей пародонта могут привести иммуносупрессивная терапия и вторичная иммуносупрессия [77]. Ослабленная иммунная система не позволяет пациенту адекватно ответить на инфекцию, в результате чего усугубляется потеря тканей. Несмотря на огромное количество информации по клеточному и гуморальному звеньям приобретенного иммунитета, не было выявлено определенных антител или субпопуляций лимфоцитов, которые можно было бы достоверно связать с повышенной восприимчивостью к заболеваниям пародонта [78].
Генетика и эпигенетика
Роль генетических факторов в развитии хронического пародонтита изучалась в семейных и близнецовых исследованиях. Изучение молодых сибсов из Индонезии, у которых тяжелая форма пародонтита не развивалась несмотря на отсутствие регулярной стоматологической помощи, позволило предположить, что генетические факторы могут предрасполагать к развитию более мягких форм заболеваний пародонта [41, 79]. На данный момент готовится масштабное исследование по обнаружению генов и полиморфизмов, связанных со всеми формами заболеваний пародонта. Вероятно, в развитие хронического пародонтита вовлечено большое количество генов. С хроническим пародонтитом могут быть связаны разнообразные варианты генотипов. Ученые уделяют наибольшее внимание поиску полиморфизмов генов, связанных с продукцией цитокинов [69], но выявить конкретные однонуклеотидные полиморфизмы не удалось [45, 80].
В ходе семейных исследований можно получить данные о повышении частоты случаев заболевания в пределах семьи, но невозможно отличить воздействие генетических факторов от средовых, поскольку факторы внешней среды могут изменять экспрессию генов. Эпигенетические изменения влияют на профиль экспрессии гена путем метилирования или ацетилирования азотистых оснований ДНК или модификаций хроматина, влияющих на доступность генетического кода для транскрипции [21], однако эпигенетическая регуляция провоспалительных и противовоспалительных генов все еще плохо изучена [82]. Эпигенетика — это относительно новая концепция в представлениях о хроническом пародонтите, которая может дополнить наши знания относительно детерминант восприимчивости и популяционной вариабельности, а также указать на связующее звено между окружающей средой, генетикой и клиническими проявлениями пародонтита.
Диагноз, скрининг и профилактика
Диагноз
Первостепенной проблемой лечения заболеваний пародонта является своевременная и точная диагностика, поскольку потеря костных и мягкотканных структур пародонта необратима и постепенно нарастает. Однако пародонтит на ранних стадиях не вызывает болезненных ощущений, и пациенты обычно обращаются за помощью на более поздних стадиях. Одним из ранних симптомов гингивита является кровоточивость во время чистки зубов, боль отмечается редко. К клиническим признакам хронического пародонтита относятся покраснение и отек десневого края, кровоточивость десневой борозды при зондировании, углубление пародонтального кармана (Рис. 2), разрушение поддерживающих структур зуба (связок и альвеолярной кости), рецессия маргинальной десны (с оголением корня) повышенная подвижность зуба и, со временем, его выпадение [83]. Болевой синдром может быть связан с формированием абсцесса или смещением зуба. Тем не менее, чаще всего пародонтит протекает безболезненно, заболевание может быть обнаружено уже на поздних стадиях.
Диагноз хронического пародонтита основывается на ряде клинических признаков, включающих в себя уровень прикрепления, кровоточивость при зондировании, глубину зубодесневого кармана, и рентгенографических данных [84] (Рис. 4). В дифференциальной диагностике различных типов заболеваний пародонта полезна дополнительная информация, такая как медицинский и семейный анамнез, специфические клинические признаки (например, локализация поражений или количество зубного налета относительно прогрессии заболевания) [85]. Тем не менее, для постановки окончательного диагноза требуется измерить несколько параметров (включая кровоточивость при зондировании, глубину пародонтальных карманов и клинический уровень прикрепления) в шести точках на каждый зуб, что приводит к напряженному процессу диагностики, требующему высокой профессиональной компетенции проводящего осмотр специалиста. Кроме того, эти манипуляции необходимо повторять при последующих посещениях для наблюдения за течением заболевания [86]. Описанные клинические параметры являются лучшими доступными на данный момент средствами диагностики, однако с их помощью возможна лишь оценка степени и тяжести заболевания в данный момент времени. Спрогнозировать течение пародонтита, опираясь на клинические характеристики, невозможно [87].
После постановки диагноза врач должен незамедлительно приступить к борьбе с этиологическими факторами (удалить микробную биопленку с поверхности зуба и десны) и уведомить пациента о возможных факторах риска (например, неудовлетворительная гигиена полости рта, курение и нелеченый сахарный диабет) (Рис. 5). Большой проблемой является то, что контроль факторов риска, а значит и успешное лечение как хронического, так и острого пародонтита преимущественно зависят от мотивации пациента и изменения его образа жизни.
Течение заболевания
Многие лица могут быть очень восприимчивы к воздействию накопления зубного налета и острым формам пародонтита в сравнительно раннем возрасте (Рис. 6), в то время как другие могут никогда в жизни не заболеть хроническим пародонтитом [18]. В некоторых случаях прогрессия заболевания медленная, а риск потери функции пародонта в течение жизни минимален, в то время как у других оно прогрессирует быстро. Кроме того, на некоторых участках десны пародонтит развивается чаще, чем на других [82].
Скрининг и профилактика
Наиболее эффективным скрининговым мероприятием является раннее выявление гингивита, в том числе и самим пациентом — по появлению кровоточивости десен. Первостепенная мера профилактики хронического пародонтита — лечение и профилактика гингивита как ранней стадии заболевания пародонта. К мероприятиям по профилактике гингивита относят подавление развития биопленки или ее регулярное разрушение. Для этого, помимо ежедневной чистки зубов, необходимо два раза в год проводить профессиональную чистку с разрушением биопленки, хотя, согласно последним данным, пациентам с низким риском развития пародонтита может быть достаточно обращаться к стоматологу раз в год [88]. Американская ассоциация стоматологов рекомендует ежедневную двукратную чистку зубов мягкой щеткой в течение двух минут, чистку языка и очистку межзубных промежутков (с помощью зубной нити или интерпроксимальных щеточек), использование зубной пасты со фтором и сбалансированную диету с уменьшением числа перекусов.
Лечение
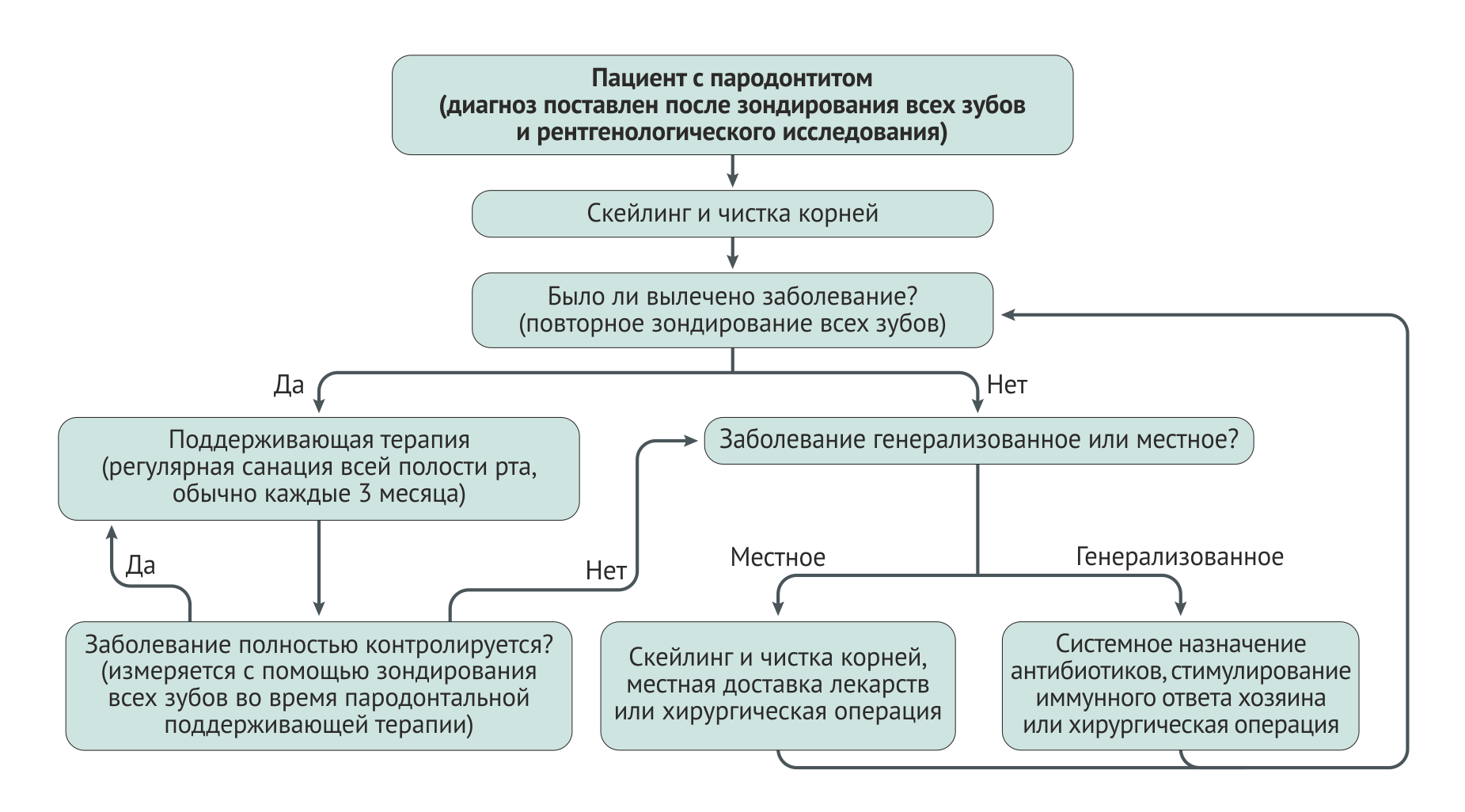
Лечение всех форм гингивита заключается в санации полости рта (скейлинге) и модификации факторов риска, а кроме того — ежедневной гигиене полости рта и профессиональной профилактике на повторных приемах. Хронический пародонтит лечится путем санации полости рта и, в некоторых случаях, хирургических вмешательств (Рис. 7). При потере зубодесневого прикрепления и/или костных структур пародонта целью лечения становится контроль воспаления, приостановка прогрессии заболевания и создание условий для длительного сохранения естественных зубов.
Нехирургическое лечение
Первоначальное нехирургическое лечение включает в себя удаление наддесневого и поддесневого зубного налета и камней с помощью скейлинга и околокорневой чистки под местной анестезией. Клинический результат сильно зависит от навыков стоматолога, мотивации пациента к поддержанию адекватного гигиенического состояния полости рта и комплаентности пациента относительно рекомендованных интервалов проведения профессиональной профилактики после завершения активного лечения. В долговременных рандомизированных контролируемых исследованиях показано, что при соблюдении этих основных условий нехирургическое лечение является эффективной стратегией, различий между хирургическим и нехирургическим лечением при сравнении средних показателей клинических измерений выявлено не было [89]. Скейлинг и околокорневая чистка проводятся с помощью ручных скейлеров и кюрет или ультразвуковыми инструментами по отдельности или совместно. Ручные скейлеры и кюреты представляют собой острые инструменты с одной или двумя режущими кромками, которые можно использовать для удаления камней, налета и пигментации как над десной, так и под ее краем, что наиболее важно в лечении пародонтита. Ультразвуковые инструменты вибрируют с частотой 25000–30000 в секунду, их можно использовать вместе с потоком воды для удаления отложений с поверхности зубов. Как ручные, так и ультразвуковые инструменты эффективны в удалении поддесневых камней и разрушении биопленки под десной [90–92]. Кроме того, при использовании обоих типов инструментов удается достичь одинакового улучшения клинических показателей [93, 94]. Скейлинг и околокорневая чистка ультразвуковыми инструментами требуют значительно меньше времени и приводят к меньшему травмированию мягких тканей, однако эти инструменты могут нанести больше ущерба корню зуба [95].
После завершения скейлинга и околокорневой чистки требуется период в 4–6 недель для заживления соединительной ткани периодонта и адекватной оценки результата лечения. Во время повторного осмотра производятся повторные диагностические клинические измерения, с помощью которых оценивают эффект первоначального лечения. Если глубина пародонтальных карманов восстановлена и нет признаков воспаления, пациента можно переводить на поддерживающую терапию. Однако при наличии остаточного воспаления или активного заболевания требуется дополнительное лечение, которое может быть местным или общим, консервативным или хирургическим в зависимости от степени тяжести остаточного воспаления.
Дополнительная (адъюнктивная) терапия
Для закрепления результатов лечения совместно с консервативной терапией используется несколько дополнительных методик. Среди них местное применение лекарств, системные антибиотики и системные иммуномодулирующие препараты.
Местное применение лекарств. Среди дополнительных препаратов выделяют антибиотики (миноциклин и доксициклин) и дезинфектанты (хлоргексидин), которые доставляются напрямую в пародонтальный карман форме порошка, геля, чипа или волокнистой системы доставки. Систематический обзор с мета-анализом предоставил доказательства эффективности миноциклинового геля и микросфер, хлоргексидинового чипа и доксициклинового геля [96]. В другом обзоре рекомендуется использовать дополнительные местные противомикробные препараты в глубоких карманах и при лечении зубов с рецидивом заболевания [97].
Системные антибиотики. Существует несколько схем лечения, отличающихся по типу антибиотика, дозировке, длительности и сроках начала; как правило, используют обычные дозировки антибиотиков широкого спектра действия в течение 1–3 недель изолированно или в комбинации с антибиотиками, преимущественно активными в отношении грамотрицательной флоры [98]. Авторы трех обзоров оценили эффективность нескольких схем приема системных антибиотиков при лечении хронического и острого пародонтита, и пришли к выводу, что комбинация амоксициллина и метронидазола является наиболее эффективной и приводит к наиболее выраженным клиническим улучшениям по показателям глубины зондирования и клинического уровня прикрепления [99–101]. Авторы обзора и мета-анализа исследований по использованию комбинации антибиотиков в качестве дополнительной терапии к неинвазивной методу лечения пришли к выводу, что есть довольно весомые доказательства в поддержку эффективности подобной стратегии лечения, среди которых значительное улучшение ряда клинических показателей: уменьшение глубины карманов, увеличение клинического уровня прикрепления и снижение кровоточивости при зондировании, — в отличие от использования только скейлинга и очистки околокорневой области [102]. Положительная динамика была больше на участках с изначальной глубиной карманов ≥ 6 мм. Результаты исследований адъюнктивной терапии системными антибиотиками довольно многообещающие, однако необходимы дополнительные исследования для определения специфических рекомендаций по некоторым аспектам лечения, таким как дозировка препаратов, длительность дополнительной терапии и оптимальное время начала адъюнктивной терапии. Кроме того, должны быть тщательно оценены возможные клинические улучшения и взвешены потенциальные риски, такие как появление резистентности к антибиотику, тяжелые нежелательные реакции и взаимодействие с другими лекарствами [98]. Также необходимо провести исследования, в которых в качестве конечной точки будет установлено выпадение зуба.
Системные иммуномодуляторы. При использовании в дозах ниже минимальных ингибирующих доксициклин оказывает влияние на иммунную систему человека. Механизм этого эффекта состоит в ингибировании металлопротеиназ межклеточного вещества [103]. Многоцентровое рандомизированное контролируемое исследование [104] ежедневного приема таких доз доксициклина в комбинации со скейлингом и очищением корней показало достоверное, но слабое улучшение пародонтального статуса, с учетом того, что неизвестны потенциальные риски и долгосрочные преимущества. Иммуномодулирование может быть полезно пациентам с повышенной чувствительностью [105].
Ограничения консервативного лечения
Консервативное лечение, осуществляемое совместно или без дополнительной терапии, является эффективным методом лечения хронического пародонтита: оно уменьшает глубину кармана и приводит к образованию нового прикрепления; однако для его проведения есть ряд ограничений, так что в некоторых случаях обойтись без хирургического вмешательства не получится. При использовании пародонтальных кюрет для нехирургического скейлинга или очистки корней можно достигнуть глубины 5,5 мм. Для полного очищения поддесневого пространства от зубных камней в среднем достаточно глубины 4 мм (Ссылка 106). Однако в умеренно глубоких (4–6 мм) и глубоких (>6 мм) карманах кюреты недостаточно эффективны, поэтому при использовании хирургического доступа эффективность очистки повышается [107]. В части случаев наблюдаются анатомические особенности, способствующие задержке биопленки (Вставка 2), в таких случаях для полного удаления пленки и камней необходим хирургический доступ. Хирургический доступ также требуется при обработке контура (изменении формы) костных дефектов, когда необходимо создать благоприятную костную архитектуру, а также при регенеративных процедурах для восполнения потерянных пародонтальных структур [108].
Хирургическое лечение
Используются несколько хирургических методов. Открытый кюретаж — это процедура, при которой участок десны хирургически отделяется от подлежащих тканей, обеспечивая доступ к очагу и его видимость. Хирургическая операция по уменьшению пародонтального кармана заключается в резекции мягких и твердых тканей с использованием различных техник [109, 110]. Регенеративная хирургическая операция подразумевает направленную тканевую регенерацию (использование барьерных мембран для контроля за ростом нового периодонта путем предотвращения роста эпителия и соединительной ткани в областях, где необходимо нарастить костную ткань и периодонтальную связку) [111], имплантацию и использование биопрепаратов [112]. Лазерная процедура формирования нового прикрепления (LANAP) [113] появилась недавно как консервативная альтернатива хирургической терапии. В ходе LANAP вместо разрезов скальпелем для деэпителизации и коагуляции используется Nd:YAG-лазер. Эта манипуляция также позволяет обойтись без активного отведения эпителиального лоскута.
- Нависающая пломба: ятрогенное увеличение размеров зубной реставрации в межзубном промежутке
- Пришеечный нарост эмали: возрастное апикальное разрастание эмали, обычно по направлению к фуркации между корнями моляров
- Адамантома: возрастное очаговое образование эмали, формирующееся дистальнее границы между эмалью и цементом, обычно расположенное в пространстве между корнями моляров
- Дистально-небный желобок: аномалия развития, обычно наблюдаемая на небе вблизи корней верхнечелюстных центральных и латеральных резцов
- Близость корней: близкое расположение корней соседних зубов, обычно из-за небольшого количества ткани между зубами
Исход лечения
Длительные рандомизированные контролируемые исследования, оценивающие различные методы традиционной консервативной и хирургической пародонтальной терапии, показали, что все методы примерно одинаково эффективны в улучшении клинических показателей и задержке прогрессирования заболевания [93, 114–119]. Опубликованные результаты поразительно согласуются во всех исследованиях независимо от места или вида оказания услуг (академическая или частная практика). При сравнении хирургических и консервативных методов терапии скорость прогрессии заболевания была меньше при хирургической терапии, особенно на боковой группе зубов с несколькими корнями [120, 121]. Фактически, хирургический доступ к больным зубам обеспечивает более точное определение прогноза; таким образом, зубы с худшим прогнозом могут быть удалены на начальном этапе хирургической терапии, что обеспечивает хороший долгосрочный прогноз для оставшихся зубов. Надлежащее лечение и выполнение пациентом всех рекомендаций оказались ключевыми факторами, способствовавшими устойчивому успеху лечения [93, 114–119].
При использовании консервативных и большинства хирургических методов терапии заживление происходит посредством формирования продолговатого эпителия пародонта или новой соединительной ткани для прикрепления к ранее пораженной поверхности корня. Регенеративные хирургические процедуры также могут способствовать восстановлению потерянных тканей альвеолярной кости, периодонтальной связки и цемента (поверхностного слоя корня), и являются заключительным этапом лечения пародонтита.
В систематическом обзоре, в котором рассматривалась направленная тканевая регенерация, приведено заключение, что с ее помощью возможна регенерация внутрикостных дефектов и дефектов фуркации (потеря костной базы корневого ствола многокорневых зубов, где встречаются два или более корней). Доказательством этому послужили улучшение клинического прикрепления, уменьшение глубины зондирования и увеличение плотности кости на рентгенограммах (хотя последний признак сам по себе не свидетельствует об успешной регенерации); кроме того, эти результаты были значительно лучше, чем те, что были получены при проведении только открытого кюретажа [122]. В другом обзоре, рассматривающем регенерацию пародонта, были подтверждены полученные результаты и уточнялось, что в случае внутрикостных дефектов использование биопрепаратов по эффективности сопоставимо с трансплантацией кости и направленной регенерацией тканей. Эти положительные результаты могут сохраняться более 10 лет [123, 124].
LANAP может способствовать образованию нового прикрепления и пародонтальной регенерации [113, 125], а также обладает потенциалом для улучшения клинических показателей, как продемонстрировано в кратковременном проспективном клиническом исследовании [126]. Однако необходимы обширные рандомизированные контролируемые исследования для оценки долгосрочной эффективности этой процедуры по сравнению с использующимися сегодня консервативными и хирургическими методами.
Поддерживающая терапия пародонта
С помощью основного лечения периодонтита можно контролировать течение заболевания и уменьшить потери зубов до 10 раз [127–132]. Однако долговременный исход такого лечения сильно зависит от поддерживающей терапии, которая начинается после завершения основного лечения [129–133]. Поддерживающее лечение пародонта заключается в регулярном удалении над- и поддесневого налета в течение всей жизни. У пациентов, проходящих лечение по поводу хронического пародонтита, чаще всего такую чистку проводят раз в 3 месяца [93, 114–119], при такой периодичности поддерживающего лечения удается разрушить вновь образованную биопленку до приобретения ей патогенных свойств. Интервал может изменяться в зависимости от восприимчивости пациента, а также наличия определенных факторов риска, таких как курение, сахарный диабет или неспособность осуществлять адекватный домашний уход.
Поддерживающая терапия ставит перед собой целью длительное поддержание естественного состояния пародонта, зубного ряда, прикуса, а также эстетических параметров. Это довольно сложная фаза лечения, так как она основана на мотивации пациента, соблюдении точных интервалов и требует значительных затрат сил и времени. Среди пациентов, проходящих лечение в частных клиниках, комплаентность составляет около 50 %, при этом полного согласия с планом лечения удается достичь менее чем у 20 % пациентов [134]. Когда были приняты меры для увеличения комплаентности (например, напоминание по телефону или с помощью почтовых открыток, назначение следующего приема по завершении текущего, напоминание о важности гигиены полости рта и лечения, обучение стоматологического персонала) этот процент достиг > 30 %; однако примерно 20 % пациентов так и не явились на повторный прием, несмотря на дополнительные меры [135]. Недостаточная комплаентность может существенно влиять на долгосрочный прогноз, так как уровень рецидивов хронических пародонтитов без поддерживающей терапии такой же, как и при нелеченном заболевании [133].
Лечение периимплантитов
В целом лечение периимплантатного мукозита и периимплантита похоже на лечение обычного заболевания пародонта, однако есть два важных отличия. Во-первых, имплантат не окружен периодонтальной связкой, так что кровоснабжение окружающих имплантат тканей ограничено. Во-вторых, титановые имплантаты мягче, чем естественные зубы, поэтому они могут поцарапаться при обычной механической обработке. Таким образом, очищающие инструменты (скейлеры и кюреты) должны быть покрыты более мягкими материалами, такими как политетрафторэтилен (тефлон), углеволокно [136], или титан [137]. То же верно и для ультразвуковых инструментов. В качестве материала для головки таких инструментов подойдет полиэфирэфиркетон. Недавно было показано, что для обработки титановых имплантатов можно использовать инструменты с еще более низкими абразивными качествами, например, поток сжатого воздуха из специального пистолета. Такие инструменты позволяют эффективно очистить поверхность имплантата, не повреждая ее [138].
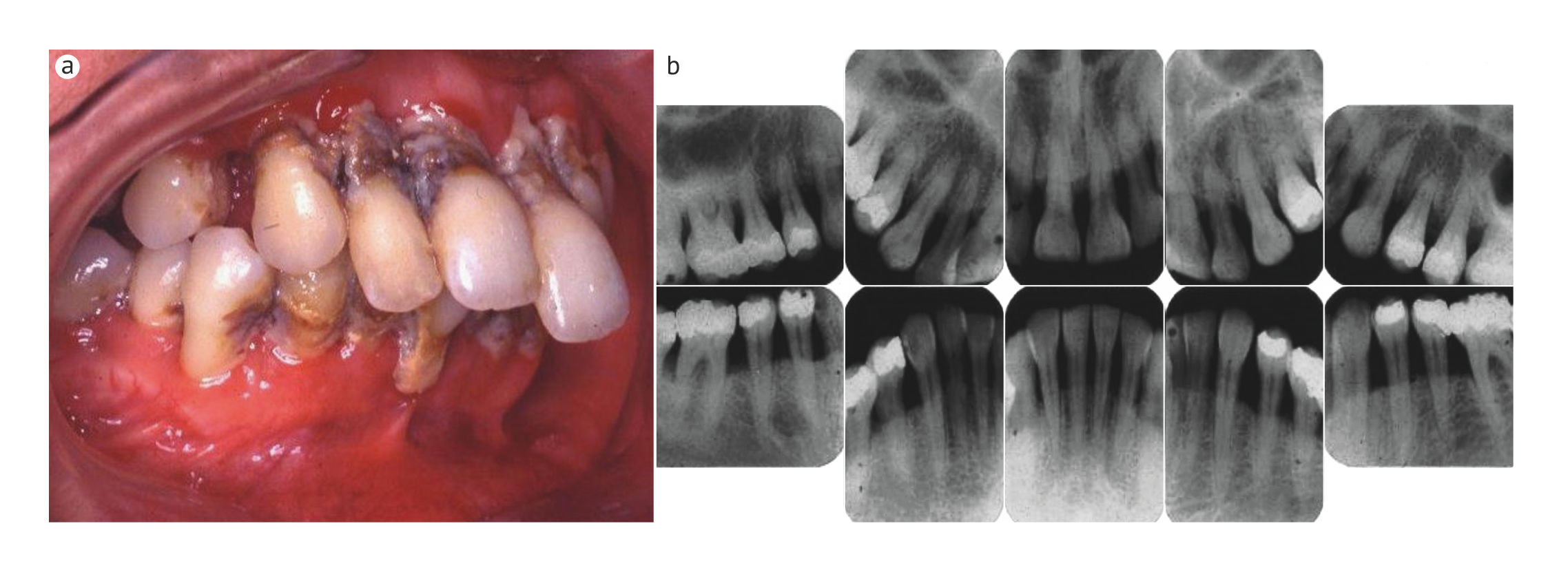
b | На рентгенограмме показан клинический случай менее тяжелого генерализованного острого пародонтита.
Качество жизни
Заболевания пародонта — бессимптомные заболевания, часто протекающие скрыто, но негативно сказывающиеся на приеме пищи, эстетике и речи [139]. При потере зубов страдает функция зубочелюстного аппарата, что может привести к значительным изменениям питания [139–141]. Изменение диеты наиболее неблагоприятно для пожилых пациентов: исследования показали, что нефункциональный зубной ряд может значительно уменьшать продолжительность жизни и коррелирует с обращением в лечебные учреждения и общей заболеваемостью [142].
Существенные эстетические последствия потери костной ткани и зубов, а также рецессии десны могут влиять на качество жизни. Эстетические последствия наиболее важны для пациента в том случае, если поврежден пародонт передних зубов, так как боковые зубы не всегда видны. Галитоз может быть немаловажной проблемой для социальных взаимодействий [143]. Нарушенный зубной ряд с преимущественно эстетическими аномалиями связан с низкими перспективами трудоустройства [144], а также с застенчивостью и стеснительностью.
Дополнительное влияние на качество жизни пациентов оказывают типичные для хронического пародонтита сопутствующие заболевания. Лонгитюдные исследования связывают хронический пародонтит и СД 2 типа двусторонней взаимосвязью: хронический пародонтит ухудшает течение СД 2 типа и наоборот. Предполагается, что оба заболевания негативно влияют на метаболизм пациента и общую воспалительную нагрузку [16]. Связи между хроническим пародонтитом и сердечно-сосудистыми заболеваниями, стрессом и ожирением также были освещены в литературе, но эти связи могут быть объяснены общими факторами риска и сопутствующими патологиями, а не непосредственными причинно-следственными связями (Рис. 5). Заболевание пародонта также может быть связано с неблагоприятными исходами беременности (преждевременные роды и небольшой вес при рождении), но интервенционные исследования [21] не смогли убедительно обосновать эту корреляцию. Пародонтит и исход беременности могут быть связаны общими факторами риска, сопутствующими патологиями, воспалительной нагрузкой и метаболическим синдромом. Вероятность наличия причинно-следственной связи между пародонтитом и неблагоприятными исходами беременности невелика, так как большинство детей рождаются от матерей до тридцати лет, в то время как хронический пародонтит обычно манифестирует примерно в 35 лет [4]. Такое временное несоответствие может быть объяснено гипотезой о том, что хронический гингивит связан с неблагоприятными исходами беременности, но умеренность протекания и выраженности хронического гингивита, а также тот факт, что хронический гингивит распространен среди всего населения Земли предполагает, что данная корреляция также маловероятна. Тем не менее, адекватная гигиена полости рта важна для снижения или предотвращения хронического гингивита и, таким образом, любых пока что не подтвержденных рисков [145].
Новые горизонты
Диагностика
Клинические показатели, такие как определение глубины карманов, уровня клинического прикрепления и кровоточивости при зондировании — ценный инструмент в диагностике заболеваний пародонта [79]. Несмотря на напряженную работу по определению других биомаркеров пародонтита в слюне или жидкости десневой борозды, таковых до сих пор не найдено. Большая информированность о болезнях пародонта и более точные методы диагностики позволят стоматологам широкого профиля предотвращать и диагностировать хронический пародонтит на ранних стадиях и в срочном порядке направлять пациентов к специалистам для дальнейшего лечения. Широко исследуется использование многочисленных биомаркеров для скрининга, диагностики и предсказания течения заболевания, однако только один из них на данный момент доступен на рынке в некоторых Европейских странах (нейтрофильная коллагеназа; также известна как матриксная металлопротеиназа 8) [45].
Перспективным биомаркером скорости убыли костной ткани является соотношение между белками RANKL и остеопротегерином (представителями суперсемейства лигандов к ФНО 11 и 11B, соответственно). Первый белок способствует дифференцировке и активации остеокластов, в то время как второй работает как его рецептор-приманка, подавляя его функцию. Несмотря на высокую информативность в отношении скорости убыли кости (а значит, и активности текущего пародонтита), это соотношение не может предсказать течение заболевания в будущем. Многие другие молекулы, имеющие отношение к разрушению тканей, такие как матриксные металлопротеиназы [45], и пародонтальному воспалению, такие как цитокины, изучаются в качестве возможных диагностических биомаркеров, но до сих пор еще нуждаются в тестах на чувствительность и специфичность для использования в качестве предикторов течения заболевания [146]. Особенности течения заболевания значительно осложняют открытие новых биомаркеров, так как заболевания пародонта протекают эпизодично и трудно дифференцировать периоды ремиссии и обострения. Потеря клинического уровня прикрепления остается самым надежным предиктором будущей потери прикрепления [79], а отсутствие некоторых признаков воспаления, таких как кровоточивость при зондировании, является отличным предиктором отсутствия воспаления [147]. Хотя сейчас они применяются довольно ограничено, в будущем биомаркеры будут подбираться таким образом, чтобы соответствовать критериям чувствительности и специфичности, оставаясь при этом доступными [146].
Вакцинация против заболеваний пародонта
Вакцина против предполагаемой бактерии, которая вызывает заболевания пародонта, была протестирована на мышиной модели [148]. В результате было выдвинуто предположение о возможности вакцинации против инфекции, вызываемой P. gingivalis, и о том, что механизм работы иммунологической защиты в данном случае заключается в изменении баланса между Th17- и Treg-лимфоцитами. Остается большое количество вопросов, в основном касающихся эффективности использования мышиных моделей пародонтальных заболеваний, так как мыши в основном не подвержены этому заболеванию, а их иммунный ответ значительно отличается от человеческого. Кроме того, доказательства специфического вовлечения и важности Тh17-опосредованных иммунологических путей в патогенез пародонтита у человека ограничены [148]. Таким образом, хотя иммунизация против заболеваний пародонта может быть разработана в будущем, мы еще не знаем, каким образом она будет работать и какие компоненты иммунной системы будут вовлечены в обеспечение защиты.
Лечение
Тканевая инженерия. Восстановление потерянных тканей — основная цель лечения. Новые направления терапии пародонта включают в себя методы, основанные на генной, белковой и клеточной тканевой регенерации, объединенные с поддерживающими и направляющими биоматериалами, которые могут быть рассасывающимися и нерассасывающимися, а также стандартными или распечатанными на 3D-принтере [149]. Все эти методы нацелены на регенерацию кости для стабилизации зубов или имплантатов, но помимо этого необходима также регенерация и мягких тканей, особенно в эстетических целях. Направленная тканевая регенерация дает непостоянный эффект, сейчас эта техника используется только в направленной костной регенерации, при которой мембранный барьер помещен под мягкие ткани (и благодаря этому менее подвержен инфекции) и используется как поддерживающее кость устройство [150]. Идет разработка мембран с включением антибиотиков или стимуляторов роста [151].
Быстро развивается 3D-печать биоматериалов и включение в их состав плазмид, пептидов, белков и живых клеток [152]. Напечатанный на 3D-принтере саморассасывающийся каркас, созданный из поликапролактона с ячейками для тромбоцитарных факторов роста, использовался для восстановления дефектов пародонта у одного пациента в Италии, спустя год результат сохраняется [153]. Однако для введения таких технологий в стандарты лечения необходимо провести качественные рандомизированные контролируемые исследования долговременных результатов
К используемым для регенерации кости биологическим медиаторам относят клетки, факторы роста и генную терапией. Методы терапии стволовыми клетками находятся в разработке и остаются многочисленные ограничения, связанные с их безопасностью. На сегодняшний день произведена имплантация выращенных из аутологичных стволовых клеток связок периодонта [151]. Основные исследованные факторы роста — тромбоцитарные факторы роста, костные морфогенетические белки и молекулы, вовлеченные в рост клеток и сосудов [154]. Была исследована генная терапия, использующая плазмиды для внедрения необходимых генов в специфические клетки определенных участков пародонта [155] и она была признана более безопасной, чем использование вирусных векторов, которые будут обладать более длительными и непредсказуемыми эффектами после того, как они внесут гены в хромосому. Также проводились исследования аденовирусов и лентивирусов, аденовирусные векторы, содержащие костный морфогенетический белок 7, использовались для усиления прикрепления и дифференцировки остеокластов вокруг титановых имплантатов [155].
Лазерная терапия. Активное изучение лазерных технологий в качестве методов терапии пародонтита не принесло успеха: их преимущество перед существующими методами механической очистки доказать не удалось [156]. По результатам исследований, эффективность пескоструйных аппаратов не отличалась от таковой у Er:YAG-лазера [157]. Пескоструйный аппарат также эффективно использовался при лечении периимплантитов и показал значительное уменьшение кровоточивости при зондировании по сравнению с обычными металлическими кюретами [158]. Лазеры также используются в противомикробной фотодинамической терапии для уничтожения микробной биопленки; однако, несмотря на впечатляющие результаты, исследования противоречат друг другу, а протоколы сильно отличаются, так что выводы делать рано. Таким образом, использование лазеров вместо классических инструментов для обработки пораженных поверхностей пока рекомендовать нельзя [159].
Модуляция иммунного ответа. Так как специфический по отношению к хозяину воспалительный ответ является ключевым элементом патогенеза (Рис. 3), чрезмерное воспаление и невозможность его купирования могут влиять на исход заболевания. Ранние исследования были сфокусированы на понимании роли простаноидов и интерлейкинов в воспалительном ответе с целью манипулировать ими, но на данный момент внимание исследователей приковано к способности прекращать воспаление путем усиления тормозящих сигналов и запуска заживления [160]. Открыты липидные противовоспалительные медиаторы, которые синтезируются через каскад арахидоновой кислоты, к ним относятся липоксины, резолвины и протектины [161]. Эти медиаторы являются ключевыми агонистами противовоспалительных путей, которые направляют восстановление по пути тканевого гомеостаза, что позволяет ткани более эффективно восстанавливаться и повышает тканевую сопротивляемость новому или текущему воспалению. Опыты на животных и людях по использованию этих агонистов для активной регуляции воспалительного ответа перспективны [162, 163]. Описанные выше медиаторы не просто обрывают воспалительный процесс, нарушая при этом защитные механизмы организма. Они взаимодействуют с физиологическими путями, способствуя более быстрому завершению воспаления и запуску восстановительных процессов [164]. У данных липидных медиаторов есть несомненный потенциал в лечении болезней пародонта.
Источники
116. Lindhe, J., Westfelt, E., Nyman, S., Socransky, S. S. & Haffajee, A. D. Long‑term effect of surgical/ non‑surgical treatment of periodontal disease. J. Clin. Periodontol. 11, 448–458 (1984).
VectorR system. A pilot study. Clin. Oral Implants Res. 16, 288–293 (2005).
