Гемостатические средства
Гемостатические средства — лекарственные средства, способствующие остановке кровотечений. Все гемостатики, в зависимости от механизма действия, подразделяются на три большие группы:
- ингибиторы фибринолиза (антифибринолитики);
- средства, усиливающие свертывание крови (коагулянты);
- средства, понижающие сосудистую проницаемость.
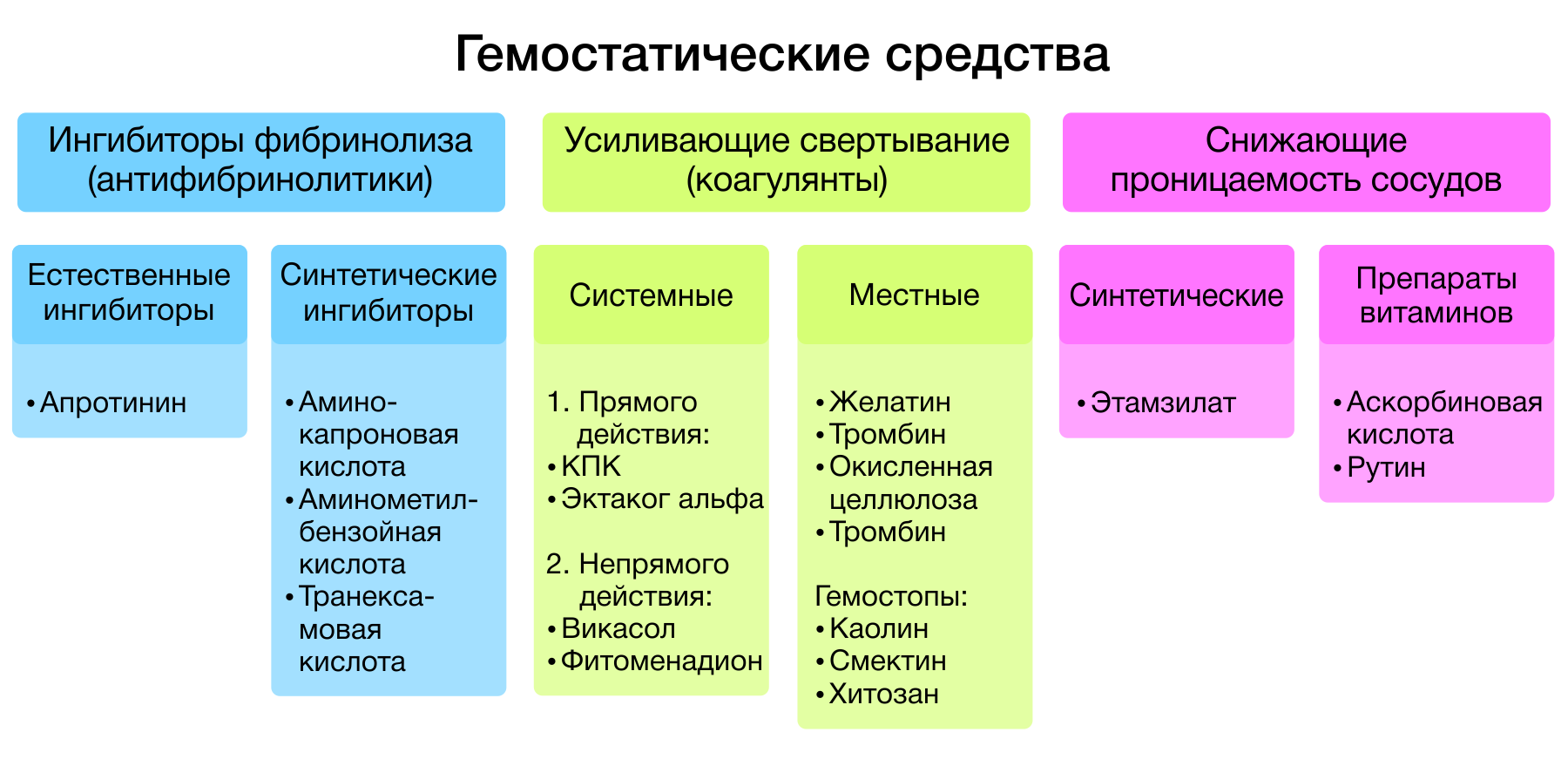
Рисунок 1 | Классификация гемостатиков.
1. Ингибиторы фибринолиза.
В клинической практике широкое распространение получили две группы препаратов ингибиторов фибринолиза: естественные ингибиторы фибринолиза (апротинин и его аналоги) и синтетические ингибиторы фибринолиза (аминокапроновая кислота, аминометилбензойная кислота, транексамовая кислота).
Апротинин — полипептид, получаемый из легких, поджелудочной и околоушной желез крупного рогатого скота, действующий аналогично α2-антиплазмину. Апротинин разрушает свободный плазмин, практически не взаимодействует со связанным плазмином, а также угнетает активацию тромбоцитов. Являясь сериновой протеазой, апротинин блокирует калликреин-кининовую систему путем разрушения калликреина, снижает активность отдельных протеолитических ферментов, таких как: трипсин, химотрипсин, кининогеназа. Изначально препарат был включен в рекомендации по лечению острого панкреатита и панкреонекроза, однако не подтвердил свою эффективность, и показания к его применению были пересмотрены.[1]
Аминокапроновая кислота – 6-аминогексановая кислота — синтетическое производное лизина. Присоединяясь к лизин-связывающему участку плазминогена, аминокапроновая кислота обратимо блокирует процесс фибринолиза, снижает активность стрептокиназы, урокиназы, тканевых киназ, калликреина, трипсина и гиалуронидазы. Аналогичным фармакологическим эффектом обладает производное аминокапроновой кислоты — аминометилбензойная кислота, отличающаяся улучшенной фармакокинетикой. Аминокапроновая кислота снижает активность тромболитических препаратов и может быть использована для нейтрализации их эффекта.
Транексамовая кислота — транс-4-(аминометил)-циклогексанкарбоновая кислота — обратимо блокирует эффект плазминогена, адгезию лейкоцитов и тромбоцитов на поверхность тромба за счет конкурентного ингибирования активатора плазминогена. Оказывает противоаллергическое и противовоспалительное действие посредством подавления образования кининов и других активных пептидов, участвующих в аллергических и воспалительных реакциях. По мощности антифибринолитического действия транексамовая кислота значительно превосходит аминокапроновую кислоту. Активность препарата в плазме сохраняется на протяжении 7-8 часов, в тканях — до 17 часов.[2]
У больных с высоким риском массивной кровопотери в плановой хирургии (сердечно-сосудистая хирургия, травматология и ортопедия, трансплантология) применение ингибиторов фибринолиза уменьшает интраоперационную кровопотерю и снижает потребность в трансфузии донорской крови. На протяжении 20 лет проводилось множество исследований, результаты которых были неоднозначны: мнения склонялись то в пользу апротинина, то в пользу синтетических производных лизина.
В 2007 году компания Bayer завершила исследование BART (Blood conservation using antifibrinolytics in a randomized trial), в котором было изучено действие апротинина у кардиохирургических больных высокого риска. Исследователи выявили большой риск летальных исходов и осложнений при использовании апротинина. В группе апротинина количество больных с массивной кровопотерей было несколько меньше, но 30-дневная летальность на 50% превышала аналогичный показатель в других группах.[3]
После публикации результатов BART компания Bayer уведомила Управление по контролю за качеством пищевых продуктов и лекарственных средств США (FDA) о намерении изъять апротинин с рынка. Показания к назначению были пересмотрены, и препарат был исключен из списка безопасных лекарственных средств.
Огромный мета-анализ позволил сделать вывод, что транексамовая кислота обеспечивает такое же снижение периоперационной трансфузии, какое наблюдается при использовании апротинина, но более безопасна. Согласно рекомендациям Европейского общества анестезиологов по ведению пациентов с массивной периоперационной кровопотерей (2013 г.), при массивном кровотечении рекомендуется применение транексамовой кислоты (20-25 мг/кг); она может быть введена повторно или применяться в виде пролонгированной инфузии (1-2 мг/кг/ч).[4]
2. Препараты, усиливающие свертывание крови
Среди средств, повышающих скорость свертывания крови, выделяют: средства системного действия и для местного применения. К препаратам системного действия относят непрямые коагулянты (фитоменадион, менадиона натрия бисульфит) и коагулянты прямого действия (факторы свертывания: концентрат протромбинового комплекса, эптаког альфа).
Менадиона натрия бисульфит — синтетический водорастворимый аналог витамина К3. Субстратно стимулирует витамин K-редуктазу, активирующую витамин К и обеспечивающую его участие в печеночном синтезе витамин K-зависимых плазменных факторов гемостаза (II, VII, IX, X). Фитоменадион является синтетическим структурным аналогом витамина К1, обладает большей активностью и более ранним началом реализации эффектов (через 6-10 часов после перорального применения, против 18-24 часов у менадиона натрия бисульфита). Данная группа препаратов показана для коррекции нарушений системы гемостаза, вызванных дефицитом витамина К1, передозировкой антикоагулянтов непрямого действия (варфарина), а также для предоперационной профилактики кровотечений.
Концентрат протромбинового комплекса (КПК) — лекарственный препарат, содержащий факторы II, VII, IX, X, а также следовые концентрации антитромбина III, гепарина, протеинов С и S. Основным показанием к применению КПК служит коррекция приобретенного дефицита витамин К1-зависимых факторов в экстренных ситуациях (кровотечение, экстренная операция). Помимо этого, КПК широко используется как средство для лечения и профилактики кровотечений у пациентов с врожденным дефицитом одного из К1 зависимых факторов свертывания (врожденная гипопротромбинемия, врожденный дефицит фактора Стюарта – Прауэра).[5]
Эптаког альфа — рекомбинантный активированный VII фактор свертывания. Механизм действия препарата заключается в прямой активации фактора Х на поверхности активированных тромбоцитов. Это вызывает «тромбиновый взрыв» независимо от имеющейся концентрации факторов VIIIa и IXa. В результате образуется стабильный фибриновый сгусток. Считается, что эптаког альфа инициирует гемостаз только в месте повреждения ткани и не вызывает системной активации механизмов свертывания. Препарат был разработан для лечения кровотечений и проведения хирургических вмешательств у пациентов с наследственной или приобретенной гемофилией и высоким титром ингибитора факторов свертывания VIIIa или IXa. Его применение у пациентов с массивным кровотечением можно сформулировать согласно рекомендациям ESA (2013): «Применение рекомбинантного фактора VII возможно только при кровотечениях, которые не могут быть устранены хирургическими методами или путем комплексной гемостаз-корригирующей терапии». Необходимо серьезное обоснование для применения данного препарата [6].
3. Местные гемостатики
Местные гемостатики используются для остановки капиллярных и паренхиматозных кровотечений преимущественно в неотложной хирургии и стоматологии. Данная группа включает в себя широкий спектр препаратов с различным механизмом действия.
Препараты на основе желатина, получаемого из свиной кожи, существуют в трех формах: пленка, губка и порошок. Желатин чрезвычайно гигроскопичен, и за счет этого свойства он абсорбирует влагу, увеличиваясь в размерах и заполняя тканевой дефект. Существуют комбинации желатина с тромбином, которые помимо пассивного гемостатического эффекта напрямую запускают коагуляционный каскад и активируют тромбоциты в месте нанесения. Желатин разрушается протеиназами в течение 4-6 недель. Несмотря на абсолютную индифферентность, желатин может служить в качестве хронического очага инфекции. Помимо этого, одним из существенных недостатков данных препаратов является отсутствие прочных связей с окружающими тканями [7].
Тромбин является естественным компонентом свертывающей системы крови. Раствор тромбина используют только местно при капиллярных или паренхиматозных кровотечениях в ходе нейрохирургических вмешательств, операций на печени и почках, в стоматологической практике. Попадание тромбина в крупные кровеносные сосуды может вызвать распространенный тромбоз [7].
Окисленная целлюлоза выпускается в виде пленок, сеток, пучков и губок. Данный биологический агент играет роль субстрата для агрегации тромбоцитов и активации механизмов гемостаза. Целлюлоза значительно снижает рН среды, что приводит к лизису эритроцитов с образованием кислого гематина, который формирует дополнительный искусственный сгусток. Помимо этого окисленная целлюлоза обладает антибактериальным эффектом, в том числе в отношении антибиотикорезистентных микроорганизмов [7].
Микрофибриллярный коллаген, производимый из кожи крупного рогатого скота, имеет ряд преимуществ перед остальными топическими биологическими кровоостанавливающими агентами, среди которых: быстрый гемостатический эффект, минимальная реактивность тканей и высокая способность к реабсорбции. Аналогично целлюлозе, микрофибриллярный коллаген является матрицей для активации тромбоцитов, агрегации и образования тромбов [7].
Подвидом местных кровоостанавливающих средств являются гемостопы, получившие большое распространение в военной медицине. Это препараты внешнего воздействия, которые почти не влияют на свертывающую и противосвертывающую системы крови. Многообразие форм выпуска обеспечивает удобство применения в полевых условиях и полностью удовлетворяет потребностям оказания неотложной помощи при любых кровотечениях. На сегодняшний день наиболее эффективным средством считается хитозан.
Хитозан – это полисахаридный биополимер, получаемый из хитиновых панцирей ракообразных. Кровоостанавливающий эффект данного вещества достигается путем связывания хлопьев хитозана с отрицательно-заряженными эритроцитами и образования гелеобразного сгустка в месте контакта с кровью. Среди преимуществ препаратов на основе хитозана выделяют его антимикробные свойства, длительный срок хранения, стабильность при перепадах температур и безопасность при наружном использовании [8].
Наиболее известным представителем группы средств, понижающих сосудистую проницаемость, является этамзилат. Гемостатический эффект данного препарата обусловлен активацией тромбопластина в месте повреждения сосудов микроциркуляторного русла и снижением синтеза простациклина PGI-2 в эндотелии сосудов, что в конечном итоге приводит к усилению адгезии и агрегации тромбоцитов, остановке или уменьшению кровоточивости. За счет антигиалуронидазного действия этамзилат обладает ангиопротективным эффектом, улучшает микроциркуляцию и нормализует проницаемость сосудистой стенки при патологических процессах [9].
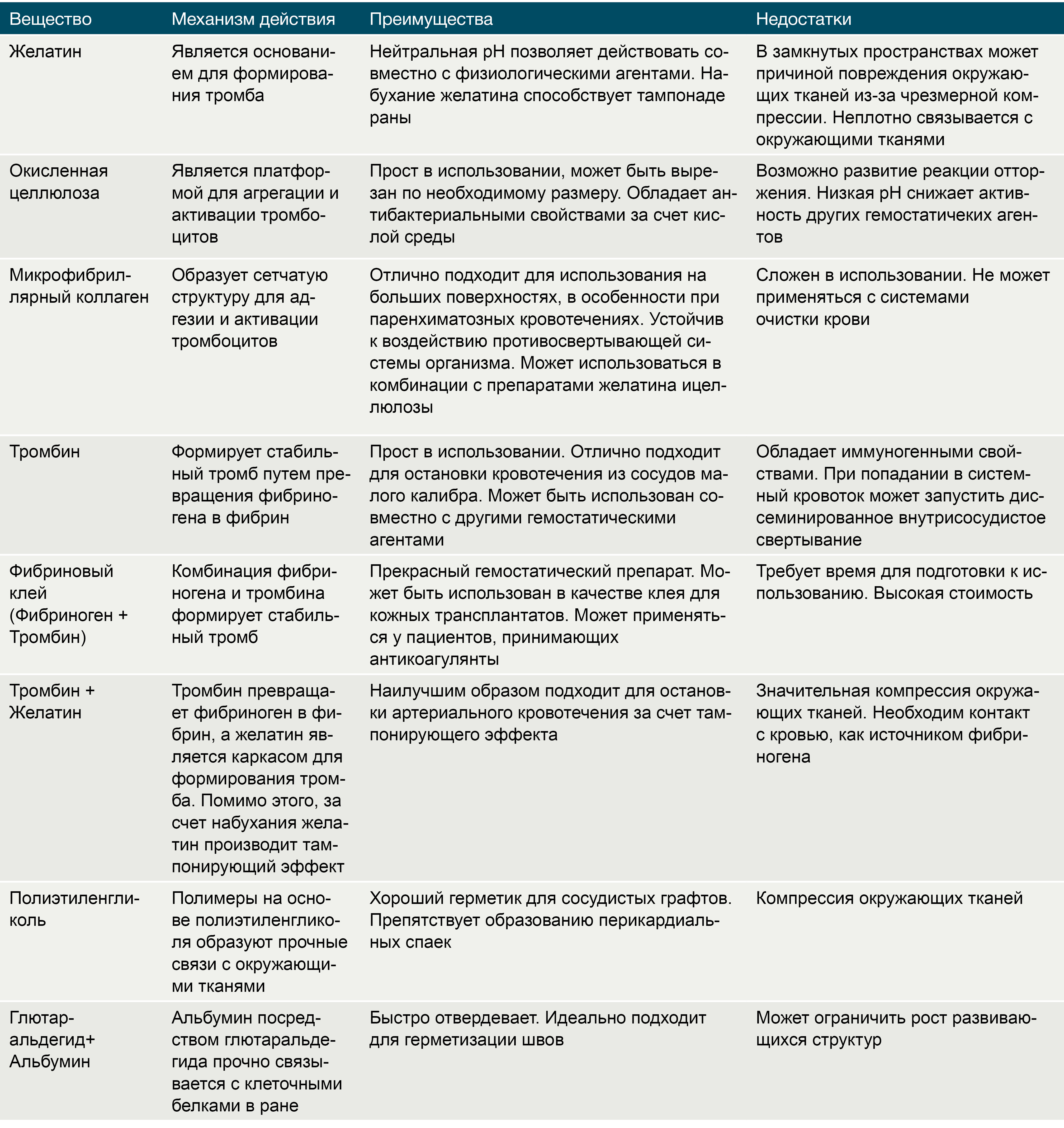 Таблица 1 | Характеристика местных гемостатиков.
Таблица 1 | Характеристика местных гемостатиков.Источники
- Fergusson D. A. et al. A comparison of aprotinin and lysine analogues in high-risk cardiac surgery //New England Journal of Medicine. – 2008. – Т. 358. – №. 22. – С. 2319-2331.
- Williams-Johnson J. A. et al. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial //West Indian Medical Journal. – 2010. – Т. 59. – №. 6. – С. 612-624.
- Ferraris V. A. et al. Perioperative blood transfusion and blood conservation in cardiac surgery: the Society of Thoracic Surgeons and The Society of Cardiovascular Anesthesiologists clinical practice guideline //The Annals of thoracic surgery. – 2007. – Т. 83. – №. 5. – С. S27-S86.
- Sedrakyan A., Treasure T., Elefteriades J. A. Effect of aprotinin on clinical outcomes in coronary artery bypass graft surgery: a systematic review and meta-analysis of randomized clinical trials //The Journal of thoracic and cardiovascular surgery. – 2004. – Т. 128. – №. 3. – С. 442-448.
- Song H. K. et al. Safety and efficacy of prothrombin complex concentrates for the treatment of coagulopathy after cardiac surgery //The Journal of thoracic and cardiovascular surgery. – 2014. – Т. 147. – №. 3. – С. 1036-1040.
- Shapiro A. D. et al. Prospective, randomised trial of two doses of rFVIIa (NovoSeven) in haemophilia patients with inhibitors undergoing surgery //Thrombosis and haemostasis. – 1998. – Т. 79. – №. 05. – С. 773-778.
- Achneck H. E. et al. A comprehensive review of topical hemostatic agents: efficacy and recommendations for use //Annals of surgery. – 2010. – Т. 251. – №. 2. – С. 217-228.
- McManus J. G., Wedmore I. Modern Hemostatic Agents for Hemorrhage Control â A Review and Discussion of Use in Current Combat Operations. – 2005.
- Okuma M. et al. Effects of etamsylate on platelet functions and arachidonic acid metabolism //Thrombosis and haemostasis. – 1982. – Т. 48. – №. 3. – С. 330-333.
