Антиагреганты

Тромбозы, тромбоциты и антиагреганты.
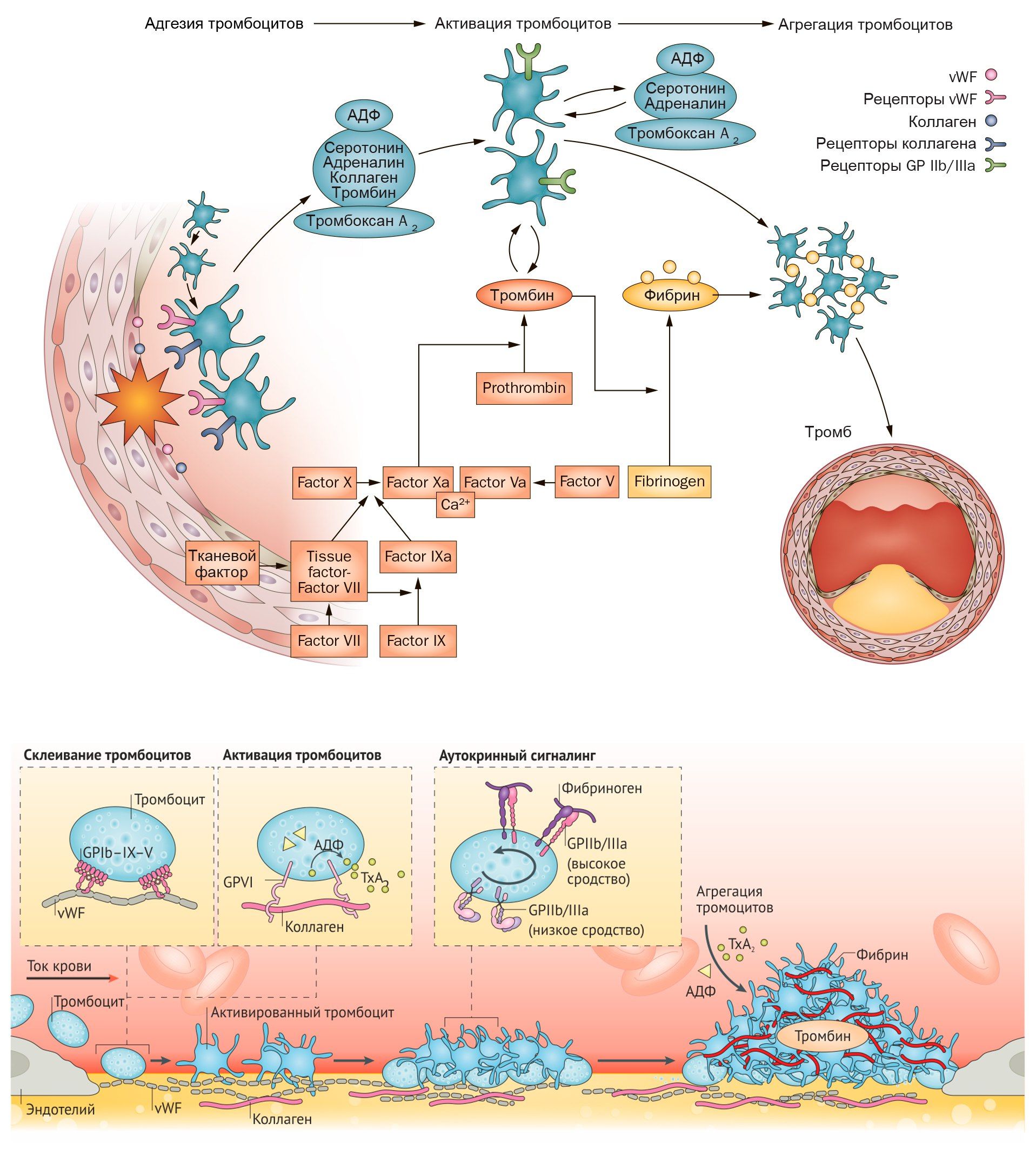
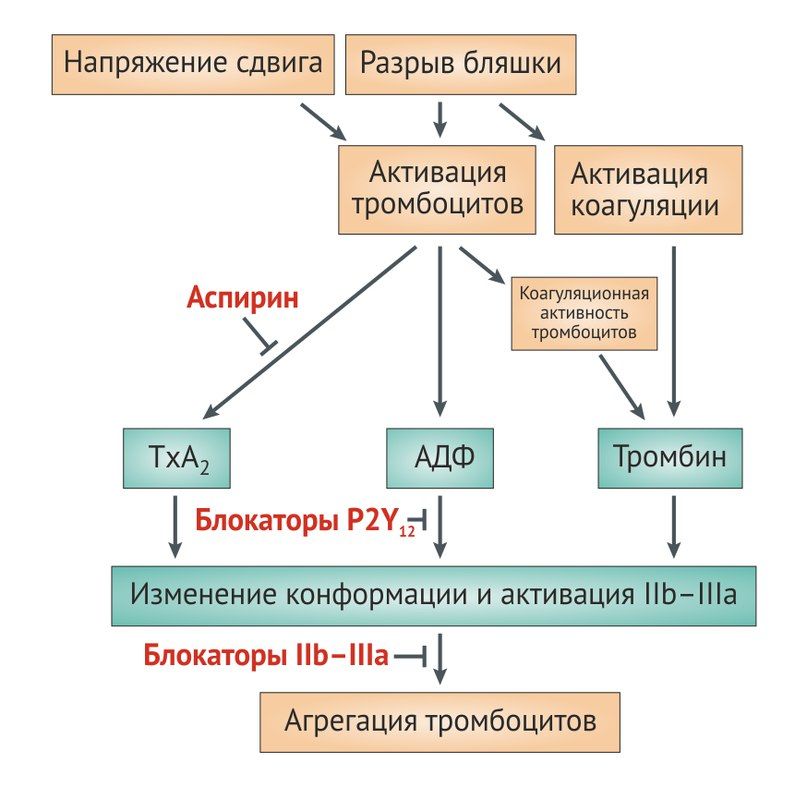
Тромбоз артерий, проявляющийся такими патологиями, как инфаркт миокарда и ишемический инсульт, является ведущей причиной смерти и нетрудоспособности в мире. В образовании тромбов как в физиологических, так и в патологических условиях ведущую роль играют тромбоциты. В сосудистом русле они находятся в неактивном состоянии, а интактный эндотелий обладает антитромботическими свойствами, так как выделяет такие вещества, как оксид азота (NO), простациклин, тканевой активатор плазминогена (t-PA), ингибитор тканевого фактора. При возникновении дефекта эндотелия или изменении напряжения сдвига происходит высвобождение тромбогенных соединений, что запускает коагуляционный (плазменный) и клеточный (тромбоцитарный) гемостаз.
Адгезия тромбоцитов к поврежденному эндотелию происходит в результате взаимодействия коллагена с гликопротеиновыми рецепторами на мембране тромбоцитов, где связующим звеном выступает фактор фон Виллебранда (фактор VIII). Вслед за адгезией к артериальной стенке или в результате взаимодействия специфических рецепторов с адреналином, тромбином, серотонином, тромбоксаном A2 (TxA2) и аденозин-дифосфатом (АДФ) происходит активация и агрегация тромбоцитов.
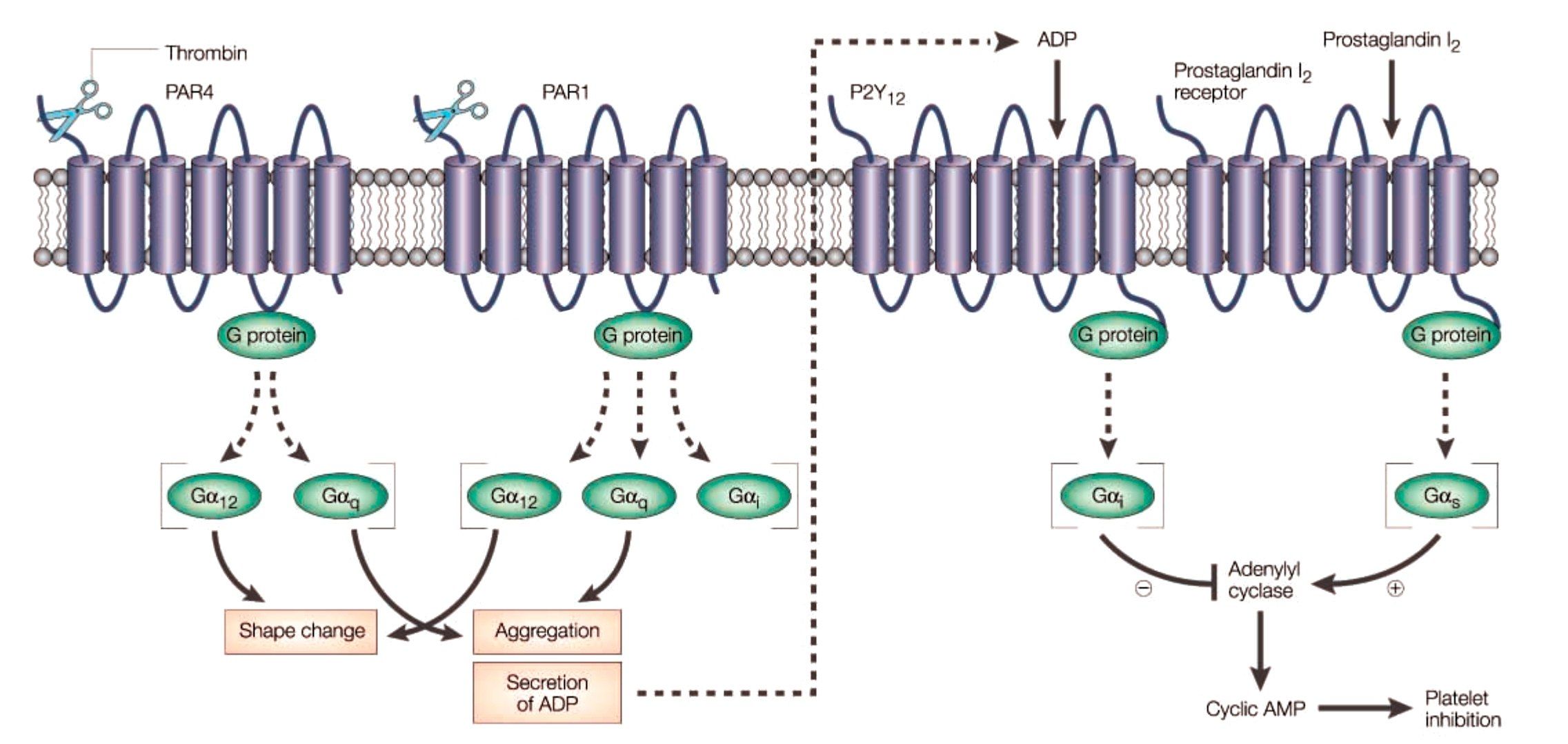
В усилении агрегации тромбоцитов участвуют сопряженные с G-белками пуриновые P2Y-рецепторы АДФ и активируемые протеазами рецепторы к тромбину (PAR). В организме человека обнаружено несколько типов АДФ-специфических рецепторов, экспрессируемых тромбоцитами. Активация P2Y12-рецепторов снижает активность аденилатциклазы (АЦ), в результате снижается количество цАМФ, происходит дегрануляция и активация тромбоцитов и в конечном счете формирование тромба.
В активированных тромбоцитах увеличивается активность фосфолипазы A2 (ФЛА2), ключевого фермента метаболизма арахидоновой кислоты. Циклооксигеназа 1-го типа (ЦОГ-1) тромбоцитов катализирует превращение арахидоновой кислоты в простагландины, которые затем трансформируются в TxA2. Тромбоциты экспрессируют специфические рецепторы к тромбоксану (TPα), стимуляция которых приводит к усилению первичной активации клеток, вызванной тромбином или коллагеном.
Тромбин взаимодействует с тромбоцитами посредством двух рецепторов, активируемых протеазами: PAR-1 и PAR-4. Стимуляция этих рецепторов через различные сигнальные молекулы приводит к активации фосфолипазы β и ингибированию АЦ. PAR-1 — основной рецептор на тромбоцитах человека, он обладает в 10–100 раз большей аффинностью к тромбину по сравнению с PAR-4 и вызывает более быструю активацию клеток. Считается, что именно опосредованная PAR-1 активация тромбоцитов обеспечивает патологическое тромбообразование, тогда как PAR-4 в основном участвует в поддержании нормального гемостаза.
Завершающий этап образования тромба опосредуется гликопротеиновыми рецепторами IIb/IIIa, которые относятся к классу интегринов (αIIbβ3) и являются наиболее многочисленными мембранными рецепторами тромбоцитов. Взаимодействие активированных интегринов αIIbβ3 с фибриногеном и фактором фон Виллебранда обеспечивает необратимое связывание тромбоцитов с чужеродными поверхностями и между собой, к стабилизации адгезии, агрегации и ретракции тромба [2].
Препараты, ингибирующие агрегационную активность тромбоцитов, эффективно предотвращают развитие острых ишемических событий в разных сосудистых бассейнах [1].
Классификация антиагрегантов.
Основные группы антиагрегантов принято условно разделять на 2 группы:
- препараты, блокирующие рецепторы тромбоцитов
- блокаторы рецепторов АДФ
- блокаторы рецепторов PAR
- блокаторы гликопротеиновых рецепторов IIb/IIIa
- препараты, ингибирующие ферменты тромбоцитов
- ингибиторы ЦОГ
- ингибиторы ФДЭ
Стоит отметить, что эта классификация может значительно пополниться в ближайшее десятиление новыми группами, описанными в данном посте.
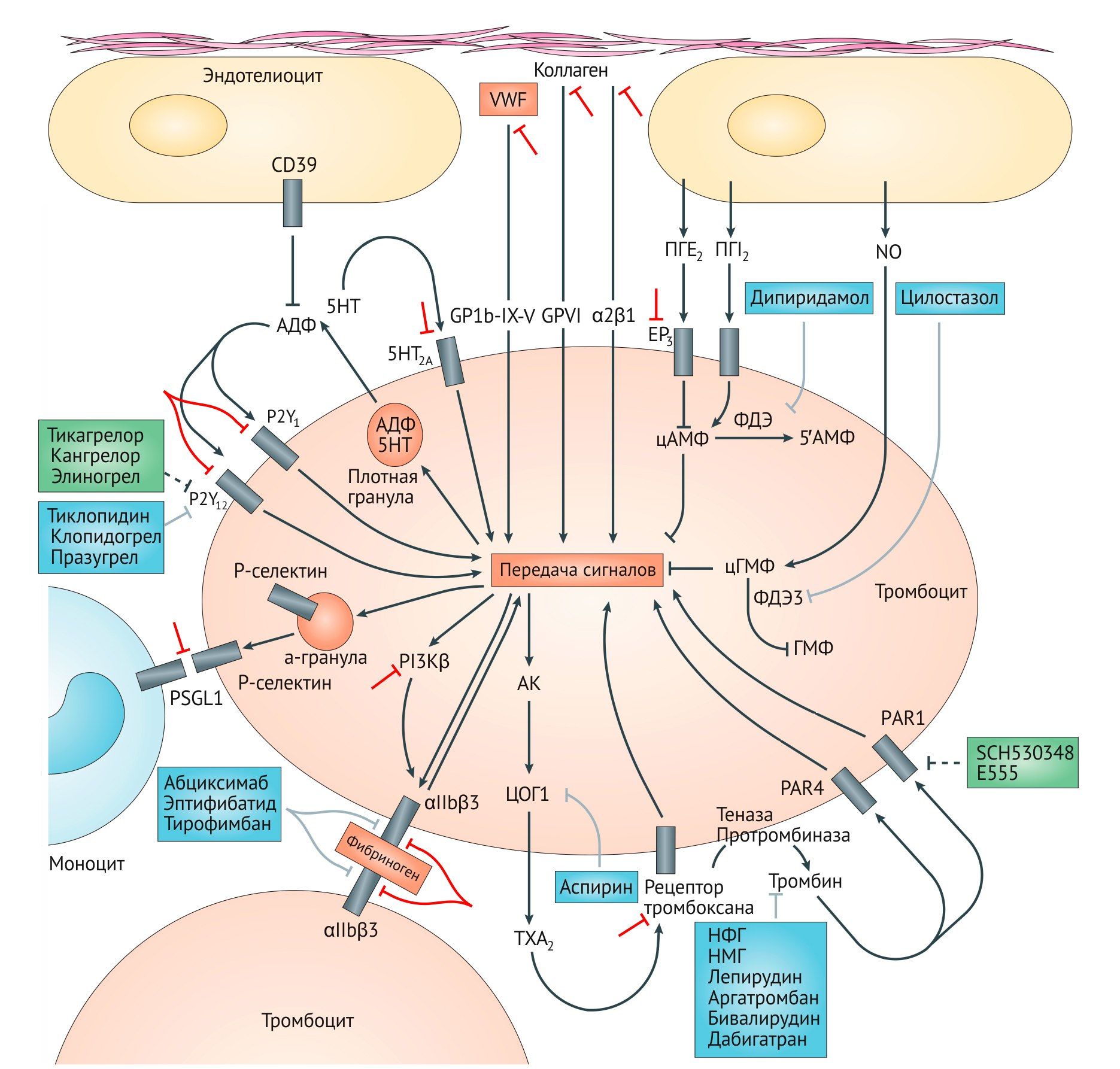
В активации тромбоцитов имеется механизмы положительной обратной связи, опоcредуемые тремя группами рецепторов – пуриновые рецепторы АДФ P2Y1 и P2Y12 (активируются АДФ, выделившимся из гранул тромбоцитов), 5HT2A-рецепторы серотонина (он также находится в тромбоцитах и высвобождается при их активации) и рецепторы простаноида тромбоксана А2 (TxA2), который образуется при участии фермента ЦОГ-1. Скрепление тромбоцитов между собой происходит при участии фибриногена и vWF, которые связываются с активированными интегринами αIIbβ3 (их около 80000 на каждом тромбоците). Фиксация межтромбоцитарных связей также опосредуется другими рецепторами, включая адгезивные молекулы JAM-A и JAM-C, фактор Gas6 и эфрин. Адгезия моноцитов и тромбоцитов происходит при участии P-селектина тромбоцитов и его лигандом PSGL1 на поверхности моноцитов. Активированные моноциты, тромбоциты и микрочастицы образуют поверхность для формирования тромба. Одобренные для применения антиагреганты показаны синим. Антиагреганты на этапах разработки и их мишени отмечены зеленым. Стратегии для создания новых аниагрегантов указаны красным.
АК – арахидоновая кислота, EP3 – рецептор ПГE2, ФДЭ – фосфодиэстераза, ПГ – простагландин, PI3Kβ - фосфоинозитид 3-киназа β.
I. Блокаторы рецепторов тромбоцитов
а) Блокаторы рецепторов АДФ
Молекулярной мишенью ингибиторов рецепторов АДФ является P2Y12-рецептор. Он относится к классу рецепторов, связанных с G-белками и активируется АДФ. Активация P2Y12-рецептора приводит к ингибированию АЦ и снижению уровня цАМФ в тромбоцитах. Это в свою очередь снижает фосфорилирование белка VASP и в итоге приводит к активации IIb/IIIa-рецепторов. Их активация повышает синтез тромбоксана и пролонгирует агрегацию тромбоцитов. Таким образом, ингибирование P2Y12-рецепторов будет нарушать связывание фибриногена с рецепторами IIb/ IIIa и оказывать антиагрегантный эффект [1, 2].
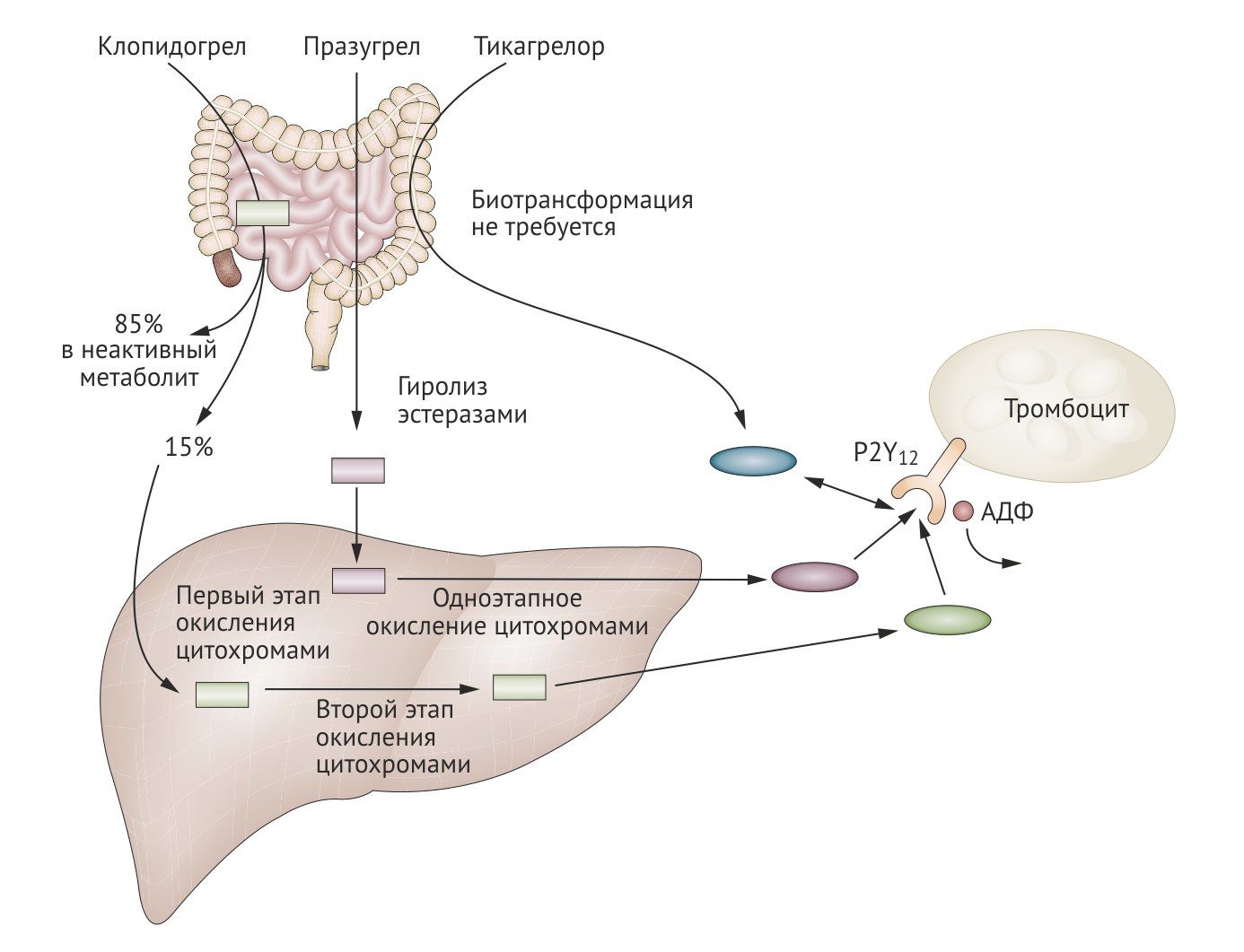
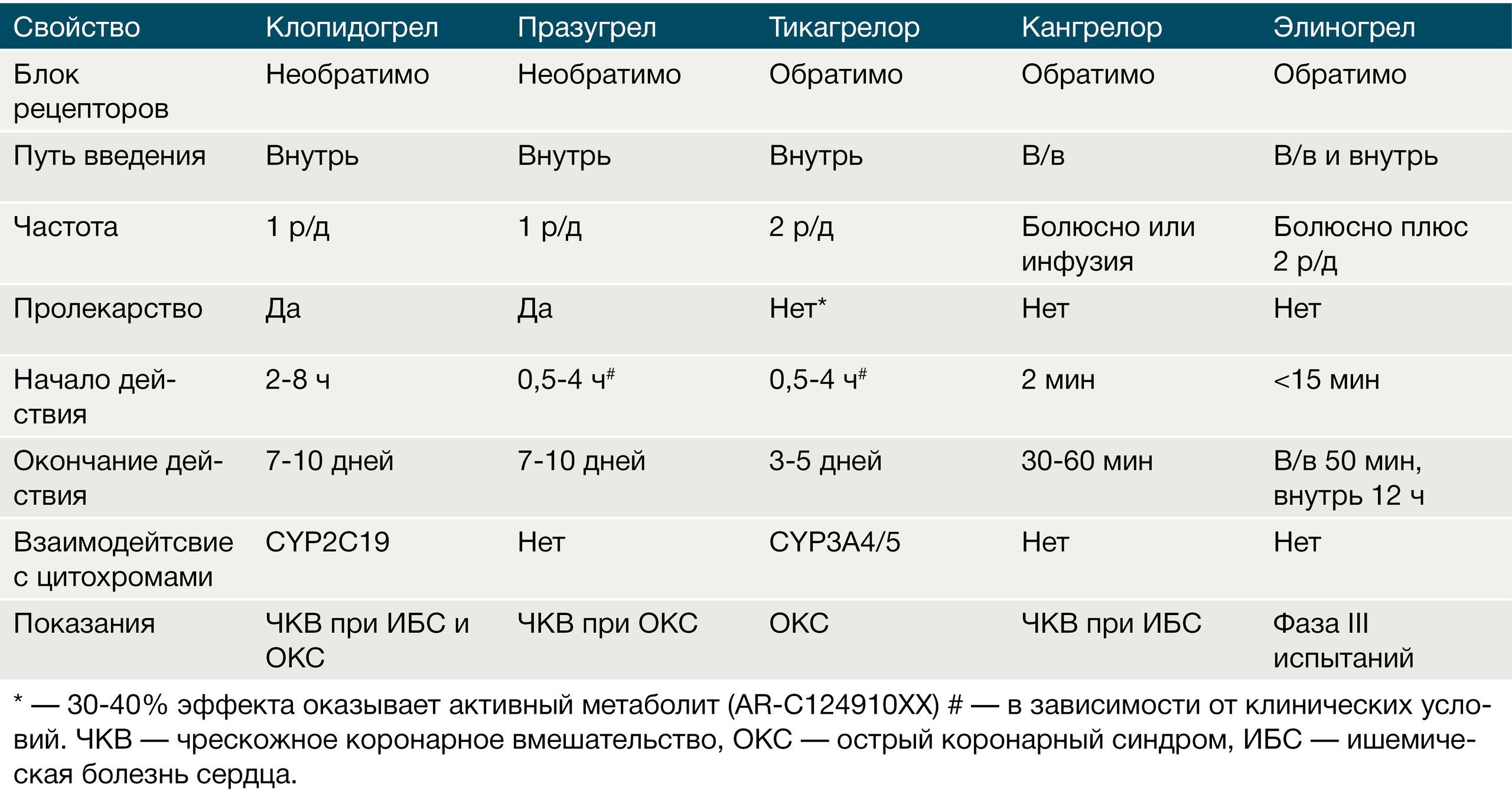
Блокаторы P2Y12-рецепторов разделяют на 2 класса: тиенопиридины (тиклопидин, клопидогрел, празугрел), которые блокируют рецепторы необратимо, и производные других соединений (кангрелор, тикагрелор, элиногрел), действующие обратимо. Все тиенопиридины являются пролекарствами, их активные метаболиты образуются эстеразами плазмы или цитохромами печени [11, 12].
• Тиклопидин
Является первым препаратом этой группы и применяется в клинической практике с 1978 г. Тиклопидин образует под влиянием изофермента CYP3А4 четыре метаболита, один из которых обладает фармакологической активностью. Снижает вызываемую АДФ экспрессию гликопротеиновых рецепторов IIb/IIIa. Значительно ингибирует агрегацию тромбоцитов, вызываемую АДФ, а также препятствует агрегации при действии коллагена, тромбина, серотонина, эпинефрина и ФАТ в малых концентрациях. Антиагрегантный эффект тиклопидина возникает через 24-48 ч после приема внутрь, достигает максимума спустя 3-5 сут, сохраняется в течение 3 сут после прекращения лечения. Агрегация тромбоцитов, индуцированная АДФ, возвращается к исходным значениям только через 4-8 сут. Биодоступность — 80-90%, связь с белками плазмы — 98%, период полуэлиминации — около 13 ч. При курсовом лечении период полуэлиминации удлиняется до 4-5 сут. Две трети дозы тиклопидина экскретируется с мочой, одна треть — с желчью [1, 5].
Побочными эффектами тиклопидина, ограничивающими его применение, являются нейтропения и тромбоцитопения. Поэтому на данный момент тиклопидин успешно заменен аналогами. Вызывает диспепсию, желудочно-кишечные кровотечения, пептическую язву желудка, лейкопению, тромбоцитопению (в первые 3-4 мес лечения необходимо проводить анализ крови каждые 2 нед), повышает в крови активность ферментов печеночного происхождения [1, 8, 11].
• Клопидогрел
Другое производное тиенопиридина, в 6 раз сильнее тиклопидина подавляет агрегацию тромбоцитов, селективно и необратимо блокирует P2Y12-рецепторы. Уменьшает АДФ-зависимую экспрессию гликопротеиновых рецепторов IIb/IIIa, что нарушает связывание с ними фибриногена. Применяется с 1998 г.
Биодоступность клопидогрела составляет 50%, так как он удаляется из энтероцитов гликопротеином Р. Связь с белками плазмы — 94-98%. Период полуэлиминации 8 ч. После всасывания в кишечнике 85% клопидогрела гидролизуется карбоксилазами в неактивный метаболит. Оставшиеся 15% быстро метаболизируются цитохромами печени (преимущественно CYP2C19) в два этапа с образованием в итоге активного метаболита (2-оксаклопидогрел), конкурентно и необратимо блокирующего P2Y12-рецепторы. Основное значение имеет окисление при участии CYP2C19, полиморфизм его гена в наибольшей степени определяет индивидуальную реакцию на клопидогрел. Препарат нерационально принимать одновременно с блокаторами кальциевых каналов группы дигидропиридина, которые окисляются CYP3А4, а также с ингибиторами протонной помпы (ИПП), снижающими активность CYP2C19 (исключения – пантопразол и рабепразол). Выводится с мочой и желчью [1, 12, 13].
Торможение агрегации начинается через 2 ч после приема клопидогрела внутрь в дозе 400 мг, максимальное действие развивается через 4-7 сут курсового лечения в дозе 50-100 мг/сут. Агрегация не восстанавливается в течение всего периода циркуляции тромбоцитов (7-10 сут).
Назначают внутрь для профилактики инфаркта миокарда, ишемического инсульта, тромбоза периферических артерий, сердечно-сосудистой смерти у больных атеросклерозом, сахарным диабетом, при наличии более одного ишемического события в анамнезе, поражении нескольких сосудистых бассейнов. Клопидогрел предупреждает тромбозы после чрескожных коронарных вмешательств, хотя его применение ограничено из-за риска кровотечений.
В клинической практике наблюдаются индивидуальные различия среди пациентов в ответе на клопидогрел. Механизмы различного ответа на препарат объясняются следующим. Во-первых, так как клопидогрел метаболизируется цитохромами печени, то препараты, конкурирующие с клопидогрелом за биотрансформацию (например, ИПП) или ингибирующие активность цитохромов печени, могут уменьшать активность клопидогрела. Например, регулярное употребление грейпфрутового сока (600-800 мл) способно значимо снизить антиагрегантный эффект клопидогрела. Хотя клиническое значение ингибиторов цитохромов в эффекте клопидогрела остается под сомнением. Во-вторых, активность клопидогрела может повышать курение, предположительно ввиду индукции CYP1A2, метаболического активатора клопидогрела. В-третьих, достаточно распространен вариант изоформы CYP2C19 с ослабленной активностью (около 30% европейцев, 40% африканцев и >50% азиатов), что значительно снижает уровни активного метаболита клопидогрела. И в-четвертых, имеются данные, что важное значение в эффективности клопидогрела играет исходный ответ тромбоцитов на АДФ, вызванный, вероятно, полиморфизмом гена рецептора Р2Y12.
Клопидогрел реже тиклопидина вызывает гастроинтестинальные события, кровотечения, лейкопению, тромбоцитопению, кожные высыпания. У больных с хорошей ответной реакцией на прием клопидогрела ниже риск тяжелых осложнений сердечно-сосудистых заболеваний, но возрастает риск кровотечений [1, 5, 10, 13, 16].
• Празугрел
Тиенопиридин, пролекарство, необратимый ингибитор P2Y12-рецепторов. Был введен на рынок фармпрепаратов в 2009-м. Отличается более высокой эффективностью по сравнению с клопидогрелом. Активные метаболиты празугрела образуются под влиянием эстераз кишечника и плазмы крови и цитохромов печени, поэтому он в меньшей степени зависит от активности последних. По сравнению с клопидогрелом действие празугрела наступает более быстро. Кроме того, празугрел имеет большую биодоступность и меньшую вариабельность ответа на лечение среди пациентов. Максимальный эффект наступает спустя 2 дня, после отмены препарата тромбоциты восстанавливают свою функцию тоже 2 дня.
Нагрузочная доза празугрела в 60 мг оказывает более выраженный антиагрегантный эффект, чем стартовые дозы клопидогрела в 300-600 мг. Поддерживающие дозы празугрела в 10 мг также более эффективны поддерживающих доз (75 мг) клопидогрела [10].
Празугрел одобрен для предотвращения тромбозов при проведении ЧКВ у пациентов ОКС. Также препарат показал свою эффективность в снижении риска ИМ. Большая антитромбоцитарная активность празугрела была сопряжена с достоверным увеличением риска геморрагических осложнений. Наиболее высоким риск геморрагических осложнений был в подгруппах пациентов, ранее перенесших инсульт или транзиторную ишемическую атаку, а также старше 75 лет и с массой тела менее 60 кг. В связи с этим предлагается использовать поддерживающую дозу 5 мг (вместо 10 мг) для пациентов с массой тела <60 кг [13].
• Тикагрелор
В отличие от тиклопидина и клопидогрела тикагрелор является циклопентил-триазоло-пиримидином и прямым обратимым антагонистом P2Y12-рецепторов. Как и празугрел, тикагрелор действует быстро и является более сильным ингибитором агрегации тромбоцитов, чем клопидогрел, а также вызывает меньший риск кровотечений.
Тикагрелор не является пролекарством и ингибирует тромбоциты исходной молекулой, хотя 30-40% своей активности он обязан метаболиту (AR C124910XX), образующемуся при участии цитохромов CYP3A4 и CYP3A5. Препарат обратимо связывает неконкурентный сайт P2Y12-рецептора, таким образом, являясь аллостерическим регулятором АДФ-зависимой активации тромбоцитов. По сравнению с клопидогрелом тикагрелор связывает более быстрый, устойчивый и предсказуемый эффект. Кроме этого тикагрелор ингибирует обратный захват аденозина, т.е. повышает его уровень в плазме. Аденозин вызывает такие эффекты как расширение коронарных сосудов, снижение ишемического и реперфузионного повреждения, подавление воспалительного ответа при стрессе, отрицательные дромотропный и хронотропный эффекты, снижение гломерулярной фильтрации и стимуляция легочных С-волокон, что может вызывать диспноэ. Хотя эти эффекты все еще предстоит изучить, они могут вносить вклад в снижение смертности пациентов с ОКС, которые получали тикагрелор (РКИ PLATO). Аденозин также объясняет побочные эффекты тикагрелора — экстрасистолы, повышение концентрации креатинина в сыворотке и диспноэ (у 15-22% пациентов).
Эффект тикагрелора наступает в течение 30 минут после приема, к этому времени происходит подавление активности более 40% тромбоцитов. Максимальный эффект развивается через 2 часа. Период полувыведения из плазмы крови 8-12 ч, устойчивая концентрация достигается через 2-3 дня. Так как он является обратимым ингибитором P2Y12-рецепторов, то при отмене препарата происходит более быстрое восстановление функции тромбоцитов, чем при приеме тиенопиридинов. Рекомендуемая нагрузочная доза тикагрелора 180 мг однократно, поддерживающая — 90 мг 2 раза в день внутрь.
Механизм действия тикагрелора (связывается обратимо) требует другого подхода в лечении пациентов, у которых развилось кровотечение. В то время как больным, получающим аспирин или тиенопиридины, достаточно переливания тромбоцитарной массы, эффекты тикагрелора и его циркулирующего метаболита не могут быть устранены таким образом [1].
• Кангрелор
Является аналогом АТФ, обратимо блокирует рецепторы Р2Y12 тромбоцитов, не требует метаболической активации, отличается коротким периодом полуэлиминации (3-6 мин), оказывает быстрый антитромбоцитарный эффект в течение 60 мин. Вводится только внутривенно. В крови кангрелор дефосфорилируется до неактивного нуклеозида. Кангрелор вливают в вену для экстренного торможения агрегации тромбоцитов при инфаркте миокарда и ЧКВ, а также в случаях, когда необходим короткий эффект, например, при аортокоронарном шунтировании [1, 9, 12].
• Элиногрел
Химически относится к производным сульфонилмочевины, является обратимым антагонистом P2Y12-рецепторов. Не требует метаболической активации, подходит для приема внутрь и внутривенного введения. Эффект развивается очень быстро (в течение 20 минут), пиковая концентрация в плазме крови достигается через 4-6 часов, практически полностью выводится через 24 часа. Период полувыведения приблизительно 12 часов. Около 60% дозы выводится с мочой. Так как является производным сульфонилмочевины, то возможна (но пока не изучена) перекрестная аллергия с другими препаратами этой группы (противодиабетические, диуретики) [12].
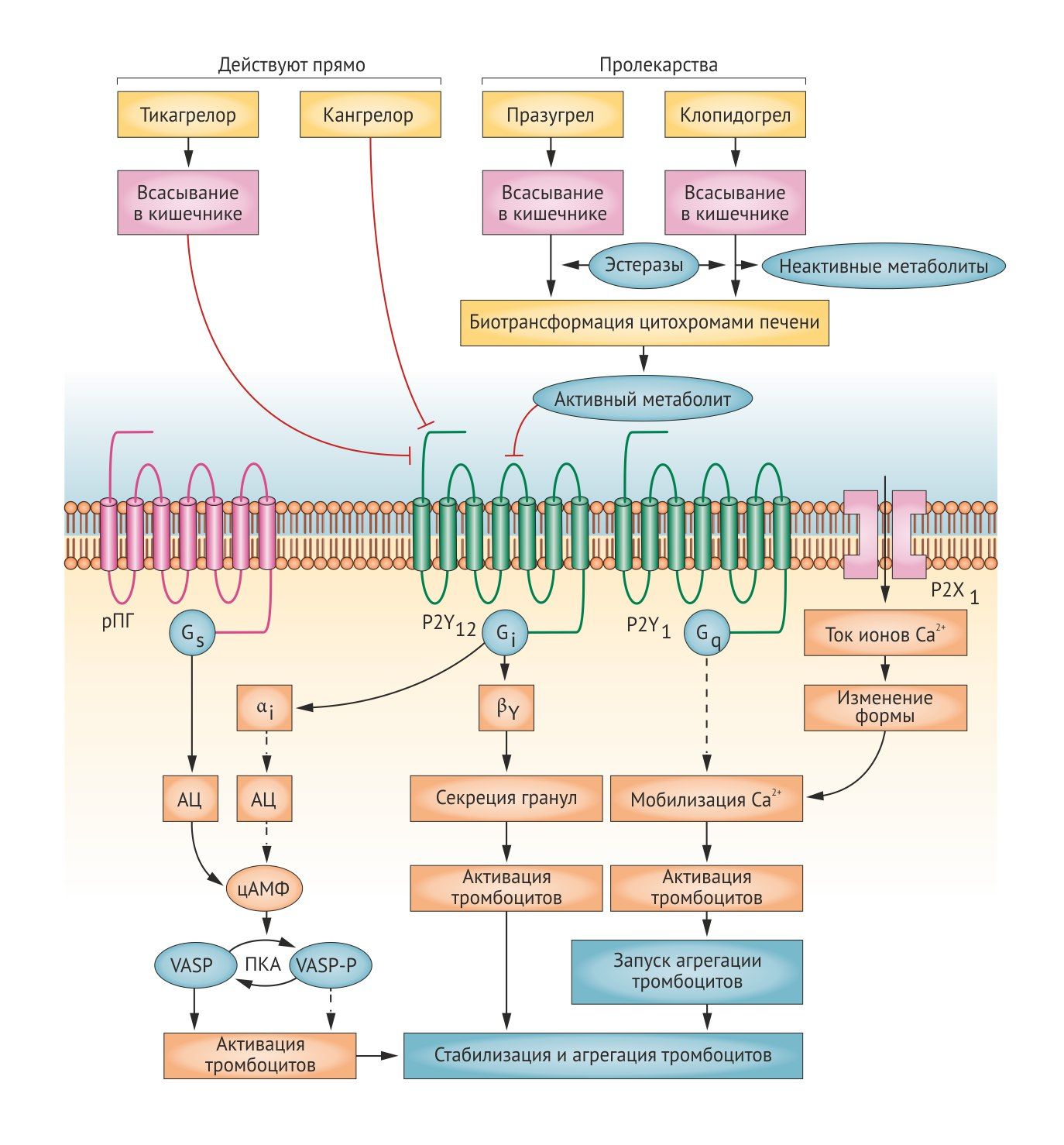
Таблица 1. Основные свойства блокаторов P2Y12 рецепторов
b) Ингибиторы PAR1
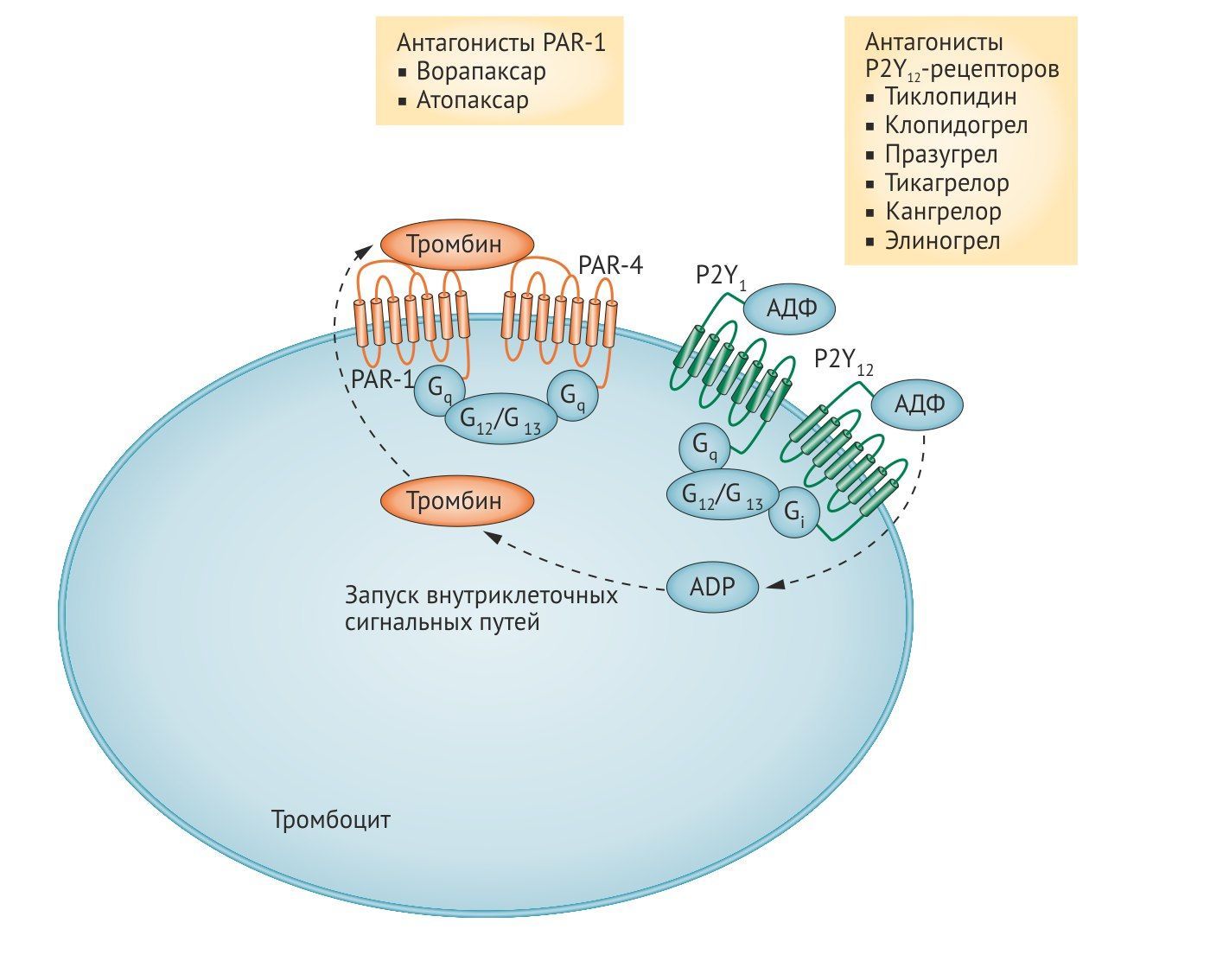
Тромбин, образующийся в процессе коагуляционного каскада, является сильным активатором тромбоцитов через два типа рецепторов, активируемых протеазами — PAR1 и PAR4. Стимуляция этих рецепторов через различные сигнальные молекулы приводит к активации фосфолипазы β и ингибированию аденилатциклазы. PAR-1 — основной рецептор на тромбоцитах человека, он обладает в 10–100 раз большей аффинностью к тромбину по сравнению с PAR-4 и вызывает более быструю активацию клеток. Считается, что именно опосредованная PAR-1 активация тромбоцитов обеспечивает патологическое тромбообразование, тогда как PAR-4 в основном участвует в поддержании нормального гемостаза. Поэтому блок PAR-1 рецепторов тромбоцитов будет ингибировать их тромбин-опосредованную активацию, но не тромбин-индуцированную активацию фибриногена, последний этап коагуляционного каскада. На данный момент изучаются и применяются 2 таких антагониста — ворапаксар и атопаксар [7, 8, 11].
• Ворапаксар
Ворапаксар является синтетическим 3-фенилпиридином, аналогом химбацина. При приёме внутрь ворапаксар быстро поступает в кровь, имеет высокую биодоступность и долгий период полувыведения (165–311 ч). Элиминация вопаксара происходит преимущественно при участии ферментов CYP3A печени, лишь 5% ворапаксара выводятся почками. Ворапаксар уже в первую неделю применения способен снижать TRAP-опосредованную агрегацию тромбоцитов на 80%. Т.к. он имеет длительный период полувыведения, то даже спустя 4 недели после отмены препарата активность тромбоцитов остается на уровне 50%. В отличие от других антиагрегантов ворапаксар не влияет на АДФ-опосредованную агрегацию тромбоцитов, параметры коагуляции и время кровотечения.
Ворапаксар одобрен FDA для лечения пациентов с инфарктом миокарда и заболеваниями периферических сосудов. Препарат противопоказан для пациентов, перенёсших инсульт, ТИА и внутричерепные кровоизлияния, т.к. значительно повышает риск кровотечений. К тому же долгий период полувыведения вопаксара создает проблему нейтрализации его антиагрегантного эффекта (пока специфического антидота нет) [5, 7, 9].
• Атопаксар
Кроме основного действия атопаксар вызывает изменения в экспрессии основных поверхностных рецепторов, включая гликопротеин IIb/IIIa, (PECAM)-1, виронектин и тромбоспондин. Элиминируется преимущественно через ЖКТ, 10% введённого вещества выводится почками. По сравнению с вопаксаром он имеет гораздо более короткий период полуэлиминации из плазмы — 22–26 ч. Вторая фаза клинических исследований показала безопасность атопаксара в дозировках 50, 100 и 200 мг и меньший риск кровотечений по сравнению с аспирином. На данный момент находится на 3 фазе клинических исследований.
Ведутся попытки создать антагонисты PAR4. Препарат под кодовым названием BMS‑986120 находится на I фазе клинических испытаний. На приматах он продемонстрировал антитромботическую эффективность, сравнимую с клопидогрелом, но без влияния на гемостаз [7].
c) Антагонисты IIb/IIIa рецепторов
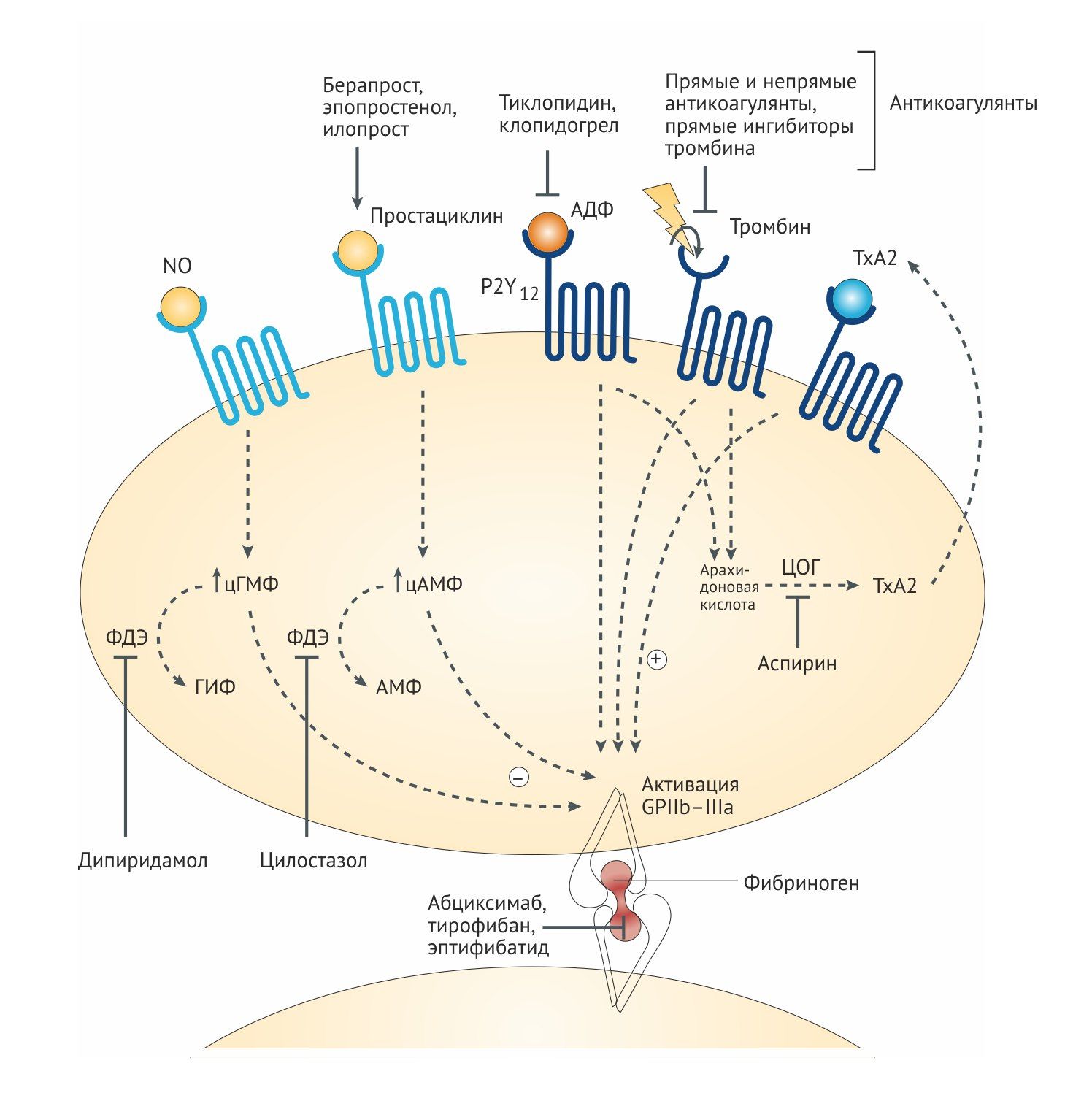
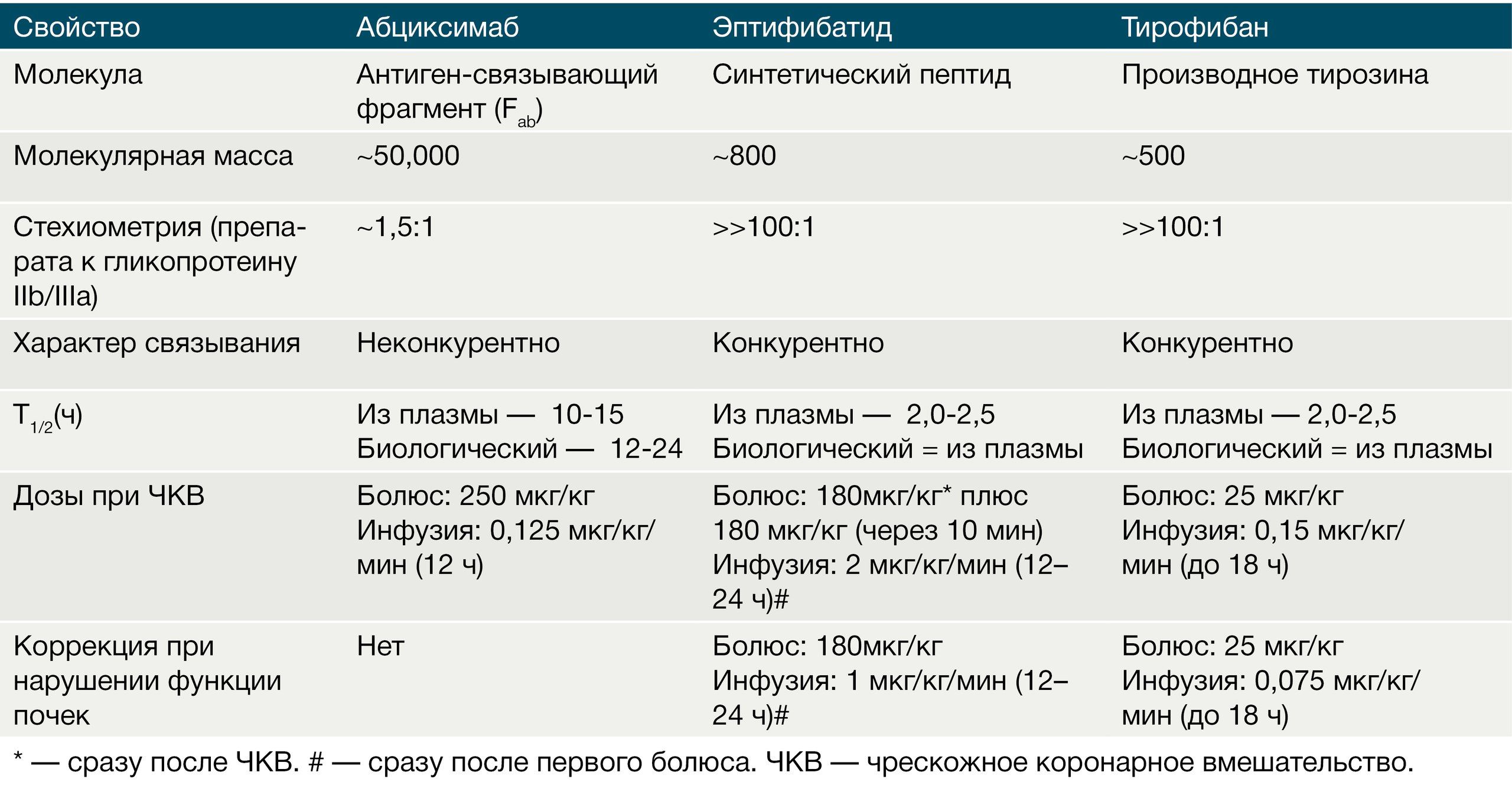
Активация гликопротеиновых IIb/IIIa рецепторов является заключительным общим этапом агрегации тромбоцитов. Антагонисты гликопротеиновых IIb/IIIa рецепторов за счёт кратковременной блокады мишеней препятствуют формированию фибриновых мостиков между тромбоцитами. Блокаторы гликопротеиновых рецепторов IIb/IIIa могут быть разделены на крупные (абциксимаб) и малые (эптифибатид, тирофибан) молекулы. Их мишенью является последний этап пути агрегации тромбоцитов, т.к. они конкурируют с фактором фон Виллебранда и фибриногеном за связь с гликопротеиновым рецептором IIb/IIIa.
Абциксимаб представляет из себя гуманизированный антиген-связывающий фрагмент моноклональных антител мыши, эптифибатид является циклическим гептапептидом с консервативной RGD-последовательностью «аргинин-глицин-аспарагин» (мимикрирует эту последовательность в фибриногене), тирофибан имеет небелковую природу, также мимикрируя связывающую область фибриногена. Все препараты вводятся только внутривенно, широко используются у пациентов с ОКС и при проведении ЧКВ. В клинических исследованиях у пациентов c ОКС интенсификация антитромбоцитарного лечения за счёт внутривенного введения блокаторов IIb/IIIa гликопротеиновых рецепторов приводила к достоверному (в среднем на 21%) снижению риска смерти и нефатальных тромбозов, связанных с внутрикоронарными вмешательствами, по сравнению с лечением аспирином, но эти результаты были получены до внедрения в клиническую практику тиенопиридиновых производных. В настоящее время использование блокаторов гликопротеиновых IIb/IIIa рецепторов ограничено интервенционным лечением ОКС в ситуациях, сопряжённых с высоким риском тромбозов или сохранением ишемии миокарда и при невозможности проведения ДААТ (стандартные режимы ДААТ не менее эффективны).
Кроме ингибирования агрегации тромбоцитов эти препараты также имеют антикоагулянтное действие, что проявляется в удлинении времени свёртывания, ингибировании образования тромбина и снижении прокоагулянтной активности тромбоцитов. Механизмы антикоагулянтного действия блокаторов IIb/IIIa рецепторов включают препятствование связыванию протромбина с рецепторами IIb/IIIa. Абциксимаб также связывается c интегринами αvβ3 и αmβ2, однако клиническое значение такого взаимодействия остается неясным.
Возможности фармакологического воздействия на другие гликопротеины, регулирующие функциональную активность тромбоцитов, активно изучаются. На разных стадиях доклинической разработки находится несколько антагонистов фактора фон Виллебранда, ингибиторов коллагенового рецептора — гликопротеина VI и гликопротеина Ib [8, 9, 11].
• Абциксимаб
Химерные антитела, состоящие из Fab-фрагментов мышиных антител против гликопротеина IIb/IIIa в комплексе с константным участком иммуноглобулина человека с7Е3. Необратимо блокирует рецепторы IIb/IIIa на тромбоцитах (80% через 2 ч после вливания в вену). Нарушает связывание с рецепторами активаторов адгезии и агрегации — витронектина, фибронектина, фактора фон Виллебранда и фибриногена. Антиагрегантное действие сохраняется в течение 48 ч (абциксимаб депонируется в связи с тромбоцитами).
Абциксимаб вводят непрерывно в вену при коронарной ангиопластике у мужчин с ОКС. Лечение наиболее эффективно при высоком уровне тропонинов и лиганда рецепторов CD40 в крови. У женщин уровень кардиальных тропонинов повышается в крови реже, поэтому лечебный эффект абциксимаба выражен слабее. Для безопасной терапии контролируют активированное частичное тромбопластиновое время (АЧТВ), гематокрит, уровень тропонинов, гемоглобина и тромбоцитов.
Побочные эффекты абциксимаба — кровотечения, брадикардия, атриовентрикулярная блокада, артериальная гипотензия, тошнота, рвота, плевральный выпот, пневмония, периферические отёки, анемия, лейкоцитоз, тромбоцитопения, аллергические реакции (до анафилактического шока) [9].
• Эптифибатид
Синтетический циклический пептид (6 аминокислот с остатком дезаминоцистеинила). Обратимо блокирует рецепторы IIb/IIIa тромбоцитов. Агрегация восстанавливается на 50% через 4 ч после прекращения инфузии. Не оказывает заметного влияния на протромбиновое время и АЧТВ. Связь с белками плазмы — 25%. Большая часть выводится почками в неизменённом виде и в виде метаболитов, период полуэлиминации — 2,5 ч. Эптифибатид вливают в вену в виде болюса, затем капельно в течение 12–72 ч при ИМ и нестабильной стенокардии, а также для профилактики тромботической окклюзии поражённой артерии и острых ишемических осложнений при ЧКВ, включая интракоронарное стентирование. При введении эптифибатида возможны кровотечения и тромбоцитопения [9, 11].
Абциксимаб и эптифибатид противопоказаны при гиперчувствительности, кровотечении, нарушении мозгового кровообращения (в том числе в анамнезе), артериальной гипертензии, геморрагическом диатезе, васкулите, тромбоцитопении, обширной хирургической операции и травме в предшествующие 1,5 мес. Антикоагулянты непрямого действия отменяют за 7 дней до предполагаемой инфузии абциксимаба и эптифибатида. Возможно резистентность, обусловленная полиморфизмом рецепторов IIb/IIIa. У части больных рецепторы IIb/IIIa находятся в цитоплазме тромбоцитов и недоступны для действия абциксимаба и эптифибатида, но активируются фибриногеном и тромбином.
• Тирофибан
Является производным тирозина непептидной природы. Наступление эффекта быстрое, как и его прекращение. Период полуэлиминации из плазмы крови составляет около 2 часов. Имеет высокую специфичность к IIb/IIIa рецепторам, но низкую аффинность. Выводится в неизменённом виде почками. Эптифибатид и тирофибан комбинируют с АСК и препаратами гепарина [9, 11].
Антагонисты IIb/IIIa для приёма внутрь (xemilofiban, orbofiban, sibrafiban, lotrafiban) оказались неэффективными в клинических испытаниях и имели высокий риск тромбоцитопении [14].
Таблица 2. Сравнительные характеристики блокаторов гликопротеиновых IIb/IIIa рецепторов.
II. Ингибиторы ферментов тромбоцитов
a) Ингибиторы фосфодиэстеразы (ФДЭ)
• Дипиридамол
Производное пиридопиримидина, антиагрегант и вазодилататор. Дипиридамол ингибирует агрегационную активность тромбоцитов благодаря нескольким механизмам: ингибирует ФДЭ, блокирует обратный захват аденозина (который действует на А2-рецепторы тромбоцитов и активирует аденилатциклазу) и ингибирует синтез тромбоксана А2. Ингибируя аденозиндезаминазу и фосфодиэстеразу III, димиридамол повышает в крови содержание эндогенных антиагрегантов — аденозина и цАМФ, стимулирует выделение простациклина эндотелиальными клетками, тормозит захват АТФ эндотелием, что ведёт к увеличению его содержания на границе между тромбоцитами и эндотелием. Дипиридамол в большей степени подавляет адгезию тромбоцитов, чем их агрегацию, удлиняет продолжительность циркуляции тромбоцитов. Расширяет коронарные артериолы, потому у пациентов с коронарным синдромом он может спровоцировать «синдром обкрадывания». Умеренно снижает системное АД.
Биодоступность — 37–66%, связь с белками плазмы — 91–99%. В печени дипиридамол преобразуется в неактивные глюкурониды, элиминируемые с желчью, 20% дозы участвует в энтерогепатической циркуляции. Период полуэлиминации препарата в первой фазе составляет 40 мин, во второй — около 10 ч. Это позволяет принимать его всего два раза в день (при использовании формы с модифицированным высвобождением).
Дипиридамол назначают для лечения и профилактики ишемических нарушений мозгового кровообращения, лечения дисциркуляторной энцефалопатии, профилактики артериальных и венозных тромбозов. Препарат используется (иногда вместе с варфарином) для профилактики послеоперационных осложнений, связанных с заменой сердечного клапана и для вторичной профилактики инсульта.
Наиболее частым побочным проявлением при применении дипиридамола является головная боль, реже — головокружение, гипотензия. Дипиридамол противопоказан при индивидуальной непереносимости, инфаркте миокарда, нестабильной стенокардии, атеросклерозе коронарных артерий, ХСН, аритмии, артериальной гипотензии, хронической обструктивной болезни лёгких, нарушениях функций печени и почек, заболеваниях со склонностью к кровотечениям [1, 7, 10].
• Пентоксифиллин
Оксигенильное производное диметилксантина, структурный аналог теобромина. Подобно другим ксантинам, ингибирует изоферменты фосфодиэстеразы III, IV и V и задерживает инактивацию цАМФ.
Накопление цАМФ сопровождается расширением сосудов, умеренным усилением сердечных сокращений, повышением диуреза, снижением агрегации тромбоцитов и эритроцитов. Наиболее важный эффект пентоксифиллина — улучшение деформируемости эритроцитов. Под влиянием пентоксифиллина в эритроцитах активируется гликолиз, что увеличивает содержание факторов эластичности. Такими факторами являются дифосфоглицерат (снижает сродство компонента цитоскелета эритроцитов спектрина к сократительному белку актину) и АТФ (связывает гемоглобин).
Пентоксифиллин, предотвращая потерю эритроцитами ионов калия, придаёт устойчивость к гемолизу. При лечении пентоксифиллином улучшение реологических свойств крови наступает через 2–4 нед. Такое замедленное действие обусловлено влиянием препарата не на циркулирующие эритроциты, а на клетки эритропоэза в костном мозге.
Пентоксифиллин хорошо всасывается из кишечника. Максимальная концентрация в крови регистрируется через 2–3 ч. В печени образуются семь метаболитов пентоксифиллина, из которых два обладают антиагрегантным влиянием. Метаболиты экскретируются с мочой. Период полуэлиминации пентоксифиллина — 1 ч [1]. Основное применение пентоксифиллина — лечение заболеваний периферический артерий, в первую очередь перемежающейся хромоты. По эффективности пенитоксифиллин значительно уступает цилостазолу, потому используется при непереносимости последнего [4].
Побочные эффекты пентоксифиллина при приёме внутрь: снижение аппетита, тошнота, диарея, головокружение, покраснение лица, сердцебиение, тахикардия, сонливость или инсомния, кожные аллергические реакции. При внутриартериальном и внутривенном вливании пентоксифиллин снижает АД. В больших дозах он может вызывать кровотечения. Пентоксифиллин противопоказан при кровотечениях, кровоизлиянии в мозг и сетчатку глаза, инфаркте миокарда, нестабильной стенокардии, атеросклерозе сосудов головного мозга и сердца.
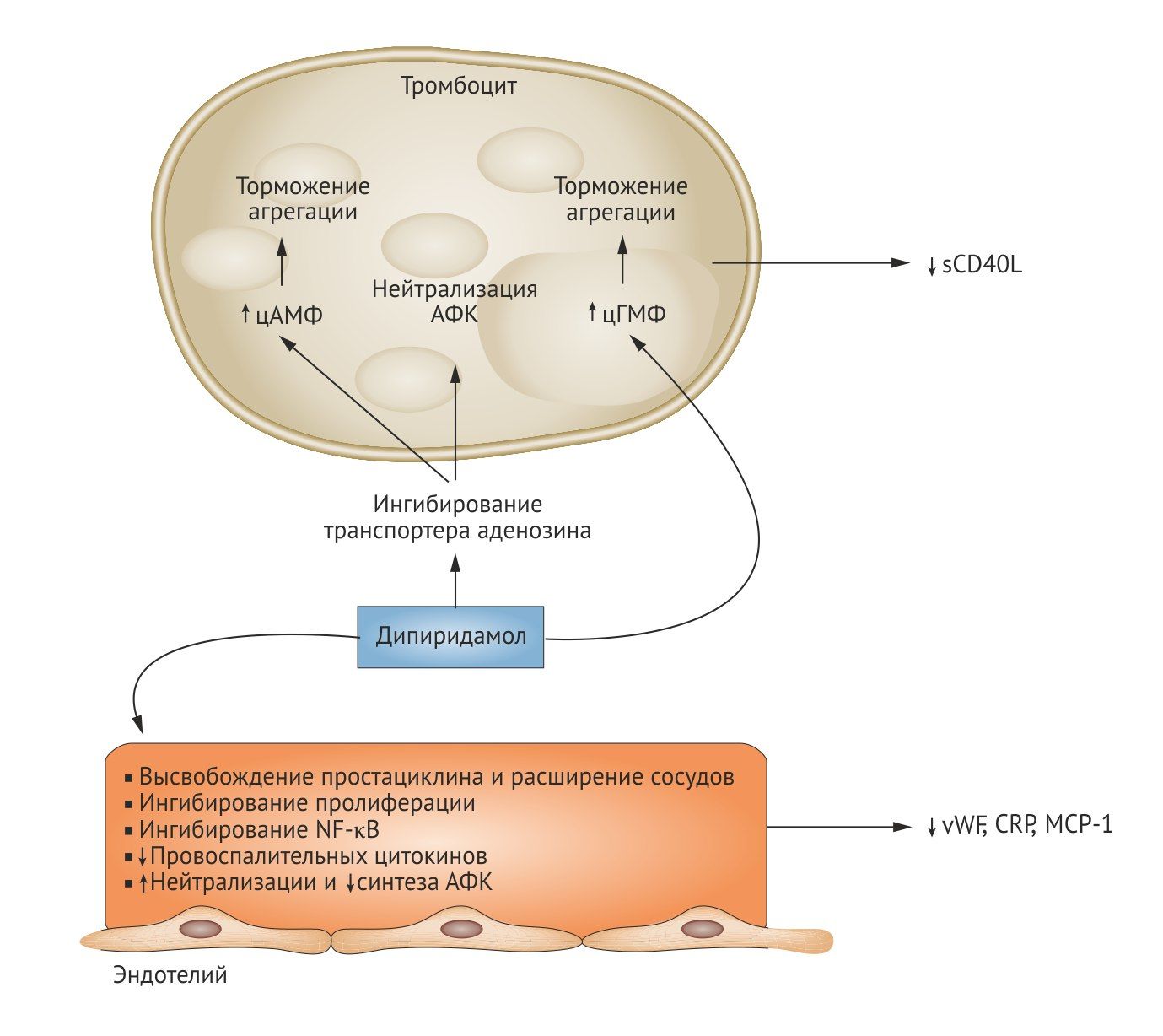
CRP, C-реактивный белок; MCP-1, хемоаттарктантный белок моноцитов 1; NF-κB, ядерный фактор κB; sCD40L, растворимый лиганд CD40 тромбоцитов; vWF, фактор фон Вллебранда.
• Цилостазол
Селективный ингибитор ФДЭ3. Увеличение уровня цАМФ повышает активность ПКА, которая опосредованно ингибирует агрегацию тромбоцитов. ПКА также предотвращает активацию киназы лёгких цепей миозина, таким образом оказывается сосудорасширяющий эффект. Кроме того, повышение уровня цАМФ ингибирует вход кальция в клетки, их миграцию, пролиферацию и синтез внеклеточного матрикса. Оказывает антиагрегантный, сосудорасширяющий и антимитогенный эффекты (ингибирует пролиферацию ГМК сосудов). Подавляет агрегацию тромбоцитов сильнее тиклопидина и аспирина.
Дозировки цилостазола 50 и 100 мг. Медленно всасывается в кишечнике, достигает пиковой концентрации в плазме через 2–4 часа. Активно связывается с альбумином (95%). Принимают за 30 минут до еды или через 2 часа после. Максимальный антиагрегантный эффект развивается через 3–6 часов. Метаболизируется цитохромами печени CYP3A4 и CYP2C19. Метаболиты элиминируются почками, период полувыведения 11–13 часов. При заболеваниях почек не требуется коррекции дозы.
Одобрен FDA для лечения перемежающейся хромоты, изучается его применение при инсульте и ЧКВ.
Побочные эффекты цитостазола — симптомы со стороны ЖКТ, кожная сыпь, головная боль — возникают у 15% пациентов, что может заставить их прекратить приём препарата. Цилостазол не повышает риск кровотечений и смертность. Как и в случае с дипиридамолом, расширение сосудов будет приводить к гипотензии и тахикардии [9, 10].
• Трифлузал
Ингибитор ЦОГ-1 и ФДЭ. Показал аналогичную аспирину эффективность в предотвращении сосудистых событий у пациентов с ИМ и инсультом. Препарат пока изучается [7].
b) Ингибиторы циклооксигеназы (ЦОГ)
• Аспирин
Аспирин (ацетилсалициловая кислота, АСК) является самым популярным антиагрегантом, назначаемым для профилактики сердечно-сосудистых заболеваний. На протяжении более 50 лет по сей день он остаётся основой антиагрегантной терапии. Главным преимуществом препарата является низкая стоимость.
Механизм действия
Тромбоксан А2 (ТхА2) является сильным проанрагентом и синтезируется при участии фермента циклооксигеназа (ЦОГ). Аспирин необратимо и неизбирательно блокирует ЦОГ, ключевой фермент синтеза простагландинов и ТхА2, ацетилируя остаток серина в области каталитического участка ЦОГ [10].
В организме существует две основные изоформы ЦОГ (образуются в результате альтернативного сплайсинга) — ЦОГ-1 и ЦОГ-2 [7]. Ацетилирование происходит по положению серин 529 у ЦОГ-1 и серин 516 у ЦОГ-2.
ЦОГ-1 является конститутивной формой и отвечает за физилогически важные функции простагландинов (регуляция тонуса гладкой мускулатуры, секреции слизи стенкой желудка, агрегация тромбоцитов).
ЦОГ-2 — индуцибельная изоформа, которая начинает активно работать при таких процессах, как воспаление. К слову, все нестероидные противовоспалительные средства являются блокаторами ЦОГ, причём для них желательно избирательное ингибирование ЦОГ-2.
ЦОГ-1 тромбоцитов выполняет важную функцию синтеза мощного проагреганта — тромбоксана А2 (через его предшественник простагландин H2). Поэтому ингибирование ЦОГ-1 будет вызывать соответствующие терапевтические (в случае антиагреганта аспирина) и побочные эффекты. В свою очередь, эндотелий синтезирует ПГ I2 — процесс, менее чувствительный к аспирину и в основном осуществляемый ЦОГ-2. Низкие дозы аспирина селективно ингибируют ЦОГ-1, оказывая антиагрегантный эффект, в то время как высокие дозы ингибируют ЦОГ-1 и ЦОГ-2, оказывая противовоспалительный и анальгетический эффекты. Поэтому малые дозы аспирина имеют ограниченное влияние на ПГ I2-зависимые функции, такие как регуляция АД, функция почек и взаимодействие с диуретиками и ИАПФ. Дневной дозы аспирина 30 мг достаточно для успешного подавления синтеза ТхА2 на 1 неделю [1, 2, 10, 12].
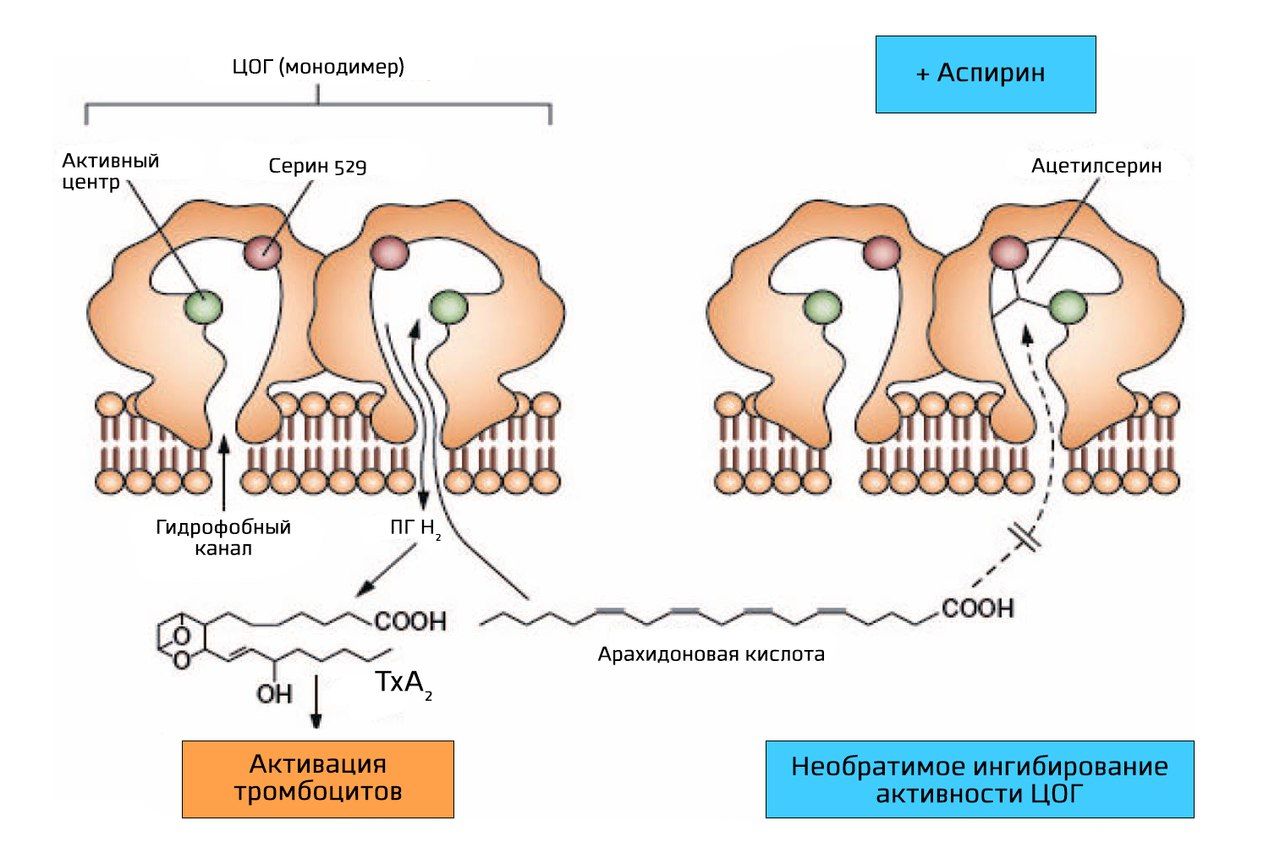
Снижение синтеза тромбоксана А2 происходит постепенно, по мере того, как фермент оказывается заблокирован во всех тромбоцитах. Благодаря снижению синтеза тромбоксана А2 уменьшается активация рецепторов тромбоксана А2 и простаноидных рецепторов тромбоцитов. Максимальный эффект достигается при приёме аспирина в дозе 75‒100 мг, дальнейшее увеличение дозы не приводит к повышению эффекта. Так как аспирин блокирует только ЦОГ, он не устраняет активацию тромбоцитов АДФ и тромбином [8].
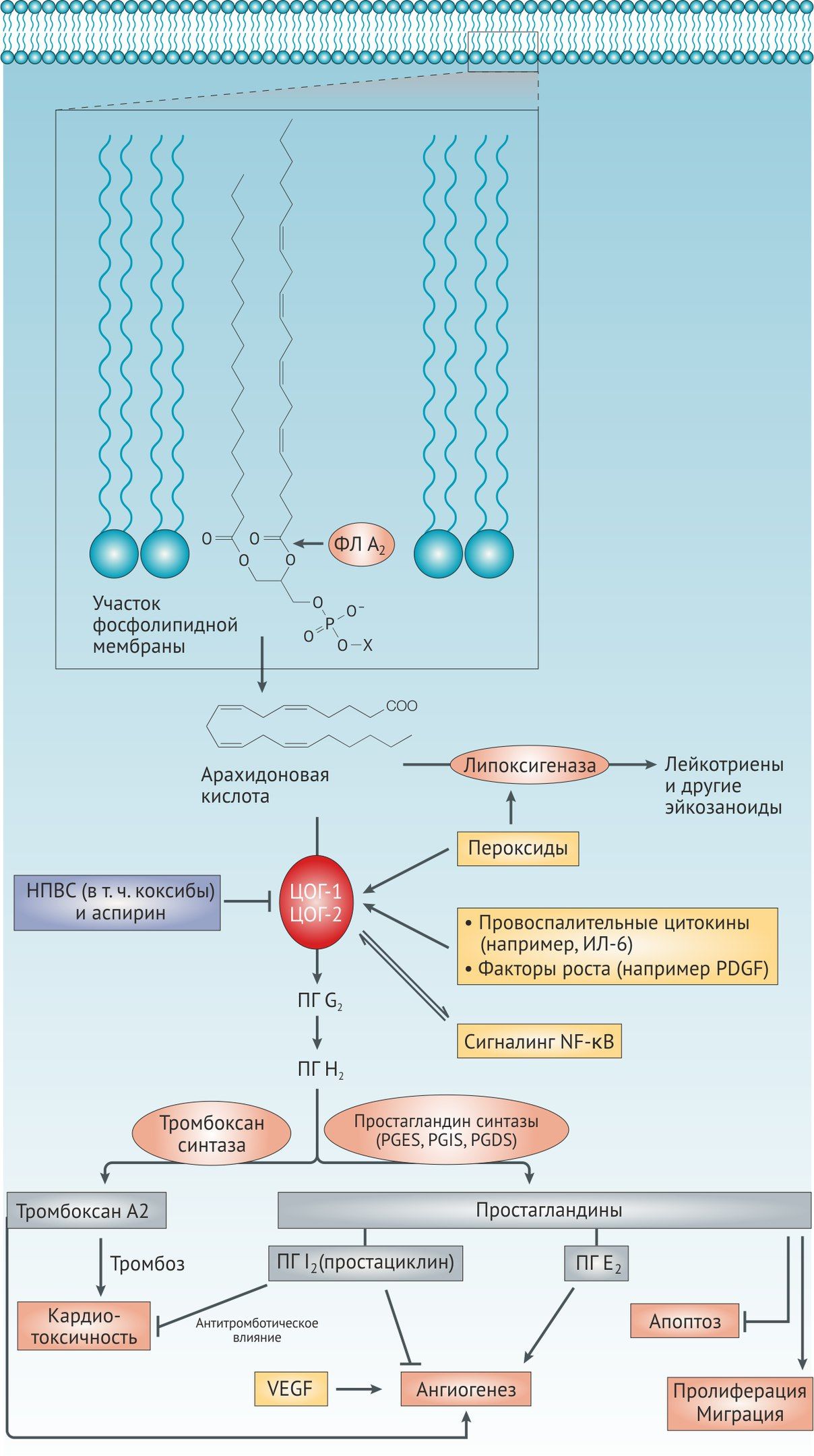
Терапевтический эффект аспирина обеспечивается не только ингибированием синтеза тромбоксана А2 в тромбоцитах, но и другими его свойствами — снижением синтеза провоспалительных цитокинов, АФК и факторов роста, усилением фибринолиза и подавлением коагуляции. Эти эффекты дозозависимы [12, 13].
Аспирин быстро всасывается пассивной диффузией в ЖКТ. Биодоступность составляет 45‒50% и остаётся на этом уровне даже при повторном приёме, однако заметно меньше у лекарственных форм с оболочкой, растворяющейся в кишечнике. Максимальная концентрация в плазме наступает через 30 минут (и через 4 часа у лек. форм с оболочкой). Так как АСК блокирует фермент необратимо, это позволяет принимать её раз в день, несмотря на быстрый период полуэлиминации (15‒20 мин). Восстановление функции тромбоцитов после отмены аспирина прямо связано с периодом жизни тромбоцитов в крови (т. к. аспирин блокирует фермент необратимо). Ежедневно мегакариоциты генерируют около 10‒12% новых тромбоцитов, поэтому практически исходный уровень гемостаза может восстановиться через 2‒3 дня после последней дозы аспирина у пациентов с нормальной функцией ККМ, хотя это время может варьироваться. Быстрая скорость оборота тромбоцитов происходит при некоторых провоспалительных состояниях (таких как ОКС и диабет), что может, в частности, объяснять феномен резистентности к аспирину. С этим можно бороться приёмом аспирина 2 раза в день вместо одного раза в день, хотя пока не доказано, способна ли эта стратегия действительно улучшить ответ на аспирин у пациентов с диабетом [12].
Побочные эффекты
Основным побочным эффектом аспирина являются кровотечения ЖКТ, хотя этот риск может быть снижен приёмом ИПП. Существует проблема резистентности к аспирину у некоторых пациентов [10, 13].
Взаимодействие
Одновременное назначение вместе с другими НПВС (ибупрофен, напроксен) может снизить эффективность аспирина ввиду конкуренции за связывание с активным центром ЦОГ-1 [10].
Клиническая эффективность
Хорошо изучена долговременная эффективность аспирина в профилактике сердечно-сосудистых заболеваний у пациентов с высоким атеротромботическим риском.
Аспирин снижает риск сердечно-сосудистых событий на 22%, включая смертность. При ОКС аспирин является терапией первой линии, снижая смертность на 23% на протяжении 5 недель. Кроме того, аспирин оказывает вторичную профилактику ИМ, снижая относительный риск ИМ на 25% [11]. Пациентам с ОКС рекомендуется разжевывать 150‒325 мг аспирина для более быстрого наступления эффекта. У пациентов, перенёсших ОКС, не наблюдается разницы эффекта низких и больших доз аспирина, однако низкие дозы (80‒100 мг) гораздо реже вызывают кровотечения. Аспирин также может быть введён внутривенно в малых дозах, если будет получено разрешение на такой путь введения [12].
Клинические исследования продемонстрировали достоверное улучшение прогноза больных стабильной ишемической болезнью сердца (ИБС) при лечении аспирином по сравнению с плацебо, уменьшение смертности и риска развития ИМ у больных нестабильной стенокардией, смертности от сосудистых осложнений при остром ИМ. Подтверждена эффективность малых (от 75 до 150 мг в сутки) доз АСК для первичной и вторичной профилактики атеротромботических осложнений.
Аспирин до настоящего времени является антиагрегантом первого выбора в лечении пациентов со стабильной ИБС и обязательной составляющей двойной антиагрегантной терапии (ДАТ) при острых коронарных синдромах (ОКС) и после пластики и стентирования коронарных артерий. Однако и на фоне применения АСК сохраняется высокий остаточный риск внутриартериальных тромбозов, обусловленный возможной резистентностью к действию аспирина, а также избыточной активностью тромбоцитов, которая поддерживается независимыми от TXA2 механизмами [2].
Низкие дозы аспирина в комбинации с блокаторами P2Y12-рецепторов являются основой антиагрегантной терапии ОКС и ОКС/ЧКВ [6]. Антиагрегантная терапия также снижает сердечно-сосудистые события у пациентов ИМ (на 25‒30%). Величина эффекта приблизительно одинакова для доз от 50 мг до 1500 мг, а вот токсичность (например, повышение риска кровотечений ЖКТ) является дозозависимой.
Аспирин (50‒350 мг в день) рекомендован руководствами США по инсульту как начальная мера вторичной профилактики ишемического инсульта и ТИА (класс рекомендаций IA). Также возможна комбинация аспирина с дипиридамолом (200 мг в день) в качестве альтернативы (класс IB) [5].
Антагонисты рецепторов тромбоксана А2.
Учитывая, что аспирин ингибирует только синтез ТхА2, остаются открытыми другие варианты активации рецепторов тромбоксана такими соединениям, как эндопероксиды, простаноиды и изопростаны, которые синтезируются через ЦОГ-независимые пути. Исходя из этого, более выгодной стратегией будет ингибирование непосредственно ТР-рецепторов тромбоксана на тромбоцитах. Другим преимуществом блокаторов ТР-рецепторов будет сохранение функции ЦОГ-2 в эндотелиоцитах, в результате чего не будет нарушаться продукция простациклина [13].
В последние годы было разработано несколько антагонистов рецепторов к тромбоксану: GR 32191, BMS-180291 (ифетробан), BM 13177 (сулотробан), S-18886 (терутробан), Bay U3405 (раматробан), BM13505 (далтробан) и блокаторов ТР-рецепторов, дополнительно ингибирующих ТхА2-синтазу (пикотамид, ридогрел и EV-077). Несмотря на хорошие результаты в исследованиях начальных фаз, антагонисты ТР-рецепторов оказались недостаточно эффективны в более крупных испытаниях. Антитромботическая, кардиопротективная и антиатерогенная активность этих веществ, продемонстрированная в эксперименте, не была подтверждена в клинических исследованиях [2]. Так, ни один из ингибиторов ТР-рецепторов не оказался эффективней аспирина в первичной и вторичной профилактике заболеваний ССС.
• Терутробан — обратимый селективный ингибитор рецепторов к TxA2 — у лабораторных животных вызывал дозозависимое увеличение времени образования тромба, но это не приводило к уменьшению площади ИМ в модели «ишемия—перфузия». Клинических преимуществ терутробана в эффективности или безопасности (повышал риск кровотечений) по сравнению с лечением аспирином продемонстрировать также не удалось. Два новых ингибитора тромбоксановых рецепторов (Z-335 и BM-573) находятся на разных стадиях доклинического изучения, и перспективы их клинического применения пока неизвестны [2, 5, 7].
Пикотамид также был многообещающим препаратом, он снижал смертность у пациентов с диабетом и заболеваниями периферических артерий на протяжении 2 лет, при этом не повышал риск кровотечений.
Ридогрел оказался не эффективней аспирина при ОКС и ИМ. EV-077 показал выраженное снижение активности тромбоцитов у здоровых волонтёров и больных сахарным диабетом, сейчас он проходит 2 фазу клинических испытаний [8].
Двойная антиагрегантная терапия (ДАТ или ДААТ, dual antiplatelet therapy DAPT)
На сегодняшний день существуют определённые клинические ситуации, характеризующиеся высоким риском тромботических осложнений и требующие использования комбинации антитромбоцитарных препаратов, при этом наибольшую доказательную базу имеет комбинация АСК и препаратов группы антагонистов рецепторов тромбоцитов P2Y12 (клопидогрел, тикагрелор, прасугрел и др.). Такая комбинация оказалась особенно эффективной у больных с острым коронарным синдромом, а также у пациентов, перенёсших чрескожное коронарное вмешательство. Среди всех возможных вариантов в клинической практике широко используют комбинацию АСК и клопидогрела как наиболее изученную и доступную. Применение именно этой комбинации обозначается термином «двойная антитромбоцитарная терапия», которая сегодня составляет основу лечения больных с ОКС и лиц, подвергающихся ЧКВ.
Огромное множество испытаний показало, что комбинация аспирина с антагонистом P2Y12-рецепторов оказывает более выраженный антитромбоцитарный эффект, чем только аспирин. Это привело к массовому использованию клопидогрела. Кроме того, в ДАТ используются празугрел и тикагрелор, они имеют больший эффект, хотя и более высокий риск кровотечений. Клиническая польза блокаторов гликопроотеиновых IIb/IIIa рецепторов в этой комбинации сомнительна, и они больше используются как средство экстренной терапии и при ЧКВ. В комбинации с аспирином показал свою эффективность ворапаксар, однако его применение ограничено ввиду серьёзного повышения риска кровотечений [11]
Современные международные руководства рекомендуют добавлять к ДАТ приём ингибиторов протонной помпы (ИПП), которые снижают геморрагический риск у пациентов с анамнезом кровотечений из верхних отделов ЖКТ. Препараты этой группы необходимы также лицам с несколькими факторами риска развития кровотечений ЖКТ, которые требуют назначения антитромбоцитарной терапии. Результаты недавно опубликованного мета-анализа обсервационных исследований и данные специального анализа рандомизированных контролированных исследований свидетельствуют о том, что приём ИПП снижает риск кровотечений на 41%, а риск смерти — на 18% по сравнению с отсутствием приёма препаратов этой группы.
Однако ИПП могут влиять на выраженность антитромбоцитарного эффекта клопидогрела, снижая формирование его активного метаболита. FDA и ЕМА сделали предупреждения, касающиеся потенциального клинического воздействия ИПП и их фармакокинетических взаимодействий. Большинство больных, включённых в мета-анализ, принимали омепразол — самый мощный среди ИПП ингибитор CYP2C19 [10].
Добавление третьего препарата
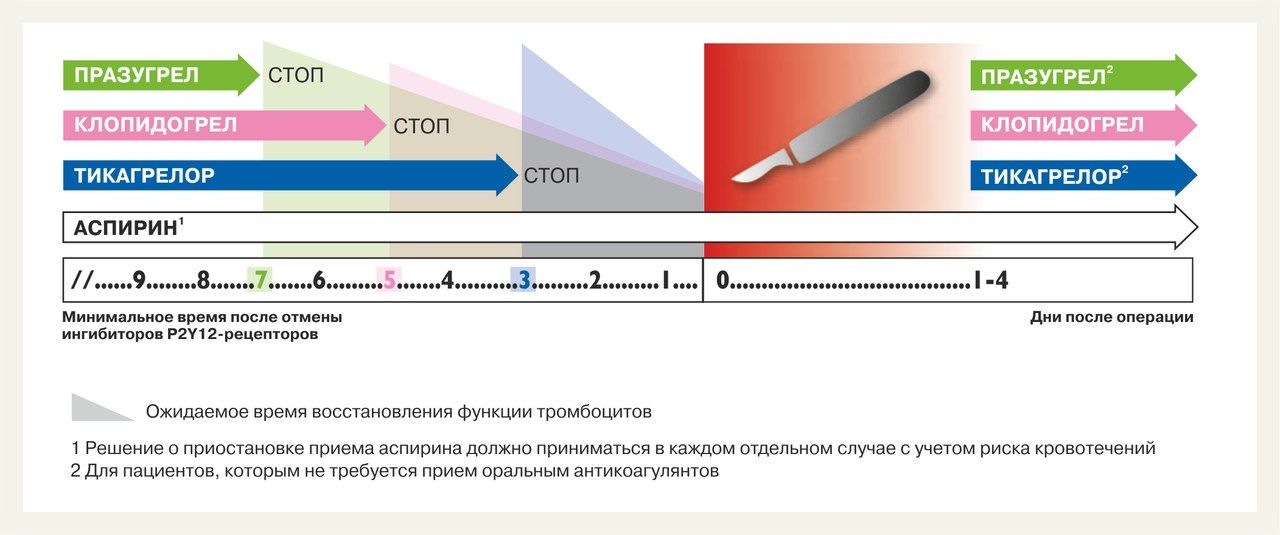
Несмотря на выраженный антиагрегантный эффект ДАТ, у некоторых пациентов продолжают развиваться ишемические поражения органов, что ставит в необходимость блокировать другие пути активации тромбоцитов. Самым важным для активации тромбоцитов соединением является тромбин. Важно, что уровни тромбина остаются повышенными после ОКС, и, таким образом, блокирование эффекта тромбина является важной стратегией по снижению сердечно-сосудистых событий у пациентов, получающих ДАТ. Существуют два подхода: непрямая модуляция эффектов тромбина путём блока PAR-1 рецепторов и прямое ингибирование тромбина или же тромбина и других факторов выше по коагуляционному каскаду. Непрямые ингибиторы тромбина применяются давно. с эпохи антагонистов витамина К, имеющих, несмотря на очевидную эффективность, ряд существенных недостатков. Появление НАОК вдохнуло новую жизнь в это направление, в частности, в определённых ситуациях возможны комбинации ДАТ и ривароксабана [8].
Таблица 3. Рекомендации ESC 2017 года по DAPT.

Подробней о ДАТ в последнем руководстве ESC [15].
Профилактика и лечение кровотечений
Ключевой стратегией по предотвращению кровотечений является индивидуализированная терапия, которая включает оценку факторов риска кровотечений, путь доступа, подбор дозировки, использование ИПП и правильный выбор ингибитора P2Y12-рецепторов [15].
Ввиду выраженных и убедительных антиагрегантных эффектов ингибиторов P2Y12-рецепторов всё чаще предлагается остановить использование аспирина после острой фазы заболевания и продолжать использовать только празугрел или тикагрелор в качестве монотерапии. Эффективность блокаторов P2Y12-рецепторов во вторичной профилактике ишемических событий была выше аспирина, хотя ниже, чем у комбинации [8].
Обсуждается совместное использование фибринолитиков и аспирина — такая комбинация не повышает риск тромбозов и предупреждает кровотечения при операциях у пациентов с высоким риском кровотечений. При сильном кровотечении и неэффективности традиционных мер может быть использован рекомбинантный фактор VII, хотя это может привести к повышению риска тромбов, особенно у пациентов с заболеваниями сосудов [10].
Мониторинг антиагрегантной терапии
Важным вопросом остается необходимость мониторинга пациентов, принимающих антиагреганты. Это может иметь быть полезно для коррекции дозы антиагрегантов и снижения риска осложнений. С целью оценки эффективности и безопасности проводимой антиагрегантной терапии предлагается использование различных методик, наиболее распространены следующие:
- определение агрегации тромбоцитов оптическим методом по Борну в присутствии агонистов — АДФ и арахидоновой кислоты;
- прикроватные «быстрые» тесты: система PFA-100 (Platelet Function Analyzer), VerifyNow, Plateletworks;
- определение стабильного метаболита TXA2 -11-дегидротромбоксана В2 в моче.
Согласно современным клиническим рекомендациям и консенсусам специалистов, тестирование ФАТ (агрегационной способности тромбоцитов) может быть рекомендовано у пациентов, получающих ДАТ в ряде клинических ситуаций. Однако вопрос о возможности, необходимости и эффективности контроля ФАТ у всех без исключения лиц, получающих антиагрегантную терапию, остается предметом изучения.
Оптическая агрегометрия — по-прежнему «золотой стандарт» оценки ФАТ, несмотря на трудоёмкость, затратность и недостаточную воспроизводимость между разными операторами и реагентами. Данный метод используется для оценки эффекта АСК, блокаторов P2Y12 рецепторов и ингибиторов GP IIb/IIIa рецепторов.
В основе метода ОА лежит стимуляция in vitro активации тромбоцитов в присутствии агонистов агрегации (АДФ, арахидоновая кислота, коллаген, адреналин). Активация тромбоцитов ведёт к формированию агрегатов тромбоцитов и к увеличению светопропускаемости образца плазмы, которая оценивается фотоспектрометром. Создатели современных коммерческих агрегометров делают попытки преодолеть недостатки, присущие данному методу. Методы исследования ФАТ могут быть использованы для выявления пациентов с высоким риском, но их использование для персонализации антиагрегантной терапии требует дальнейшего изучения, в том числе в крупномасштабных исследованиях [15]. Разработан и доступен для применения ряд «прикроватных» устройств «быстрой» (экспресс) оценки ФАТ, сопоставимых по своим возможностям как с оптической агрегометрией (ОА) (например, уровень ингибирования тромбоцитов, определенный с использованием ОА, коррелировал с результатами, полученными с помощью VerifyNow P2Y12) и проточной цитометрией, так и между собой. Гораздо подробнее про контроль антиагрегантной терапии в источнике 3.
Источники:
- Венгеровский А. И. Фармакология Курс лекций: учеб. пособие. - 4 изд М.: ГЭОТАР-Медиа. – 2015.
- Михайлова И. Е. Антитромбоцитарные препараты в профилактике и лечении коронарного атеротромбоза. Обзор литературы //Вестник Санкт-Петербургского университета. Серия 11. Медицина. – 2014.
- Пучиньян Н. Ф. и др. Проблема контроля эффективности антитромбоцитарной терапии в кардиологической практике //Рациональная фармакотерапия в кардиологии. – 2017. – Т. 13. – №. 1.
- Bonaca M. P., Creager M. A. Pharmacological treatment and current management of peripheral artery disease //Circulation research. – 2015.
- Capodanno D., Alberts M., Angiolillo D. J. Antithrombotic therapy for secondary prevention of atherothrombotic events in cerebrovascular disease //Nature Reviews Cardiology. – 2016.
- Capodanno D., Ferreiro J. L., Angiolillo D. J. Antiplatelet therapy: new pharmacological agents and changing paradigms //Journal of Thrombosis and Haemostasis. – 2013
- Depta J. P., Bhatt D. L. New approaches to inhibiting platelets and coagulation //Annual review of pharmacology and toxicology. – 2015
- Franchi F., Angiolillo D. J. Novel antiplatelet agents in acute coronary syndrome //Nature Reviews Cardiology. – 2015
- Franchi F., Rollini F., Angiolillo D. J. Antithrombotic therapy for patients with STEMI undergoing primary PCI //Nature Reviews Cardiology. – 2017
- Hall R., Mazer C. D. Antiplatelet drugs: a review of their pharmacology and management in the perioperative period //Anesthesia & Analgesia. – 2011
- McFadyen J. D., Schaff M., Peter K. Current and future antiplatelet therapies: emphasis on preserving haemostasis //Nature Reviews Cardiology. – 2018.
- Mega J. L., Simon T. Pharmacology of antithrombotic drugs: an assessment of oral antiplatelet and anticoagulant treatments //The Lancet. – 2015.
- Michelson A. D. Antiplatelet therapies for the treatment of cardiovascular disease //Nature Reviews Drug Discovery. – 2010.
- Pancioli A. M., Brott T. G. Therapeutic Potential of Platelet Glycoprotein IIb/IIIa Receptor Antagonists in Acute Ischaemic Stroke //CNS drugs. – 2004.
- Valgimigli M. et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS //European Journal of Cardio-Thoracic Surgery. – 2017. Исправления https://academic.oup.com/eurheartj/advance-article/doi/10.1093/eurheartj/ehx638/4566123
- Yousuf O., Bhatt D. L. The evolution of antiplatelet therapy in cardiovascular disease //Nature Reviews Cardiology. – 2011.
