Теория скольжения филаментов

Взаимодействие мышечных белков лежит в основе нашего нынешнего понимания сокращения саркомера. Как оно происходит? Это как-то связано со скользящим взаимодействием между актином и миозином.
Основные понятия
Перед тем, как углубиться в физиологию, ознакомимся с основной терминологией.
На электронной микрофотографии тонкого среза мышечных волокон изображена группа нитей.
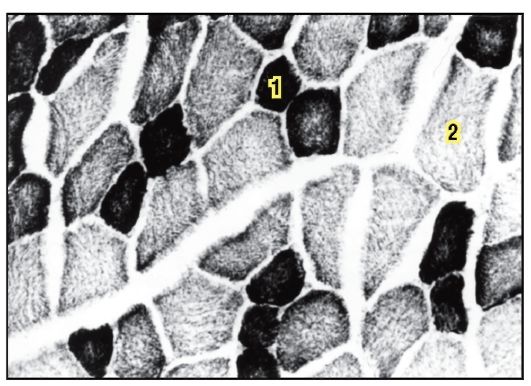
Рисунок 1. 1 — тонкие нити (I тип, красные нити) — не интенсивная, длительная работа.
2 — толстые нити (II тип, белые нити) — интенсивная и кратковременная работа.
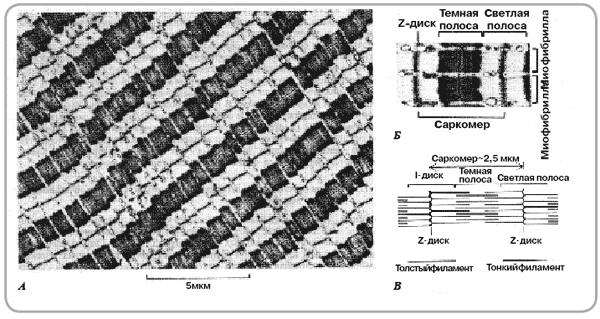
Каждый массив нитей — миофибрилла — имеет форму цилиндра, внутри которого чередуются пучки тонких и толстых нитей. Внутри волокна нити находятся в строгом порядке, так что области с одинаковой плотностью находятся рядом друг с другом, за счет чего волокно имеет характерную полосатую окраску в поляризованном световом микроскопе. Единица между двумя темными полосами — саркомер.
В продольном разрезе группы миофибрилл имеется полоса низкой плотности, называемая I-полосой. В центре I-полосы имеется заметная плотная линия, называемая Z-диском. Область между двумя линиями Z — саркомером — может считаться основной структурной и функциональной единицей, непосредственно ответственной за сокращение мышц. Таким образом, миофибриллу можно рассматривать как группу саркомеров.
Группа миофибрилл образует симпласт. На поверхности мышечной клетки плазматическая мембрана (сарколемма) образует впячивания, где формируется система Т-трубочек, обеспечивающая сокращение миоцитов. Представляет собой сеть взаимосвязанных колец, каждое из которых окружает миофибриллу и обеспечивает важный путь коммуникации между наружной частью волокна и миофибриллами, которые расположены глубоко внутри волокна.
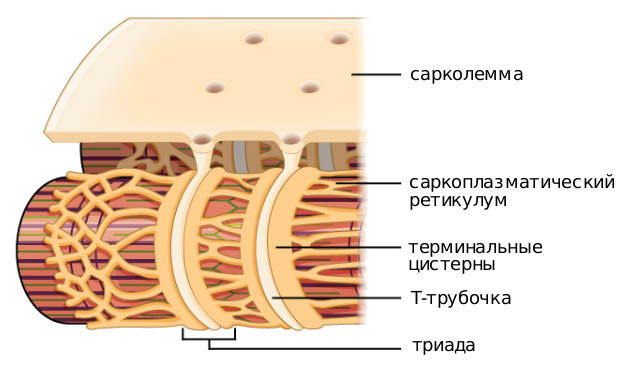 Другая мембранная система, которая окружает каждую миофибриллу — саркоплазматический ретикулум, образующий ряд закрытых мешковидных мембран. Участок, контактирующий с Т-трубочкой, образует увеличенный мешок, называемый терминальной цистерной. У большинства позвоночных каждая Т-трубочка имеет две цистерны, тесно связанные с ней, образуя трехэлементный комплекс, называемый триадой. Количество триад на саркомер зависит от вида. Например, в мышце лягушки есть одна на триаду, а в мышцах млекопитающих — две. У рыб и ракообразных только одна цистерна связана с каждой поперечной трубочкой, образуя диаду.
Другая мембранная система, которая окружает каждую миофибриллу — саркоплазматический ретикулум, образующий ряд закрытых мешковидных мембран. Участок, контактирующий с Т-трубочкой, образует увеличенный мешок, называемый терминальной цистерной. У большинства позвоночных каждая Т-трубочка имеет две цистерны, тесно связанные с ней, образуя трехэлементный комплекс, называемый триадой. Количество триад на саркомер зависит от вида. Например, в мышце лягушки есть одна на триаду, а в мышцах млекопитающих — две. У рыб и ракообразных только одна цистерна связана с каждой поперечной трубочкой, образуя диаду.
Мышечные белки
Основной составляющей толстых нитей является миозин. Каждая толстая нить состоит из около 250 молекул миозина. Миозин играет две важные роли: структурную как строительный блок для толстых нитей и функциональную как катализатор распада АТФ во время сокращения и взаимодействия с актином в составе силового генератора мышц. Хвост длиной около 120 нм состоит из двух цепей белка, каждая из которых намотана на так называемую α-спираль, вместе образуя структуру спиральных катушек. На другом конце молекулы две белковые цепи образуют две глобулярные головные области, которые обладают способностью сочетаться с белковым актином и несут ферментативные сайты для гидролиза АТФ.
В средней части толстой нити молекулы собраны в хвост-хвост. Вдоль остальной части нити наматываются с головы до хвоста. Хвостовые части молекул образуют сердцевину нити; головные части выступают из нити.
Тонкие нити содержат три разных белка: актин, тропомиозин и тропонин. Актин, составляющий около 25 % белка миофиламентов, является основным компонентом тонких нитей в мышцах. Актиновые молекулы повторяются каждые 2,75 нм вдоль тонкой нити. Они создают спиральную структуру, которая может рассматриваться как двойная или одинарная спираль.
Тропомиозин представляет собой стержнеобразную молекулу длиной около 40 нм. Имеет структуру, аналогичную структуре хвоста миозина, являющейся спиральным звеном двух белковых цепей. Каждая молекула тропомиозина находится в контакте с семью актиновыми единицами.
Тропонин представляет собой комплекс из трех различных субъединиц белка: I, T и C. Тропонин С может связывается с кальциевыми ионами. Тропонин T присоединяется к тропомиозину, образуя с ним тропонин-тропомиозиновый комплекс. Тропонин I соединяется с актином в тонких филаментах. Один тропониновый комплекс связан с каждой молекулой тропомиозина. Молекула тропонина расположена примерно каждые 40 нм вдоль нити.
Тропонин и тропомиозин участвуют в регуляции сокращения и расслабления мышц. Одной из субъединиц является рецептор для Ca2+, высвобождаемый из саркоплазматического ретикулума при активации мышцы. Считается, что связывание кальция затем приводит к дальнейшим структурным изменениям взаимодействия актина, тропомиозина и другой субъединицы тропонина, которые приводят к сокращению путем активации взаимодействия актин-миозин.
Историческая справка
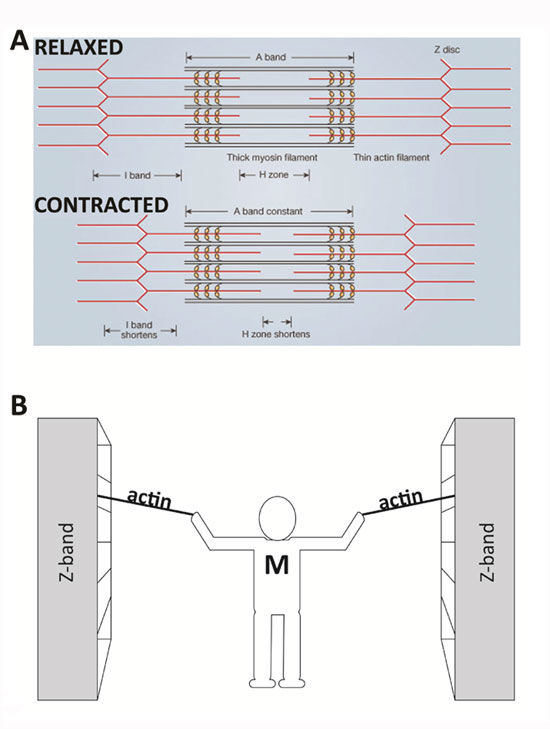
В 1954 году ученые опубликовали две новаторские статьи, описывающие молекулярную основу сокращения мышц. В этих работах описывалось положение миозиновых и актиновых филаментов на разных стадиях сокращения мышечных волокон и предлагалось, как это взаимодействие вызывает сократительную силу. Используя микроскопию высокого разрешения, А. Ф. Хаксли и Р. Нидерберг (1954) и Х. Э. Хаксли и Дж. Хансон (1954) наблюдали изменения в саркомерах по мере сокращения мышечной ткани. Они заметили, что одна зона повторного саркомера, «полоса А», оставалась относительно постоянной по длине во время сокращения. Полоса А содержит толстые нити миозина. Предполагалось, что миозиновые нити остаются центральными и постоянными по длине, в то время как другие области саркомера сокращаются.
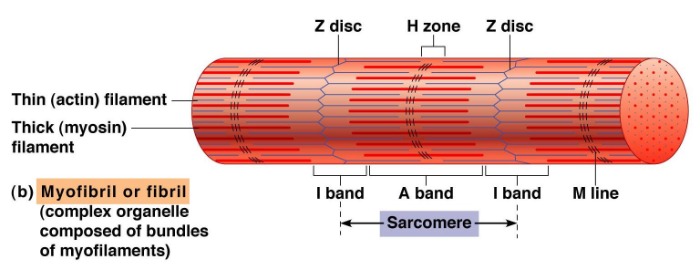
Эти наблюдения побудили их предложить теорию скользящих нитей, в которой говорится, что скольжение актина относительно миозина вызывает напряжение мышц. Поскольку актин привязан к структурам, расположенным на боковых концах каждого саркомера, называемых z-дисками или «z-полосами», любое сокращение длины нити актина приведет к сокращению саркомера и, следовательно, мышцы.
Механизм сжатия
Когда нервный импульс от головного и спинного мозга переносится по двигательному нейрону в мышечное волокно, Ca2+ ионы высвобождаются в терминальном аксоне.
Увеличение концентрации ионов кальция стимулирует высвобождение нейротрансмиттера ацетилхолина в синаптической щели.
Нейротрансмиттер связывается с рецептором на сарколемме, происходит деполяризация, и генерируется потенциал действия через мышечное волокно для сокращения мышц. Потенциал действия распространяется по всему мышечному волокну и перемещается в соседние волокна вдоль Т-трубочек.
Инициируется выделение ионов кальция из саркоплазматического ретикулума, которые стимулируют сокращение мышц. Последовательность сокращения мышц, объясняемая моделью скользящих нитей, выглядит следующим образом:
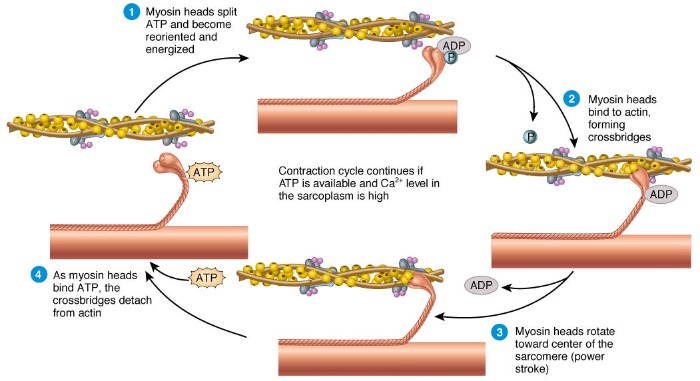
1. Блокировка головной части миозина:
Актин и миозин перекрывают друг друга, образуя поперечный мостик. Поперечный мостик активен только тогда, когда головка миозина прикреплена, как крючок, к нити актина. Когда мышца находится в состоянии покоя, перекрытие актиновой нити к головке миозина блокируется тропомиозином. Миофиламент актина находится в положении покоя.
2. Выделение иона кальция:
Нервный импульс, вызывающий деполяризацию и потенциал действия в сарколемме, вызывает выброс ионов кальция. Ион кальция связывается с тропониновым комплексом на нити актина, сдвигая тропомиозин из его места блокировки. Миофиламент актина находится в активном положении.
3. Поперечный мостик:
Поперечный мостик между актином и миозином действует как фермент (миозин АТФ-аза), который гидролизует АТФ, хранящийся в головке миозина, в АДФ, вследствие чего высвобождается энергия. Эта освобожденная энергия используется для перемещения головки миозина в направлении актиновой нити. Головка миозина наклоняется и тянет актиновую нить так, что миозин и актиновая нить скользят друг к другу. Противоположные концы нитей актина в саркомере движутся в направлении друг к другу, что приводит к сокращению мышцы. После сближения поперечный мостик отсоединяется, а актин и миозиновая нить возвращаются в исходное положение.
Аналогия, наглядно иллюстрирующая теорию
Представьте, что вы стоите между двумя большими шкафами с книгами. Они находятся на расстоянии нескольких метров друг от друга и расположены на рельсах, так что их можно легко перемещать. Вам дается задача объединить два книжных шкафа, но вы ограничены использованием только ваших рук и двух веревок. Стоя в центре между книжными шкафами, вы тянете за две веревки (по одной на руку), которые надежно привязаны к каждому книжному шкафу. Повторяющимися движениями вы подтягиваете каждую веревку к себе, перехватываете ее, а затем снова тянете. В конце концов книжные шкафы движутся вместе и приближаются к вам. В этом примере ваши руки похожи на молекулы миозина, веревки — это актиновые нити, а книжные шкафы — это z-диски, на которых закреплен актин и которые составляют боковые концы саркомера. Подобно тому, как вы остаетесь в центре между книжными шкафами, миозиновые нити остаются центрированными во время нормального сокращения мышц.
Регуляция
АТФ поставляет энергию, как и было описано выше, но что делает кальций? Кальций требуется двум белкам (тропонину и тропомиозину), которые регулируют сокращение мышц. В покоящемся саркомере тропомиозин блокирует связывание миозина с актином. В вышеупомянутой аналогии вытягивания шкафов тропомиозин будет мешать вашей руке, поскольку он будет удерживать актин-веревку.
В 1994 году Уильям Леман и его коллеги продемонстрировали, как тропомиозин вращается, изучая форму актина и миозина в богатых кальцием растворах и растворах, содержащих низкий уровень кальция (Lehman, Craig, & Vibertt, 1994). Сравнивая действие тропонина и тропомиозина в этих двух условиях, они обнаружили, что присутствие кальция является существенным для механизма сжатия. В отсутствие свободного кальция связывание актина и миозина не происходит, поэтому наличие свободного кальция является важным регулятором мышечного сокращения.
Нерешённые вопросы
Ученым предстоит выяснить о нескольких белках, которые явно влияют на сокращение мышц. Например, молекулы, такие как титин, необычно длинный и «упругий» белок, охватывающий саркомеры у позвоночных, предположительно связывается с актином. Кроме того, ученые исследовали мышечные клетки, которые сокращаются по иному принципу. Например, некоторые мышцы у моллюсков и членистоногих выдерживают силовую нагрузку в течение долгого времени — явление, иногда называемое «уловкой» или силовым гистерезисом (Hoyle, 1969). Изучение этих и других примеров пластичности мышц — захватывающие возможности для новых открытий в биологии.
Источники:
