Синдром Бругада – загадочная причина внезапной смерти

Внезапная сердечная смерть — одна из ведущих причин смертности в развитых странах. Частота ее развития составляет 15–20 % от всех ненасильственных случаев смерти. К заболеваниям, ассоциированным с высоким риском ВСС в молодом возрасте, относят синдром внезапной смерти младенцев, синдром удлиненного интервала Q-T, аритмогенную дисплазию правого желудочка, идиопатическую фибрилляцию желудочков и др. Сегодня речь пойдет об одном из наиболее загадочных заболеваний в этом ряду — синдроме Бругада. Впервые данный синдром описан испано-бельгийскими кардиологами, братьями Хосепом и Педро Бругада. В 1992 г. они опубликовали результаты наблюдения за 8 пациентами, имевшими в анамнезе синкопе и эпизоды клинической смерти. Для верификации причин этому пациентам были выполнены инструментальные исследования: ЭКГ, эхокардиография, нагрузочное тестирование, ангиография, ЭФИ сердца, биопсия миокарда. В результате исследования братьями Бругада впервые были описаны характерные изменения на электрокардиограмме, позволяющие определить высокий риск возникновения нарушений ритма у лиц без органических изменений сердца.
Итак, что же такое синдром Бругада?
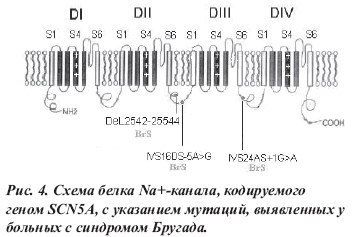
Синдром Бругада — это генетически детерминированное нарушение сердечного ритма, обусловленное мутацией гена SCN5A, кодирующего биосинтез белковых субъединиц натриевого канала кардиомиоцитов, и проявляющееся синкопальными состояниями, подъемами сегмента ST в правых прекардиальных отведениях (V1-V3) с инвертированным зубцом Т, полной или неполной БПНПГ, периодическим удлинением интервала P-R с высоким риском развития жизнеугрожающих желудочковых тахиаритмий (эпизодов полиморфной ЖТ и ФЖ), обычно развивающихся во сне или в спокойном состоянии.
Эпидемиология
Частота встречаемости данного заболевания — 5 на 10 000 человек, хотя, учитывая сложность диагностики, точную цифру назвать трудно. Наиболее распространен этот синдром в Юго-Восточной Азии, тогда как в западных странах частота встречаемости несколько ниже (2–3 случая на 10 000 человек).
Патофизиологические основы
Ионные механизмы синдрома Бругада связаны с уменьшением количества или ускоренной инактивацией натриевых каналов в клетках эпикарда правого желудочка, что приводит к уменьшению плотности потока натрия и преждевременной реполяризации эпикарда. Кроме того, было обнаружено перемещение натриевых каналов с поверхности клеток в ЭПР, что также нарушает их функцию. Потеря вершины ПД на участках эпикарда при его нормальной величине в эндокарде создает дисперсию реполяризации стенки желудочка, приводящую к трансмуральному градиенту напряжения, который проявляется на ЭКГ подъемом сегмента ST. Вследствие указанных выше процессов образуется «уязвимое окно», во время которого может возникнуть механизм re-entry, запускающий ЖТ и ФЖ.
Клинические особенности и диагностика
Чаще всего синдром Бругада наблюдается у пациентов в 30–40-летнем возрасте. Клиническая картина заболевания характеризуется частым возникновением синкопе на фоне приступов желудочковой тахикардии и ВСС, преимущественно во сне, а также отсутствием признаков органического поражения миокарда.
Выраженность клинических проявлений СБ определяется степенью повреждения натриевых каналов: при повреждении менее 25 % каналов ЭКГ-паттерн и нарушения ритма наблюдаются только после введения блокаторов натриевых каналов; при увеличении количества поврежденных натриевых каналов (свыше 25 %) риск ВСС резко возрастает.
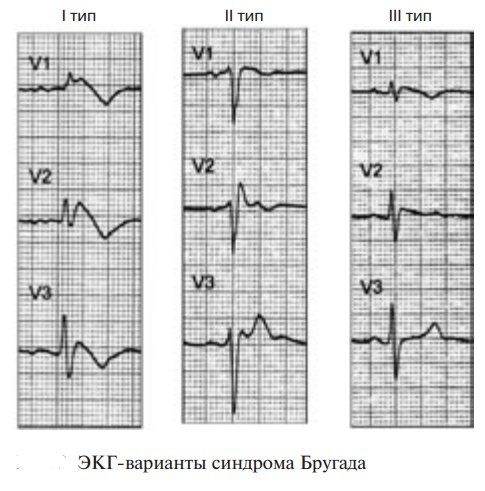
Описаны два типа подъема сегмента ST при синдроме Бругада: сводчатый (coved) и седловидный (saddleback). Подъем сводчатого типа преобладает при симптомных формах СБ с фибрилляцией желудочков в анамнезе, в то время как седловидный чаще встречается при бессимптомных формах СБ. Однако изменения на ЭКГ при СБ могут носить преходящий характер, что требует поиска дополнительных методов верификации. Для верификации диагноза необходимо проведение нагрузочных проб с лекарственной нагрузкой (антиаритмические препараты IA класса) с введением блокаторов натриевых каналов (аймалин, новокаинамид). Тест с блокаторами натриевых каналов проводится в условиях реанимационного отделения, так как во время его проведения существует большая вероятность развития желудочковой тахикардии по типу TdP и ФЖ.
Лечение
Лечение проводят с учетом клинических особенностей заболевания и характера генетических нарушений (дефект Na-каналов). При наличии клинических симптомов больным необходима имплантация кардиовертера-дефибриллятора.
Из антиаритмических препаратов необходимо назначать хинидин, дизопирамид, амиодарон. Следует избегать назначения препаратов I класса, таких как новокаинамид, флекаинид, аймалин, которые являются блокаторами натриевых каналов и провоцируют клиническое проявление синдрома Бругада.
Еще один препарат, рассматриваемый для лечения СБ — тедисамил, который в настоящее время используется для лечения фибрилляции предсердий. Он способен подавлять механизм развития СБ путем блокирования Itо, и может оказаться более эффективным, чем хинидин.
Анестезиологическое пособие у больных СБ
У больных с подтвержденным диагнозом СБ необходимо осторожно подходить к выбору метода анестезии. Исходя из механизмов развития СБ, предпочтительным методом является общая анестезия. Успешно используется как ингаляционная анестезия (изофлюран, севофлюран), так и неингаляционная (барбитураты, мидазолам, фентанил). С осторожностью следует применять пропофол (риск синдрома инфузии пропофола) и кетамин (риск манифестации СБ).
Регионарная анестезия у больных СБ имеет свои особенности и используется реже ввиду возможных осложнений. Прежде всего анестезиолог должен определиться с препаратами для местной анестезии. Наиболее приемлемыми являются местные анестетики короткого действия, такие как лидокаин. Использование препаратов длительного действия (бупивакаин) неоправданно ввиду их способности длительно блокировать Na-каналы, что может вызвать серьезные осложнения. Немаловажным фактором успеха является снижение дозы анестетика. Достичь этого можно двумя путями — использовать адъювант (адреналин, фентанил) или проводить катетеризацию неврального ложа под контролем УЗИ.
Вне зависимости от выбранного метода анестезии необходимо тщательно подойти к вопросу интраоперационного мониторинга. Операционная должна быть оборудована кардиомонитором (для регистрации ЭКГ), BiS-монитором (для оценки глубины наркоза, т. к. недостаточная аналгезия может привести к повышению тонуса вегетативной нервной системы, что в свою очередь может спровоцировать фибрилляцию желудочков), а также дефибриллятором на случай возникновения осложнений.
Источники
- Carey S. M., Hocking G. Brugada Syndrome-a review of the implications for
the anaesthetist - Бокерия Л. А., Бокерия О. Л., Киртбая Л. Н. Синдром Бругада: клеточные механизмы и подходы к лечению //Анналы аритмологии. – 2010.
