Иммунная система и канцерогенез
 Человеческий организм постоянно подвергается воздействию эндогенных и экзогенных канцерогенных факторов, под действием которых в различных тканях каждую секунду образуются тысячи злокачественных клеток. Но почему из огромного числа опухолей, возникающих в период онтогенеза, клинически значимых размеров достигают единицы? Известен феномен так называемой спонтанной регрессии опухоли (СР, термин, предложенный Стюартом в 1952 году) [1] или синдрома Перегрина. Суть явления заключается в том, что в некоторых случаях происходит частичное или полное исчезновение опухоли при отсутствии первоначального ответа на проводимое лечение.
Человеческий организм постоянно подвергается воздействию эндогенных и экзогенных канцерогенных факторов, под действием которых в различных тканях каждую секунду образуются тысячи злокачественных клеток. Но почему из огромного числа опухолей, возникающих в период онтогенеза, клинически значимых размеров достигают единицы? Известен феномен так называемой спонтанной регрессии опухоли (СР, термин, предложенный Стюартом в 1952 году) [1] или синдрома Перегрина. Суть явления заключается в том, что в некоторых случаях происходит частичное или полное исчезновение опухоли при отсутствии первоначального ответа на проводимое лечение.
Первые упоминания о СР относятся к 13 веку [2]: по словам святого Перегрина, у него исчезла саркома кости после перенесенной бактериальной инфекции. В 1966 году Эверсон и Коле провели анализ медицинской литературы и обнаружили 176 документально подтвержденных случаев СР, в том числе и на распространенных стадиях [3]. Согласно последним исследованиям, СР чаще всего наблюдается при хориокарциноме, нейробластоме, опухолях почек и меланоме [4-6]. При этом у детей до 1-2 лет СР наблюдается чаще, чем в старшем возрасте и у взрослых [7]. Риск развития злокачественных опухолей возрастает при любых вариантах иммуносупрессии [8]. В одном исследовании у 38 из 60 детей с нефробластомой до постановки диагноза отмечались вирусные или бактериальные инфекции дыхательных путей. Частота возникновения злокачественных опухолей возрастает у лиц с приобретенным иммунодефицитом, например, у получающих кортикостероидную терапию или ВИЧ-инфицированных (саркома Капоши) [9-11].
В норме злокачественные клетки разрушаются иммунной системой, а прогрессия опухоли возможна лишь при иммуносупрессии. Однако злокачественные опухоли способны подавлять и перепрограммировать работу иммунной системы. Выделяют три стадии опухоль-иммунного взаимодействия: элиминации (elimination), равновесия (equilibrium) и избегания/ускользания (escape) (рис. 1) [12,13].
Рисунок 1 | Этапы иммунного редактирования
На первом этапе (а) постоянно появляются новые опухолевые клетки, но иммунная система успевает полностью их элиминировать. На втором этапе (b) различные факторы (хроническое воспаление, иммунодепрессанты, стресс и т.д.) нарушают работу иммунной системы, и отдельные опухолевые клетки могут длительно персистировать в очаге, оказывая влияние на иммунную систему. На третьем этапе (c) происходит перепрограммирование иммунной системы, она перестает подавлять опухолевый рост, и начинается активная прогрессия заболевания. Каждый этап сопровождается характерными перестройками в работе иммунной системы, о которых далее пойдет речь.
Задачей первой линии противоопухолевой защиты, включающей печеночные ферменты (главным образом цитохром P450), является инактивация канцерогенных факторов. Попадающие в организм химические канцерогены подвергаются инактивации с помощью микросомальной системы в печени или почках и выводятся из организма с мочой. Критически важным является нормальное функционирование второй ферментной системы, осуществляющей инактивацию активных метаболитов [15]. Большую роль в канцерогенезе играют и вирусы (ретровирусы, герпесвирусы, папилломавирусы и др. [16]). Защита организма от онкогенных вирусов осуществляется через механизмы врожденного и адаптивного иммунитета, что используется в частности при вакцинации от ВПЧ. Существующие системы контроля генетической стабильности останавливают клеточное деление и запускают механизм апоптоза при повреждении ДНК клетки. Нарушения работы этих механизмов приводят к опухолевой трансформации клеток [17].
Второй линией защиты является иммунологический надзор за генетической стабильностью. Клетки человеческого организма несут на своей поверхности главный комплекс гистосовместимости первого класса (major histocompatibility complex, MHC-I). Он представляет собой «молекулярный паспорт» клетки и позволяет отличить клетки своего организма от “чужеродных”. Механизм его работы заключается в экспрессии на поверхности клеточной мембраны фрагментов белков, случайным образом захваченных из клетки. Поскольку их антигенная структура определяется генетическим материалом, в большинстве клеток организма будут экспрессироваться схожие пептидные фрагменты (рис.2) [18].
Рисунок 2 | Механизм работы MHC-I
Особая популяция лимфоцитов, названная «естественными киллерами» (natural killer, NK), является звеном врожденного иммунитета. Повреждение или отсутствие MHC-I на поверхности клеток приводит к активации NK-клеток и выбросу ими перфоринов, гранзимов и проапоптотических факторов. Белки перфорины приводят к образованию пор в мембране атакуемой клетки, через которые внутрь проникают лизосомальные ферменты или проапоптотические факторы. NK-клетки могут запускать апоптоз и напрямую, через взаимодействие с такими рецепторами, как Fas (также известный как CD95), TRAIL и т.д., которые представлены трансмембранными белками, с общей последовательностью из 80 аминокислот, индуцирующую каскад апоптотических реакций (она же называется «доменом смерти») (рис. 3) [19].
Рисунок 3 | Механизм активации NK-клеток
В случае повреждения или отсутствия MHC-I на поверхности клетки, запускается ее лизис или апоптоз. Повреждение или отсутствие MHC-I характерно для заражения вирусом или при опухолевой трансформации клетки, поэтому «естественные киллеры» являются важнейшим звеном противоопухолевого врожденного иммунитета. Кроме прямого цитотоксического действия, NK-клетки продуцируют широкий спектр цитокинов с двояким эффектом. Фактор некроза опухоли альфа (ФНО-α) подавляет опухолевый рост, однако оказывает системное действие на организм, приводя, в частности, к потере массы тела [22]. Интерферон гамма (ИФ-γ) подавляет пролиферацию трансформированных клеток и оказывает активирующее влияние на макрофаги (повышает их цитотоксичность в отношении опухолей), стимулирует экспрессию MHC-I на поверхности антигенпрезентирующих клеток, а также активирует Т-клеточное звено иммунитета.
Кроме того, NK-клетки продуцируют широкий спектр цитокинов, стимулирующих пролиферацию гранулоцитов, макрофагов, дендритных клеток и активирующих антигенпрезентирующую функцию, тем самым способствуя работе специфического звена иммунитета. Однако под влиянием определенных факторов, NK-клетки продуцируют интерлейкин-10, который обладает иммуносупрессивным действием в большей степени в отношении специфического клеточного звена иммунитета. При снижении активности или количества NK-клеток в результате хронического воспаления, аутоиммунных заболеваний, приема кортикостероидов или иммунодефицита другого генеза (в том числе и связанного с психоэмоциональными расстройствами), значительно возрастает риск развитие злокачественных опухолей, ухудшается прогноз и повышается частота рецидивов [23].
Во врожденной системе противоопухолевого иммунитета участвуют и гуморальные факторы [24]. Система комплемента (СК) является гуморальным фактором противоопухолевого врожденного иммунитета. СК представляет собой комплекс белков плазмы, способных к каскадной активации и формированию белковых пор в клеточной мембране, что приводит к ее осмотическому лизису (рис. 4). Кроме этого, компоненты комплемента опсонизируют клетку для макрофагов и Т-киллеров. В процессе активации СК образуются биологически активные молекулы, которые стимулируют миграцию гранулоцитов и лимфоцитов в опухолевый очаг, повышают температуру тела и стимулируют дифференцировку Т-лимфоцитов [24].
Рисунок 4 | Последние стадии активации белков комплемента (С1-С9), завершающиеся образованием белковой поры в клеточной мембране. Повреждение мембраны приводит к лизису клетки.
В экспериментах на мышах было обнаружено, что уменьшение компонентов СК С3 и С5аR приводило к снижению риска развития злокачественных опухолей. Важным компонентом опухолевой иммуносупрессии являются клетки опухолевого окружения, в частности — Т-хелперы и макрофаги второго типа (М2), которые продуцируют цитокины, подавляющие клеточный иммунитет. СК провоцирует воспаление, миграцию и дифференцировку клеток опухолевого окружения (макрофагов, фибробластов, перицитов, лимфоцитов и т.д.), что способствует росту опухоли. Была показана важная роль СК в опухолевом ангиогенезе и метастазировании за счет активации клеток соединительной ткани и эпителиально-мезенхимального перехода. В заключение можно сказать, что на начальных этапах канцерогенеза СК оказывает протективное действие, однако при длительном персистировании опухоли на первый план выходят эффекты, способствующие опухолевой прогрессии [24,27].
Третьей линией противоопухолевой защиты является адаптивный иммунитет. Развитие специфического иммунного ответа связано с появлением на поверхности опухолевых клеток новых антигенов (АГ). Их можно разделить на две группы: специфические и опухоль-ассоциированные АГ. Специфические АГ проявляются только в неопластических клетках и связаны с генными мутациями, в результате которых образуются измененные белки. Они, в свою очередь, делятся на уникальные и общие. Уникальные АГ являются высокоспецифичными и экспрессируются только при определенных типах злокачественных опухолей. Общие АГ выявляются в широком спектре новообразований. К общим относятся и вирусные опухолевые АГ, возникновение которых связано с инфицированием онкогенным вирусом. Опухоль-ассоциированные АГ связаны с дифференцировкой опухолевых клеток , они представлены главным образом экспрессированными факторами роста и встречаются в определенных тканях во время онтогенеза. В таблице 1 представлена классификация опухолевых АГ [28,29].
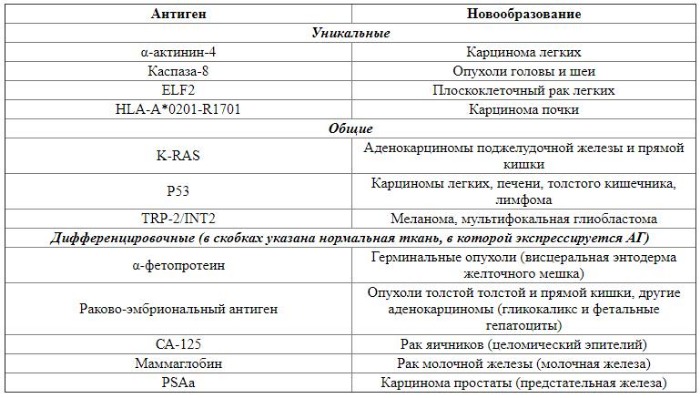
Таблица 1 | Примеры некоторых опухолевых АГ и связанные с ними новообразования
Иногда наблюдается феномен антигенной дивергенции — появление в малигнизированных клетках АГ, свойственных нормальным тканям, не гомологичным опухоли. Антигенная дивергенция вызывает определенные типы паранеопластических синдромов [30]. Специфический иммунный ответ начинается с захвата опухолевых АГ антигенпрезентирующими клетками (АПК). К этим клеткам относятся дендритные клетки, макрофаги, активированные B-лимфоциты и некоторые эпителиальные клетки. Их особенностью является наличие главного комплекса гистосовместимости 2 класса (MHC-II) и способность к фагоцитозу. Фрагменты погибших в результате некроза или апоптоза опухолевых клеток захватываются АПК, в фаголизосоме вычленяется АГ детерминанта, которая встраивается в MHC-II и экспрессируется на поверхности АПК (рис. 5) [31].
В дальнейшем АПК должны взаимодействовать с T-хелперами и T-киллерами. Дифференцировка тимоцитов проходит два этапа: позитивной и негативной селекции. На первой стадии происходит отбор тимоцитов, имеющих, помимо Т-клеточного рецептора (TCR), корецепторы CD4+ или CD8+, необходимые для связывания с MHC1 и MHC2. На этапе негативной селекции тимоциты, реагирующие на антигены собственного организма при захвате их молекулой MHC, подвергаются апоптозу. Несущие на своей поверхности TCR и CD4+ или CD8+, но не имеющие специфичности в отношении определенных антигенов тимоциты называются нативными и мигрируют в периферические лимфатические узлы. После захвата опухолевого АГ АПК перемещается в ближайший лимфатический узел и вступает в контакт с нативными Т-хелперами (CD4+). Если принесенный АГ является чужеродным, то посредством цитокинов (главным образом, интерлейкина 21) запускается пролиферация и селекция Т-киллеров, B-лимфоцитов и макрофагов. АПК могут напрямую активировать Т-киллеры (CD8+), презентируя АГ в комплексе с MHC1 (рис 6) [33].
Рисунок 5 | Механизм работы MHC2
Рисунок 6 | Активация Т-лимфоцитов АПК с помощью MHC1 и MHC2
В зависимости от воздействующих на наивный Т-хелпер цитокинов, он может дифференцироваться в несколько подтипов, главными из которых являются Т-хелперы первого типа (Th1), Т-хелперы второго типа (Th2) и регуляторные Т-хелперы (Treg). Th1 активируют клеточное звено иммунного ответа — Т-киллеры и макрофаги. Th2 запускают гуморальный иммунный ответ, активируя B-лимфоциты. При этом, обе популяции выделяют факторы, подавляющие пролиферацию друг друга, благодаря чему в организме преобладает только один тип иммунного ответа. Treg оказывают иммуносупрессивное действие. Кроме этого, Th1 продуцируют ряд цитокинов, в частности ИФ-γ, ФНО-α, которые активируют макрофаги и NK-клетки, а также оказывают токсическое действие на опухолевую ткань [33]. Активация Т-киллеров проходит этапы негативной и позитивной селекции.
Активированные Т-киллеры мигрируют в очаг опухоли и взаимодействуют со злокачественными клетками через TCR. Если в MHC1 опухолевых клеток присутствует специфический антиген, то Т-киллер запускает программу клеточной гибели через апоптоз или с помощью перфоринов и гранзимов (рис. 7). Кроме того, часть Т-киллеров превращается в клетки памяти, оставаясь в тканях и обеспечивая быстрый иммунный ответ в случае рецидива [35].
Рисунок 7 | Схема активации Т-киллера (CD8+-лимфоцита)
Активация В-лимфоцитов приводит к их дифференцировке в плазматические клетки и продукции противоопухолевых антител. Иммуноглобулины связываются с опухолевыми АГ, активируя комплемент по классическому пути или опосредуя антител-зависимую клеточную цитотоксичность посредством макрофагов [37]. Однако роль гуморальных факторов адаптивного иммунитета играет двоякую роль, о чем будет сказано далее.
Большинство возникающих микроскопических опухолей разрушаются иммунной системой в стадию элиминации (рис. 1) , они никогда не вырастают до клинически значимых размеров. Однако в случае хронического воспаления, продолжительного воздействия канцерогенных факторов, локального или общего иммунодефицита, медикаментозного воздействия — скорость элиминации опухоли может быть недостаточной, и вследствие этого появится длительно персистирующий опухолевый очаг (стадия равновесия). Несмотря на то что на этой стадии размеры опухоли практически не увеличиваются, в результате пролиферации происходит селекция клеток, резистентных к действию иммунной системы. Опухолевые клетки способны избегать узнавания и уничтожения иммунной системой, что получило название иммунологического «ускользания» [38].
Воздействие канцерогенов и некоторых онкогенных вирусов может ослаблять иммунную систему. Связано это с тем, что поверхностные опухолевые АГ представляют собой, по большей части, аутоантигены, и к ним может формироваться иммунологическая толерантность. В частности, она формируется к вирусным онкогенам, попавшим в организм с половыми клетками. Кроме того, для опухолевых клеток характерна низкая плотность АГ на поверхности, что приводит к низкой иммуногенности и индуцированной супрессии клеточного звена иммунитета на первых этапах. Более того, многие опухоли утрачивают MHC1, что делает невозможным направленное действие Т-киллеров [39].
Среди механизмов иммунного ускользания отдельного внимания заслуживает антигенная модуляция. Для ряда опухолей было показано, что взаимодействие антител с поверхностными АГ вызывает эндоцитоз и разрушение комплекса антиген-антитело самими опухолевыми клетками. Это приводит к потере специфических АГ, к которым уже сформировался адаптивный иммунитет. Через определенное время на поверхности злокачественных клеток появляются новые, измененные АГ. Время, которое иммунная система тратит на формирование ответа на постоянно меняющиеся АГ, дает опухоли возможность для роста и метастазирования [12]. В ряде случаев поверхностные АГ находятся в комплексе с мембранными структурами, которые экранируют их эпитопы от компонентов иммунной системы. Другим примером является формирование физических барьеров из коллагена, фибрина и клеток микроокружения [40]. Неоднозначность действия гуморальных факторов иммунитета связана с тем, что, помимо антигенной модуляции, IgG могут полностью скрывать опухолевые АГ от Т-киллеров и NK-клеток, не активируя при этом СК. Связано это с тем, что из-за редкого расположения поверхностных АГ, Fc-фрагменты иммуноглобулинов расположены слишком далеко, чтобы запустить СК по классическому пути (рис 8)[40].
Рисунок 8 | Схема активации комплемента по классическому пути
В связи с особенностями строения для активации комплемента достаточно всего одной молекулы IgM, однако их концентрация в плазме незначительна по сравнению с IgG, и они не могут проникать из кровеносного русла в опухолевый очаг. Эффект, связанный с экранированием АГ антителами, получил название иммунологического усиления. Кроме этого, циркулирующие в крови комплексы антиген-антитело выключают часть Т-киллеров и макрофагов из иммунного ответа. Последние исследования показывают, что гуморальные факторы иммунного ответа эффективны, главным образом, в отношении циркулирующих в крови клеток, например — в случае гемобластозов и метастатических эмболов [39]. В настоящее время изучается активное влияние опухоли на иммунную систему. Опухолевые клетки способны продуцировать вещества, разрушающие Т-киллеры (PD1), или опосредовать их контактную гибель, взаимодействуя с рецепторами CD95 (система Fas-рецепторов), что индуцирует механизмы апоптоза. Кроме того, злокачественные клетки способны продуцировать супрессоры, в частности, интерлейкин 10, которые подавляют клеточное звено иммунитета [40].
Во-вторых, важную роль в защите опухоли играет ее иммунное микроокружение, в состав которого входят макрофаги, дендритные клетки, NK-клетки, тучные клетки, В-лимфоциты, Т-киллеры, Th1, Th2 и Treg, и которые опухоль способна перепрограммировать. Выделяют два основных фенотипа макрофагов: М1 и М2. М1 участвуют в процессах воспаления, способны к презентированию АГ и участвуют в цитотоксических реакциях. М2, наоборот, подавляют иммунные процессы и запускают процессы регенерации и репарации. В норме повреждающий фактор вызывает активацию М1, которые устраняют поврежденные клетки и инфекционные агенты, а само заживление контролируется М2. Воздействие опухолевых клеток на макрофаги приводит к накоплению в очаге преимущественно М2, которые продуцируют цитокины, подавляющие иммунный ответ, и факторы роста, способствующие прогрессии опухоли [42,43]. Похожим эффектом обладают опухоль-ассоциированные фибробласты и мезенхимальные стволовые клетки (МСК). Накапливаясь в опухолевом очаге, они формируют и перестраивают межклеточный матрикс, способствуя эпителиально-мезенхимальному переходу, неоангиогенезу и метастазированию [44].
Накопление в опухолевом очаге Treg приводит к сильной иммуносупрессии и переключению на гуморальное звено иммунитета. Основную роль в этом играет интерлейкин 10, трансформирующий фактор роста (TGF-β) и ганглиозиды [45]. Рецепторы Treg обладают высокой аффинностью к ИЛ-2, который участвует в активации Т-лимфоцитов (CD4+ и CD8+). При этом они фактически сорбируют ИЛ-2, что приводит к снижению его концентрации. Кроме того, Treg снижают экспрессию CD80/86 на АПК, необходимые для костимуляции Тh1 и CD8+-лимфоцитов (рис.9) [46].
Рисунок 9 | Иммуносупрессивное действие Treg клеток
Суммируя вышеизложенное, можно привести следующую упрощенную схему этапов взаимодействия злокачественной опухоли и иммунной системы:
Стадия элиминации. На первых этапах активно клеточное звено врожденного и адаптивного иммунитета: NK-клетки, Т-киллеры, М1, Th1. Кроме того, рост опухоли подавляется ФНО-α, ИФ-γ и ИФ-α/β.
Стадия равновесия. При длительном персистировании опухоли, она начинает перепрограммировать микроокружение и активирует обсуждавшиеся виды иммунологического избегания.
Стадия ускользания. Накопление в опухолевой ткани интерлейкина 10, трансформирующего фактора роста и токсических для Т-киллеров веществ приводит к переключению с клеточного на гуморальное звено иммунитета. На этой стадии преобладают Th2, Treg, М2 и опухоль-ассоциированные фибробласты. За счет накопления противоопухолевых антител формируется иммунологическое усиление, что вместе с подавлением клеточного звена приводит к активному росту опухолевой ткани. Активация эпителиально-мезенхимального перехода за счет накопления компонентов СК запускает метастазирование опухоли, которое приводит к быстрой и необратимой прогрессии на фоне повышения уровня антител, не обладающих протективными свойствами.
Что дает клиницисту знание механизмов иммунологического ускользания злокачественных опухолей?
Канцерогенез связан с нарушениями в работе иммунной системы.
Пациенты с иммунодефицитом любого генеза представляют собой группу высокого риска развития злокачественных опухолей, и в их отношении должна быть постоянная онконастороженность. Любые состояния, проявляющиеся гиперреактивностью и перегрузкой иммунной системы (хронические инфекционные заболевания, очаги хронического воспаления, аутоиммунные заболевания, парапротеинемии и т.д.), особенно связанные с активацией гуморального звена иммунитета, приводят к истощению и нарушению работы CD8+-лимфоцитов, что создает благоприятный фон для развития опухоли.
Важно! Нельзя бесконтрольно давать пациентам с онкозаболеваниями иммуномодуляторы. Для большинства препаратов этой группы не установлен точный механизм действия, нет сведений о влиянии препаратов на разные популяции иммунокомпетентных клеток. Так, возможна активация Th2 и гуморального звена иммунитета с реципрокным подавлением Th1 и T-киллеров.
Изменения в иммунной системе специфичны для определенных стадий опухолевой прогрессии.
Есть данные о связи между исходом заболевания и фенотипом иммунных клеток, входящих в опухолевое окружение. Так, большое количество CD8+, Th1, NK-клеток и М1, обнаруженное при биопсии, коррелировало с благоприятным прогнозом и высокой частотой ремиссий. С другой стороны, инфильтрация Th2, М2, Treg и МСК была ассоциирована с высокой агрессивностью опухоли и неблагоприятным прогнозом [50]. Более того, изменения в иммунном профиле позволяют судить об ответе опухоли или ее резистентности к проводимому химиотерапевтическому лечению гораздо раньше, чем стандартные критерии оценки [51].
Новые перспективные методы терапии злокачественных опухолей.
Сейчас активно внедряется в практику такой метод, как «вакцинация», которая заключается в введении в организм пациента собственных АПК (чаще всего дендритных), активированных в отношении высокоспецифичных и консервативных АГ каждой конкретной опухоли. Возможна модуляция рецепторов Т-киллеров пациента (химерные TCR) с последующим введением лимфоцитов непосредственно в опухолевый очаг. Рассматриваются различные методы перепрограммирования клеток опухолевого микроокружения. Исследования в данной области уже позволили отказаться от определенных протоколов химиотерапии, которые помимо прочего вызывали апоптоз Th1 и CD8+-лимфоцитов [52].
Источники:
- Stewart F.W. Experiences in spontaneous regression of neoplastic disease in man. Tex Rep Biol Med. 1952;10(1):239-53.
- Jackson R. Saint Peregrine, O.S.M.-the patron saint of cancer patients. Can Med Assoc J. 1974;111(8):824, 827.
- Everson T. C., Cole W. H. (1966). Spontaneous Regression of Cancer. Philadelphia: W.B. Saunders.
- Jessy T. Immunity over inability: The spontaneous regression of cancer. J Nat Sci Biol Med. 2011;2(1):43-9.
- Khosravi H., Akabane A.L., Alloo A., Nazarian R.M., Boland G.M. Metastatic melanoma with spontaneous complete regression of a thick primary lesion. JAAD Case Rep. 2016;2(6):439-441.
- Brodeur G.M. Spontaneous regression of neuroblastoma. Cell Tissue Res. 2018;372(2):277-286.
- Chodorowski Z., Anand J.S., Wiśniewski M., Madaliński M., Wierzba K., Wiśniewski J. [Spontaneous regression of cancer--review of cases from 1988 to 2006]. Prz Lek. 2007;64(4-5):380-2.
- Penn I., Starzl T.E. Immunosuppression and cancer. Transplant Proc. 1973;5(1):943-7.
- Dolcetti R., Gloghini A., Caruso A., Carbone A. A lymphomagenic role for HIV beyond immune suppression?. Blood. 2016;127(11):1403-9.
- Kneale O.W., Stewart A.M. Pre-cancers and liability to other diseases. Br J Cancer 1978;37:448-457.
- Michaud D.S., Houseman E.A., Marsit C.J., Nelson H.H., Wiencke J.K., Kelsey K.T. Understanding the Role of the Immune System in the Development of Cancer: New Opportunities for Population-Based Research. Cancer Epidemiol Biomarkers Prev. 2015;24(12):1811-9.
- Pardoll D. Cancer and the Immune System: Basic Concepts and Targets for Intervention. Semin Oncol. 2015;42(4):523-38.
- Candeias S.M., Gaipl U.S. The Immune System in Cancer Prevention, Development and Therapy. Anticancer Agents Med Chem. 2016;16(1):101-7.
- Vesely M.D., Kershaw M.H., Schreiber R.D., Smyth M.J. Natural innate and adaptive immunity to cancer. Annu Rev Immunol. 2011;29:235-71.
- Wahlang B., Falkner K.C., Cave M.C., Prough R.A. Role of Cytochrome P450 Monooxygenase in Carcinogen and Chemotherapeutic Drug Metabolism. Adv Pharmacol. 2015;74:1-33.
- Schiller J.T., Lowy D.R. Virus infection and human cancer: an overview. Recent Results Cancer Res. 2014;193:1-10.
- Conolly R.B., Gaylor D.W., Lutz W.K. Population variability in biological adaptive responses to DNA damage and the shapes of carcinogen dose-response curves. Toxicol Appl Pharmacol. 2005;207(2 Suppl):570-5.
- Janeway C.A. Jr., Travers P., Walport M., et al. Immunobiology: The Immune System in Health and Disease. 5th edition. New York: Garland Science; 2001
- Mandal A., Viswanathan C. Natural killer cells: In health and disease. Hematol Oncol Stem Cell Ther. 2015;8(2):47-55.
- Adapted from the Wikimedia Commons “File: MHC Class I processing.svg” https://commons.wikimedia.org/wiki/File:MHC_Class_I_processing.svg?uselang=ru
- Immunobiology 7 PB (Janeway’s Immunobiology) Garland Science; 7 edition 2007 ISBN 0-8153-4123-7
- Pfeffer K. Biological functions of tumor necrosis factor cytokines and their receptors. Cytokine Growth Factor Rev. 2003;14(3-4):185-91.
- Vivier E., Raulet D.H., Moretta A., et al. Innate or adaptive immunity? The example of natural killer cells. Science. 2011;331(6013):44-9.
- Pio R., Corrales L., Lambris J.D. The role of complement in tumor growth. Adv Exp Med Biol. 2014;772:229-62.
- The immune system. Garland Science; 3 edition 2009 ISBN 978-0-8153-4466-7.
- Lin K., He S., He L., et al. Complement component 3 is a prognostic factor of non‑small cell lung cancer. Mol Med Rep. 2014;10(2):811-7.
- Mamidi S., Höne S., Kirschfink M. The complement system in cancer: Ambivalence between tumour destruction and promotion. Immunobiology. 2017;222(1):45-54.
- Croce C.M. Oncogenes and cancer. N Engl J Med. 2008;358(5):502-11.
- Vicente-Dueñas C., Romero-Camarero I., Cobaleda C., Sánchez-García I. Function of oncogenes in cancer development: a changing paradigm. EMBO J. 2013;32(11):1502-13.
- Fel'VIa. [The antigenic divergence of tumor cells due to the expression of hetero-organic antigens as a manifestation of disordered differentiation in carcinogenesis]. Tsitologiia. 1990;32(5):407-21.
- Den Haan J.M., Arens R., Van Zelm M.C. The activation of the adaptive immune system: cross-talk between antigen-presenting cells, T cells and B cells. Immunol Lett. 2014;162(2 Pt B):103-12.
- Галактионов В.Г. «Иммунология»: учебник. – М.; Нива России, 2000.
- Nakayamada S., Takahashi H., Kanno Y., O'shea J.J. Helper T cell diversity and plasticity. Curr Opin Immunol. 2012;24(3):297-302.
- Галактионов В.Г. Генетический контроль взаимодействия иммунокомпетентных клеток. Соросовский образовательный журнал. 1997;2
- Shin H., Iwasaki A. Tissue-resident memory T cells. Immunol Rev. 2013;255(1):165-81.
- Adapted from the Wikimedia Commons “File:ТхелперТкиллер.jpg”
https://commons.wikimedia.org/wiki/File:%D0%A2%D1%85%D0%B5%D0%BB%D0%BF%D0%B5%D1%80%D0%A2%D0%BA%D0%B8%D0%BB%D0%BB%D0%B5%D1%80.jpg?uselang=ru - Lebien T.W., Tedder T.F. B lymphocytes: how they develop and function. Blood. 2008;112(5):1570-80.
- Mittal D., Gubin M.M., Schreiber R.D., Smyth M.J. New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape. Curr Opin Immunol. 2014;27:16-25.
- Israël M., Schwartz L. The metabolic advantage of tumor cells. Mol Cancer. 2011;10:70.
- Rettig T.A., Harbin J.N., Harrington A., Dohmen L., Fleming SD. Evasion and interactions of the humoral innate immune response in pathogen invasion, autoimmune disease, and cancer. Clin Immunol. 2015;160(2):244-54.
- Соколова Е.И. Клиническая иммунология. Руководство для врачей; Москва «Медицина», 1998
- Kim J., Bae J.S. Tumor-Associated Macrophages and Neutrophils in Tumor Microenvironment. Mediators Inflamm. 2016;2016:6058147.
- Hui L., Chen Y. Tumor microenvironment: Sanctuary of the devil. Cancer Lett. 2015;368(1):7-13.
- Wang M., Zhao J., Zhang L., et al. Role of tumor microenvironment in tumorigenesis. Journal of Cancer. 2017;8(5):761-773. doi:10.7150/jca.17648.
- Wang K., Vella A.T. Regulatory T Cells and Cancer: A Two-Sided Story. Immunol Invest. 2016;45(8):797-812.
- Chaudhary B., Elkord E. Regulatory T Cells in the Tumor Microenvironment and Cancer Progression: Role and Therapeutic Targeting. Whiteside TL, ed. Vaccines. 2016;4(3):28. doi:10.3390/vaccines4030028.
- Zitvogel L., Apetoh L., Ghiringhelli F., Kroemer G. Immunological aspects of cancer chemotherapy. Nat Rev Immunol. 2008;8(1):59-73.
- Knuth A, Jäger D., Jäger E. Cancer immunotherapy in clinical oncology. Cancer Chemother Pharmacol. 2000;46 Suppl:S46-51.
- Zaidi M.R., Merlino G. The two faces of interferon-γ in cancer. Clin Cancer Res. 2011;17(19):6118-24.
- Kim K-J., Wen X-Y., Yang H.K., Kim W.H., Kang G.H. Prognostic Implication of M2 Macrophages Are Determined by the Proportional Balance of Tumor Associated Macrophages and Tumor Infiltrating Lymphocytes in Microsatellite-Unstable Gastric Carcinoma. Singh PK, ed. PLoS ONE. 2015;10(12):e0144192. doi:10.1371/journal.pone.0144192.
- Barnes T.A., Amir E. HYPE or HOPE: the prognostic value of infiltrating immune cells in cancer. British Journal of Cancer. 2017;117(4):451-460. doi:10.1038/bjc.2017.220.
- Medler T.R., Cotechini T., Coussens L.M. Immune response to cancer therapy: mounting an effective antitumor response and mechanisms of resistance. Trends in cancer. 2015;1(1):66-75. doi:10.1016/j.trecan.2015.07.008.
