Ключевые молекулярные признаки эпигенетического контроля

C. David Allis и Thomas Jenuwein
Резюме | За последние 20 лет отношение ученых к эпигенетике изменилось: из набора любопытных биологических феноменов она превратилась в область научных исследований, поддающуюся функциональному анализу. Произошло это благодаря передовым открытиям хроматин-модифицирующих ферментов и связанных с ними механизмов, изменяющих структуру хроматина в ответ на физиологические и патологические сигналы. В этой статье представлен взгляд авторов на историю развития эпигенетики от ее возникновения до наступления периода, названного учеными «современной эпохой эпигенетических исследований». Прежде всего авторы рассматривают ключевые молекулярные механизмы и основные достижения в изучении эпигенетического контроля, изменившие представления о нормальном развитии и его нарушениях.
Глоссарий
Двоичный переключатель
Модификация соседних или близкорасположенных остатков гистонов, нарушающая распознавание и связывание код-считывающими белками.
Репрограммирование клетки
Возвращение дифференцированной клетки к эмбриональному состоянию.
Эффекты заряда
Эффект, заключающийся в воздействии посттрансляционных модификаций гистонов на изменение электростатических взаимодействий с ДНК.
E(z) (Enhancer of zeste).
Ген, выявленный при скрининговом поиске гомеозисных трансформаций у Drosophila melanogaster. Позже было показано, что этот ген кодирует фермент, метилирующий лизин 27 гистона H3 (H3K27).
Стирающие белки
Ферменты, устраняющие модификации гистонов из хроматина.
Эухроматин
Светлоокрашенные, деконденсированные и доступные для транскрипции регионы генома.
Гетерохроматин
Темноокрашенные, конденсированные и бедные генами регионы генома.
Гистоновые кассеты
Короткие последовательности в гистоновых белках, где сосредоточены модификации гистонов, различными способами управляющие считыванием биологической информации.
Импринтинг
Состояние хроматина, определяющееся в зависимости от пола родителя, передавшего ген или локус гена
Локусы типов спаривания
Генетические элементы дрожжей, несущие информацию о типе спаривания (a или α). Активируются путем рекомбинации гетерохроматиновых копий одного из двух аллелей типов спаривания
Мультивалентность
Свойство, при котором отдельные модификации гистонов функционируют совместно для усиления связывания с код-считывающими белками или стабилизации упаковки нуклеосомы.
Polycomb
Ген, выявленный при скрининговом поиске гомеозисных трансформаций у Drosophila melanogaster. Позже было показано, что этот ген кодирует хромодомен-содержащий фактор, связывающий метилированный лизин 27 гистона H3 (H3K27me).
Мозаичный эффект положения
(МЭП). Случайная и мозаичная экспрессия генов, возникающая из-за непосредственного соседства с гетерохроматиновыми доменами.
Считывающие белки
Белки, которые распознают и связывают хроматин благодаря наличию доменов распознавания гистоновых модификаций.
Домен SET
Домен гистоновых лизин-метилтрансфераз (KMT), состоящий из 120 аминокислот. Консервативен у Su(var)3–9, E(z) и Trithorax
Белки регуляции «молчащей» информации
Комплекс транс-действующих белков сайленсинга, вовлеченных в установление и поддержание гетерохроматина у почкующихся дрожжей
Su(var)3–9
(супрессор мозаичности 3–9). Ген, выявленный при скрининговом поиске мозаичного эффекта положения у Drosophila melanogaster. Позже было показано, что этот ген кодирует фермент, метилирующий лизин 9 гистона H3 (H3K9).
Топологически соединяющиеся домены
(ТСД). Крупные регионы генома, обеспечивающие регуляторные взаимодействия путем формирования хроматиновых структур высшего порядка, разделенных пограничными регионами.
Трансгенерационная наследственность
Передача эпигенетической информации через гаметы без изменения последовательности ДНК.
Trithorax
Ген, выявленный при скрининговом поиске гомеозисных трансформаций у Drosophila melanogaster. Позже было показано, что этот ген кодирует фермент, метилирующий лизин 4 гистона H3 (H3K4).
Записывающие белки
Ферменты, которые добавляют гистоновые модификации в хроматин.
Инактивация X-хромосомы
Процесс, протекающий на ранних этапах развития, при котором одна из двух X-хромосом в клетках самок млекопитающих случайным образом инактивируется.
В 1942 году Конрад Уоддингтон (Conrad Hal Waddington) ввел термин «эпигенетика» для объяснения малопонятных на тот момент механизмов реализации некоторых особенностей развития. Он определил этот термин как «изменения фенотипа при отсутствии изменений генотипа» [1, 2]. Спустя почти 75 лет стало известно, что эпигенетические механизмы преобразовывают унаследованные паттерны (особенности распределения — прим. пер.) экспрессии генов не изменяя последовательность ДНК, а воздействуя на хроматин, представляющий собой адаптированную к физиологии нашего организма форму хранения генетической информации. Эпигенетические механизмы дополняют генетический код ДНК и стабилизируют программы экспрессии генов, тем самым обеспечивая идентичность клеток одного типа. Важность эпигенетического контроля уже давно признана научным сообществом, однако ощущается нехватка данных о ферментативной регуляции определенных состояний хроматина, стимулирующих или подавляющих активность генов.
Технологические достижения, такие как разработка метода иммунопреципитации хроматина с последующим секвенированием нового поколения (ChIP-seq) и его вариации, обеспечили возможность анализа эпигенома с разрешением примерно в одну пару оснований и позволили проводить «эпигеномное профилирование» как нормальных, так и аномальных клеток и тканей. В некоторых случаях эпигеномное профилирование позволило точнее определить критически важные контролирующие элементы ДНК: энхансеры и промоторы генов. При сопоставлении с данными секвенирования ДНК это обеспечивает получение ценной информации о лежащих в основе некоторых заболеваний процессах. Большая часть известных эпигенетических модификаций хроматина обратима, что подает большие надежды в отношении терапии, управляющей пластичными механизмами эпигенетического контроля. Эпигенетика была и продолжает оставаться одной из самых инновационных исследовательских областей в современной биологии и медицине.
В данной статье рассматривается развитие эпигенетики от ее возникновения до «современной эпохи эпигенетических исследований», под которой авторы подразумевают последние 20 лет — с 1996 по 2016 годы. Авторы описывают основополагающие открытия, которые привели к определению ферментов, участвующих в регуляции состояний хроматина, которые стимулируют (эухроматин) или подавляют (гетерохроматин) активность генов, а также позволили понять роль эпигенетических механизмов в стабилизации хроматина, регуляции генов, транскрипционном сайленсинге («выключении» гена — прим. пер.) и обратимости как модификации гистонов, так и метилирования ДНК. Авторы обсуждают, как знание этих механизмов и полногеномное профилирование хроматина обеспечило лучшее понимание идентичности клеток одного типа и открыло новые возможности для исследования репрограммирования, ответа хроматина на условия среды, а также для разработки эпигенетической терапии для улучшения наследования хроматина и здоровья человека. Авторы описывают многие — но, конечно же, не все, — крупные открытия и прежде всего освещают наиболее важные, концептуальные достижения в понимании механизмов эпигенетического регулирования. Здесь цитируются самые важные основополагающие статьи, однако для углубленного ознакомления и получения дополнительных подробностей читателю рекомендуется время от времени обращаться к учебнику «Эпигенетика» (Epigenetics [3]) или другим актуальным обзорам.
Основы эпигенетики
В самых ранних работах, проведенных между 1869 и 1928 гг. такими исследователями, как Мишер, Флемминг, Коссель и Хайц (Miescher, Flemming, Kossel и Heitz), были выделены нуклеиновые кислоты, хроматин и гистоновые белки, что привело к цитологическому разграничению между эухроматином и гетерохроматином (Рис. 1a) [4]. После этого Г. Мёллером (на Drosophila melanogaster) [5] и Б. Мак-Клинток (на кукурузе) [6] были проведены основополагающие исследования мобильных генетических элементов и эффекта положения [гена] мозаичного типа (МЭП, PEV — position-effect variegation), что обеспечило начальное представление о неменделевской наследственности. В дальнейшем описание феномена инактивации X-хромосомы [7] и импринтинга [8, 9] привело к формированию основных представлений о том, что одинаковый генетический материал в одном и том же ядре может храниться во «включенном» либо в «выключенном» состоянии, но оставались непонятными лежащие в основе этого механизмы.
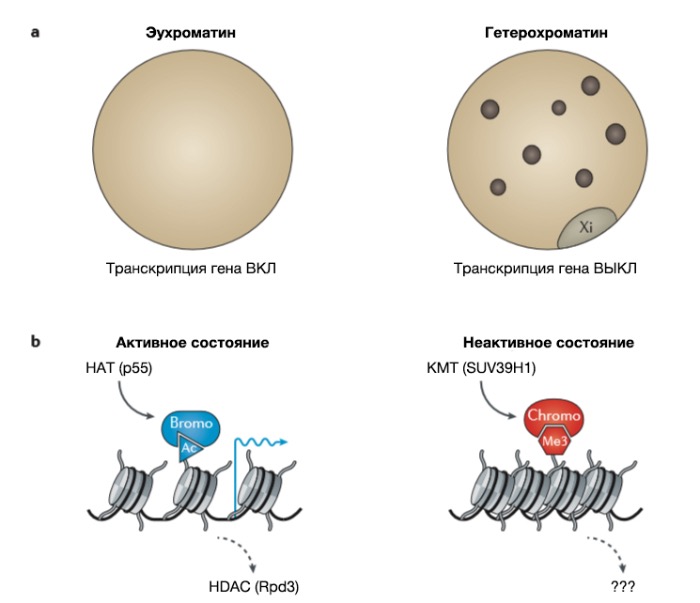
b | Ферменты, определяющие состояние хроматина, стимулирующее активность генов (ацетилирование гистонов белком p55 (также известным как Gcn5)) или подавляющее активность генов (метилирование гистонов ферментом SUV39H1). В 1996 году у инфузории Tetrahymena thermophila была описана ядерная гистон-ацетилтрансфераза (HAT) p55, которая функционирует как коактиватор транскрипции, ацетилирующий амино-концевой хвост гистона H3. Ацетилированный (Ac) лизин гистона H3 (H3K14ac) формирует место прикрепления бромодомен-содержащих (Bromo) вспомогательных белков, которые связываются с нуклеосомой, поддерживая ее доступность для ферментов транскрипции и, следовательно, транскрипционную активность. Ацетилирование гистонов обратимо и может устраняться гистон-деацетилазами (HDACs), что часто ведет к подавлению транскрипции. В 2000 году у человека была описана гистон-лизинметилтрансфераза (KMT) SUV39H1 — ортолог фактора мозаичного эффекта положения Su(var) у Drosophila melanogaster, который метилирует N‑концевой хвост гистона H3. Триметилированный гистон H3K9 (H3K9me3) формирует место прикрепления для хромодомен-содержащего (Хромо) гетерохроматинового белка 1 (HP1), который нарушает доступность нуклеосомы для ферментов и приводит к подавлению экспрессии генов. Обратимость метилирования лизина гистонов к настоящему времени не установлена.
Метилирование ДНК
Химические модификации оснований ДНК были обнаружены еще в 1948 году [10], а в середине 1970-х Р. Холлидей, Д. Пью (Holliday, Pugh) и др. установили роль метилирования ДНК — в частности, азотистого основания цитозина с образованием 5-метилцитозина (5mC), — в регуляции генов [11]. К 1980 г. была установлена функциональная взаимосвязь между метилированием ДНК и подавлением экспрессии генов [12], а также обнаружены CpG-островки [13]. В это же время на клеточной линии фибробластов был применен первый «эпигенетический препарат» 5-азацитидин (также известный как 2′-дезокси-5-азацитидин и позже получивший название децитабин (decitabine)), блокирующий метилирование ДНК и тем самым изменяющий экспрессию генов и фенотип [14]. Вскоре после этого Файнберг и Фогельштейн (Feinberg и Vogelstein) (далее имена авторов приводятся без транслитерации — прим. пер.) выявили глобальное гипометилирование ДНК при раке [15], а десять лет спустя было обнаружено локальное гиперметилирование ДНК в генах-супрессорах опухолей, подтвержденное несколькими исследователями [16]. Эта информация послужила веской причиной для продолжения изучения «энзимологии» метилирования ДНК, чему способствовали такие важные достижения, как успешное выделение и клонирование фермента ДНК-(цитозин-5)-метилтрансферазы 1 (DNMT1) мыши [17, 18], а также создание и исследование мышей с мутацией в гене Dnmt1 [19]. В это же время был обнаружен первый метил-ДНК связывающий белок, MeCP2 (метил-CpG-связывающий белок 2) [20]. Научное сообщество убедилось в том, что метилирование ДНК и образование 5mC (считающегося «пятым основанием») являются важнейшим эпигенетическим механизм у многих, хотя и не всех, биологических видов.
Нуклеосома
Модель нуклеосомной организации хроматина сегодня общепризнана и подтверждена многочисленными исследованиями [21], но когда они была впервые предложена в 1974 году, это было достаточно смелое предположение о субъединичном строении хроматина [22]. В 1997 году с помощью рентгеновского излучения была визуализирована характерная кристаллическая структура гистонового октамера как составляющей ДНК [23], а также было показано, что в качестве основной единицы хроматиновой нити выступает нуклеосомная коровая частица, состоящая из двух копий каждого из четырех гистоновых белков (гистонового октамера) и участка ДНК длиной в 147 пар оснований, накрученного на эту структуру.
Модификации гистонов
В середине 1960-х годов основополагающие исследования Allfrey по модификациям гистонов, а именно по их ацетилированию [24], привели к появлению гипотезы о том, что ацетилирование тесно связано с активностью генов [25]. В дальнейшем другие ученые, в частности Grunstein с соавт., провели множество исследований по изучению мутаций гистоновых хвостов, которые нарушают сайленсинг генов на теломерах и в локусах генома, определяющих тип спаривания у дрожжей Saccharomyces cerevisiae. Эти фундаментальные работы обеспечили первоначальные функциональные доказательства гипотезы, в т. ч. впервые охарактеризовали белки регуляции «молчащей» информации [26, 27]. Turner и другие исследователи разработали антитела со специфичностью к отдельным сайтам и модификациям (например, антитела к ацетилированному лизину 16 гистона 4 — H4K16ac). Их использование позволило обнаружить неслучайные паттерны ацетилирования гистонов, например, гипоацетилирование неактивной X-хромосомы у самок млекопитающих [28] или «молчащие» гены типов спаривания у дрожжей [29]. Также удалось определить гиперацетилирование как в X-хромосомах с удвоенным уровнем экспрессии у самцов D. melanogaster [30], так и в экспрессируемых генах β-глобина в эритроцитах курицы [31].
Эти крупные открытия убедительно подтвердили, что модификации гистонов, наряду с метилированием ДНК, переносят информацию, позволяющую отличать эухроматин от гетерохроматина. Крупные генетические исследования на мухах [32, 33, 34], дрожжах [35, 36] и растениях [33, 37] установили другие ключевые факторы хроматин-зависимой регуляции генов, такие как HP1 (гетерохроматиновый белок 1), Su(var)3–9 (супрессор мозаичного эффекта положения 3–9), E(z) (Enhancer of zeste — SET-гистонметилтрансфераза), белки групп Polycomb (РcG) и Trithorax (TrxG), Clr4 (регулятор скрытых локусов 4) и DDM1 (фактор 1 уменьшения метилирования ДНК). Однако молекулярная функция этих хроматиновых факторов, а также способы «переключения» хроматина из эухроматинового состояния в гетерохроматиновое и обратно все еще оставались неизвестными.
Ферменты, определяющие состояние хроматина
Активность генов и эухроматин
В 1996 году Allis с коллегами, используя в качестве модельного организма одноклеточную инфузорию Tetrahymena thermophila [38] и комбинируя биохимические подходы с гелевыми методиками анализа, впервые очистили и клонировали из макронуклеуса (активного ядра инфузории) ген, кодирующий ассоциированную с транскрипцией гистоновую ацетилтрансферазу (HAT). Удивительно, но HAT (p55) инфузории оказалась ортологом описанного ранее коактиватора транскрипции Gcn5 почкующихся дрожжей, что указало на прямую связь между ацетилированием гистонов и активностью генов. Кроме того, было показано, что фермент Gcn5 дрожжей также проявляет HAT-активность (Рис. 1b, 2). Интересно, что фермент инфузории содержал фрагменты активных сайтов, обнаруженных и у других ацетилтрансфераз (например, цитоплазматического фермента Hat1 дрожжей) [39, 40], а также высококонсервативный бромодомен, который, как предположили Allis с соавт. [38], способен управлять организацией хроматина неизвестными на тот момент способами. В последующих работах Allis и его команды [41] были получены окончательные доказательства того, что избирательное ацетилирование гистонов ферментом Gcn5 приводит к активации генов. Выявление других HAT, включая TAF1 (он же TAF(II)250; субъединица 1 фактора TFIID, ассоциированного с ТАТА-связывающим белком (ТРВ)) [42], PCAF (p300/CBP-ассоциированный фактор) [43] и CBP/p300 (CREB-связывающий белок и p300) [44, 45], позволило подтвердить и распространить вышеописанную модель на клетки млекопитающих [46].
Примерно через месяц после публикации о сходстве таких HAT, как p55 и Gcn5, Schreiber с коллегами [47] сообщили об очистке и клонировании первой гистоновой деацетилазы (HDAC), которую исследователи определили по аффинной матрице с применением трапоксина (trapoxin) — ингибитора HDAC (HDACi). Примечательно, что трапоксин-связывающий белок млекопитающих представляет собой ортолог ко-репрессора транскрипции Rpd3 почкующихся дрожжей (Рис. 1b, 2). Это одно из ключевых открытий, которое позволило доказать, что деацетилирование гистонов связано с подавлением транскрипции. Исследования HAT и HDAC 1996 года в своей совокупности обеспечили мощное подтверждение предложенной Allfrey гипотезы о том, что ацетилирование гистонов напрямую связано с «включенным» и «выключенным» состоянием регуляции генов [24].
Открытия HAT и HDAC привели к росту интереса к другим белкам, также способным проявлять каталитическую активность [46, 48]. В 2000 году Guarente с коллегами [49] показали, что критически важный белок, необходимый для сайленсинга генов у дрожжей, Sir2, представляет собой NAD-зависимую HDAC (Рис. 2). Затем в клетках млекопитающих были обнаружены семь Sir2-подобных ферментов, сейчас известных как белки семейства Sirtuin. Значительный интерес ученых к HDAC семейства Sirtuin обусловлен не только отличными от других HDAC требованиями к условиям среды и кофакторам, но и участием данной группы ферментов в активно изучаемых процессах метаболизма и старения [50].
Несмотря на значительный прогресс, остается неизученным вопрос о том, каким способом ацетилирование гистонов обеспечивает активное состояние хроматина. Долгое время существовала следующая точка зрения: ацетилирование гистонов регулирует структуру хроматина и активность генов путем нейтрализации положительного заряда гистонов, ослабляющей их связи с ДНК (цис-эффект). В 1999 году Zhou с коллегами [51] описали бромодомен PCAF как участок, связывающий ацетилированный лизин для присоединения к ацетилированным гистонам. Именно обнаружение первого домена, связывающего модифицированные гистоны, указало на существование принципиально нового механизма (транс-эффекты) связывания бромодомен-содержащих факторов с ацетилированными мишенями хроматина (Рис. 1b, 2). На данный момент выявлено множество хроматин-связывающих модулей, при этом многие из них описаны с точностью до атома вместе со связанными с ними модифицированными гистонами [46, 52].
Репрессия генов и гетерохроматин
Открытие первой гистоновой лизин-метилтрансферазы (KMT) произошло благодаря результатам двух исследований: Reuter обнаружил, что доминантные факторы модификации МЭП у Drosophila melanogaster содержат эволюционно консервативный SET-домен [53], а Jenuwein клонировал этот фактор и определил его ортологи у млекопитающих [54]. SET-домен присутствует в белках Su(var)3–9, E(z) и Trithorax (название домена дано по первым буквам этих белков — прим. пер.), каждый из которых вовлечен в эпигенетическую регуляцию и не имеет доказанной ферментативной активности. Jenuwein предсказал каталитическую активность домена SET [55]; однако для выявления его отдаленной связи с метилтрансферазами растений потребовались более глубокие исследования. В результате таких исследований и была обнаружена регуляция фосфорилирования гистона H3 посредством SUV39H1 (гомолог 1 Su(var)3–9) [56] и одновременно предоставлена идея для важного эксперимента: проверить KMT-активность рекомбинантного белка SUV39H1 на гистоновом субстрате [57]. Этот эксперимент показал, что SET домен рекомбинантного SUV39H1 in vitro обладает устойчивой каталитической активностью в отношении метилирования гистона H3. Дальнейшие совместные исследования, проведенные Jenuwein и Allis в своих лабораториях [57], показали, что SUV39H1 избирательно метилирует лизин 9 гистона H3 (H3K9me3). Схожим примером эпигенетической «магии» является генетическая классификация гена Su(var)3–9 у D. melanogaster, в ходе которой Reuter «предсказал» субстрат- и сайт-специфичность (метилирование H3K9) фермента, кодируемого данным геном. В 2000 году Jenuwein опубликовал статью, посвященную SUV39H1 как первой обнаруженной KMT (Рис 1b, 2) [57].
Вскоре после открытия KMT SUV39H1 было показано, что у Schizosaccharomyces pombe хромодомен HP1 связывает метилированный H3K9 [58, 59] тем же способом, что и Swi6 — родственный HP1 белок (Рис. 1b, 2) [60]. В совокупности эти результаты предоставили биохимическое объяснение формирования и наследования гетерохроматина, необходимость в котором существовала с 1928 года [4], а также определили класс ферментов, необходимых для метилирования остатков лизина в составе гистонов, который оставался невыясненным с 1960-х годов [61]. Сегодня известно, что система метилирования гистонов SUV39H1-HP1-H3K9, осуществляющая репрессию генов и сборку гетерохроматина, эволюционно более консервативна, чем метилирование ДНК, и имеется у одноклеточных организмов (например, S. pombe), растений и беспозвоночных (например, D. melanogaster), а также у сложных многоклеточных организмов (млекопитающих и человека), что подчеркивает ее важность [32, 36, 37, 62].
SET домен белка SUV39H1 представляет собой характерный каталитический домен, поэтому для многих содержащих его белков изучалась возможность их действия в роли KMT. В геноме млекопитающих обнаружено примерно 50 генов, кодирующих содержащие домен SET белки, и ферментативная активность многих из этих белков интенсивно изучается [63]. Метилирование остатков лизина в гистонах может приводить как к подавлению экспрессии генов, например, в случае SUV39H1-опосредованного триметилирования H3K9 (Рис. 1b), так и к ее активации, как происходит при метилировании H3K4. Другие группы белков определяют «молчащее» или активное состояние хроматина, контролируемое в процессе развития (например, H3K9me2 находится под контролем G9a64, H3K27me3 контролируется белками Polycomb и EZH2 (гомолог 2 Enhancer of zeste) [65–68], H3K4me3 — белками Trithorax и MLL [69–73] (Рис. 2)), а также структуру гетерохроматина инактивированной X-хромосомы млекопитающих [74–78]. Описаны даже KMT, не содержащие домена SET и метилирующие сайты вне гистоновых хвостов (например, фермент DOT1L, метилирующий H3K79) [79]. С регуляцией генов связано метилирование не только лизиновых, но и аргининовых остатков в составе гистонов. Так, коактиватор CARM1 (ассоциированная с коактиватором аргинин метилтрансфераза 1) [80] или PRMT1 (белковая аргинин-N-метилтрансфераза 1) [81] способны опосредовать гормон-зависимую стимуляцию транскрипции путем метилирования H3R17 [82] или H4R3 [81].
Гистоновые модификации, несомненно, крайне важны для хроматин-зависимой регуляции генов. Тем не менее, ключевым оставался вопрос о том, является ли метилирование лизина гистонов ферментативно обратимым, подобно процессу ацетилирования гистонов. Поиск лизиновых деметилаз или других подобных механизмов требовал значительных затрат времени и новых открытий в этой области.
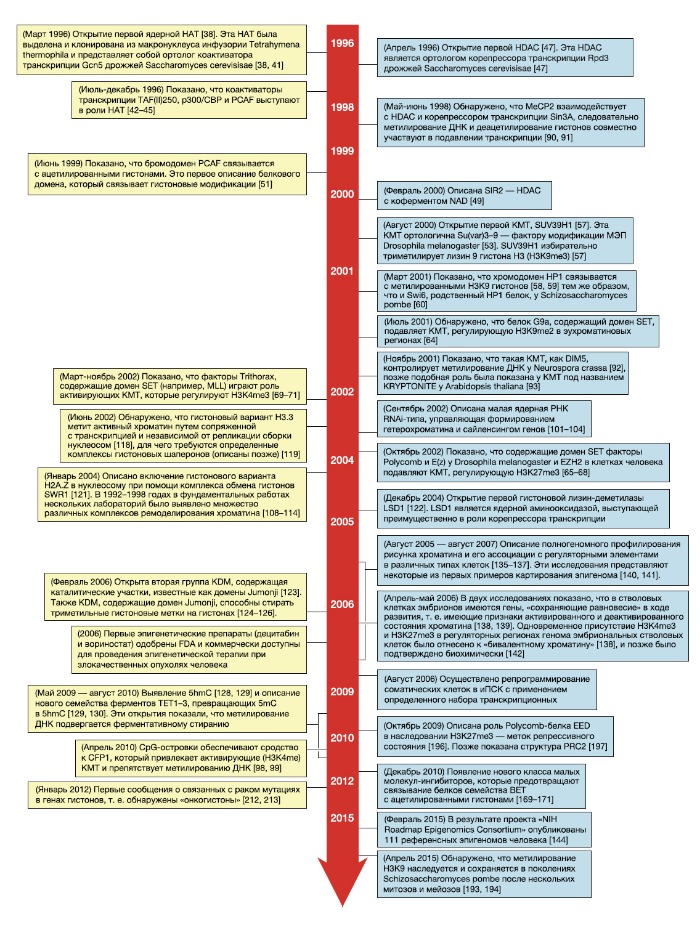
5hmC — 5‑гидроксиметилцитозин; 5mC — 5‑метилцитозин; FDA — Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США; HAT — гистоновая ацетилтрансфераза; HDAC — гистоновая деацетилаза; HP1 — гетерохроматиновый белок 1; иПСК — индуцированные плюрипотентные стволовые клетки; KDM — гистоновая лизин-деметилаза; KMT — гистоновая лизин-метилтрансфераза; LSD1 — лизин-специфическая гистоновая деметилаза 1; MLL — лейкемия смешанного происхождения; МЭП — мозаичный эффект положения гена; RNAi — РНК-опосредованная интерференция.
Современная эпоха эпигенетических исследований
Можно утверждать, что вышеупомянутые исследования совместно с развитием новых технологий, таких как полногеномное профилирование хроматина, ознаменовали начало «современной эпохи эпигенетических исследований», о чем свидетельствует появление множества публикаций в этой области начиная с 2000 года [83]. Нарастающий ажиотаж вокруг открытий фундаментальных механизмов, лежащих в основе эпигенетического контроля, поддерживают новые собрания и инициативы по всему миру. Важнейшими их примерами служат посвященные исключительно эпигенетике конференции, проводимые множеством организаций: лабораторией Колд Спринг Харбор (Cold Spring Harbor Laboratory), Американской ассоциацией по исследованию рака (American Association for Cancer Research, AACR), Федерацией американских обществ экспериментальной биологии (Federation of American Societies for Experimental Biology, FASEB), — а также Гордоновские конференции (Gordon Research Conferences, GRC) и Симпозиум по молекулярной и клеточной биологии в Кистоуне (Keystone Symposia). Кроме того, запущены несколько крупных консорциумов, обеспечивающих взаимосвязь многих исследовательских групп в Европе (сети передового опыта (The Networks of Excellence) «Epigenome» и «EpiGeneSys»), США («Дорожная карта эпигеномного картирования» на базе Национальных институтов здравоохранения США — Roadmap Epigenomics Project, и «ENCODE»), Канаде, Азии и по всему миру («Международный консорциум по эпигеному человека» — International Human Epigenome Consortium, IHEC).
Ниже авторы описывают основные выдающиеся открытия, произошедшие с 2000 по 2016 год. Эти открытия хронологически упорядочены на рис. 2, хотя авторы не всегда представляли их в строгой последовательности, а скорее группировали согласно сходству механизмов и принципиальным достижениям.
Гипотеза гистонового кода и связанные с ней теории
Нарастающее число открытых ковалентных гистоновых модификаций позволило предположить, что нуклеосомы несут эпигенетическую информацию [84], однако оставалось невыясненным, через цис- или же через транс-механизмы передается эта информация. В 1999 году Zhou и его коллеги открыли бромодомен, связывающий ацетил-лизин [51], и этот эксперимент стал одним из первых доказательств, которые привели к формулировке важной «гипотезы гистонового кода», выдвинутой годом позже [85]. Данная теория предполагает, что комбинаторные паттерны гистоновых модификаций определяют конкретные биологические последствия, в частности, путем привлечения эффекторных белков, осуществляющих транскрипцию (т. н. «считывающих белков» по аналогии с «записывающими белками», которые представляют собой гистон-модифицирующие ферменты), или транс-действующих комплексов. Гипотеза гистонового кода предсказала обнаружение белков, считывающих другие гистоновые модификации. И действительно, было обнаружено несколько типов модулей, связывающих гистоновые модификации (например, хромодомены, Tudor-домены и растительный гомеодомен (PHD), содержащий цинковый палец). Их структура позволила объяснить специфичность связывания соответствующих лигандов, что расширило гипотезу гистонового кода и позволило создать на ее основе более широкое понятие — «эпигенетический код» [86]. В последующем гипотезу дополнили такие открытия, как гистоновые кассеты, двоичные переключатели [87] и мультивалентность реакций связывания эффектор-лиганд [88]. Хотя в научном сообществе ведутся энергичные дебаты о том, действительно ли ковалентный «язык» гистоновых модификаций соответствует определению «кода» [89], в большей части исследований несомненно показано, что транс-механизмы связывания эффекторных белков дополняют цис-механизмы (изменение заряда гистонов) и играют значительную роль в считывании информации, закодированной в гистонах и модификациях ДНК.
Модификации гистонов и метилирование ДНК
Наблюдение, что гистоновые модификации по своей природе комбинаторны, также приводит к вопросу об их функциональной связи с метилированием ДНК. Взаимодействие белка MeCP2 с HDAC и корепрессором транскрипции SIN3A приводит к подавлению транскрипции (Рис. 2) [90, 91]. Selker и его коллеги [92] в эксперименте на модельном объекте — грибке Neurospora crassa, — получили веские доказательства того, что для метилирования ДНК необходимо метилирование гистона H3K9 (осуществляемое KMT под названием DIM5) (Рис. 2). Последующие исследования подтвердили наличие аналогичного механизма у растений [93], в случае которых метилирование ДНК контролируется KMT под названием KRYPTONITE, метилирующей H3K9. При реализации этого механизма репрессии генов H3K9me играет роль сайта присоединения для хромометилазы DNMT, осуществляющей сайленсинг повторяющихся элементов. Формировать связь между метилированием H3K9 и полуметилированной ДНК для стабилизации DNMT1 способны такие мультидоменные факторы, как убиквитин-подобный PHD или UHRF1 (он же Np95) [63]. Возможен и другой способ: каталитически неактивный DNMT3-подобный адаптор избирательно связывается своим ADD-доменом (ATRX, DNMT и DNMT3L) с немодифицированным H3K4, но при наличии на хроматине H3K4me3 образование связи блокируется [94]. Выявлена сложная взаимозависимость между модификациями гистонов и метилированием ДНК при контроле экспрессии генов [95, 96], а также при сайленсинге, опосредованном белками Polycomb [97]. Однако оставалось неясным, существует ли конкретная последовательность ДНК, способная управлять процессом метилирования данного участка ДНК. В выдающемся исследовании 2010 года было показано, что CpG-островки обеспечивают сродство к транскрипционным факторам, таким как CFP1 (CXXC-type zinc finger protein 1), которые привлекают активирующие KMT и предотвращают метилирование ДНК (Рис. 2) [98, 99] . Таким образом, ДНК, богатая CpG-сайтами, может воздействовать на активный хроматин и защищать его от метилирования de novo даже при отсутствии активной транскрипции. Также различия между низким, средним и высоким уровнями метилирования CpG-сайтов ДНК способны объяснить, могут ли различные транскрипционные факторы получить доступ к своим специфичным сайтам связывания [100].
Некодирующие РНК и транскрипционный сайленсинг гена
Несмотря на значительный прогресс, достигнутый в выявлении модификаций ДНК и гистонов, мало что было известно о способе присоединения этих меток к определенным местам в геноме. Частично эту проблему решило открытие малых РНК и предположение об их возможной роли «матриц» в эпигенетическом механизме. В 2002 году 4 исследовательских группы, используя модели на делящихся дрожжах (Grewal [101] и Martienssen [102]) или T. thermophila (Allis [103] и Gorovsky [104]), показали, что малые РНК взаимодействуют с процессами модификации хроматина в определенных локусах-мишенях генома и, предположительно, управляют ими (Рис. 2). Обычно двухцепочечные РНК (дцРНК) ингибируют экспрессию генов, подавляя трансляцию матричной РНК в цитоплазме — этот процесс называется РНК-опосредованной интерференцией (RNAi) или посттранскрипционным сайленсингом гена (post-transcriptional gene silencing, PTGS). Однако вышеупомянутые малые РНК осуществляют процесс, называемый «транскрипционным сайленсингом гена» (transcriptional gene silencing, TGS) (Рис. 3), что происходит не только за счет управления сборкой гетерохроматина и сайленсинга генов у S. pombe [105], но и с помощью контроля элиминации ДНК у T. thermophila [106]. В обеих моделях было показано, что малые РНК взаимодействуют с ранее открытыми компонентами ферментативного аппарата метилирования остатков лизина в составе гистонов, и это привело к интересному предположению о том, что эти системы развились для защиты генома от вредоносных ДНК или вирусов, которые могут его разрушить, если не подвергнуть их сайленсингу. В качестве следствия этой модели повсеместно считается, что некодирующие РНК (нкРНК) выступают в роли полногеномного «надзорного» механизма, контролируя качество РНК [107].
Хотя остаются вопросы о порядке различных этапов в данных сигнальных путях, результаты исследований подчеркивают, что ДНК, РНК и гистоновые белки, как и их модификации, действуют совместно для формирования конкретных состояний хроматина, важных для поддержания функций генома. TGS представляет собой механизм РНК-управляемой гетерохроматинизации, основанный на комплементарности последовательностей и заключающийся в том, что РНК отправляет сигналы к ДНК и стабилизирует неактивное состояние хроматина, которое может наследоваться в ходе многочисленных циклов деления клетки.
Ремоделирование нуклеосом и гистоновые варианты
Другим важным механизмом, способствующим изменению контактов между ДНК и гистонами, являются АТФ-зависимые комплексы ремоделирования хроматина, которые обеспечивают доступность ДНК и обмен новых гистонов и транскрипционных факторов внутри и вне хроматина. С 1992 по 1998 год в качественных генетических и биохимических исследованиях были обнаружены факторы SWI/SNF [108–110], NURF (фактор ремоделирования нуклеосом) [111] и другие АТФ-зависимые комплексы ремоделирования нуклеосом [112–114]. Также были получены базовые представления о механизме действия этих комплексов, и эта область эпигенетики сегодня активно исследуется [34, 115]. Стимулом для дальнейших исследований послужило выявление часто встречающихся мутаций в компонентах комплекса ремоделирования BAF (BRG1-ассоциированный фактор) при раке у человека [116].
Отличный пример работы этих комплексов ремоделирования можно увидеть, если обратить внимание на недооцененный компонент хроматина — варианты гистонов. Раньше считалось, что варианты гистонов, которые лишь на несколько аминокислот отличаются от основных канонических взаимозаменяемых гистонов, встречаются слишком редко, а отличия в их аминокислотной последовательности крайне малы и не приводят к функциональным изменениям [117]. На культуре клеток различных тканей D. melanogaster показано, что H3.3 — вариант гистона H3, — обнаруживается в хроматине независимо от репликации ДНК и преимущественно отмечает активно транскрибируемые участки (Рис. 2) [118]. Вскоре после этого с помощью биохимических подходов был обнаружен H3.3-селективный шаперон (HIRA) [119], который отличался от основных факторов сборки хроматина H3 (фактор CAF1 — chromatin assembly factor 1, — для вариантов H3.1 и H3.2) [120], функционирующих во время S-фазы клеточного цикла. Кроме того, быстрая замена гистоновых вариантов как внутри, так и вне хроматина, осуществляемая специализированными механизмами, избирательно распознающими гистоновые варианты [121], послужила аргументом в пользу мнения о том, что гистоновые варианты обеспечивают основные механизмы включения стратегически важных вариаций в нить хроматина (Рис. 2) [115]. Даже для центромерного хроматина имеется собственный специализированный вариант H3 (у млекопитающих известный как центромерный протеин А (CENP-A)); накапливаются доказательства того, что CENP-A маркирует эпигенетически идентичные центромеры [117]. Внимание уделяется и другим гистоновым вариантам, помимо H3: например, H2A.X в фосфорилированном состоянии маркирует двуцепочечные разрывы ДНК в хроматине; H2A.Z присутствует преимущественно в сайтах старта транскрипции и его уровень обратно коррелирует с уровнем 5mC; а для macroH2A, крупной изоформы H2A показано преобладание на неактивной X-хромосоме (Рис. 3) [117]. Очевидно, что мозаика хроматин-опосредованной эпигенетической регуляции состоит из многих фрагментов, но существование гистоновых вариантов демонстрирует, что даже крохотные кусочки этой мозаики являются весьма важными.

DNA-me — метилирование ДНК; DNMT — ДНК (5-цитозин)-метилтрансфераза; H3K4me3 — триметилированный лизин 4 гистона H3; HAT — гистоновая ацетилтрансфераза; HP1 — гетерохроматиновый белок 1; — гистоновая лизин-метилтрансфераза; днРНК – длинные некодирующие РНК; RNAi — РНК-опосредованная интерференция; TF — транскрипционные факторы; TGS — транскрипционный сайленсинг гена.
Все хроматиновые метки обратимы
«Стирающие» ферменты были обнаружены только для процессов ацетилирования (деацетилазы) и фосфорилирования (фосфатазы), двух основных обратимых гистоновых модификаций Их обратимость обеспечивает динамичный транскрипционный ответ на постоянно изменяющиеся потребности клетки. Для метилирования гистонов «стирающие» ферменты, напротив, установлены не были и эта гистоновая метка считалась «постоянной», по крайней мере, одной из ферментативно необратимых. Отсюда возникла привлекательная идея: если бы метильные метки на гистонах были абсолютно стабильными, то потенциально они могли бы наследоваться. Однако в 2004 году Shi с коллегами [122] опровергли эту идею, выявив и описав первую гистоновую лизин-деметилазу (KDM) под названием LSD1 (лизин-специфическая деметилаза 1) — гомолог ядерной ФАД-зависимой аминооксидазы (Рис. 2). Но все же, неспособность LSD1 деметилировать триметилированные гистоны оставляла интригующую возможность того, что постоянной эпигенетической меткой является триметилирование лизинов.
Тем не менее, некоторое время спустя, Zhang с соавт. [124] опровергли и это мнение, описав второй класс лизиновых деметилаз, Fe(II)- и альфа-кетоглутарат-зависимых диоксигеназ с каталитическими модулями, известными как домен Jumonji (Рис. 2). Этот класс ферментов обладает способностью удалять триметил-лизиновые метки с гистонов [124–126], что в очередной раз доказывает обратимость всех типов эпигенетических меток. Как и другие стирающие ферменты, KDM проявляют значительную субстратную и сайт-специфичность. Исследования KDM способствовали активному изучению и значительному расширению списка эпигенетических регуляторов, обладающих важными каталитическими и регуляторными функциями. Исторически в отношении фундаментальных трудов по обратимости метилирования ДНК наблюдалась значительная путаница, в частности, касательно удаления 5mC.
Специалисты по биологии развития издавна описывали волны полногеномного деметилирования ДНК, наблюдаемые в зародышевой линии и на ранних стадиях эмбриогенеза [127]; тем не менее, механизм, посредством которого происходит деметилирование ДНК оставался невыясненным, что побудило ученых провести исследования, в которых изучались и сравнивались пассивные (удаление метильных групп в ходе репликации ДНК) и активные (ферментативные) процессы деметилирования. Важнейшим кусочком мозаики стало открытие 5-гидроксиметилцитозина (5hmC, рис. 2) [128, 129]. В исследованиях, которые провели Rao [129] и Zhang [130], было обнаружено новое семейство ферментов под названием TET1–3 (ten-eleven translocation 1–3, рис. 2), обладающих способностью превращать 5mC в 5hmC в окислительно-восстановительной реакции с образованием промежуточных продуктов (5-формилцитозина (5fC) и 5-карбоксилцитозина (5caC)). Затем может последовать ферментативное отщепление этих модифицированных оснований ДНК-гликозилазами, что приводит к образованию полностью деметилированной матричной ДНК [131]. Как и в случае метилирования гистонов, доказано, что в метилирование ДНК вовлечено множество записывающих, считывающих и стирающих белков. Очевидно, что этот «язык» ковалентных модификаций ДНК [62] во много раз сложнее, чем в случае гистонов.
Бивалентный хроматин и характеристики эпигенома
К 2005 году гистоновые метки, такие как ацетилирование, фосфорилирование и метилирование, были выделены в группу хорошо изученных гистоновых модификаций. С помощью таких чувствительных подходов, как масс-спектрометрия, продолжилось выявление поразительного числа гистоновых модификаций, хотя многие из них — если не большинство, — встречались гораздо реже, чем вышеперечисленные основные метки [132]. Соответственно, продолжались разработка антител, селективных в отношении конкретных модификаций, и применение их для изучения конкретных «избранных» генов методом ChIP. Некоторые дальновидные лаборатории начали применять иной, потенциально более мощный подход: первые вариации полногеномного ChIP-анализа для более глубокого анализа эпигенетических ландшафтов в норме и патологии. Ранние версии этих методик оказались как информативными, так и наглядными. Так, при сравнении распределения H3K4me2 (метка «вкл») и H3K9me2 (метка «выкл»), между этими метками была показана явная отрицательная корреляция на протяжении крупных хромосомных регионов [133, 134]. Проведение подобного исследования на эмбриональных стволовых клетках (ЭСК) с использованием ChIP-seq оказалось особенно информативным, в частности, из-за способности ЭСК к управляемой дифференцировке в определенном направлении [135, 136]. Вскоре были установлены четко прослеживающиеся закономерности расположения гистоновых меток. Например, метка H3K4me3 оказалась связана с активными элементами промотора, в то время как H3K27me3 встречалась преимущественно в области хроматина, который в процессе развития подавляется (Рис. 2, 3) [137]. Началось выявление «инструктирующих» характеристик эпигенома, что вызвало интерес к полногеномным подходам, сохраняющийся и по сей день
Однако в 2006 году выяснилось, что эта незатейливая бинарная логика «вкл/выкл» оказалась слишком простой для описания гистоновых меток. Неожиданно в крупных исследованиях ЭСК, которые провели Lander [138] и Fisher [139], были обнаружены классы генов, «сохраняющие равновесие» в ходе развития и несущие как активирующие, так и подавляющие метки. Такой паттерн с перекрывающимися регионами H3K4me3 и H3K27me3 получил название «бивалентный хроматин» (Рис. 2, 3) [138]. Открытие бивалентности равновесных генов оказалось неожиданным и важным — оно впервые указало на «промежуточное»» состояние, в случае которого бивалентно меченые гены способны в процессе развития переходить в активное или молчащее состояние. Бивалентный хроматин не специфичен для ЭСК; он обнаружен и в клетках других типов [140,141].
Важным вопросом остается то, каким образом обеспечивается поддержание и упорядоченность бивалентного хроматина на уровне нуклеосом. Находятся ли разнонаправленные метки H3K4me3 и H3K27me3 на одном и том же хвосте гистона H3, на отдельных хвостах H3 в пределах одной нуклеосомы, или же на соседних нуклеосомах? Первоклассные исследования, которые провел Reinberg [142], показали, что метки H3K4me3 и H3K27me3 не располагаются на одном хвосте H3, и это приводит к их асимметричному распределению внутри нуклеосомы (Рис. 2). Такое расположение меток влияет на образование и наследование бивалентных доменов.
Вполне ожидаемо, что такая сложность служит, в частности, для точной маркировки других цис-регуляторных геномных элементов в хроматине. Например, такие эпигенетические метки, как H3K4me1 и H3K27ac часто указывают на «активные» энхансеры, специфичные для конкретного типа клеток [143]. Таким образом, при профилировании на уровне генома были установлены воспроизводимые паттерны гистоновых модификаций, которые позволили делать прогнозы относительно функциональности тех или иных генетических элементов (что относится к эпигеномному профилированию). Изменения хроматина (группа модификаций коровых гистонов и метилирование ДНК) были совместно картированы относительно нуклеосом и сайтов связывания транскрипционных факторов и сопоставлены с РНК, считывающейся с генома (Рис. 3).
«Инструктирующие» паттерны гистоновых модификаций — такие как H3K4me1 и H3K27ac в энхансерных регионах, H3K4me3 в промоторных регионах, H3K36me3 в регионах, подвергающихся транскрипции, H3K27me3 в регионах, считывание которых подавляется белками Polycomb, и H3K9me3 в гетерохроматиновых регионах (Рис. 3), — применялись в исследованиях NIH Roadmap Epigenomics Consortium и IHEC для профилирования референсных эпигеномов и сравнения эпигенетических характеристик клеток в норме и при патологии (Рис. 2). Сегодня новые технологические достижения позволяют с большей точностью проанализировать эпигеномы единичных клеток и по-новому взглянуть на процесс дифференцировки клеток [145, 146]. Определение транскриптомов единичных клеток расширило имевшиеся ранее данные, установив, что почти весь геном подвергается транскрипции. При этом образуется значительное число нкРНК, которые выполняют определенные регуляторные функции [147], вероятно, оказывающие важное воздействие на формирование эпигенетических ландшафтов различными путями, которые в настоящее время активно изучаются.
Развитие организма и заболевания
Благодаря множеству вышеперечисленных передовых открытий и концептуальных достижений были сформулированы молекулярные признаки эпигенетического контроля, важные для поддержания идентичности клеток одного типа и процесса клеточного репрограммирования (Рис. 4). Еще более важно, что эти признаки отвечают на изменения организма во время развития и окружающей среды и потенциально обратимы при помощи химического ингибирования хроматин-модифицирующих ферментов и модификации считывающих белков (Рис. 4). Многие другие аспекты эпигенетического ответа — например, на изменение метаболизма (при изменении питания), циркадные ритмы, старение или в случае расхождения фенотипов при одном и том же шаблоне генома (например, при импринтинге или у близнецов), — недавно рассматривались в обобщающем обзоре [3] и выходят за рамки данной статьи. В этой же статье авторы сосредоточились на роли молекулярных особенностей эпигенетического контроля развития (например, репрограммирования) и некоторых патологических состояний человека, отвечающих на эпигенетическую терапию, таких как онкологические заболевания, воспаление и иммунный ответ (Рис. 4).
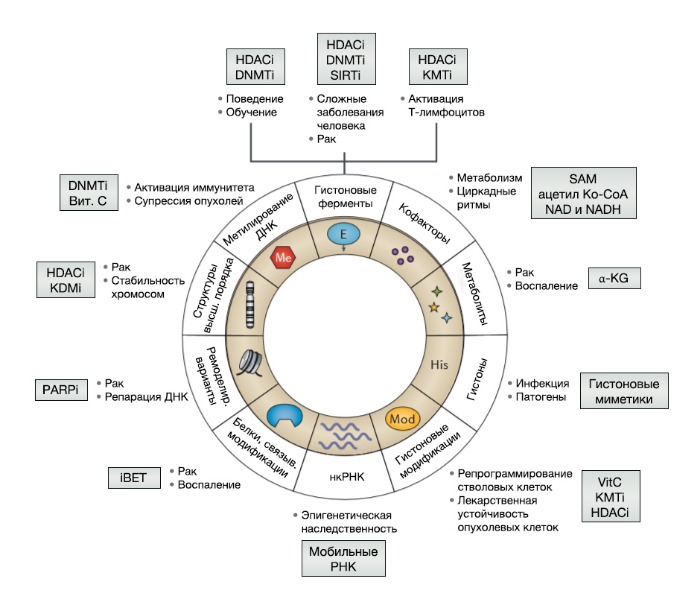
iBET — ингибиторы белков семейства BET; KDMi — ингибиторы гистоновой лизин-деметилазы; KDMi — ингибиторы гистоновой лизин-метилтрансферазы; нкРНК — некодирующие РНК; PARPi — ингибиторы поли(АДФ-рибозо)полимеразы; SAM — S‑аденозилметионин; SIRTi — ингибиторы сиртуина; Вит. C, витамин С. Адаптировано с разрешения [158].
Эпигенетический барьер для репрограммирования
Эпигенетический контроль крайне важен для поддержания идентичности клеток одного типа и процесса клеточного репрограммирования. Первые эксперименты, которые провел Weintraub с коллегами [148] показали, что цис-действующий фактор MyoD, крайне важный для миогенной дифференцировки, способен репрограммировать фибробласты. Через двадцать лет эти наблюдения вновь заставили о себе говорить, когда Yamanaka с коллегами [149] «перевели часы назад», почерпнув основные представления о механизмах репрограммирования из классических экспериментов по репрограммированию ядер, которые провели Gurdon, Briggs и другие (Рис. 2) [150]. Прорывное исследование по репрограммированию показало, что одновременное воздействие нескольких определенных транскрипционных факторов (в настоящее время известных как «Yamanaka factors» («факторы Яманаки»)) при экспрессии в дифференцированных и зрелых соматических фибробластах индуцирует плюрипотентность и приводит к образованию индуцированных плюрипотентных стволовых клеток (иПСК).
Рак и эпигенетическая терапия
Большинство из вышеупомянутых передовых открытий проводились не из-за необходимости установить взаимосвязи между заболеваниями. Так, исследования в области онкологии были традиционно сосредоточены на генетических нарушениях (таких как мутации, генные перестройки и вариации числа копий), лежащих в основе опухолеобразования и ведущих к приобретению опухолью ключевых признаков [158]. На раннем этапе исследований было установлено потенциальное клиническое значение аномальных эпигенетических характеристик (например, метилирования ДНК) при раке, что послужило значительным стимулом для разработки эпигенетической терапии [16, 48, 159]. Химические ингибиторы метилирования ДНК (DNMTi) в исследовании Jones и Baylin реактивировали подвергшиеся аберрантному сайленсингу гены-супрессоры опухолевого роста [159]. В клинических исследованиях противоопухолевый эффект показали HDACi, такие как трихостатин А (TSA) и трапоксин, разработанные Yoshida [47], и вориностат (субероиланилид гидроксамовой кислоты, SAHA), который открыл Marks [160], что подготовило почву для этой многообещающей области эпигенетики (Рис. 4) [161].
В 2006 году в продаже появились первые из одобренных FDA эпигенетических противоопухолевых препаратов — децитабин и вориностат (Рис. 2). Многообещающий клинический потенциал эпигенетического воздействия стал одним из наиболее убедительных аргументов в пользу важности изучения эпигенетики. Стала активно развиваться индустрия биотехнологических компаний, сосредоточенных на эпигенетических исследованиях и поиске соответствующих препаратов. Даже крупные фармацевтические компании прониклись идеей о том, что эпигенетические нарушения, в отличие от генетических изменений, обратимы. Уроки, извлеченные из результатов терапии DNMTi и/или HDACi, стали веским аргументом в пользу того, что другие классы записывающих или стирающих ферментов также могут выступать в качестве перспективных мишеней для таргетных препаратов (Рис. 4) [162, 163]. Более того, опухолевые клетки с лекарственной устойчивостью отвечают на терапию HDACi с одновременным подавлением KDM, что нарушает механизмы выживания и индуцирует более серьезные повреждения ДНК (Рис. 4) [164].
Общее представление о том, что хроматин раковых клеток более хрупок, чем хроматин нормальных, и обладает более высоким уровнем «эпигенетического шума» [165] могло бы объяснить, почему раковые клетки более восприимчивы к лечению эпигенетическими ингибиторами в сочетании, например, с лучевой терапией [166]. Несмотря на то, что в литературе стремительно накапливаются данные о многочисленных связях между эпигенетикой и другими, неонкологическими заболеваниями (Рис. 4) [167], злокачественные опухоли по-прежнему лучше других заболеваний отвечают на эпигенетическую терапию [159, 168]. В 2012 году некоторые типы рака даже были связаны с «драйверными» мутациями в гистонах, получивших название «онкогистоны» (Вставка 1; Рис. 2).
И записывающие, и стирающие гистон-модифицирующие ферменты оказались привлекательными лекарственными мишенями в онкологии. Работы исследовательских групп под руководством таких исследователей, как Bradner [169], Tarakhovskly [170] и Kouzarides [171] добавили к списку новых эпигенетических мишеней и направлений терапии считывающие ферменты. В этих исследованиях было показано, что бромодомен-содержащие белки, такие как члены семейства BET (Рис. 2), поддаются воздействию малых молекул (например, ингибиторов JQ1 или iBET), которые связываются с ацетил-лизин-связывающим карманом, нарушая взаимодействие между ферментами и гистонами. Одновременное применение вышеуказанных препаратов и низкомолекулярных ингибиторов HAT и HDAC влияет на транскрипцию генов-мишеней. Так, мишенью малых молекул является BRD4 — один из наиболее изученных бромодомен-содержащих белков, компонент пути элонгации транскрипции. В онкогематологических процессах вышеуказанный путь крайне важен для экспрессии онкогенов, ускоряющих развитие опухоли (MYC), и провоспалительных генов (NFKB) (Рис. 4). На сегодняшний день другие хроматин-считывающие белки также являются предметом значительного исследовательского интереса, но явное преимущество отдается ингибиторам бромодоменов [172, 173].
Иммунная защита
Хроматин-опосредованная регуляция экспрессии генов особенно часто наблюдается в иммунной системе в ходе специализации клеточных линий, ответа на сигналы извне и индукции клеточной памяти [174]. Клетки гемопоэтических линий отвечают на сигналинг изменениями хроматина, которые регулируют активность генов [175, 176] и могут приводить к «запоминанию» активированного состояния, что было недавно продемонстрировано на макрофагах [177]. Провоспалительные сигналы (например, при обнаружении липополисахаридов) приводят к активации транскрипции провоспалительных генов (например, NFKB). РНК-полимераза II (Pol II) при этом связывается с ними заранее для обеспечения быстрого ответа [178]. РНК-полимераза II не способна к самостоятельной элонгации цепи и, в случае многих генов, требует присутствия комплекса элонгации PCAF-HAT [179]. Считается, что избирательный ответ NFKB на iBET подавляет воспаление, нарушая взаимодействие PCAF с провоспалительными генами [170].
Эпигенетический контроль также важен для активации иммунных клеток. С помощью эпигенетических препаратов возможно фармакологическое усиление иммунного ответа. Неожиданное открытие способности КМТ EZH2 управлять активацией Т-лимфоцитов путем метилирования актина цитоплазмы [180] предоставило яркий пример того, что многие гистон-модифицирующие ферменты имеют негистоновые субстраты. Кроме того, HDACi могут продлевать активацию Т-клеток, предотвращая их индуцированную активацией гибель (Рис. 4) [181]. Фармакологическое ингибирование KMT G9a и устранение репрессии генов приводят к активации транскрипции генов интерферонов и повышенной устойчивости к патогенам (Рис. 4) [182]. DNMTi влияют не только на гены-супрессоры опухолей, но и на повторяющиеся элементы, реагирующие на снижение уровня метилирования ДНК. Лечение некоторых типов рака малыми дозами DNMTi активирует эндогенные ретровирусы, что приводит к опосредованному дцРНК иммунному ответу, мишенью которого затем становятся опухолевые клетки (Рис. 4) [183, 184]. Нарушение иммунной толерантности и усиление иммунного ответа — два основных механизма борьбы с опухолевыми клетками. Roeder с коллегами при изучении ацетилирования опухолевого супрессора р53 впервые показали, что мишенями гистон-модифицирующих ферментов могут выступать множество ядерных и цитоплазматических белков [185–187]. Этому необходимо уделять пристальное внимание при анализе, изучении и использовании низкомолекулярных ингибиторов гистон-модифицирующих ферментов. В частности, при эпигенетической терапии следует тщательно поддерживать баланс — атаковать клетки опухоли, не ослабляя защищающие организм иммунные клетки.
Эпигенетический контроль, в том числе посттрансляционные модификации негистоновых белков, дополнительно расширяет спектр функционального влияния хроматина. Например, отдельные кассеты модификаций в гистонах [87], в частности, типа ARKS/T, также обнаружены в нескольких негистоновых белках и позволяют осуществлять их посттрансляционную модификацию и распознавание считывающими белками. Согласно имеющимся сообщениям, короткие имитаторы гистонов необходимы для запуска активности KMT G9a посредством ее аутометилирования; это привело к появлению общей концепции «мимикрии» под гистоны [188]. Неструктурный белок 1 (NS1) вируса гриппа содержит аминокислотную последовательность, которая очень похожа на N-концевую область гистона H3 и может сигнализировать о его метилировании по аналогии с H3K4. Такое метилирование NS1 «отвлекает» PCAF и ослабляет транскрипцию противовирусных генов [189]. Таким образом, мимикрия белков под гистоны используется патогенными организмами для подавления клеточной защиты (Рис. 4). Эти данные стали основанием для предположения о том, что некоторые имитаторы гистоновых пептидов могут использоваться для разработки новых эпигенетических лекарственных средств.
Основной вопрос в активном обсуждении эпигенетических исследований заключался в том, являются ли гистоны и их модификации истинными носителями эпигенетической информации. В отличие от метилирования ДНК или других модификаций нуклеиновых кислот, механизмы наследования гистонов оставались неизученными, отчасти из-за давних споров о том, как происходит сегрегация гистонов (старых и новых) в области репликативной вилки [190]. Первые намеки на то, что измененные состояния хроматина могут оказаться наследуемыми, получили Grewal и Klar в работах на S. pombe [191] и Paro с соавт. в исследованиях D. melanogaster [192]. Не так давно исследовательские группы Moazed [193] и Allshire [194] показали, что H3K9 может временно метилироваться и наследоваться многими поколениями клеток даже при отсутствии цис-действующих факторов транскрипции или направляющих их последовательностей ДНК (Рис. 2). Важно отметить, что такое наследование хроматина возможно лишь при истощении противодействующих факторов, которые препятствуют метилированию H3K9. Результаты исследований Strome с соавт. [195] позволили обнаружить наследование H3K27me3-модификации хроматина, опосредованное PRC2 (комплексом 2 репрессии Polycomb), у Caenorhabditis elegans. Эти исследования демонстрируют, что, по крайней мере, у этих модельных организмов гистоновые белки могут передавать информацию по наследству, хотя точные молекулярные детали этого процесса продолжают активно изучаться. Reinberg, Gamblin и их коллеги [196] показали, что наследование подавляющих гистоновых меток H3K27me3 обусловлено положительной аллостерической регуляцией комплекса КМТ PRC2 через его некаталитическую субъединицу EED (Рис. 2). Эти исследования и новые работы по структуре PRC2 [197] обеспечивают биохимические доказательства существования в хроматине системы упреждающих сигналов, которая вполне может способствовать наследованию модификаций гистонов.
Можно ли полученные результаты перенести на наследование эпигенетических факторов в нескольких поколениях, то есть, на распространенный феномен, получивший название трансгенерационной наследственности? Действительно, новые исследования, проведенные на дрозофилах и мышах, говорят о том, что изменения в питании (в частности, питании отца) и других факторах окружающей среды, способны репрограммировать метаболизм потомства так, что он наследуется дальнейшими поколениями, например, приводя к ожирению потомства [198, 199]. Как и при экспериментах на S. pombe, считается, что в подобное репрограммирование вовлечены изменения метилирования гистонов. Поскольку гистоновые метки могут влиять на ферментные системы, ответственные за метилирование ДНК de novo, а также на экспрессию нкРНК, другие, более распространенные механизмы, в основе которых лежит изменение матрицы нуклеиновых кислот, скорее всего, также входят в общее уравнение эпигенетической наследуемости. Показано, что в растениях «главный компонент эпигенетического контроля» — мобильные РНК, — являются носителями эпигенетической информации [200], а цепочки малых РНК применялись для репрограммирования оплодотворенных ооцитов мыши [201]. Фрагменты нкРНК и тРНК в последнее время были обнаружены даже в сперматозоидах [202–204], и это указывает на то, что наследоваться может не только последовательность ДНК (Рис. 4).
Прогноз
За последние 20 лет был достигнут неожиданный прогресс в выявлении молекулярных механизмов эпигенетического контроля, что значительно повлияло на понимание нормального развития и способов лечения заболеваний человека. В данной статье авторы выступают за доработку определения эпигеномных характеристик согласно последним достижениям методов анализа единичных клеток [146, 205], но подчеркивают необходимость различать причины и следствия эпигеномных изменений. В связи с этим авторы ожидают дальнейшего применения технологии редактирования генома CRISPR-Cas9 для обеспечения более полного анализа генетического и эпигенетического контроля. Динамику хроматина больше нельзя рассматривать как одно- или двумерную проблему, так как уже хорошо описаны взаимодействия в трехмерном пространстве, приводящие к возникновению топологически ассоциированных доменов (ТАД) и других хроматиновых структур, которые упорядочивают и организуют геном, а также новые подходы к их определению (Рис. 3) [206–208]. Кроме того, важность нкРНК для многих аспектов эпигенетического контроля выходит далеко за рамки TGS, опосредованного РНК-интерференцией и микроРНК-зависимого PTGS. Выявляется все больше хроматин-ассоциированных РНК (например, длинные нкРНК, энхансерные РНК и повторяющиеся РНК), которые инициируют переход хроматина в различные состояния и стабилизируют их, даже в случае аллелей с одинаковой последовательностью ДНК. Фактически, РНК можно рассматривать как одну из «главных молекул» эпигенетического контроля и важные функции нкРНК подробно рассмотрены в последних обзорах [147, 209]. Также предполагается, что поисковые исследования в области более сложных заболеваний (например, метаболических и нейродегенеративных заболеваний) и врожденных функций (таких как обучение и память) установят их восприимчивость к комбинированной эпигенетической терапии по мере разработки более точных ингибиторов (например, HDACi, DNMTi, iBET и ингибиторов сиртуина) (Рис. 4). Кроме того, для анализа вклада эпигенетики в поведение и полиморфизм фенотипов у общественных насекомых начинают применять новые экспериментальные системы [210]. В частности, при метаболических нарушениях и адаптациях к изменениям окружающей среды, по-видимому, именно хроматин служит физиологической матрицей, объединяющей входящие трансформирующие сигналы [50, 157, 211]. Учитывая прогресс, достигнутый в период с 1996 по 2016 год, авторы ожидают продолжения открытий, которые позволят установить, как происходит организация адаптаций хроматина и каким образом они раскрывают информацию, хранящуюся в нашем геноме.
