siRNA — часть мира РНК, которая захватила умы ученых

Молекулы малых интерферирующих РНК (миРНК) образуются путем расщепления ряда молекул РНК ферментом Dicer. Самые распространенные источники миРНК это короткие РНК, образующие шпильки (элементы вторичной структуры одноцепочечной РНК, имеющие на своем конце неспаренный участок, напоминающий по форме петлю), но сама природа Dicer позволяет обрабатывать таким образом любые двухцепочечные РНК достаточной длины, например, геномы РНК-вирусов. Готовые миРНК представляют собой двухцепочечные молекулы РНК длиною в 21–23 нуклеотида с двумя добавочными нуклеотидами на 3’-конце, которые состоят из смысловой и антисмысловой цепи. Основным отличием миРНК от другой молекулы, которая принимает участие в РНК-интерференции (РНКи) — микроРНК — является экзогенное происхождение первых. Антисмысловая цепь миРНК может быть интегрирована в мультибелковый комплекс RISC, в составе которого миРНК может связываться с комплементарной матричной РНК (мРНК). Один из основных протеинов RISC — Ago 2 — является нуклеазой. Он дестабилизирует целевую мРНК, которая в дальнейшем разрушается цитоплазматическими нуклеазами. Подобный механизм действия вызывает интерес исследователей, так как позволяет осуществить посттрансляционную инактивацию многочисленных генов. миРНК рассматриваются многими как многофункциональный агент, который может быть применен для лечения генетических, а также вирусных заболеваний. Очень низкие дозы миРНК вызывают значительный по длительности и эффективности посттранскрипционный сайленсинг генов, что связано с высокой стабильностью миРНК, ассоциированных с RISC, а также самой природой РНКи, которая позволяет одному комплексу RISC обрабатывать большое количество целей за малый промежуток времени.
Таблица 1. | Сравнение общих свойств миРНК и микро РНК (Lam et al., 2015)
Естественная роль миРНК в организме млекопитающих
Наиболее изученная функция миРНК в организме — это их роль в иммунной системе. Исследования последних лет демонстрируют роль миРНК в защите клеток от одноцепочечных и двухцепочечных РНК вирусов, геномы которых фермент Dicer сегментирует для образования миРНК. Молекулы одноцепочечной РНК не могут быть непосредственно расщеплены ферментом, это становится возможным лишь на этапе репликации вируса. Полученные молекулы миРНК используются клеткой для разрушения вирусных транскриптов (Pис. 1).
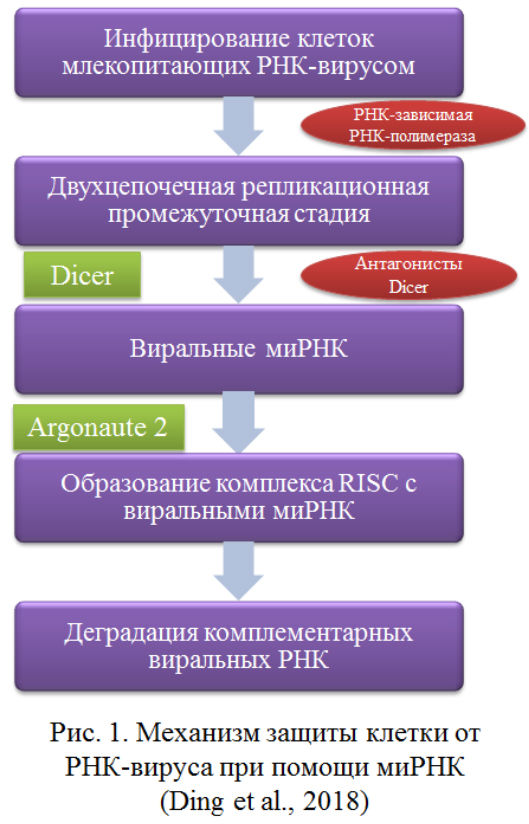
Также известна способность некоторых одноцепочечных вирусов семейств Picornaviridae (к нему относятся полиовирус, вирус Коксаки, эховирус) и Orthomixoviridae (вирусы гриппа) противодействовать этому защитному механизму, избегая действия Dicer при помощи ряда вирусных протеинов, которые связывают двухцепочечные молекулы РНК и таким образом защищают от действия Dicer. Дальнейшие исследования данных механизмов и способов их блокировки могут помочь повысить эффективность противовирусной терапии. Также миРНК наравне с микроРНК могут участвовать в процессе подавления транскрипции, индуцируемого РНК. При этом молекулы РНК также взаимодействуют с представителем семейства белков Argonaute — Ago1, — но образованный комплекс имеет другую функцию. Процесс, осуществляемый данным комплексом, приводит к инактивации генов путем модификации гистонов, ведущей к образованию гетерохроматина (Pис. 2).
Терапевтическое применение миРНК
Важно отметить, что миРНК имеют ряд преимуществ, которые делают их применение привлекательным для медицинских исследований. В первую очередь, это возможность лечить практически любое генетическое заболевание, причиной которого является синтез чрезмерного количества белка или его патологическая функция, приобретенная вследствие мутации. Многие лекарственные вещества, используемые сегодня, могут инактивировать лишь четко очерченный круг белков. Однако миРНК может быть направлена против абсолютно любого белка без ограничений.
Несмотря на это, их медицинское применение все еще не получило широкого распространения. В первую очередь это связано с трудностями доставки молекул миРНК в клетку-мишень. Крупные (~12 кДа) отрицательно заряженные молекулы РНК не могут свободно диффундировать сквозь клеточную мембрану и требуют наличия специального переносчика. Молекулы миРНК также нуждаются в защите от нуклеаз плазмы крови. Для этого исследователи модифицируют нуклеиновые кислоты, а также создают наночастицы особой конфигурации, которые препятствуют расщеплению связанных с ними молекул.
Эндотелий сосудов является непреодолимым препятствием для многих способов доставки миРНК, которые изучаются сегодня, потому исследователи сконцентрировали свое внимание на органы, доставка в которые не требует преодоления этого природного барьера. В первую очередь это органы с фенестрированными сосудами (почки, печень, некоторые опухоли), клетки крови (при внутривенных инъекциях), а также локальное применение веществ (кожа, глаза).
Большую сложность вызывает также высвобождение миРНК из эндосом, в которых они оказываются после того, как рецептор, с которым молекула-переносчик миРНК связывается, подвергается эндоцитозу. Многие существующие системы доставки позволяют внести в клетку достаточное количество миРНК, но молекулы оказываются пойманными в эндосомах и не могут достичь цитоплазмы, где находятся все белки, участвующие в РНКи. Сегодня исследователи рассматривают несколько вариантов решения данного вопроса. Попытки использовать вирусные белки, которые активируются в кислой среде и используются для освобождения вирусов из эндосом, ведут к высокой цитотоксичности. Специально смоделированные белки с транспортной функцией теряют большую часть эффективности в присутствии белков плазмы крови. Многие альтернативные методы также имеют низкий показатель эффективности, потому сегодня поиски оптимального способа доставки продолжаются.
Трудности возникают также с дизайном самих миРНК. Несмотря на высокоточное распознавание цели этими молекулами, некоторые последовательности могут присутствовать и в нецелевой мРНК. Предпринимаются попытки решить проблему нецелевого распознавания путем более тщательного дизайна миРНК с помощью современных методов биоинформатики, а также снижением концентрации действующего вещества до минимальной.
Далее рассмотрим некоторые способы доставки миРНК в клетки и какое применение данным техникам может быть найдено сегодня.
Липиды
Первые опыты, связанные с доставкой миРНК, были осуществлены с использованием липидных наночастиц (ЛНЧ), соединенных с молекулами РНК. ЛНЧ состоят из смеси липидов, связанных с полиэтиленгликолем (ПЕГ), холестерола и нуклеиновых кислот. Они обладают свойством накапливаться в печени, поэтому большая часть лекарств, находящихся сегодня в разработке, направлена на лечение заболеваний этого органа. Также данный способ используется для разработки лекарств с топическим применением. В 2018 году успешно завершилась третья стадия клинических исследований препарата патисиран, созданного для терапии наследственного транстиретинового амилоидоза. В июле 2018 года Европейским агентством лекарственных средств была дана положительная рекомендация касательно выпуска данного препарата на европейский рынок. Таким образом, данный препарат может стать одним из первых на рынке, действующим веществом которого является миРНК.
N-ацетилгалактозамин
Данная молекула является лигандом асиалогликопротеинового рецептора (ASGPR), который активно экспрессируется гепатоцитами. После связывания с рецептором, комплекс подвергается эндоцитозу и попадает в эндосому. Такой способ доставки наиболее подходящий для лечения заболеваний печени. К сожалению, данный метод может иметь побочные эффекты. В 2017 году была приостановлена 3 стадия испытаний препарата RG-101 для лечения гепатита С в связи с потенциальной гепатотоксичностью. Большие надежды связывают с препаратом фитусиран, третья стадия исследований которого начнется в конце 2018 года. Препарат разработан для терапии гемофилии типов А и В. 1 ноября 2018 года стартует третья стадия исследования медикамента гивосиран для лечения порфирии.
Динамические поликонъюгаты
Различные системы доставки миРНК в цитоплазму на основе белков , способных разрушать эндосомы, находятся в разработке. Одним из наиболее перспективных сегодня является мелиттин. Этот пептид был выделен в 1958 году немецкими биохимиками Эрихом Кайзером и Герибертом Михлем из пчелиного яда, в котором он является основным действующим веществом. Данный пептид обладает ярко выраженной цитотоксичностью в связи со способностью разрушать клеточные мембраны. Несмотря на негативные эффекты, которые мелиттин может вызывать, его использование для разрушения мембран эндосом перспективно, так как негативные эффекты (преимущественно гемолитическая активность) можно предотвратить при помощи упаковки мелиттина в специальные наночастицы, которые диссоциируют при низких значениях рН, или рН-зависимом блокировании гидрофобных групп. Данные способы доказали снижение цитотоксичности мелиттина и долгосрочное подавление трансляции генов после трансфекции миРНК. Несколько препаратов на основе данного способа доставки находятся на ранних стадиях клинических исследований.
Побочные эффекты терапии миРНК
Как и любой другой препарат, препараты на основе миРНК имеют свои побочные эффекты. Большая часть белков выполняет более одной функции в клетке, многие из которых все еще неизвестны или до конца не проанализированы. Постранскрипционная инактивация гена приводит к значительному снижению количества целевого белка в клетках-мишенях. Если данный белок был задействован и в других процессах, помимо патологического, то его отсутствие в клетке может иметь отрицательный эффект.
Также были зафиксированы аллергические реакции на компоненты системы доставки миРНК. В 2014 были опубликованы данные о приостановке исследований нового препарата, в составе которого был полиэтиленгликоль, в связи с тяжелыми анафилактическими реакциями, в некоторых случаях использование препарата приводило к фатальному исходу .
Двухцепочечные молекулы миРНК могут ошибочно быть распознаны некоторыми рецепторами врожденной иммунной системы, например, TLR-3, как вирусная РНК и вызывать активацию иммунной системы. Также TLR-7 и TLR-8 могут детектировать богатые урацилом мотивы, которые часто встречаются в вирусной РНК. Активация этих трех рецепторов врожденной иммунной системы сигнализирует об инфицировании организма вирусом и запускает синтез интерферонов. Современные молекулы миРНК подвергаются тщательной проверке на иммуногенность. Свойство миРНК активировать иммунный ответ также помогает добиться положительных результатов при некоторых видах противовирусной терапии.
Терапия миРНК сегодня продолжает динамично развиваться. Широкий спектр потенциальных мишеней данной методики привлекает большой интерес как исследователей , так и инвесторов. Несмотря на то, что большинство заболеваний, которые пытаются лечить при помощи миРНК сегодня являются редкими, фармацевтические компании активно вкладывают средства в развитие таких препаратов, так как их эффект не является постоянным и пациент, получающий такую терапию, будет нуждаться в ней на протяжении всей жизни.
Источники:
- Ding S. W. et al. Antiviral RNA interference in mammals //Current opinion in immunology. – 2018. – Т. 54. – С. 109-114.
- Hou K. K. et al. A role for peptides in overcoming endosomal entrapment in siRNA delivery—a focus on melittin //Biotechnology advances. – 2015. – Т. 33. – №. 6. – С. 931-940.
- Lam J. K. W. et al. siRNA versus miRNA as therapeutics for gene silencing //Molecular Therapy-Nucleic Acids. – 2015. – Т. 4.
- Moazed D. et al. Studies on the mechanism of RNAi-dependent heterochromatin assembly //Cold Spring Harbor symposia on quantitative biology. – Cold Spring Harbor Laboratory Press, 2006. – Т. 71. – С. 461-471.
- Wittrup A., Lieberman J. Knocking down disease: a progress report on siRNA therapeutics //Nature Reviews Genetics. – 2015. – Т. 16. – №. 9. – С. 543.
- https://www.nejm.org/doi/full/10.1056/NEJMoa1716153
- http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/004699/smops/Positive/human_smop_001335.jsp&mid=WC0b01ac058001d127
- https://hemophilianewstoday.com/2018/01/12/hemophilia-clinical-program-fitusiran-among-2018-goals-alnylam-pharmaceuticals-announces/
- https://clinicaltrials.gov/ct2/show/NCT03338816
- http://clinicaltrials.pharmaceutical-business-review.com/news/regulus-to-terminate-development-of-hcv-candidate-rg-101-130617-5841251
