Контрольные точки и их ингибиторы

Иммунотерапия онкологических заболеваний сегодня быстро развивается и становится эффективным инструментом для борьбы с различными формами рака. В последние годы появилось много информации о том, что иммунологические эффекторные клетки могут быть блокированы различными ингибиторами, называемыми «иммунными контрольными точками». В норме контрольные точки служат для предотвращения аутоиммунного повреждения тканей. Опухолевые клетки приспособились использовать эти ингибиторы, чтобы уйти от иммунного контроля и элиминации. На основе этих данных были получены лекарственные средства, способные ингибировать контрольные точки, тем самым создавая возможность собственному иммунитету уничтожать опухолевые клетки. Эти вещества получили название «ингибиторы контрольных точек» (ИКТ). В клинических испытаниях использовались три вида ИКТ. Это человеческие моноклональные антитела, нацеленные на цитотоксический Т-лимфоцитарный антиген 4 (CTLA4), белок запрограммированной смерти клеток 1 (PD-1), или его лиганд 1 (PD-L1). Эти препараты можно отнести к группе таргетных препаратов, поскольку они прицельно связываются с конкретными молекулами-мишенями. Клинический эффект применения наблюдался при меланоме, почечно-клеточной карциноме, немелкоклеточном раке легкого и других опухолевых заболеваниях.
CTLA4 (CD152) экспрессируется в основном CD4+ и CD8+ Т-клетками и является одним из нескольких коингибирующих белков, участвующих в модификации ответа Т-лимфоцитов на активацию антигеном. Основная функция CTLA4 — это изменение реакции Т-клеток на стимулы. CTLA4 регулирует всплеск клонирования Т-лимфоцитов во время прайминга и вторичную экспансию Т-клеток, которые пропорциональны степени активации комплекса TCR-MHC, как с точки зрения аффинности связывания, так и с точки зрения костимуляции дополнительными сигналами. CTLA4 представляет собой ингибирующий белок, обнаруженный на Т-клетках, гомологом которого является CD28. CD28 является костимулирующим сигналом, но CTLA4 обладает более высокой авидностью для своих лигандов, чем CD28, что говорит о преобладании сигналов ингибирования при активации иммунного ответа. Лигандами для CD28 и CTLA4 являются белки B7, которые экспрессируются антигенпрезентирующими клетками (АПК). Белки B7 делят на два вида: B7-1 (CD80) и B7-2 (CD86). Для активации начала пролиферации T-клеток нужно, чтобы молекула CD80 или CD86 на поверхности АПК связалась с CD28 на Т-лимфоците, при этом при связывании CTLA-4 и B7 передача сигнала блокируется. Соотношение количества связей CD28:B7 и CTLA-4:B7 дает ответ, начнется ли активация пролиферации T-лимфоцитов или нет.
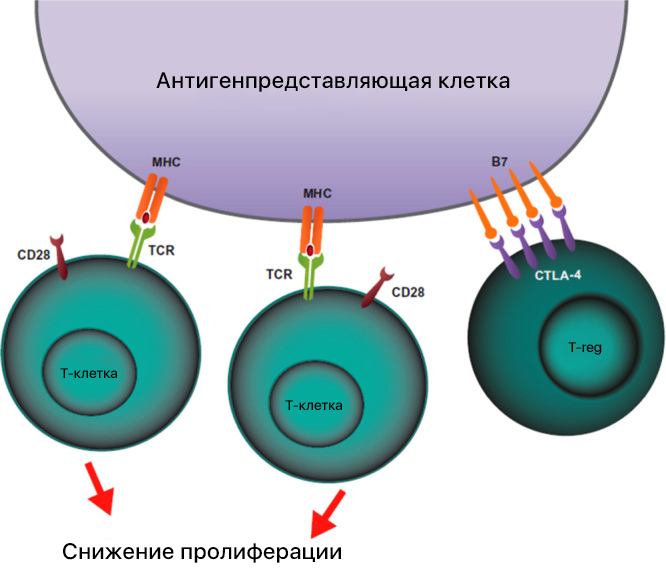
В нормальных условиях Т-клетки экспрессируют CTLA4 на своей поверхности после ответа на антигенную стимуляцию TCR. В теории блокирующее антитело должно ослаблять ингибирующий сигнал, опосредованный CTLA4, что имеет значение в повышении противоопухолевого иммунитета, так как это усиливает взаимодействие B7 с CD28, что и было получено в доклинических моделях.
Но B7 редко обнаруживается в микроокружении опухоли, что приводит к второй гипотезе о том, как антитела против CTLA4 могут усилить иммуноопосредованное уничтожение опухоли. CTLA4 дифференциально экспрессируется среди отдельных подтипов T-лимфоцитов. Действительно, более высокие уровни поверхностной экспрессии CTLA4 наблюдаются в регуляторных Т-клетках (клетках Treg) по сравнению с эффекторными Т-клетками (клетками Teff). Treg уменьшают экспрессию B7.
Помимо того, что B7 непосредственно сигнализирует CTLA4, что вызывает его коингибирующее действие, существует и обратный сигнал от CTLA4 для АПК через B7. CTLA4 обратная сигнализация через B7 может вызвать увеличение экспрессии индоламина-2,3-диоксигеназы (IDO). IDO снижает количество триптофана в микроокружении, что ингибирует активацию и пролиферацию Т-клеток. Наконец, недавно выделены молекулы мРНК, которые кодируют растворимые CTLA4, лишенные трансмембранных доменов. Эти растворимые CTLA4 также могут вызывать снижение иммунитета либо через сигнализацию для B7, как описано выше, либо путем блокирования взаимодействия B7:CD28.
Клинические исследования на основе анти-CTLA4 препаратов (ипилимумаб и тремелимумаб) продолжаются. К сожалению, на терапию отвечают далеко не все пациенты и в настоящее время нет биомаркеров для прогнозирования того, какие пациенты или типы опухолей чаще реагируют на анти-CTLA4-терапию.
По сравнению с ограниченными исследованиями с CTLA4, сразу семь фармацевтических компаний проявили огромный интерес и инвестировали в ИКТ на основе комплекса PD-1:PD-L1. Этот интерес оправдан, так как результаты клинических испытаний подтверждают, что ингибирование PD-1:PD-L1 эффективнее, нежели чем ингибирование пути CTLA4.
PD-1 (CD274) экспрессируется на Т-лимфоцитах при их развитии в тимусе. Также как CTLA4, PD-1 экспрессируется на CD4+ и CD8+ Т-лимфоцитах во время антигенной стимуляции, являясь коингибирующим белком. Кроме того, PD-1 экспрессируется многими другими иммунными клетками, включая NK-лимфоциты, В-клетки, моноциты и дендритные клетки. PD-1 взаимодействует с двумя основными лигандами: PD-L1 (B7-H1) и PD-L2 (B7-DC). PD-L2 имеет более высокое сродство к PD-1, экспрессируется активированными дендритными клетками, макрофагами, некоторыми B-клетками и др. PD-L1 более широко распространен различных тканях.
Взаимодействие PD-1 с лигандом PD-L1 снижает продукцию цитокинов, цитолитическую активность и пролиферацию лимфоцитов. У ВИЧ-инфицированных PD-1 активно экспрессируется и постоянно взаимодействует с PD-L1, экспрессируемым АПК, что приводит к блокировке активации Т-лимфоцитов. В эксперименте с использованием В-лимфоцитов у ВИЧ-инфицированных пациентов отмечался более активный ответ на антигены ВИЧ при применении блокирующих PD-1 антител in vitro. Из этих наблюдений следует, что активный иммунный ответ можно вызвать блокировкой взаимодействия пути PD-1:PD-L1.
В случаях с опухолевыми заболеваниями срабатывает тот же механизм. Опухоли, уклоняющиеся от иммунных клеток, экспрессируют PD-L1 после инфильтрации Т-клетками и экспрессии интерферона-гамма. Экспрессия PD-L1 означает плохой прогноз при многих видах злокачественных опухолей, что подразумевает ведущую роль PD-L1 в защите нормальной ткани от иммунных атак.
Препараты анти-PD-1 (ниволумаб, пембролизумаб, пидилизумаб) показали лучшие результаты по сравнению с анти-CTLA4 препаратами, ответ на лечение наблюдается чаще, но клинические испытания еще продолжаются.
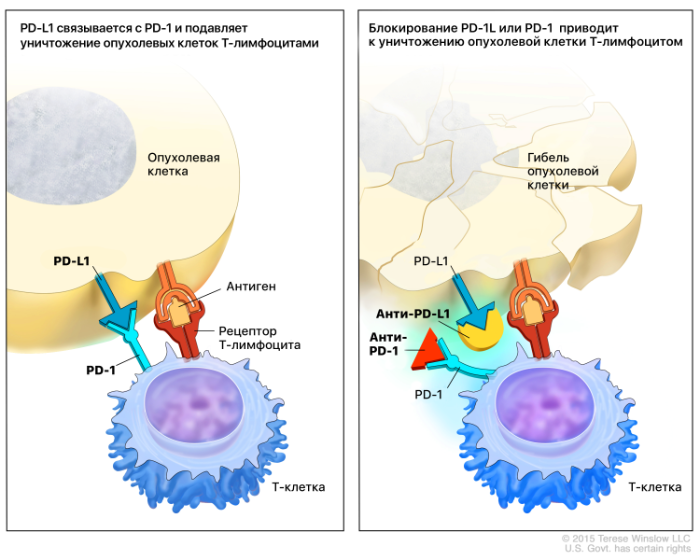
Рисунок 2
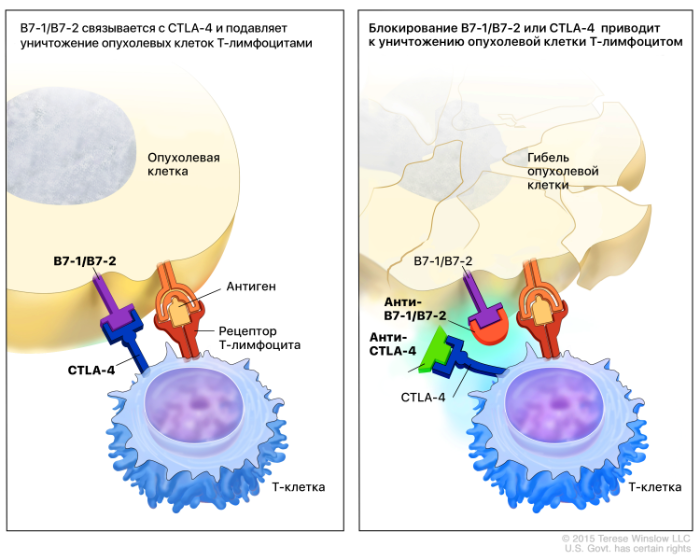
Рисунок 3
Источник: Sharon E. et al. Immune checkpoint inhibitors in clinical trials //Chinese journal of cancer. – 2014. – Т. 33. – №. 9. – С. 434.
