Эстрогены: роль в норме и в патогенезе заболеваний

Эстрогены — это группа стероидных гормонов, которые играют ключевую роль в развитии и функционировании репродуктивной системы, а также оказывают значительное влияние на сердечно-сосудистую, опорно-двигательную, иммунную и нервную системы.
В организме гормон имеет три формы: 17β-эстрадиола (эстроген Е2) и его метаболиты — эстрон (Е1) и эстриол (Е3). Важно заметить, что именно эстрадиол (Е2) обладает наибольшим сродством к основному эстрогеновому рецептору ER-α, другие же являются более слабыми агонистами. Вырабатываются эстрогены в основном яичниками и яичками (хотя и не только), мишенью служат клетки самых разнообразных тканей — молочных желез, мочеточника, яичников, яичек, простаты, костной ткани, а также сердечно-сосудистой, нервной и иммунной систем [1].
Биосинтез эстрогенов
В организме женщины в пременопаузе эстрогены синтезируются из холестерола преимущественно в яичниках, также в большом количестве вырабатывается плацентой. Гораздо меньшее количество эстрогенов образуется в негонадных органах — печени, сердце, коже и мозге.
Как уже было сказано выше, наибольшую биологическую активность проявляет 17β-эстрадиол, или просто эстрадиол, или Е2. Именно он является основным продуктом пути биосинтеза эстрогенов и играет наибольшую роль в пременопаузном периоде.
Цепочка превращений из холестерола в Е2 выглядит следующим образом:
Холестерол → прегненолон → прогестерон → андрогены → эстрадиол
Е1 — эстрон — проявляет себя в основном в постменопаузе, синтезируется в адипоцитах.
Е3 — эстриол, обладает наименьшим эффектом, синтезируется из Е1 (через промежуточные вещества) в плаценте, играет ключевую роль при беременности.
Одним из важнейших ферментов, участвующих в метаболизме эстрогенов, является ароматаза. Она относится к цитохром-p450-суперсемейству и широко распространена в клетках различных тканей. Ферменту не чужда определенная тканеспецифичность, которая достигается альтернативным сплайсингом, специфичными для некоторых тканей промоторами и факторами транскрипции. Функция ароматазы – обеспечить последнюю реакцию превращения предшественника эстрогена в активный 17β-эстрадиол.
Биосинтез эстрогенов сильно отличается у женщин репродуктивного возраста и у женщин в постменопаузе или в дорепродуктивном возрасте; особенно выражены отличия в способе функционирования. Эстрадиол, производимый яичниками женщинами в пременопаузе, выходит в кровоток и оказывает системное действие. В случае, когда гормон синтезируется в негонадных органах, он обычно реализует свое действие местно.
Так, обнаружена высокая активность ароматазы в остеобластах и остеокластах – эстрогены оказывают значительное влияние на морфогенез костной ткани (см. ниже). Также гормон синтезируется в мужских яичках, он крайне необходим для созревания сперматозоида.
Биосинтез эстрадиола в яичниках. На рис. 1 показаны основные стадии метаболизма гормона, который происходит в тека-клетках и гранулезных клетках (как мы помним, фолликул в яичнике содержит ооцит 1-го порядка, его окружают гранулезные клетки, а поверх — тонким слоем тека-клетки).
В растущем фолликуле происходит «содружественный» биосинтез эстрогенов — тека-клетки не могут из андрогенов в итоге получить эстрогены, а гранулезные клетки — не могут из прогестерона синтезировать андрогены. Поэтому происходит определенный обмен промежуточными веществами между клетками.
Данный механизм является тканеспецифичным, его активность зависит от репродуктивного статуса.
Биосинтез эстрадиола в головном мозге. Как ни странно, лучше всего метаболизм эстрогенов изучен в яичниках и мозге. Цепочка, представленная на рис. 1, имеет место в гиппокампе, гипоталамусе, миндалевидном теле, хвостатом ядре, таламусе, мозжечке и даже коре головного мозга.
В этом случае также имеет место тканеспецифичный механизм – нейроны способны продуцировать эстрогены из тестостерона или холестерола, циркулирующих в крови; но к этому абсолютно неспособны клетки микроглии и олигодендроциты [2].
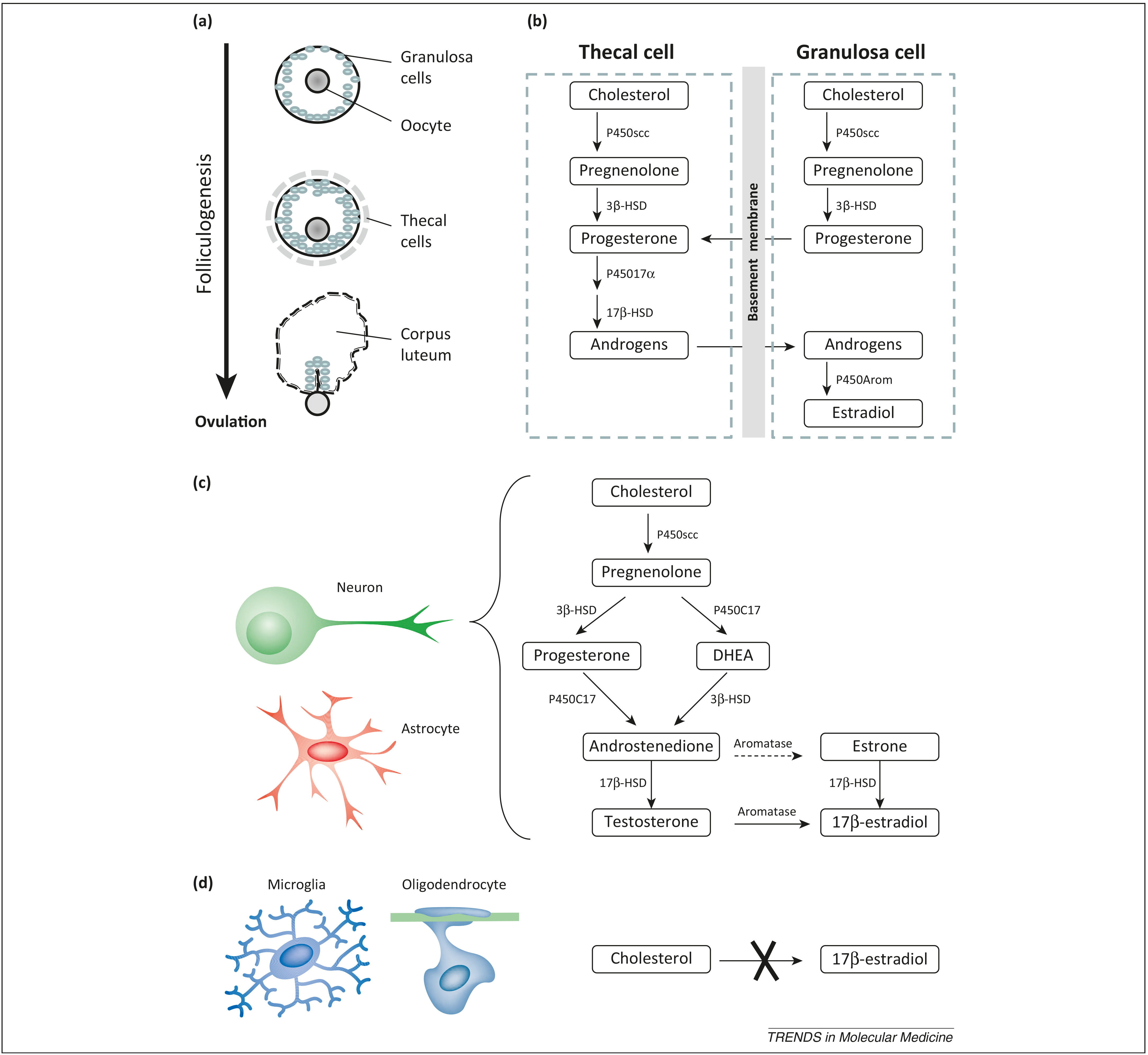
Рис. 1. Биосинтез эстрогенов в яичниках и мозге.
(а) Фолликулогенез. Примордиальный фолликул состоит из ооцита и слоя гранулезных клеток в начале фолликулогенеза. Клетки Тека формируют слой, окружающих гранулезные клетки, когда фолликул активируется. В конце фолликулогенеза клетки Тека становятся частью желтого тела.
(b) Тканеспецифичный синтез эстрогенов в яичнике. Продукция эстрогенов начинается с синтеза прегненолона из холестерола, катализирует реакцию фермент расщепления боковой цепи семейства цитохрома-p450 (p450-scc). Прегненолон далее превращается в прогестерон ферментом 3β-гидроксистероиддегидрогеназа (3β-HSD) в клетках Тека и гранулезных клетках. Прогестерон превращается в андрогены с помощью еще одного фермента семейства p450. И уже из андрогенов фермент ароматаза образует эстрадиол.
(с) Тканеспецифичный биосинтез эстрогенов в мозге. В нейронах содержатся все ферменты, необходимые для синтеза эстрогенов. (d) Клетки микроглии и олигодендроциты неспособны синтезировать эстрогены [2].
Рецепторы эстрогенов
Еще в 50-х годах прошлого столетия Элвуд Дженсен описал белок, который связывает этот гормон; сегодня он известен как рецептор эстрогенов типа α — ER-α (estrogen receptor). Достаточно долгое время считалось, что лишь ER-α активируется эстрогенами, пока в 1996 году не был обнаружен еще один рецептор, названный ER-β [3].
Оба белка относятся к суперсемейству ядерных, или нуклеарных, рецепторов (NR — nuclear receptor) и имеют порядковый номер NR3A1 (ERα) и NR3A2 (ERβ). Они достаточно неодинаковы, кодируются разными генами, по-разному представлены в органах и тканях и отличаются по выполняемым функциям (Рис. 2)
В строении рецептора выделяют следующие функциональные участки:
- А/В-домен — N-концевой. Представлен наиболее вариабельным участком, ответственным за лиганд-независимую активацию транскрипции (AF-1 — activation function);
- C-домен — ДНК-связывающий, также называемый DNB (DNA-binding domain);
- D-домен — своеобразный «шарнир» между С- и Е-участками (hinge);
- E-домен или LBD — лиганд-связывающий (ligand-binding domain). Участок играет важную роль в димеризации, а также имеет функциональную область AF-2, отвечающий за лиганд-зависимую активацию транскрипции;
- F-домен — C-концевой, отвечает за общую модуляцию работы рецептора, участвует в белок-белковых взаимодействиях.
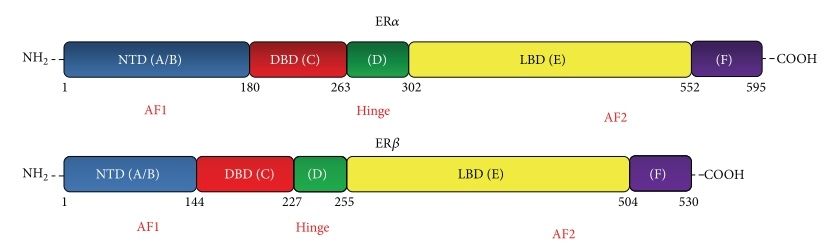
Рис. 2. Функциональные отличия в структуре ERα и ERβ [4].
Следует заметить, что рецепторы эстрогена также насчитывают некоторые подвиды, отличающиеся по своему строению. Так, ERα насчитывает несколько изоформ, разнящиеся по строению некоторых функциональных участков [5]; как это влияет на их функцию — вопрос дискутабельный.
Механизмы функционирования эстрогеновых рецепторов
В настоящее время выделяют четыре общих механизма реализации рецепторами своей функции (см. рис. 3). Это — прямой (direct), «классический» механизм; связанный с другими факторами транскрипции (TF), негеномный механизм регулирования и особняком выделяют лиганд-независимую активацию эстрогеновых рецепторов [5]. Имеет смысл разобрать каждый подробнее.
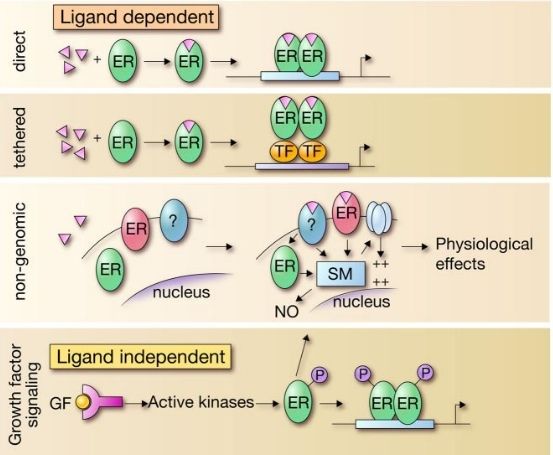
Рис. 3. Виды функционирования эстрогеновых рецепторов в клетке [5].
Классический механизм — самая обыкновенная активация рецептора лигандом (гормоном), который вместе с белками-корегуляторами как-то изменяет экспрессию отдельных генов.
Вторая модель несколько сложнее. Здесь рецептор взаимодействует с комплексом других факторов транскрипции, которые модулируют влияние рецептора на экспрессию гена. Это также очень важный регуляторный механизм.
Третий вид функционирования назван «негеномным», так как не затрагивает геном напрямую. Он гораздо менее изучен и реализует себя через определенный каскад реакций (на сегодняшний день неизвестных), следствием чего является изменение клеточной функции в виде открытия/закрытия ионных каналов, изменения концентрации NO в клетке. Эта модель опосредует «быстрые реакции», т. е. ответ на стимул происходит за считанные секунды. Предполагается, что в этом могут участвовать ER, непосредственно связанные с клеточной мембраной, а не свободно плавающие в цитоплазме; также есть гипотезы, что это вообще неэстрогеновые рецепторы (хотя и активируются эстрадиолом).
Предыдущие три механизма функционирования рецептора называют «лиганд-зависимыми», так как рецептор реагирует на гормон. Четвертый — лиганд-независимый способ активации рецептора — не предполагает участия специфического гормона. Любое высокоактивное вещество (например, фактор роста — GF — grows factor) связывается с мембранными рецепторами; это вызывает каскад разнообразных реакций, активацию протеинкиназ, которые, взаимодействуя уже с рецепторами эстрогена, фосфорилируют его; хотя имеются гипотезы, что протеинкиназы взаимодействуют не с ER, а с белками-корегуляторами [5].
Рецептор ER-α
Это — первый из двух обнаруженных типов рецептора к эстрогенам; он преимущественно синтезируется в органах и тканях репродуктивной системы — молочные железы, матка, шейка матки, влагалище и пр. [6].
Как и большинство рецепторов к стероидным гормонам, рецепторы эстрогена осуществляют свою функцию путем активации/деактивации экспрессии различных генов (геномная функция). Однако помимо этого существует и негеномная роль рецептора, которая проявляет себя гораздо быстрее, нежели произойдет реализация наследственной информации (как уже было упомянуто выше). Рецепторы, находясь в цитоплазме, могут связываться с аденилатциклазой, протеинкиназами, запуская определенный каскадный процесс. Именно негеномные функции эстрогеновых рецепторов представляют наибольший интерес для современных исследователей [1].
Например, эстрогеновый рецептор инициирует транскрипцию и в AP-1-сайтах (кодирующих белки AP-1) [7] с помощью комплекса белков-активаторов и репрессоров. AP-1 (activation proteins) представляют собой семейство различных факторов транскрипции, которые играют важную роль в регуляции клеточной цикла, димеризации и общей жизнеспособности клетки [8].
Рецептор ER-β
В 1996 году был выделен новый подтип рецептора к эстрогену, который получил название ER-β [3]. Исследователи изучили строение данного белка и выяснили, что он в целом достаточно гомологичен альфа-рецептору; однако имеются и отличия (см. рис. 4). Если кратко – высококонсервативный ДНК-связывающий домен практически идентичен (96% сходство), лиганд-связывающий – всего 58 % одинаковой структуры; остальные участки молекулы совершенно не совпадают или вовсе отсутствуют, как видно из рисунка 2. Этим же исследованием было продемонстрировано, что ER-β также активируется эстрадиолом, хотя сродство к нему несколько меньше, нежели у ER-α.
В отличие от ERα, данный подтип экспрессируется преимущественно в яичниках, яичках, простате, тимусе, селезенке, легких и гипоталамусе [6].

Рис. 4. Отличия в аминокислотной последовательности рецепторов ER-α и ER-β [3].
Рецептор GPER
В том же 1996 году был обнаружен еще один рецептор, который назвали «G-связанный рецептор» — GPR30 [9]. Во многих источниках этот белок фигурирует именно под таким названием, хотя официально в 2007 году ему присвоили звание самостоятельного G-связанного эстрогенового рецептора — GPER (G-protein coupled estrogen receptor) [10].
GPER – 7-сегментный доменный трансмембранный рецептор, который отвечает за особые реакции, которые названы «быстрыми эффектами» (англ. rapid effects), активируя различные каскадные сигнальные пути. Именно он отвечает за «негеномные» функции эстрогена. GPER связан с плазматической мембраной, а также с ЭПС и комплексом Гольджи, широко распространен в клетках печени, сердца, кишечника, яичников, ЦНС, поджелудочной железы, иммунокомпетентных клетках, адипоцитах и клетках репродуктивной системы [11].
Еще один новый эстрогеновый рецептор?
Не успели ученые опомниться от предыдущих открытий, как в 2002 году была опубликована статья [12], авторы которой уведомили об открытии нового эстрогенового рецептора, который назвали ER-X. Он связан с плазматической мембраной и в большой концентрации определяется в матке и головном мозге. Однако статья видится мне довольно сомнительной: авторы объясняют, почему обнаруженный ими рецептор не является ни альфа-, ни бета-подтипом, но в исследовании совершенно не упоминается GPER (который, как мы помним, тогда назывался GPR30).
На сегодня имеется очень скудный перечень литературы по данному вопросу. ER-X вскользь упоминается в обзоре 2013 года [2]; в это же самое время (в том же месяце – марте) опубликована другая статья, где говорится уже о нескольких новых рецепторах ER-X и ER-x [13], правда, автор вежливо называет их «кандидатами» на роль эстрогеновых рецепторов.
Как бы там ни было, пока что нет единого мнения, отнести ли обнаруженные новые рецепторы к эстрогенам, какую функцию они выполняют, и вообще – действительно ли это «новые» рецепторы, а не методологическая ошибка.
Рецепторы эстрогенов и морфогенез
Суть морфогенеза, осуществляемого под влиянием эстрогеновых рецепторов, напрямую вытекает из предыдущего раздела. ER (или корегуляторы, взаимодействующие с ними), могут активироваться различными факторами роста – именно в этом и состоит суть регуляции ER в развитии целого ряда тканей и органов.
Прежде всего, эстрогеновые рецепторы важны для нормального развития молочных желез и простаты. Морфогенез в этом случае опосредован действием на рецепторы определенных факторов роста и рецепторов к ним, среди которых можно выделить:
- Рецептор к эпидермальным факторам роста (EGFR-1 – epidermal grows factor receptor) необходим для развития эпителиальной и соединительной тканей, тканевой репарации, участвует в ангиогенезе, задействован в опухолевом росте;
- Эпидермальный фактор роста (EGF – epidermal grows factor);
- Трансформирующий фактор роста (TGF- α – transforming grows factor);
- Бетацелюлин;
- Гепарин-связывающий эпидермальный фактор роста (HP-EGF – heparin binding epidermal grows factor);
- Фактор роста фибробластов (FGF)
- Амфирегулин;
- Эпирегулин.
Все данные факторы роста активируют указанный выше рецептор EGFR-1, который, по-видимому, играет ключевую роль в морфогенезе вышеуказанных тканей и органов. Также все данные биологически активные вещества синтезируются в виде предшественников и нуждаются в частичном протеолизе с помощью комплекса каталитических белков [5]. Разумеется, весь спектр своих функций факторы роста осуществляют, взаимодействуя также и с другими рецепторами; но в данном случае нас интересует именно EGFR-1.
Молочные железы
В эксперименте [14] на мышах с нокаутом гена, отвечающего за экспрессию ERα, было установлено, что у животного без данного рецептора не происходит удлинения протоков молочной железы. Несмотря на нормальную работу гипофиза и адекватную выработку половых гормонов, у мышей без ERα развивались «усеченные» молочные железы.
Эмпирически было выяснено, что рецептор ERα оказывает влияние на выработку амфирегулина, который, активируя уже известный нам EGFR-1, обеспечивал нормальное развитие молочных желез [5].
Существует еще одна важная функция эстрогеновых рецепторов в ткани молочной железы – это сообщения эпителиальных и мезенхимальных клеток между собой, а также клеточная адгезия.
Из-за этого свойства ERα играет важную роль в онкогенезе. На культуре раковых клеток MCF7 было выявлено, что ERα участвует в перестройке актиновых филаментов, сообщая клетки между собой и клетки с внеклеточным матриксом.
С течением онкогенеза изменяется экспрессия многих белков интегринов, молекул адгезии и протеинов, участвующих в миграции и метастазировании. Особая роль принадлежит катгеринам и катенинам (гормон-зависимым белкам адгезии), которые выполняют, с одной стороны, защитную роль, являясь супрессорами для онкогенеза; с другой – некоторые из них позволяют отличить один вид рака от другого. Так, Е-кадгерин синтезируется в большом количестве при ERα-позитивном раке МЖ, тогда как Р-кадгерин определяется при ERα-негативном низкодифференцированном раке [5, 15].
ERβ в свою очередь влияет на дифференцировку железистых эпителиоцитов; отсутствие рецептора приводит к таким дефектам как отсутствие межклеточного матрикса, отсутствие базальной пластинки, увеличение интерэпителиального межклеточного пространства. Это происходит из-за снижения выработки гормонзависимых молекул адгезии – Е-кадгерина, коннексина и других [5].
Простата
Вспомним знаменитый скандал с диэтилстильбэстролом – ДЭС (или просто стильбэстролом). У беременных женщин, которые принимали ДЭС по показаниям, рождались дети с различными аномалиями урогенитального тракта (независимо от пола детей).
В этом исследовании [16] ученые изучали, как ДЭС будет влиять на развитие простаты у мышей с нокаутом ERα (ERKO-α – estrogen receptor knockout), нокаутом ERβ (ERKO-β ) и обычной немутантной мыши. У двух последних (ERKO-β и обычная мышь) развивались разнообразные нарушения в морфогенезе простаты, тогда как мышь с нокаутом ERα оказалась резистентна к действию препарата. Таким образом была установлена ключевая роль ERα в морфогенезе простаты.
Что рецепторы делают физиологически, в нормальном организме? Костные морфогенетические белки (bone morphogenic factor — BMP, принадлежат к суперсемейству трансформирующих факторов роста-β) секретируются в строме органа, замедляя ветвление и рост простаты. Особая роль принадлежит BMP7, который ингибирует сигнальный путь Notch [17]. Данная сигнальная система была открыта лишь недавно, на сегодняшний момент известно, что Notch крайне важен для регуляции развития клетки, ее пролиферации и апоптоза.
ERα в свою очередь увеличивают экспрессию особого белка фоллистатина в железистом эпителии; фоллистатин оказывает ингибирующее влияние на BMP7 [5]. Соответственно, Notch-сигнальная система работает, и морфогенез идет нормальным путем.
Роль ERβ в морфогенезе простаты, по-видимому, не так значительна, хотя дефект этого рецептора приводит к нарушениям вентральной доли простаты. Основное значение ERβ – ограничение роста простаты путем активации трансформирующих факторов роста TGF-β (последние ингибируют EGF и тестостерон-зависимый рост железы) [5].
Яичники
В этом органе в большом количестве секретируется ERβ, который играет ключевую роль в развитии и созревании фолликулов. В эксперименте ERKO-β мышь была субфертильна, в яичниках таких животных находится большое количество атретических фолликулов. При стимуляции гонадотропином, все же происходила выработка небольшого количества ооцитов – предполагается участие в этом ERα, которые, вероятно, обеспечивают частичную компенсацию утраченной функции [18].
Матка
И вновь обратимся к мышкам ERKO-α и ERKO-β, у которых имеется ряд нарушений в развитии такого важного органа. У ERKO-α мышки матка в общем сохраняет свою структуру, однако имеет место ярко выраженная гипоплазия – вес органа едва достигает половины от нормального веса и размера матки здоровой особи. Строма между эндометрием и миометрием гипотрофична, менее организована; маточные железы редкие и негустые. Эпителиоциты кажутся вполне здоровыми, несмотря на это, в эндометрии вместо призматического эпителия (в норме) преобладает кубический. Зато матка ERKO-β мыши абсолютно нормальна – орган вполне функционален, претерпевает циклические гормон-зависимые изменения [19].
Костная система
В развитии костной ткани однозначно необходима роль ERα; не так давно был обнаружен мужчина с мутацией данного гена, имеющий незакрепленные эпифизы костей и низкую прочность самой кости из-за сниженного количества минералов. Терапия эстрадиолом эффекта не дала [18]. Подобные данные для β-рецептора на сегодняшний день отсутствуют.
Нервная система
Не так давно стало известно, что эстрогены оказывают огромное влияние на развитие головного мозга, рост аксонов и ветвление дендритов, опосредуют сексуальное поведение, память и обучение [5]. Механизмы этих явлений достаточно сложны; известно, что эстрогены регулируют фактор роста нервной ткани (NGF – nerve growth factor) и его рецепторы в холинергических нейронах; TGF-β в гипоталамусе, нейротрофический фактор мозга (brain-derived neurotrophic factor, BDNF) в коре; инсулиноподобный фактор роста и его рецепторы в гипоталамусе.
Оба вида рецептора широко представлены в клетках ЦНС, как выяснили исследователи, изучавшие мозг мыши [20]. Они имеют различную локализацию и «плотность», а функции их не ограничиваются лишь формированием сексуального поведения.
GPER. Как выяснилось, он тоже достаточно активно представлен в ЦНС и определяется во многих структурах переднего, среднего, продолговатого отделов мозга, а также гипофизе, гипоталамусе и гиппокампе [21]. Однако поскольку GPER – самый молодой из представленных рецепторов, мы почти ничего не знаем о его роли в морфогенезе.
Некоторые патологии и заболевания, связанные с метаболизмом эстрогена и функционированием эстрогеновых рецепторов
1. Ожирение
Эстроген играет достаточно значимую функцию в липидном обмене, особенно выражено его действие у женщин в пременопаузе. В отношении распределения подкожной жировой клетчатки выражен половой диморфизм; имеются данные, что именно эстрадиол участвует в развитии жировой клетчатки по «женскому» типу.
Основные рецепторы, запускающие процесс липолиза в организме – α2- и β-адренорецепторы; воздействуя на ERα, эстроген увеличивает количество и плотность этих рецепторов у женщин репродуктивного возраста, что обеспечивает нормальный жировой обмен [22].
Особая роль в этом вопросе принадлежит GPER. В серии опытов на мышах с нокаутом гена GPER было выяснено, что GPER-КО особи весили значительно больше, а подкожная жировая клетчатка была гораздо более выражена. Более того, у таких мышей был повышен уровень холестерола и триглицеридов в крови, а также, как следствие, имел место неалкогольный стеатоз печени [11].
Кроме этого, гормон Е2 играет важную роль в формировании аппетита, усиливая синтез лептина и холецистокинина – эти вещества способны оказать угнетающее воздействие на аппетит. В эксперименте было установлено, что опосредует связь между Е2 и этими гормонами все три типа рецепторов – ERα и ERβ, представленные в некоторых ядрах гипоталамуса [22]; также в ЦНС широко представлен GPER, который, в отличие от остальных эстрогеновых рецепторов, по-видимому, усиливает аппетит. В опытах на мышах GPER-КО особи были гораздо менее чувствительными к лептину и холецистокинину (однако это касается лишь особей женского пола) [11].
Исходя из вышеизложенного, менопауза (и снижение выработки эстрогена) – тот самый «переходный» момент, после которого женщина автоматически относится к группе риска по ожирению, а также ряда некоторых других нарушений (см. ниже). Существуют попытки профилактики ожирения (и ряда других заболеваний) заместительной терапией, однако на сегодня еще нет необходимой доказательной базы, подтверждающей ее эффективность.
2. Сахарный диабет
Достаточно сложные отношения гормона Е2 и инсулина. В исследованиях было показано, что женщина в постменопаузе встречается с крайне высоким риском развития метаболического синдрома, диабета, ожирения. Данные эффекты были продемонстрированы в опытах на ERKO-α мышах – из-за дефицита эстрогенового рецептора типа альфа у мышей наблюдалась инсулинорезистентность, гиперинсулинемия, гиперлипидемия; в случае же нокаута гена ERβ – подобных нарушений не было, более того, имело место некоторое усиление чувствительности к инсулину и толерантности к глюкозе. То есть, можно сказать, что именно с ERα связано большинство проблем [4].
На практике все оказывается несколько сложнее. Многочисленные исследования, описанные в статье 2017 года [23], показывают, что мы знаем слишком мало, чтобы делать какие-то выводы. Имеются достаточно противоречивые данные по поводу менопаузы и риска развития диабета 2 типа; эстроген-заместительная терапия и вовсе показала свою неэффективность в качестве профилактического средства в этом случае.
По-прежнему остается неясным множество вопросов касательно регуляции эстрогеновыми рецепторами уровня инсулина и глюкозы; и для снижения риска развития диабета 2 типа все так же предлагается лишь адекватная диета и поддержание ИМТ в пределах нормы.
3. Рак молочных желез
Существуют различные механизмы развития этого заболевания, не связанные с изменением гормонального фона (например, мутации генов BRCA1 и BRCA2), однако во многих случаях существенную роль в канцерогенезе играет менопауза и снижение количества циркулирующих эстрогенов [24].
В серии исследований было выяснено, что эстрадиол в ткани молочной железы способен превращаться в генотоксические, потенциально канцерогенные, формы. У мышей с нокаутом ERα было выявлено существенное снижение частоты возникновения опухолей; оофорэктомия также задерживала канцерогенез. Этим же эффектом обладает препарат летрозол – ингибитор ароматазы [25].
Эти данные могут существенно повлиять на терапию ER+ опухолей молочных желез, однако механизмы канцерогенеза и точная роль эстрогена (и эстрогеновых рецепторов) на сегодня остается невыясненной.
4. Болезнь Альцгеймера
Это наиболее известное нейродегенеративное заболевание, причиной которого, как считается, является накопление и агрегация β-амилоида в головном мозге. Исследования показывают, что риск развития болезни Альцгеймера связан со снижением концентрации половых гормонов с возрастом; причем чаще заболеванию подвергаются женщины в постменопаузе, нежели мужчины того же возраста [26].
Чтобы разобраться в этом, нужно немного остановиться на деталях. Существуют особые ферменты — β-секретаза (BACE1) и γ- секретаза, которые и синтезируют из белка-предшественника амилоида (БПА) — β-амилоид, приводящий к развитию заболевания. β-амилоид могут утилизировать инсулин-разрушающий фермент (IDE – insulin-degrading enzyme) и фермент неприлизин (NEP – nephrilysin – вырабатывается эндотелием сосудов, участвует в деактивации предсердного натрий-уретического пептида). Именно эти два фермента повышают свою активность под действием эстрогенов; в этом же причина накопления амилоида при снижении выработки эстрадиола [27].
Далее происходит беспрепятственное накопление β-амилоида в клетке, что приводит к извращению функции митохондрии – она начинает продуцировать большое количество активных форм кислорода, в результате клетка входит в состояние т.н. «окислительного стресса», что в конечном итоге заканчивается ее гибелью [26].
В отношении профилактики болезни Альцгеймера очень популярна идея заместительной эстрогено-терапии – существует множество попыток, некоторые из них довольно успешны. Исследования показывают, что, если начать заместительную терапию примерно в момент наступления менопаузы – риск возникновения болезни будет заметно снижен; если затянуть лет на 10-15 — не получим никакого эффекта [2].
Однако эти данные, как считают некоторые исследователи (достаточно обоснованно) – в некотором роде излишне оптимистичны [28]. Многие источники изобилуют различными исследованиями о нейропротекторной функции эстрогена, надеясь, что гормоно-заместительная терапия поможет сохранить когнитивные способности. Авторы критического обзора справедливо замечают, что большинство исследований проводится на мышах, тогда как их нейрофизиология мышей существенно отличается от человеческой; к тому же термин «когнитивные способности» — крайне сложен, так же, как и патогенез многих нейродегенеративных заболеваний. Так что на данный момент можно говорить лишь о предпосылках к созданию новых методик лечения, да и то с осторожностью.
5. Болезнь Паркинсона
Еще одно распространенное нейродегенеративное заболевание; в отличие от болезни Альцгеймера, в этом случае женщины имеют более низкий риск. При этом заболевании страдает в большей степени стриатум и черное вещество – структуры, где экспрессируются все три типа эстрогеновых рецепторов; наиболее выражено влияние ERα, который обеспечивает протекцию дофаминергических нейронов [2].
Имеются данные, что эстрадиол, воздействуя на все три типа рецепторов мозга, способен оказать существенное нейропротекторное действие у особей обоих полов; разрабатываются стратегии, способные применить эти данные в терапии болезни Паркинсона, однако все они еще нуждаются в подтверждении [29].
6. Сердечно-сосудистые заболевания
В этом вопросе женщины репродуктивного возраста имеют огромное преимущество. Активация ERα у мышей связана с более низкой степенью поражения сосудов атеросклерозом; эстроген путем воздействия на ERβ способен предотвратить кардиофиброз. А рецептор GPER способен уменьшить ишемическое поражение и сохранить функцию сердца в норме [2]. К сожалению, все эти преимущества сходят на нет с возрастом или оофорэктомией, а эффективность использования эстроген-заместительной терапии в качестве профилактики и лечения на сегодняшний день не доказана.
Источники:
- B. J. Csheskis, J. G. Greger, S. Nagpal, and L. P. Freedman, “Signaling by Estrogens,” J. Cell. Physiol., vol. 213, pp. 610–617, 2007.
- R. Li and Y. Shen, “Estrogen and brain : Synthesis , function and diseases,” Trends Mol. Med., vol. 19, pp. 197–209, 2013.
- S. Mosselman, J. Polman, and R. Dijkema, “ERβ: Identification and characterization of a novel human estrogen receptor,” FEBS Lett., vol. 392, no. 1, pp. 49–53, 1996.
- A. A. Gupte, H. J. Pownall, and D. J. Hamilton, “Estrogen : An Emerging Regulator of Insulin Action and Mitochondrial Function,” vol. 2015, 2015.
- N. HELDRING et al., “Estrogen Receptors: How Do They Signal and What Are Their Targets,” Physiol Rev, vol. 87, pp. 905–931, 2007.
- J. M. Hall, J. F. Couse, and K. S. Korach, “The Multifaceted Mechanisms of Estradiol and Estrogen Receptor Signaling,” J. Biol. Chem., vol. 276, no. 40, pp. 36869–36872, 2001.
- P. J. Kushner et al., “Estrogen receptor pathways to AP-1,” J. Stetoid Biochem. Biol., vol. 74, pp. 311–317, 2000.
- M. Karin, Z. g Liu, and E. Zandi, “AP-1 function and regulation.,” Curr. Opin. Cell Biol., vol. 9, no. 2, pp. 240–6, 1997.
- C. M. Revankar, D. F. Cimino, L. A. Sklar, J. B. Arterburn, and E. R. Prossnitz, “A transmembrane intracellular estrogen receptor mediates rapid cell signaling,” Science (80-. )., vol. 307, no. 5715, pp. 1625–1630, 2005.
- M. Barton, E. J. Filardo, S. J. Lolait, P. Thomas, M. Maggiolini, and E. R. Prossnitz, “Twenty years of the G protein-coupled estrogen receptor GPER: Historical and personal perspectives,” J. Steroid Biochem. Mol. Biol., vol. 176, pp. 4–15, 2018.
- G. Sharma, F. Mauvais-Jarvis, and E. R. Prossnitz, “Roles of G protein-coupled estrogen receptor GPER in metabolic regulation,” J. Steroid Biochem. Mol. Biol., vol. 176, no. 2016, pp. 31–37, 2018.
- C. D. Toran-Allerand et al., “ER-X: A Novel, Plasma Membrane-Associated, Putative Estrogen Receptor That Is Regulated during Development and after Ischemic Brain Injury,” J. Neurosci., vol. 22, no. 19, pp. 8391–8401, 2002.
- K. Soltysik and P. Czekaj, “Membrane estrogen receptors - is it an alternative way of estrogen action?,” J. Physiol. Pharmacol., vol. 64, no. 2, pp. 129–142, 2013.
- [14] N. J. Kenney, A. Bowman, K. S. Korach, J. C. Barrett, and D. S. Salomon, “Effect of exogenous epidermal-like growth factors on mammary gland development and differentiation in the estrogen receptor-alpha knockout (ERKO) mouse,” Breast Cancer Res. Treat., vol. 79, no. 2, pp. 161–173, 2003.
- P. Cowin, T. M. Rowlands, and S. J. Hatsell, “Cadherins and catenins in breast cancer,” Curr. Opin. Cell Biol., vol. 17, no. 5 SPEC. ISS., pp. 499–508, 2005.
- G. S. Prins, L. Birch, J. F. Couse, I. Choi, B. Katzenellenbogen, and K. S. Korach, “Estrogen Imprinting of the Developing Prostate Gland Is Mediated through Stromal Estrogen Receptor ␣ : Studies with ␣ ERKO and  ERKO Mice 1,” Environ. Prot., pp. 6089–6097, 2001.
- S. Artavanis-Tsakonas, M. D. Rand, and R. J. Lake, “Notch signaling: Cell fate control and signal integration in development,” Science (80-. )., vol. 284, no. 5415, pp. 770–776, 1999.
- H. A. Harris, “Estrogen Receptor-β: Recent Lessons from in vivo Studies,” Mol. Endocrinol., vol. 21, no. 1, pp. 1–13, 2007.
- J. F. Couse and K. S. Korach, “Estrogen receptor null mice: What have we learned and where will they lead us?,” Endocr. Rev., vol. 20, no. 3, pp. 358–417, 1999.
- I. Merchenthaler, M. V. Lane, S. Numan, and T. L. Dellovade, “Distribution of Estrogen Receptor α and β in the Mouse Central Nervous System: In Vivo Autoradiographic and Immunocytochemical Analyses,” J. Comp. Neurol., vol. 473, no. 2, pp. 270–291, 2004.
- E. Brailoiu et al., “Distribution and characterization of estrogen receptor G protein-coupled receptor 30 in the rat central nervous system,” J. Endocrinol., vol. 193, no. 2, pp. 311–321, 2007.
- F. Lizcano and G. Guzmán, “Estrogen deficiency and the origin of obesity during menopause,” Biomed Res. Int., vol. 2014, 2014.
- C. A. Stuenkel, “Menopause, hormone therapy and diabetes,” Climacteric, vol. 20, no. 1, pp. 11–21, 2017.
- H. Samavat and M. S. Kurzer, “Estrogen metabolism and breast cancer,” Cancer Lett., vol. 356, no. 2, pp. 231–243, 2015.
- R. J. Santen, W. Yue, and J. P. Wang, “Estrogen metabolites and breast cancer,” Steroids, vol. 99, no. Part A, pp. 61–66, 2015.
- J. Viña and A. Lloret, “Why women have more Alzheimer’s disease than men: Gender and mitochondrial toxicity of amyloid-β peptide,” J. Alzheimer’s Dis., vol. 20, no. SUPPL.2, pp. 527–533, 2010.
- R. Li, P. He, J. Cui, M. Staufenbiel, N. Harada, and Y. Shen, “Brain endogenous estrogen levels determine responses to estrogen replacement therapy via regulation of BACE1 and NEP in female Alzheimer’s transgenic mice,” Mol. Neurobiol., vol. 47, no. 3, pp. 857–867, 2013.
- B. B. Sherwin and J. F. Henry, “Brain aging modulates the neuroprotective effects of estrogen on selective aspects of cognition in women: A critical review,” Front. Neuroendocrinol., vol. 29, no. 1, pp. 88–113, 2008.
- M. Bourque, D. E. Dluzen, and T. Di Paolo, “Signaling pathways mediating the neuroprotective effects of sex steroids and SERMs in Parkinson’s disease,” Front. Neuroendocrinol., vol. 33, no. 2, pp. 169–178, 2012.
