Сказка о потерянных фолликулах: оцениваем овариальный резерв

Девочка появляется на свет, имея при себе один-два миллиона примордиальных фолликулов. К моменту первой овуляции их количество сокращается до 400 тысяч, однако это все еще огромный пул фолликулов, которого хватило бы примерно на тысячу лет ежемесячных овуляций. Но после 30 лет вероятность зачатия стремительно уменьшается, а к 50–55 годам наступает период менопаузы, связанный с естественным истощением яичника. Так куда же пропадает столь ценный для женщины запас фолликулов и зачем врачу акушеру-гинекологу знать состояние овариального резерва?
Для начала следует вспомнить фолликулогенез: от рождения и до момента первой менструации в яичниках присутствуют только примордиальные фолликулы с первичными ооцитами, часть которых подвергается атрезии. Несколько примордиальных фолликулов, находясь в аваскулярной зоне яичников в течение нескольких месяцев, стимулируются местными факторами роста и созревают до стадии вторичного фолликула. Далее под действием преимущественно фолликулостимулирующего гормона вторичный фолликул превращается в третичный, или антральный. Поздний третичный, или преовуляторный, фолликул в момент овуляции разрывается, выпуская ооцит в маточную трубу.
.
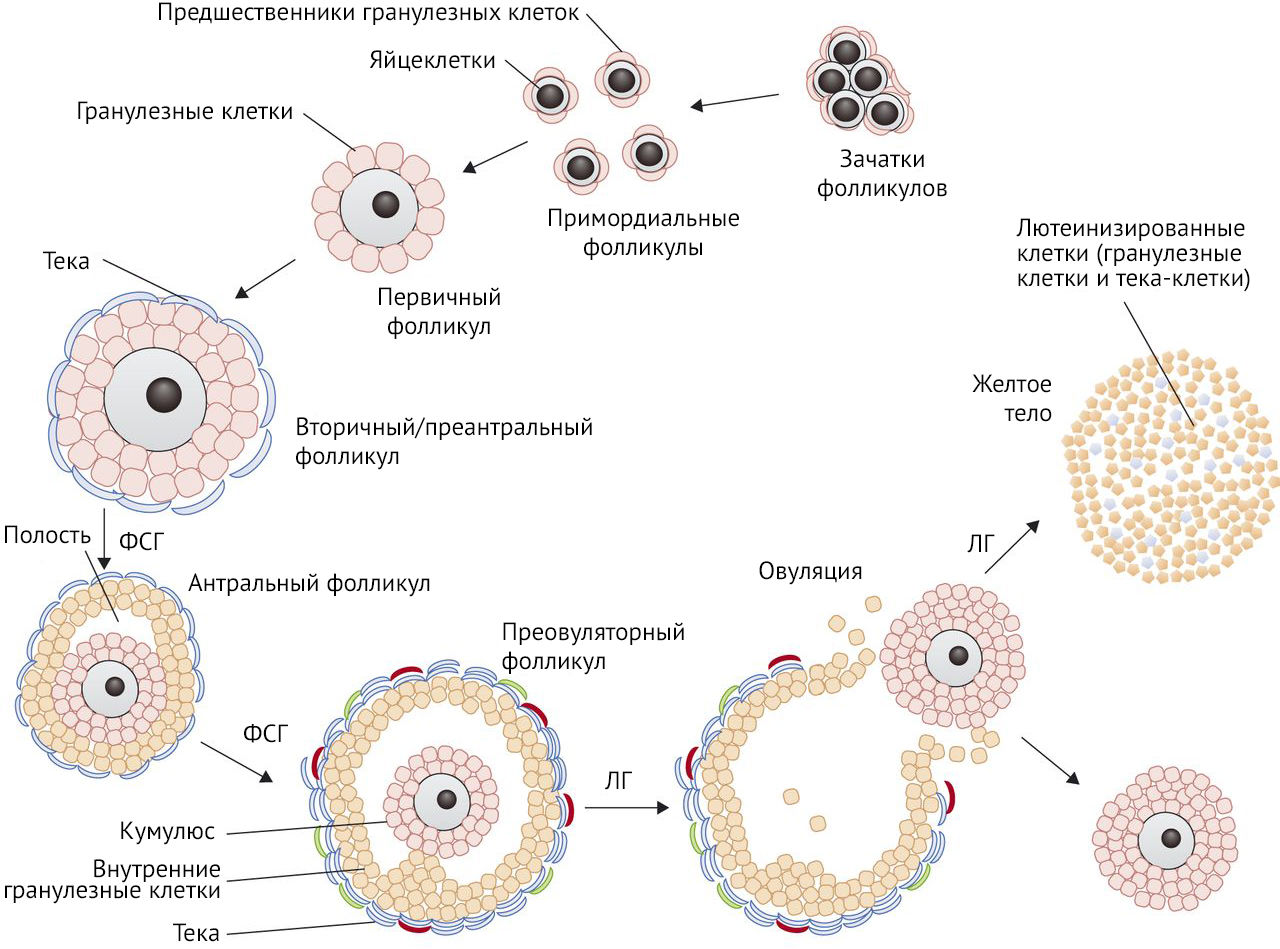
Рисунок 1 | Схема стадий фолликулогенеза
Развитие первичного фолликула до преовуляторного занимает более 120 дней. После того, как он становится преантральным фолликулом диаметром около 0,2 мм, ему требуется около 65 дней для превращения в преовуляторный фолликул. Группы фолликулов постоянно развиваются, но «отбирается» и становится доминирующим фолликулом только один, а все остальные подвергаются атрезии.
Исследование овариального резерва представляет собой косвенную оценку оставшегося фолликулярного пула женщины. Результаты исследования могут помочь дифференцировать женщин с нормальным и плохим ответом яичников во время стимуляции, а также выявить женщин, которым необходима консервация яйцеклеток перед медицинскими вмешательствами. Также немаловажна оценка резерва в периоде пременопаузы, так как это позволяет вовремя назначить заместительную гормонотерапию, избавив женщину от неприятных симптомов в менопаузе.
На данный момент для оценки овариального резерва, помимо ультразвукового исследования, используются четыре маркера: фолликулостимулирующий гормон, эстрадиол, ингибин В и антимюллеровский гормон, а также тест с использованием кломифена.
Ультразвуковая визуализация
Ультразвуковой метод подсчета фолликулов считается одним из лучших маркеров для оценки функционального резерва яичников, прогнозирования ответа на стимуляцию гонадотропином и для определения вероятности беременности после ЭКО. Исследование помогает предсказать как плохой, так и чрезмерный ответ яичников, и поэтому полезен для индивидуализации оптимальной дозы гонадотропина.
В раннюю фолликулярную фазу (2–5 дни менструального цикла) производится подсчет фолликулов диаметром от 2 до 10 мм, на основании чего рассчитывается доза гонадотропина для стимуляции яичников и оценивается ее эффективность.
.
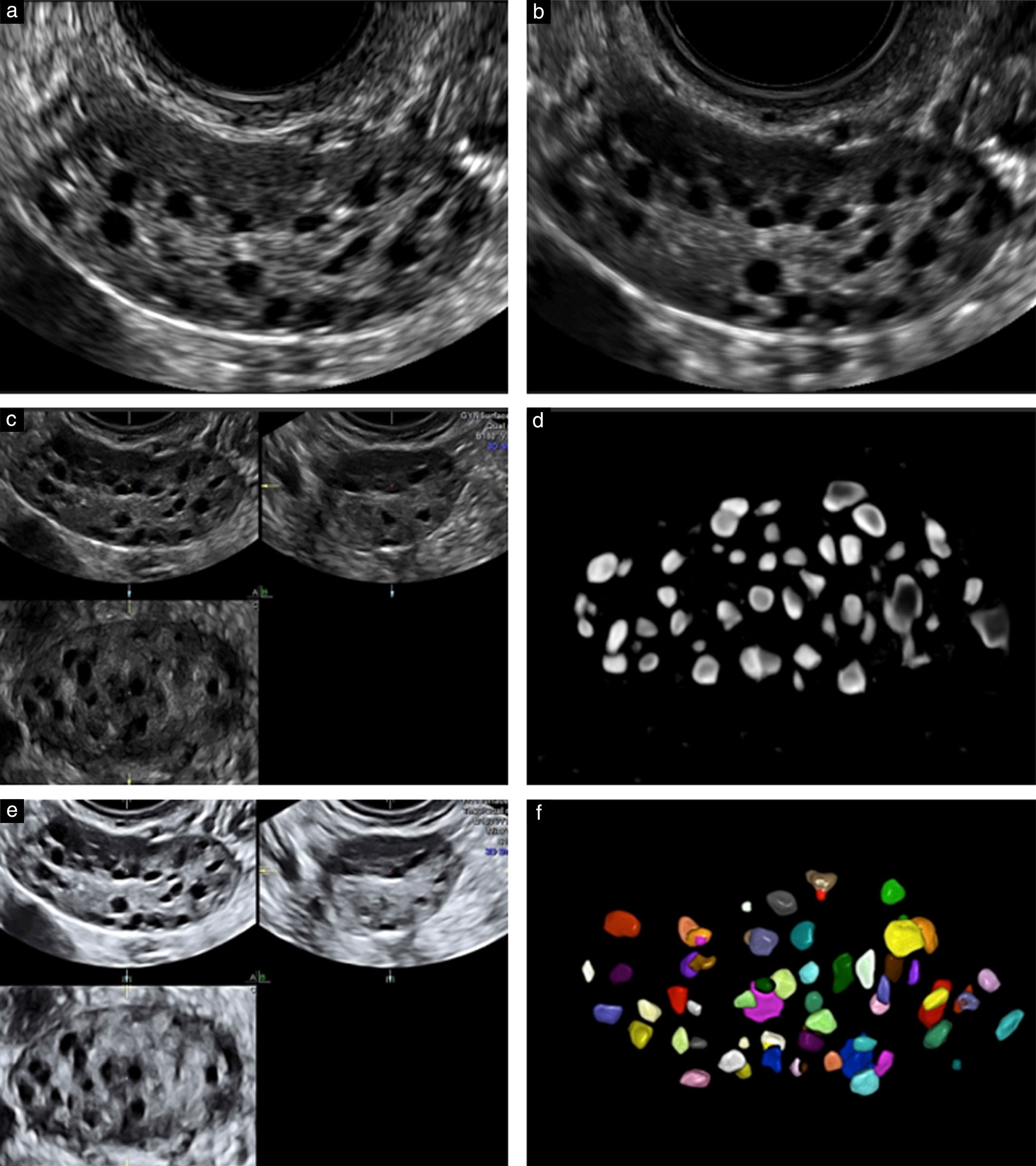
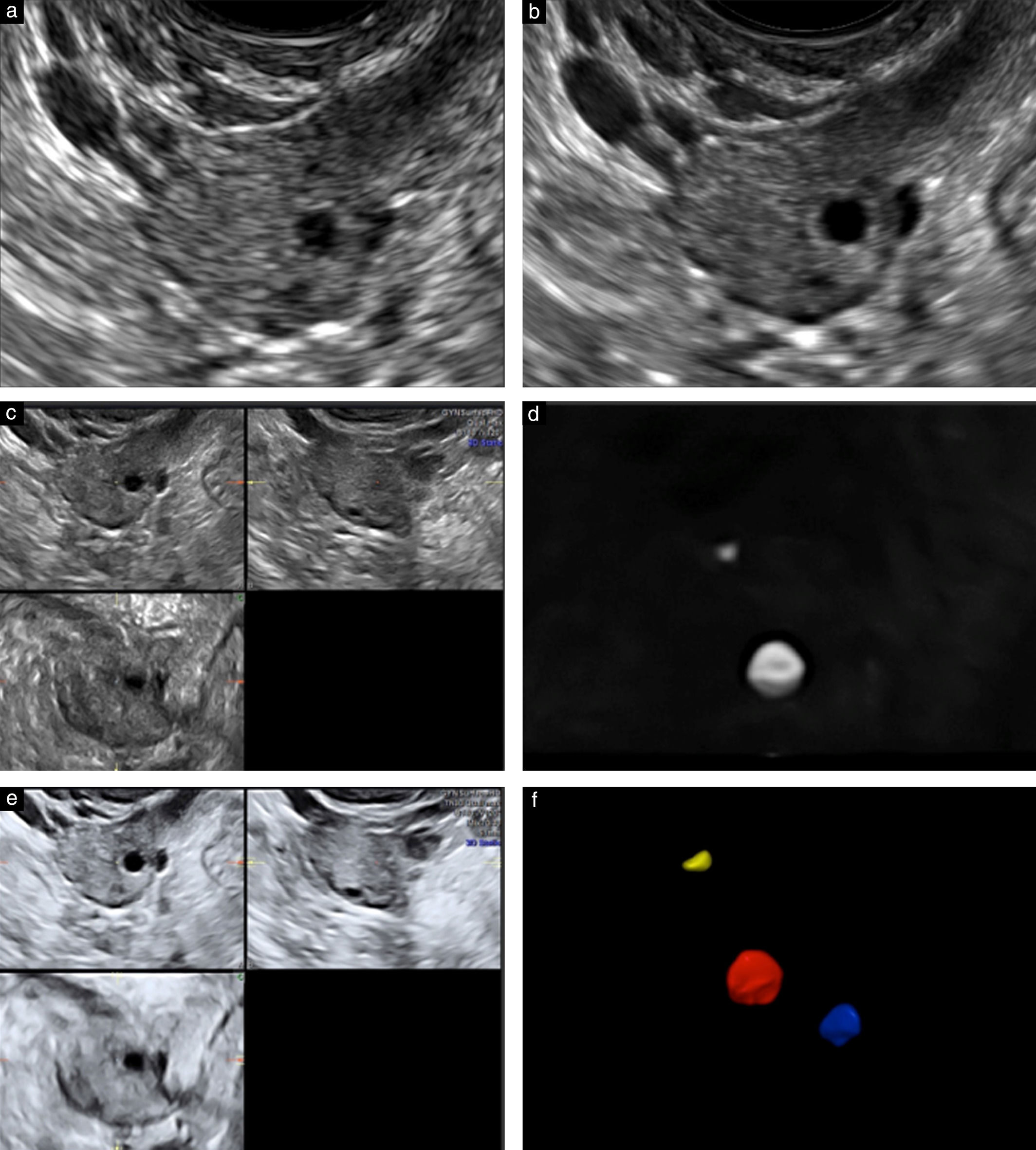
Рисунок 2, 3 | Ультразвуковая картина яичников с нормальным и сниженным количеством фолликулов
Таблица 1 | Интерпретация результатов подсчета фолликулов в общей гинекологической практике и перед стимуляцией яичников

Таблица 2 | Интерпретация результатов подсчета фолликулов перед стимуляцией яичников

Биохимические маркеры
В стандарты диагностики входят два маркера: фолликулостимулирующий гормон (ФСГ) и антимюллеровский гормон (АМГ).
Фолликулостимулирующий гормон (ФСГ) — гликопротеиновый гормон, который вырабатывается и накапливается в передней доле гипофиза и влияет на функцию половых желез, в частности на рост и созревание фолликулов. Его базальная концентрация увеличивается на 2–4 день цикла и зависит от уровня эстрадиола и ингибина В, а также возраста женщины. Результаты теста варьируются в зависимости от цикла, но анализ получил широкое распространение из-за своей простоты и доступности.
Для оценки овариального резерва имеет значение повышение уровня ФСГ (> 10–20 МЕ/л), так как организм по мере истощения резерва будет активно стимулировать рост оставшихся фолликулов, и, чем их меньше, тем выше уровень ФСГ.
В первую очередь этот метод используется для прогнозированиия слабого ответа на стимуляцию (< 2–3 фолликулов или ≤ 4 извлеченных ооцитов) во время ЭКО. Также по уровню ФСГ мы можем заподозрить первичную яичниковую недостаточность, связанную с врожденным или ятрогенным (химиотерапия, лучевая терапия, резекция яичника) уменьшением числа фолликулов, аутоиммунной дисфункцией яичников. Немаловажным является повышение ФСГ в пременопаузальном периоде — при значении ФСГ > 18 МЕ/л овариальный резерв считается истощенным, менструальная функция прекращается и женщина входит в менопаузу.
Антимюллеровский гормон (AMГ) — пептидный фактор роста семейства трансформирующих факторов роста бета (TGF-β) — хорошо известен своей ролью в дифференцировке по половому признаку. У женщин АМГ вырабатывается и секретируется зернистыми клетками фолликулов примерно с 36 недели гестации и до менопаузы. Уровень АМГ очень низок и едва выявляется в неонатальном периоде, но, тем не менее, небольшое его увеличение происходит через несколько недель после рождения, а пик достигается в возрасте около 25 лет. Функция антимюллеровского гормона в организме женщины репродуктивного возраста заключается в участии в созревании фолликулов за счет подавления роста соседних примордиальных фолликулов и уменьшения их чувствительности к ФСГ, что создает условия для овуляции только одного фолликула в каждом менструальном цикле. Так как АМГ синтезируется растущими фолликулами, его концентрация напрямую зависит от их количества. В свою очередь пул небольших растущих фолликулов параллелен общему количеству первичных фолликулов, и во время ранней фолликулярной фазы количество антральных фолликулов и уровни AMГ коррелируют, что позволяет использовать данный маркер для оценки овариального резерва. Преимущество данного маркера в стабильности показателей в отдельном цикле и между циклами.
Сывороточные уровни AMГ снижаются с возрастом — начиная с 21 года уровень этого гормона ежегодно уменьшается на 5,6 %, и за 3–5 лет до наступления менопаузы АМГ перестает обнаруживаться при анализе.
С 2013 года ESHRE (Европейское общество репродукции человека и эмбриологии) и NICE (Национальный институт здравоохранения и клинического совершенствования) рекомендуют измерять уровень AMГ перед проведением ЭКО, чтобы индивидуализировать тактику стимуляции яичников. Консенсус NICE устанавливает пороговое значение АМГ 0,75 нг/мл (5,4 пмоль/л) для прогнозируемого низкого ответа на стимуляцию и 3,5 нг/мл (25 пмоль/л) для сильного ответа.
Недавние исследования показали, что AMГ демонстрирует лучшие результаты по сравнению с ФСГ и ингибином В при прогнозировании ятрогенной потери фолликулов. Также его анализ позволяет отслеживать изменения яичникового резерва во время химиотерапии. Сообщается о снижении уровня АМГ на 55 % после одного цикла ХТ, а также о корреляции базовых уровней АМГ с уровнями АМГ после первого цикла ХТ, поскольку они оставались выше у пациенток с более высокими базовыми уровнями АМГ в сыворотке. Лучевая терапия также признана высокотоксичной для яичников даже в низких дозах и связана с крайне низкими или необнаружимыми значениями АМГ у пациенток после лечения. Кроме того, можно оценить овариальный резерв после оперативного вмешательства на яичниках (эндометриомы, кисты и т. д.) путем сравнения уровней AMГ до и после операции. Операция по удалению эндометриом, требующая резекции участка ткани яичника, приводит к значительному снижению уровня АМГ, выраженность чего также коррелирует с двусторонностью поражения и тяжестью эндометриоза. Поэтому крайне важно учитывать эти последствия перед операцией у пациенток с эндометриозом, в будущем планирующих беременность.
Другие маркеры, такие как ингибин В и эстрадиол, имеют широкую вариабельность показателей в зависимости от цикла и не могут быть изолированно использованы в качестве достоверного маркера для оценки овариального резерва, однако стоит сказать пару слов и о них.
Ингибин В — гликопротеиновый гормон, который выделяется в основном преантральными и антральными фолликулами. Его концентрация напрямую зависит от их количества: чем меньше фолликулов, тем ниже уровень ингибина В. Благодаря отрицательной обратной связи с центром, контролирующим секрецию ФСГ, уменьшение концентрации ингибина В приводит к повышению секреции гипофизом ФСГ и к его более высоким уровням в ранней фолликулярной фазе.
Эстрадиол — стероидный гормон из группы эстрогенов, секретируются развивающимися фолликулами. Как и ингибин В, эстрадиол посредством отрицательной обратной связи изменяет уровень ФСГ — увеличение эстрадиола уменьшает секрецию ФСГ. Повышение эстрадиола > 60–80 пг/мл в раннюю фолликулярную фазу может свидетельствовать об ускоренном развитии фолликулов с истощением фолликулярного аппарата, а также общем старении репродуктивной системы. Измерение эстрадиола полезно в случае с изолированным ложно-низким уровнем ФСГ, так как повышенный эстрадиол может замаскировать повышение ФСГ за счет обратной связи.
Снижение эстрадиола и ингибина В свидетельствует об уменьшении количества фолликулов в пременопаузальный период и у женщин с первичной недостаточностью яичников.
Провокационная проба с кломифеном (СССT)
Для начала следует сказать, что на данный момент проба не входит в стандарты первичной оценки функционального резерва яичников и может быть использована в случаях с немолодыми пациентками, имеющими трудности с зачатием при нормальном уровне фолликулостимулирующего гормона.
Кломифен представляет собой нестероидный блокатор эстрогеновых рецепторов — его прием приводит к снижению уровня эстрадиола, что посредством обратной связи должно повлиять на секрецию ФСГ, увеличивая ее.
CCCT (Clomiphene Citrate Challenge Test) основан на измерении уровня сывороточного ФСГ до (3-й день цикла) и после (10-й цикл цикла) приема кломифена (100 мг/сут с 5 по 9 дни цикла). Повышение концентрации ФСГ в любой из этих дней свидетельствует о снижении резерва яичников. По данным некоторых исследований, посвященных ЭКО, пациенткам с увеличением ФСГ на 10 день после пробы для индукции овуляции может потребоваться большая дозировка препаратов, а частота беременностей у них ниже. Но, учитывая вариабельность результатов этого теста в зависимости от цикла, его прогностическая ценность невелика.
Источники:
- Oh S. R., Choe S. Y., Cho Y. J. Clinical application of serum anti-Müllerian hormone in women //Clinical and experimental reproductive medicine. – 2019. – Т. 46. – №. 2.
- Jirge P. R. Ovarian reserve tests //Journal of human reproductive sciences. – 2011. – Т. 4. – №. 3.
- Practice Committee of the American Society for Reproductive Medicine et al. Testing and interpreting measures of ovarian reserve: a committee opinion //Fertility and sterility. – 2015. – Т. 103. – №. 3.
- Coelho Neto M. A. et al. Counting ovarian antral follicles by ultrasound: a practical guide //Ultrasound in Obstetrics & Gynecology. – 2018. – Т. 51. – №. 1.
- Committee on Gynecologic Practice et al. Committee opinion no. 618: Ovarian reserve testing //Obstetrics and gynecology. – 2015. – Т. 125. – №. 1.
- Carr B. R. Essential reproductive medicine. – McGraw Hill Professional, 2005.
- Georges A. et al. FOXL2: a central transcription factor of the ovary //Journal of molecular endocrinology. – 2014. – Т. 52. – №. 1.
