Келоидные и гипертрофические рубцы

Введение
Гипертрофические и келоидные рубцы представляют собой доброкачественные фибропролиферативные образования, которые возникают после повреждения дермального слоя кожи. Подобные визуальные дефекты кожного покрова негативно сказываются на качестве жизни пациентов, в том числе вызывая неудовлетворенность от проведенных оперативных вмешательств.
В представленной статье мы попытаемся разобраться в патофизиологии гипертрофических и келоидных рубцов и ответить на вопросы - почему воспалительный процесс играет против лечения, и как можно и нужно бороться с такими кожными дефектами.
Патогенез формирования рубцов
Заживление ран - это сложный динамический процесс, который подразделяется на три фазы, которые часто накладываются друг на друга: воспаление, пролиферация и ремоделирование.
Воспаление - это первая реакция на повреждение кожи - альтерацию. Из–за нарушения барьерной функции кожи в раневую поверхность устремляются бактериальные, вирусные и микотические агенты. В ответ на инфекцию активируются иммунные клетки кожи и начинается выработка как провоспалительных, так и противовоспалительных цитокинов.
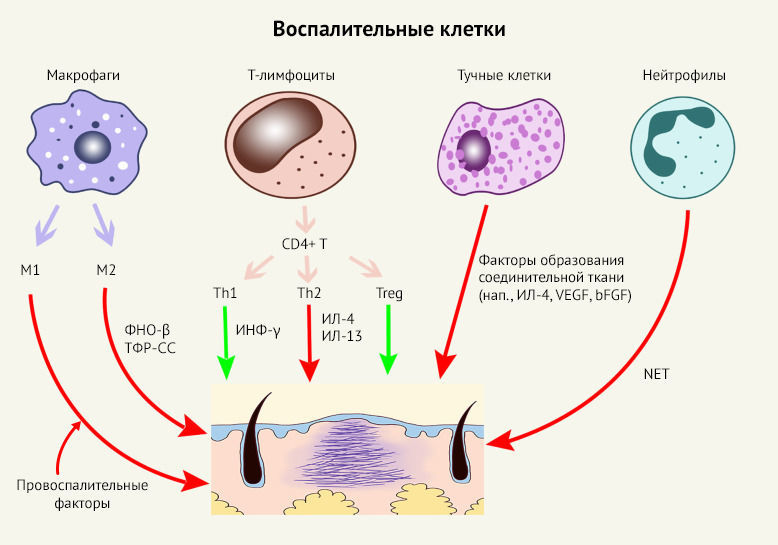
Treg - регуляторные Т-клетки; Th - хелперные Т-клетки; TGF-β - трансформирующий фактор роста-β; PDGF–CC - фактор роста тромбоцитов-CC (фактор образования новых сосудов); IFN-γ - интерферон γ; IL-4 - интерлейкины-4; IL-13 - интерлейкины-13; VEGF - фактор роста эндотелия сосудов; bFGF - основной фактор роста фибробластов; NETs - нейтрофильные внеклеточные ловушки
Классически в заживлении ран участвуют провоспалительные цитокины: IL-6, IL-8 и противовоспалительные цитокины: IL-10. Другими факторами, которые регулируют процесс заживления, являются матриксные металлопротеиназы, тромбоцитарный фактор роста (PDGF), инсулиноподобный фактор роста (IGF-1), эпидермальный фактор роста, фактор роста эндотелия сосудов (VEGF), фактор некроза опухоли-α и фактор роста соединительной ткани. В совокупности эти участники воспаления способствуют созданию среды, в которой наблюдается повышенная пролиферация фибробластов, снижение их апоптоза и перепроизводство коллагена и внеклеточного матрикса.
В фазе ремоделирования происходит созревание ткани. Заканчивается формирование новой сосудистой сети, образуются организованные коллагеновые волокна - основа нормального рубца.
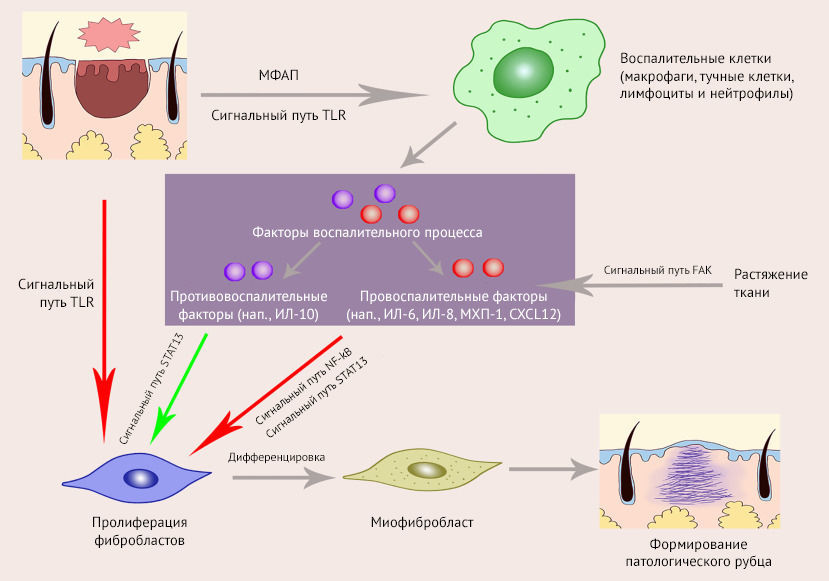
TLR - Toll-подобные рецепторы; DAMPs - молекулярные паттерны, связанные с повреждением; NF-κB - ядерный фактор каппа B; STAT-3 - преобразователь сигнала и активатор транскрипции 3; FAK - киназа местной адгезии; IL-6- интерлейкин-6; IL-8 - интерлейкин-8; MCP-1 - моноцитарный белок-хемоаттрактант-1; CXCL12 - хемокин подсемейства CXC.
Каждая фаза заживления раны требует синхронизации и регуляции множества клеточных популяций. Нарушение любого из этих процессов может привести к широкому спектру патологий: от хронических незаживающих ран до чрезмерного рубцевания. Гипертрофические и келоидные рубцы связаны с множеством неблагоприятных явлений, в их числе косметический дефект, боль, зуд, контрактуры и ограничение движений. Они становятся причинами как физических, так и психологических травм.
В чем разница между келоидным и гипертрофическим рубцом?
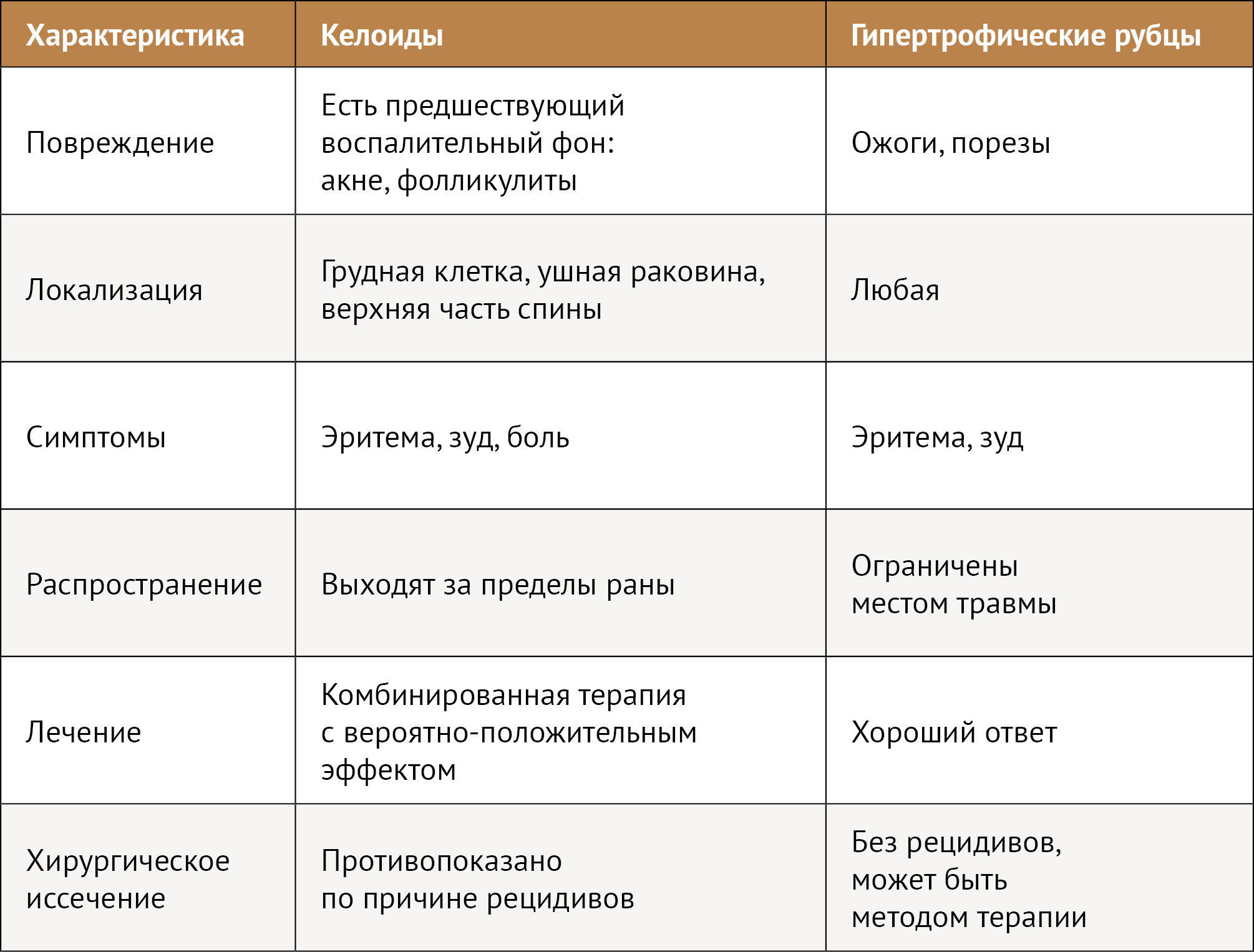
Разница между гипертрофическими и келоидными рубцами заключается в прогнозе: первые развиваются в пределах первоначальных границ раны и склонны к регрессу с течением времени, в то время как вторые растут без пространственных ограничений и редко регрессируют. Как правило, рубцы, в которых воспаление утихает в достаточно короткие сроки, становятся гипертрофическими рубцами, тогда как рубцы с длительным воспалением - келоидами.
Таб. 1. Клинические различия
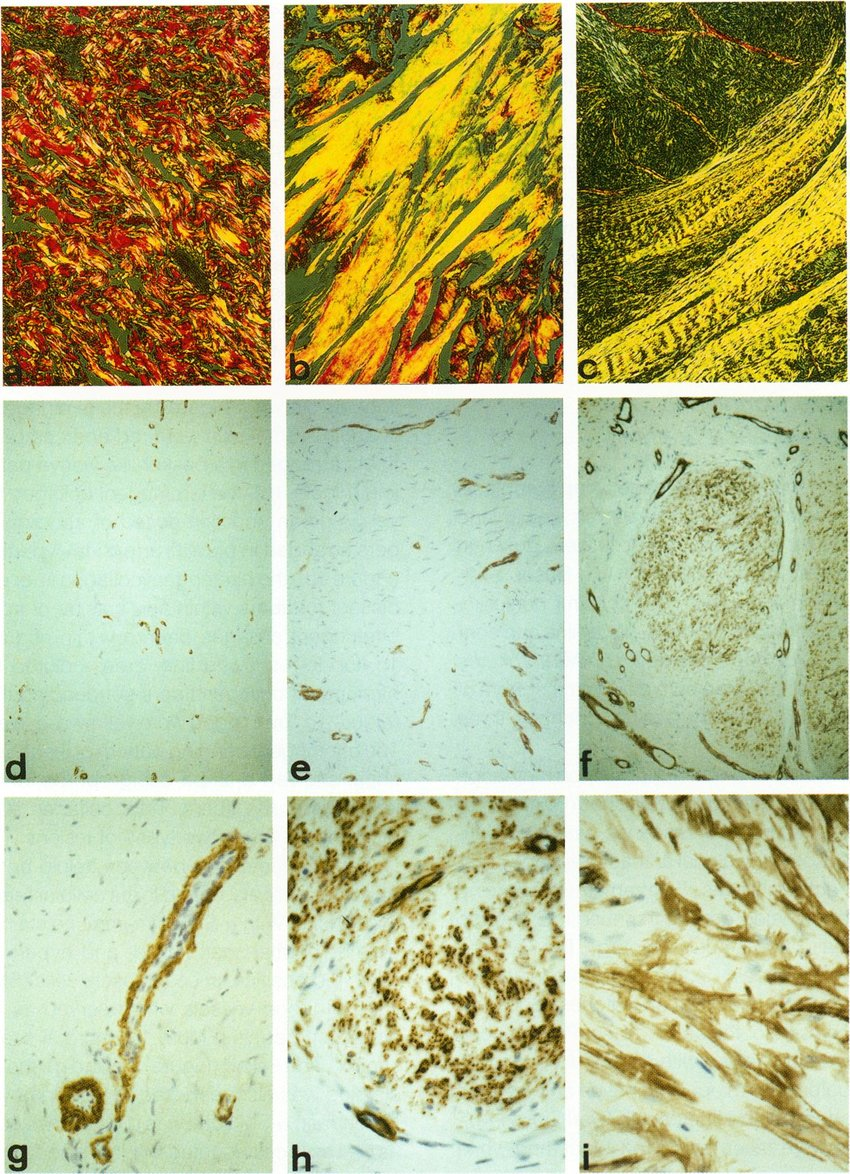
Как правило, эпидермальный слой гипертрофических и келоидных образований гистологически нормальный [2]. Патологические изменения происходят в ретикулярном слое дермы, где наблюдается избыточное отложение коллагеновых волокон и повышенная васкуляризация и клеточность. В гипертрофическом рубце происходит уплощение эпидермиса и замещение дермы тонкими коллагеновыми волокнами, организованными в виде волнистой регулярной структуры параллельной эпидермису, при этом сосуды ориентированы вертикально. Гипертрофический рубец имеет большее содержание коллагена I и III типов по сравнению с нормальной тканью, при этом наблюдается повышенное соотношение коллагена III и I типов и повышенные уровни протеогликан-дерматан-сульфата низкой плотности.
Сравнительно похожая ситуация наблюдается и в келоидных рубцах. В отличие от нормальной кожи келоиды гиперваскуляризированы, дермальный слой истончен, и в нем повышено содержание воспалительных клеток. Келоидные образования содержат больше зрелого коллагена (тип I), чем незрелого коллагена (тип III). Коллагеновых волокон очень много, при этом они имеют структуру более толстую, чем в обычной коже. Также отмечено повышенное содержание фибронектина, гликозаминогликанов, хондроитинсульфата и протеогликанов, но сниженное содержание эластина.
Предотвращение и снижение рисков
Воспалительная реакция является нормальным этапом заживления раны, служащим как иммунологическим барьером, так и стимулом для фиброзирования – закрытия поврежденного участка кожи. Наблюдения за патологическими рубцами людей разных возрастных групп показывают то, что избыточная воспалительная реакция лежит в основе чрезмерного фиброза, наблюдаемого при образовании гипертрофических рубцов.
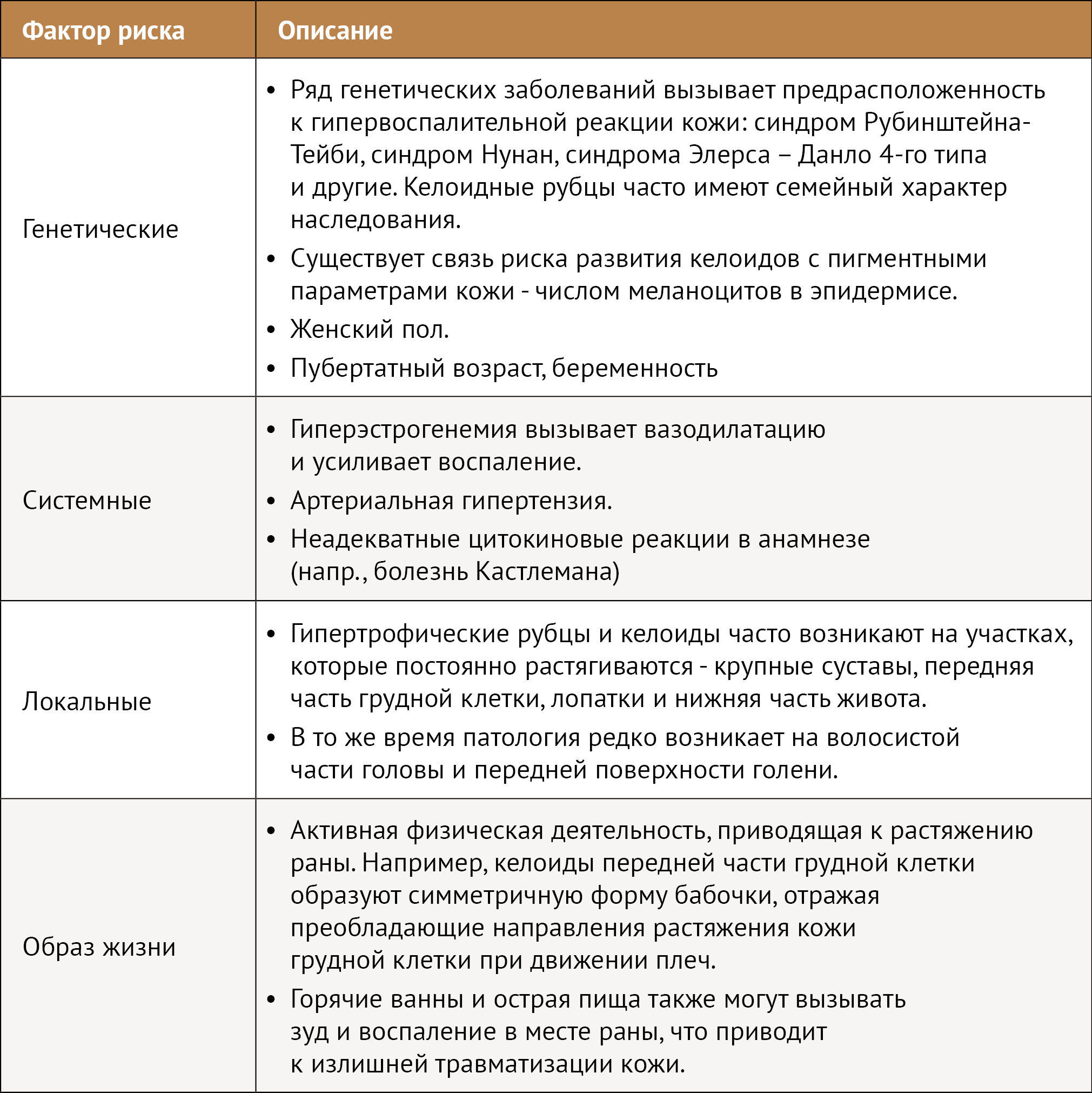
Следует выделить факторы риска патологического фиброза после повреждения кожи [4].
Таб. 2. Факторы риска патологических рубцов
Современные стратегии профилактики патологических рубцов сосредоточены на контроле воспалительной реакции. Одним из методов, значение которого невозможно переоценить, является закрытие раны без натяжения. Возможно использование различных методов пластики кожи для достижения наилучшего косметического эффекта и предотвращения натяжения тканей. Зашитые послеоперационные раны следует ежедневно промывать физиологическим раствором или дезинфицирующим средством и закрывать асептическими материалами до тех пор, пока швы не будут сняты. Это предотвращает инфицирование послеоперационной раны, тем самым блокируя чрезмерное воспаление. Если человек подвержен высокому риску образования келоидов и/или рубцы расположены на участках, склонных к патологическому рубцеванию, покой рубца (отсутствие натяжения, инсоляции, гипертермии и проч.) должен быть продлен по крайней мере на 6-12 месяцев после его формирования.
Еще одним методом профилактики является использование давящих материалов: бинтов, лейкопластырей или специализированных приспособлений. Они сводят к минимуму образование патологических рубцов. Теоретически, давящие повязки уменьшают кровоснабжение раны, что приводит к снижению синтеза воспалительных цитокинов и коллагена, что напрямую влияет на образование рубца. При этом следует учитывать способность клеток кожи реагировать на механическое воздействие. В частности, интегрины (белки клеточной мембраны) активируются механическими стимулами, что приводит к увеличению выживаемости фибробластов, а также к патологическому ремоделированию коллагена и фибрина. Пролиферация и миграция кератиноцитов аналогичным образом регулируются механическим воздействием. Так чрезмерное механическое воздействие приводит к образованию гипертрофических рубцов [6].
Возможно применение медицинских губчатых гелевых повязок. Силиконовый гелевый слой представляет собой мягкий самоклеющийся полуокклюзионный лист с медицинским силиконом и армированной мембранной подложкой в составе. При использовании такой повязки происходит увлажнение внешнего слоя эпидермиса и защита его пористой структуры от внешних агентов. Губчатый компонент повязок адсорбирует на себе экссудат и поддерживает умеренно-влажную среду внутри раневой поверхности. Силиконовую пленку накладывают примерно через 2 недели после первичной обработки раны и каждодневно сменяют на протяжении как минимум 2-х месяцев [7].
Силиконовые повязки и давящие материалы являются также консервативными методами терапии гипертрофических рубцов. Метаанализ Ая Джин-Вея с соавт. от 2017 года, состоящий из 12-ти рандомизированных контролируемых исследований, показал, что компрессионная терапия от 15 до 25 мм рт. ст. улучшает заживление послеожогового и гипертрофического рубцов, снижает воспалительный процесс [15].
На сегодняшний день неоднозначно использование растительных экстрактов. В исследовании от 2020 г. Поэтешке Дж. с соавт. было показано, что флавоноид кверцетин (содержится в таких продуктах как лук, яблоки и ягоды) ингибирует пролиферацию и активность фибробластов и выработку коллагена [8]. В ряде других исследований испытывались гели наподобие «Контратубекса» и «Mederma», однако большой и достоверной доказательной базы исследования не получили.
Массаж, субъективно уменьшающий боль и зуд также не получил достоверных доказательств в предотвращении келоидов и гипертрофических рубцов. Поскольку массаж растягивает рубец, он, наоборот, может провоцировать образование патологических формирований. Его назначение противопоказано пациентам со свежими ранами, а также пациентам с высоким риском патологических рубцов.
Использование солнцезащитного крема и увлажнение кожи с помощью смягчающих средств, таких как вазелин - два других метода профилактики. Избегание длительной инсоляции и использование солнцезащитных средств с высоким фактором защиты (SPF) защищают от воздействия ультрафиолетового излучения, которое усиливает пигментацию и ухудшает вид рубцов.
Лечение
Гипертрофические рубцы редко требуют хирургического вмешательства, кроме тех случаев, когда они стягивают суставы и ограничивают амплитуду движений. Все операции при гипертрофических рубцах нацелены на снижение натяжения тканей - используется Z-пластика, W-пластика и пластика местными кожными лоскутами.
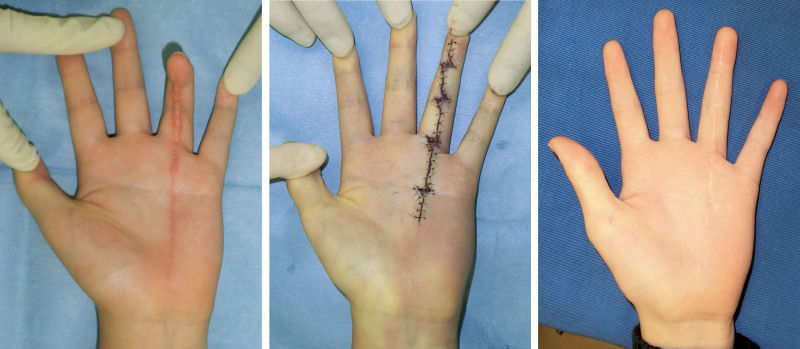
10-ти летний мальчик получил травму безымянного пальца и ладони левой руки. Развился гипертрофический рубец с рубцовой контрактурой. Поскольку ширина рубца была небольшой, шрам удалось полностью удалить. После этого на кожу над областью суставов и на складку ладони была наложена Z-пластика. Послеоперационная рана зажила без каких-либо осложнений, рубцевание завершилось в течение года.
Единичные или небольшие келоиды можно лечить консервативно. Оперативное лечение может быть использовано при наличии грубых, больших, множественных келоидов. Хирургическое вмешательство в этом случае также направлено на снижение натяжения тканей. Используются глубокие фасциальные разрезы, Z-пластика кожи, пересадка лоскутов. При келоидных образованиях мочки уха применяется клиновидное иссечение с резекцией патологически разросшейся ткани.
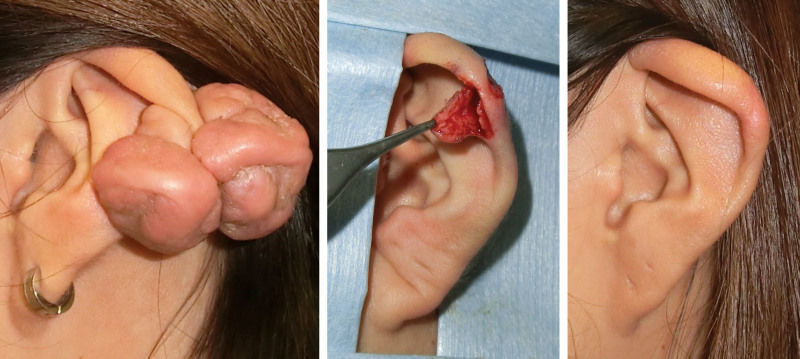
У 20-ти летней женщины развился келоид в области ушной раковины. На передней поверхности уха был выкроен кожный лоскут и хирургически удален келоид. Лоскут впоследствии был пришит полипропиленовыми нитями 6-0. После операции место было подвергнуто радиотерапии (15 Гр двумя фракциями в течение 2 дней). Рубец сформировался без осложнений в течение 18 месяцев.
Лучевая терапия является эффективным методом регрессии келоидов. Она подавляет ангиогенез и, следовательно, воспаление. Также уменьшается субъективная симптоматика: боль и зуд; в течение года улучшается цвет и толщина рубцов. Лучевую монотерапию возможно назначать пожилым пациентам или пациентам с огромными келоидами. Однако особенно эффективна лучевая терапия в качестве вспомогательного средства при хирургическом лечении. Метаанализ 2017 года Питера Манковски с соавт. показал, что комбинированное лечение связано с меньшим количеством рецидивов (22 % рецидивов), чем лучевая монотерапия (37 % рецидивов, p = 0.005) [9]. Максимальная биологически эффективная доза при келоидных рубцах составляет 30 Гр [10]. Учитывая, что кожа разных частей тела различается по структуре и восприимчивости кожи, биологически эффективная доза в 30 Гр не всегда необходима – возможно использование меньших доз облучения.
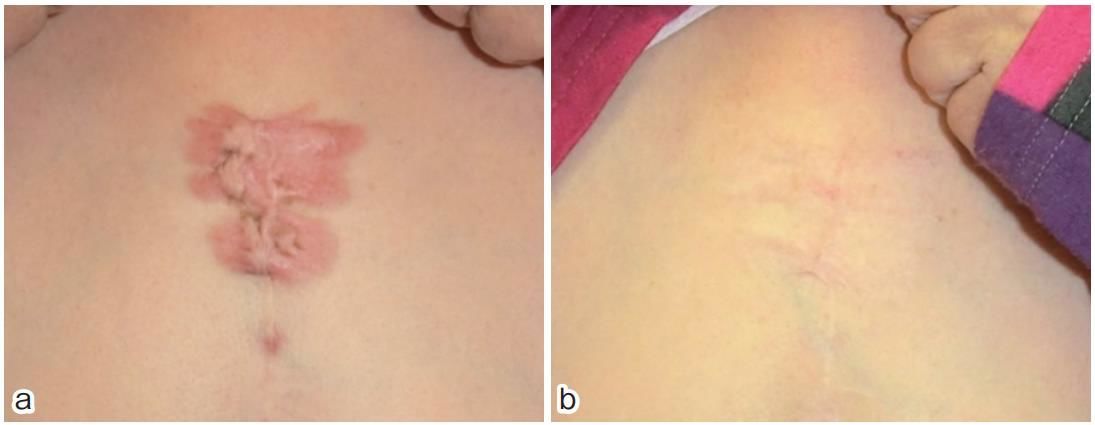
Этот келоид передней поверхности грудной клетки лечили с помощью высокодозной поверхностной брахитерапии (25 Гр пятью фракциями в течение 5 дней) [11]. Воспаление полностью прошло. Шесть месяцев спустя субъективные и объективные симптомы значительно снизились. Восемнадцать месяцев спустя сформировался физиологический рубец.
Для лечения также можно использовать несколько типов инъекционных препаратов. Одним из методов лечения гипертрофических и келоидных рубцов являются внутрикожные инъекции кортикостероидов. Кортикостероиды обладают противовоспалительными, антипролиферативными, иммуносупрессивными и сосудосуживающими свойствами, снижают боль и зуд. Стероиды уменьшают синтез коллагена и гликозаминогликанов, ингибируют пролиферацию фибробластов, что способствует развитию нормального рубца. В качестве препарата выбора используется триамцинолон в дозировке от 10 до 40 мг/мл каждые 4-6 недель. Системные побочные эффекты после применения низких доз этого препарата обычно не развиваются. Однако не исключены побочные реакции в виде гипертонии, сахарного диабета, а также местных бактериальных и грибковых инфекций. Возможными постинъекционными осложнениями могут стать: кровотечения, кровоподтеки, инфекция места прокола, стерильные абсцессы, липоатрофия, телеангиоэктазии и локализованные стероидные акне. Альтернативу или дополнение к внутрикожным инъекциям составляют кремы, гели и пластыри с глюкокортикоидами. Положительный эффект от введения кортикостероидов усиливается комбинацией с крио- или лазеротерапией [12].
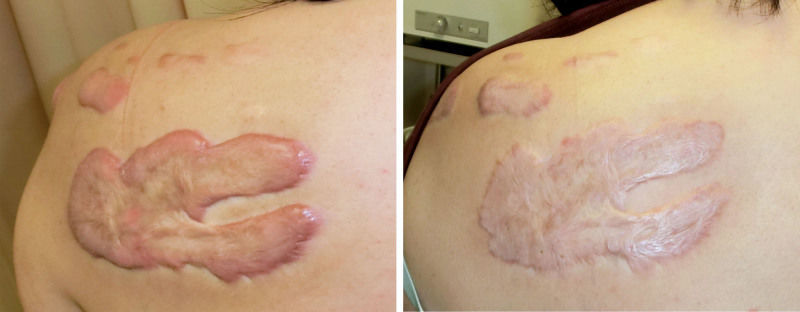
У 40-летней женщины в результате фолликулита образовался келоид на левом плече. Применена терапия пластырем с депродона пропионатом. Соблюдалось ежесуточное ношение пластыря в течение 24 часов в течение 3-х лет. Через шесть месяцев после начала терапии келоид смягчился. Через 3 года терапии рубец стал почти плоским.
Другой вариант инъекционной терапии - внутрикожное введение ботулинического токсина А, вызывающего паралич мускулатуры, окружающей рубец, и снижающего натяжение тканей. В рандомизированном контролируемом исследовании Эмана Шаарави с соавт. от 2015 года была показана эффективность препарата ботулотоксина в сравнении с инъекционной кортикостероидной терапией [13]. После лечения наблюдалось значительное уменьшение объема келоидных рубцов: уменьшение объема составило 82,7 % в группе, получавшей кортикостероиды, и 79,2 % в группе, получавшей ботулотоксин А (p < 0,01).
Следующим препаратом выбора являются инъекции 5-фторурацила, представляющего собой аналог пиримидина и ингибитор фермента тимидилатсинтазы. Его действие основано на снижении пролиферации фибробластов, индуцировании их апоптоза, торможении клеточного цикла и регрессии синтеза коллагена I типа, индуцированного трансформирующими фактором роста-β (TGF-β).
Также проводились исследования по применению блеомицина для лечения гипертрофических и келоидных рубцов. Блеомицин – цитотоксический гликопептидный антибиотик, синтезируемый бактериями Streptomyces verticillus. Механизм его действия на кожное воспаление до сих пор изучается. Исследование Кристофера Дэвид Джонса с соавт. от 2015 года показало его роль в снижении синтеза коллагена и уровня лизооксидазы, одновременной активации апоптоза фибробластов [14]. Подобно блеомицину, препарат митомицин С обладает противоопухолевыми и антипролиферативными свойствами. Его применение в клинической практике находится на рассмотрении научного сообщества, необходимы дополнительные исследования.
Лазерная терапия — еще один метод лечения патологических рубцов. Метод не является первой линией терапии в связи с низкой эффективностью и низким уровнем доказательной базы [16]. На практике чаще всего используются импульсные лазеры на красителе (PDL) в желтой полосе видимого света с длиной волны 585 нм. В систематическом обзоре Седрика Остерхоффа с соавт. от 2020 года при использовании подобных лазерных установок установлено общее снижение рубцовой эритемы на 37 %. По данным исследования наибольшей эффективностью обладают лазеры CO2 и Er:YAG с длинами волн 10 600 нм и 2 940 нм соответственно [17]. Применение высокоинтенсивной лазеротерапии направлено на восстановление микроциркуляции и снижение синтеза коллагена. Лазерная терапия может быть применена к рубцам с плоской и ровной поверхностью, поскольку в этом случае лазерный луч может равномерно достигать кровеносных сосудов в дерме. Лазеротерапия неэффективна при толстых и сильно воспаленных патологических рубцах.
Существуют и другие разработки в области терапии патологических рубцов, в том числе использование мезенхимальных стволовых клеток, пересадка жировой ткани, препараты интерферона-α-2β и человеческих рекомбинантных антител, нейтрализующих TGF-β1-3.
Последующее наблюдение
Пациенты с келоидными и гипертрофическими рубцами должны получать комплексную терапию, длительно находиться под наблюдением и обучаться обращению со своими рубцами и любыми другими ранами. Обучение пациентов самостоятельному контролю является чрезвычайно важным фактором, определяющим успех в профилактике и лечении патологических рубцов. Пациенты с гипертрофическими рубцами и келоидными рубцами могут испытывать психологический стресс, возможно консультирование с психологами для улучшения психоэмоционального состояния.
Список литературы:
- Wang Z. C., Zhao W. Y., Cao Y., Liu Y. Q., Sun Q., Shi P., Cai J. Q., Shen X. Z., Tan W. Q. (2020). The Roles of Inflammation in Keloid and Hypertrophic Scars. Frontiers in immunology, 11, 603187. doi.org/10.3389/fimmu.2020.603187
- Barone N., Safran T., Vorstenbosch J., Davison P. G., Cugno S., Murphy A. M. (2021). Current Advances in Hypertrophic Scar and Keloid Management. Seminars in plastic surgery, 35 (3), 145–152. doi.org/10.1055/s-0041-1731461
- Ehrlich H. Paul Alexis, Desmoulière Diegelmann, Robert Cohen, Irwin Compton, Carolyn Garner, W Kapanci Y, Gabbiani Giulio. (1994). Morphological and immunochemical differences between keloid and hypertrophic scar. The American journal of pathology. 145. 105-13.
- Ogawa R. (2022). The Most Current Algorithms for the Treatment and Prevention of Hypertrophic Scars and Keloids: A 2020 Update of the Algorithms Published 10 Years Ago. Plastic and reconstructive surgery, 149 (1), 79e–94e. doi.org/10.1097/PRS.0000000000008667
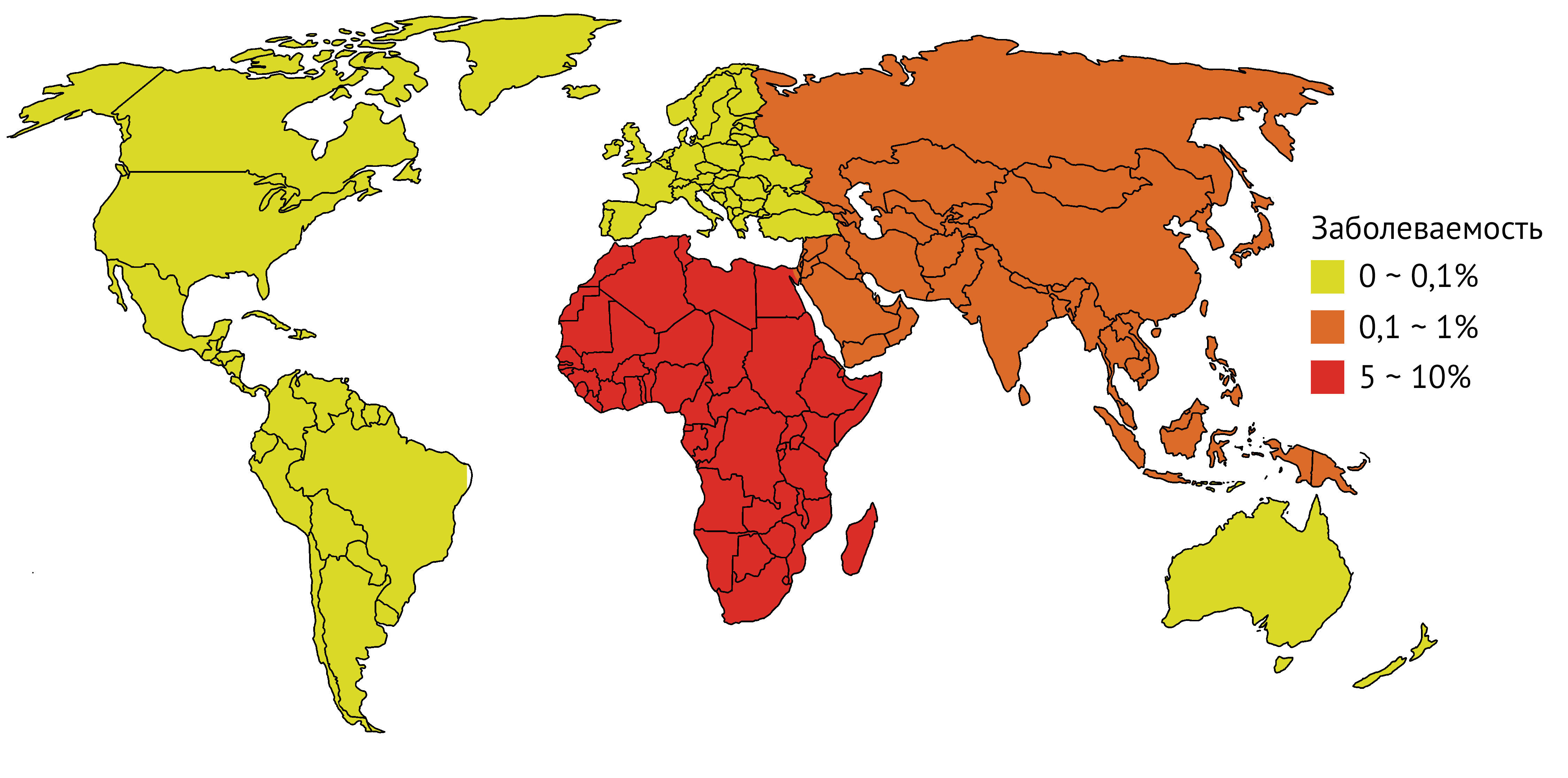
- Kiprono S. K., Chaula B. M., Masenga J. E., Muchunu J. W., Mavura D. R., Moehrle M. (2015). Epidemiology of keloids in normally pigmented Africans and African people with albinism: population-based cross-sectional survey. The British journal of dermatology, 173 (3), 852–854. doi.org/10.1111/bjd.13826
- Aarabi S., Longaker M. T., Gurtner G. C. (2007). Hypertrophic scar formation following burns and trauma: new approaches to treatment. PLoS medicine, 4(9), e234. doi.org/10.1371/journal.pmed.0040234
- Lee H. J., Jang Y. J. (2018). Recent Understandings of Biology, Prophylaxis and Treatment Strategies for Hypertrophic Scars and Keloids. International journal of molecular sciences, 19 (3), 711. doi.org/10.3390/ijms19030711
- Poetschke J., Gauglitz G. G. (2020). Onion Extract. In L. Téot (Eds.) et. al., Textbook on Scar Management: State of the Art Management and Emerging Technologies. (pp. 209–213). Springer.
- Mankowski P., Kanevsky J., Tomlinson J., Dyachenko A., Luc M. (2017). Optimizing Radiotherapy for Keloids: A Meta-Analysis Systematic Review Comparing Recurrence Rates Between Different Radiation Modalities. Annals of plastic surgery, 78 (4), 403–411. doi.org/10.1097/SAP.0000000000000989
- Guix B., Henríquez I., Andres A., Finestres F., Tello J. I., Martínez A. (2001). Treatment of keloids by high-dose-rate brachytherapy: A seven-year study. International journal of radiation oncology, biology, physics, 50 (1), 167–172. doi.org/10.1016/s0360-3016(00)01563-7
- Ogawa R., Dohi T., Tosa M., Aoki M., Akaishi S. (2021). The Latest Strategy for Keloid and Hypertrophic Scar Prevention and Treatment: The Nippon Medical School (NMS) Protocol. Journal of Nippon Medical School = Nippon Ika Daigaku zasshi, 88 (1), 2–9. doi.org/10.1272/jnms.JNMS.2021_88-106
- Yosipovitch G., Widijanti Sugeng M., Goon A., Chan Y. H., Goh C. L. (2001). A comparison of the combined effect of cryotherapy and corticosteroid injections versus corticosteroids and cryotherapy alone on keloids: a controlled study. The Journal of dermatological treatment, 12 (2), 87–90. doi.org/10.1080/095466301317085363
- Shaarawy E., Hegazy R. A., Abdel Hay R. M. (2015). Intralesional botulinum toxin type A equally effective and better tolerated than intralesional steroid in the treatment of keloids: a randomized controlled trial. Journal of cosmetic dermatology, 14 (2), 161–166. doi.org/10.1111/jocd.12134
- Jones C. D., Guiot L., Samy M., Gorman M., Tehrani H. (2015). The Use of Chemotherapeutics for the Treatment of Keloid Scars. Dermatology reports, 7 (2), 5880. doi.org/10.4081/dr.2015.5880
- Ai J. W., Liu J. T., Pei S. D., Liu Y., Li D. S., Lin H. M., Pei B. (2017). The effectiveness of pressure therapy (15-25 mmHg) for hypertrophic burn scars: A systematic review and meta-analysis. Scientific reports, 7, 40185. doi.org/10.1038/srep40185
- Leszczynski R., da Silva C. A., Pinto A. C. P. N., Kuczynski U., da Silva E. M. (2022). Laser therapy for treating hypertrophic and keloid scars. The Cochrane database of systematic reviews, 9 (9), CD011642. doi.org/10.1002/14651858.CD011642.pub2
- Oosterhoff T. C. H., Beekman V. K., van der List J. P., Niessen F. B. (2021). Laser treatment of specific scar characteristics in hypertrophic scars and keloid: A systematic review. Journal of plastic, reconstructive & aesthetic surgery: JPRAS, 74 (1), 48–64. doi.org/10.1016/j.bjps.2020.08.108
