Воспалительное старение усугубляет негативные последствия инсульта
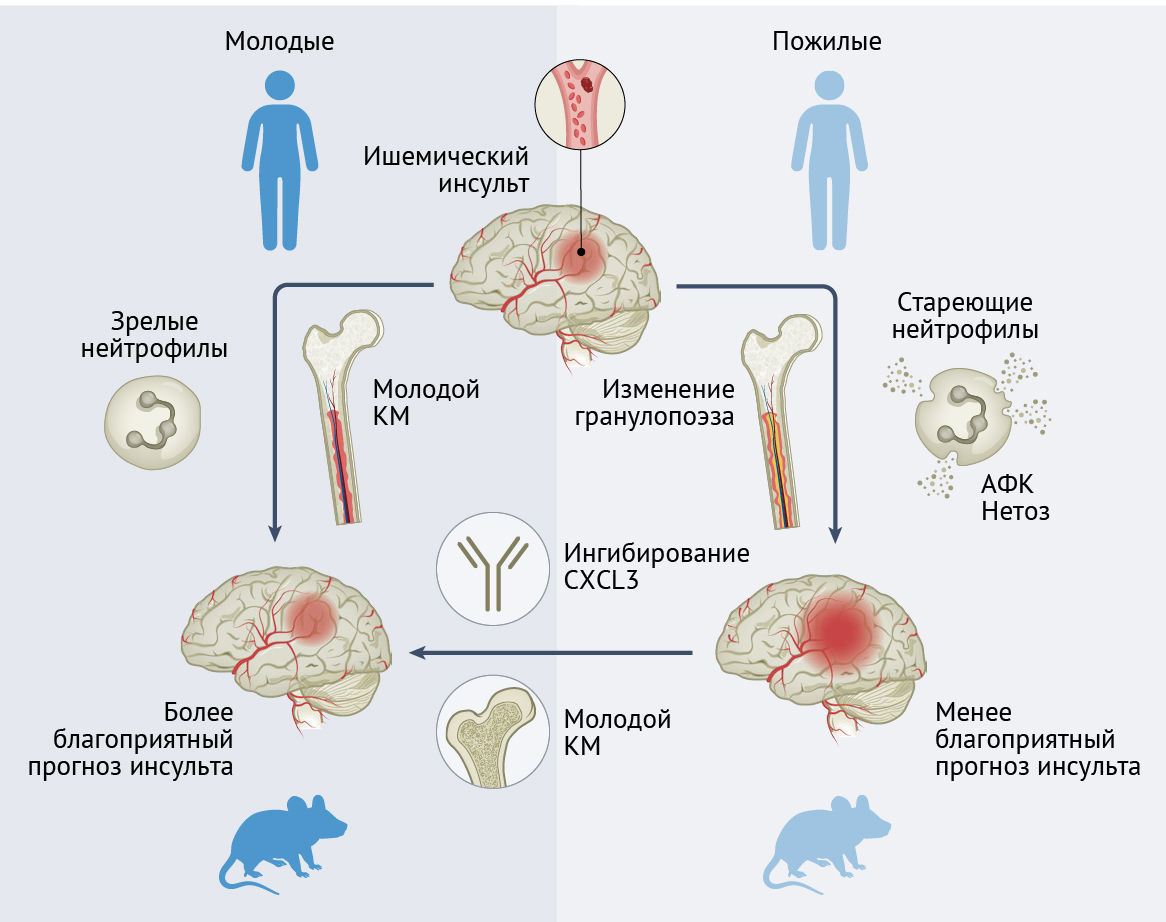
Изменения фенотипа и функциональности нейтрофилов у мышей и людей по мере старения организма усугубляют тромбовоспаление при ишемическом поражении головного мозга и определяют патологию, связанную с инсультами. Ингибирование CXCL3-сигналинга и обновление костного мозга у мышей могут помочь в ограничении повреждения головного мозга и улучшении исхода инсульта.
Ишемический инсульт представляет собой распространенное сердечно-сосудистое событие и связан с высокой заболеваемостью и смертностью [1]. Для облегчения процесса восстановления тканей после ишемического повреждения головного мозга необходим хорошо скоординированный иммунный ответ. Однако, возрастные изменения кроветворения и иммунных функций могут влиять на воспалительные процессы и усугублять патологию инсульта [2]. В этом выпуске журнала Nature Immunology Gullotta с соавт. [3] исследуется ишемический инсульт у старых мышей и пожилых людей, были выявлены возрастные изменения гранулопоэза, вызванного инсультом. Кроме того, была дана характеристика патогенной сигнатуры циркулирующих нейтрофилов, которая связана с более неблагоприятными исходами. Изменение фенотипа нейтрофилов у старых мышей путем переноса молодых кроветворных клеток улучшало регенерацию тканей после инсульта (рис. 1).
Нейтрофилы играют решающую роль в многих воспалительных состояниях, включая ишемию головного мозга. Благодаря тому, что они довольно быстро выделяются из костного мозга и способны так же быстро мигрировать в места повреждения, нейтрофилы могут обеспечить быстрый и эффективный иммунный ответ. Он в конечном итоге может помочь в регенерации тканей, но также может привести к побочному повреждению головного мозга [4]. Более того, нейтрофилы способствуют внутрисосудистым процессам тромбообразования и усиливают их даже в начале церебральных ишемических событий [5]. Таким образом, активация нейтрофилов и образование нейтрофильных внеклеточных ловушек (NET) стали потенциальными терапевтическими мишенями для уменьшения тромбовоспаления — динамического пагубного взаимодействия между тромбообразованием и воспалением, при котором каждый процесс может запускать и поддерживать другой. Борьба с тромбовоспалением улучшает исход ишемии мозга [4]. Однако, остается неясным, коррелируют ли возрастные изменения нейтрофильного компартмента с патологией инсульта, и влияют ли они на нее. В работе Gullotta с соавт. [3] было показано, что у старых мышей на ранних стадиях инсульта наблюдается повышенная концентрация нейтрофилов в микроциркуляторном русле головного мозга. В сочетании с усиленным выделением фибрилл ДНК из клеток в закупоренных сосудистых сегментах это свидетельствует о важной роли стареющих нейтрофилов в церебральном тромбовоспаленим у старых мышей.
Авторы провели подробный клеточный и молекулярный анализ состояния людей и мышей, перенесших инсульт, и обнаружили, что при старении нейтрофилы меняют свой фенотип и функциональность [3]. В частности, преобладание подгрупп нейтрофилов с фенотипами CD177hiCD101loCD62Llo, а также CD101+ CD62Llo, называемых стареющими нейтрофилами, была связана с повышенной способностью образовывать активные формы кислорода и повышенной склонностью к нетозу. Среди кластеров нейтрофилов, которые Gullotta с соавт. [3] исследуют у людей и мышей, некоторые подтипы напоминают ранее описанные нейтрофилы, определяемые низкой экспрессией CD62L и высокой экспрессией CXCR4 и обладающие повышенной воспалительной и миграционной способностью [3]. Gullotta с соавт. [3] обнаружили в костном мозге мышей большое количество стареющих нейтрофилов CD177hiCD101loCD62Llo и CD101+ CD62Llo. Также удалось узнать, что нейтрофилы способны быстро попадать в кровоток и накапливаться в очаге церебральной ишемии. Присутствие фенотипа CD62Llo было связано с плохой реперфузией у людей, перенесших инсульт, и предвещало худший исход.
Gullotta с соавт. [3] представили прямые доказательства того, что возрастные изменения нейтрофильного компартмента определяют патологию инсульта у старых мышей. Путем адаптивного переноса нейтрофилов костного мозга от старых мышей к молодым перенесшим инсульт реципиентам было доказано, что возрастные изменения фенотипа нейтрофилов вызывают патологические изменения, связанные с инсультом. Обновление костномозгового компартмента путем трансплантации “молодого” цельного костного мозга стареющим мышам привело к изменению кластеров нейтрофилов в сторону снижения количества патогенных нейтрофилов CD62Llo. Это было связано с уменьшением участков гибели тканей (инфарктов) и улучшением исхода инсульта головного мозга по сравнению с результатами, полученными в результате трансплантации “старого” костного мозга мышам. Это наблюдение также предлагает механистическое объяснение предыдущих данных о том, что опосредованное антителами истощение нейтрофилов улучшало исход ишемического инсульта у старых мышей и не влияло на молодых мышей [7]. Несмотря на результаты эксперимента по трансплантации Gullotta с соавт. [3], которые показали, что возрастные внутренние клеточные изменения в нейтрофилах способствуют возникновению стареющего фенотипа CD62Llo, стоит отметить, что на созревание нейтрофилов также могут влиять внешние факторы окружающей среды, включая микробиом [8].
Если говорить о молекулярных сигнальных путях, измененных у перенесших инсульт пожилых людей и старых мышей, стоит отметить, что Gullotta с соавт. [3] обнаружили экспрессию в связанных со старением нейтрофилах CD62Llo хемокина CXCL3 и обильное выделение его в кровоток после инсульта. Введение CXCL3 молодым мышам приводило к появлению стареющих нейтрофилов CD62Llo и было связано с нарушением реперфузии и худшими исходами при ишемическом инсульте. Опосредованная антителами нейтрализация CXCL3 уменьшала связанную с инсультом патологию и улучшала исход болезни у старых мышей, а также у тех молодых мышей, которым вводили стареющие нейтрофилы CD62Llo. Это указывает на то, что CXCL3 действует как ауторегуляторный сигнал, влияющий на старение нейтрофилов. Хотя патофизиологическая роль оси CXCL3–CXCR2 и ее терапевтическое значение еще предстоит более подробно изучить, исследования показали резкое усиление экспрессии Cxcl3 во время ранней фазы ишемии миокарда у мышей [9]. Таким образом, эта реакция может представлять собой общий ответ нейтрофилов.
Воспалительные реакции являются частью системы защиты организма от инфекции и травм. Однако, по мере старения организма развивается хроническое состояние стерильного воспаления низкого уровня, называемое воспалительным старением (англ. inflammaging — прим. перев.), которое считается фактором риска многих болезненных состояний, включая инсульт [10]. Детальные изменения, происходящие на клеточном уровне и в определенных компартментах, остаются не до конца изученными. Важно отметить, что возрастные изменения происходят не только в тканях, но и на системном уровне. В этот процесс вносят свой вклад нейтрофилы, так как их фенотип и функции тесно переплетены с фенотипом органов, в которых они находятся (временно) [11]. При воспалительном старении измененные нейтрофилы также могут передавать воспалительные сигналы периферическим тканям, вызывая повреждения отдаленных органов [12]. Таким образом, воздействие на стареющие нейтрофилы может не только устранить воспаление во внутренних органах, но и уменьшить воспалительную нагрузку, связанную со старением. В будущем крайне важно определить специфические мишени тканевого воспаления, опосредованного стареющими нейтрофилами CD62Llo, которые не нарушают иммунитет на системном уровне. Исследуя старых мышей и пожилых людей, Gullotta с соавт. подчеркнули важность применения трансляционных моделей, которые воспроизводят определенные не проявляющиеся у молодых животных патологические процессы, такие как воспалительные сигналы.
Таким образом, Gullotta с соавт. [3] определили возрастные изменения нейтрофилов у людей и мышей, перенесших инсульт, и описали ингибирование оси хемокина CXCL3 как потенциальную терапевтическую стратегию. Их исследование также доказывает концепцию о том, что “омоложение” гемопоэтического компартмента изменяет гетерогенность нейтрофилов и влияет на патологии, возникающие в результате инсульта. Следовательно, нейтрофилы играют существенную роль в возрастных патологиях, и эту концепцию стоит изучить и при других заболеваниях [2].
