Уремическая энцефалопатия

Синдром уремической энцефалопатии включает в себя спектр различных нарушений функций мозга от легкого нарушения концентрации внимания вплоть до комы. Кроме того, пациенты с почечной недостаточностью подвержены и другим энцефалопатиям, которые могут развиться при наличии сопутствующих факторов, например таких как нарушения сна, недостаточность питания и осложнениями заместительной почечной терапии.
У пациентов с уремией мозг обладает пониженной метаболической активностью и, соответственно, характеризуется сниженным потреблением кислорода. Исследования указывают на роль в этих процессах уремических токсинов, накапливающихся из-за почечной недостаточности. В результате их воздействия происходит нарушение баланса возбуждающих и ингибирующих нейротрансмиттеров, осуществляемое органическими веществами, в частности соединениями на основе гуанидина, содержание которых в спинномозговой жидкости повышено. Эти соединения являются антагонистами рецепторов γ-аминомасляной кислоты (ГАМКА) и в то же время агонистами NMDA-рецепторов, что приводит к повышенной корковой возбудимости. При почечной недостаточности увеличивается содержание асимметричного диметиларгинина (ADMA), ингибирующего эндотелиальную синтазу оксида азота, и его уровень коррелирует с выраженностью цереброваскулярных осложнений у данной группы пациентов.
Нарушения в метаболизме моноаминов, включая снижение уровня норадреналина и подавление выработки дофамина в ЦНС, в модели на уремических крысах были связаны с моторными расстройствами. Происходящая нейрональная дисфункция также обусловлена снижением транспортной функции клеток ЦНС и повышением проницаемости гематоэнцефалического барьера (ГЭБ), воздействием миоинозитола, карнитина, индоксила сульфата и полиаминов. На процесс нейродисфункции могут влиять в том числе и метаболиты некоторых лекарств, например циметидина и ацикловира, концентрация в крови которых повышается вследствие ингибирования транспортера органических анионов (OAT-3). Концентрация опиатов и в особенности меперидина также способна повышаться из-за снижения их экскреции. Вторичный гиперпаратиреоидизм может играть роль в развитии уремической энцефалопатии посредством увеличения мозгового кальция и кальциевых транспортеров в нейронах, чувствительных к паратиреоидному гормону.
Также при уремии возникают нарушения в области регуляции аппетита. Проникновение большого количества триптофана через гематоэнцефалический барьер может повышать синтез серотонина — главного ингибитора аппетита. Одновременно с этим затрагиваются и другие звенья регуляции пищевого поведения: наблюдаются высокие уровни холецистокинина (мощного анорексигенного гормона) и низкое содержание нейропептида Y (стимулятора аппетита). Возможно развитие кахексии как результата не только анорексии, но и ацидоза, воспаления. Провоспалительные цитокины, такие как лептин, ФНО-α, ИЛ-1, могут стимулировать синтез анорексигенных нейропептидов, проопиомеланокортина и α-меланоцитостимулирующего гормона в аркуатных ядрах гипоталамуса. Все эти факторы приводят к недостаточности питания у многих пациентов с почечной недостаточностью.
В то время как около 20 % всех пациентов с острым почечным повреждением, находящихся в отделениях интенсивной терапии, имеют неврологические нарушения, у пациентов с хронической почечной недостаточностью не обнаружено четкой корреляции между неврологическими симптомами и тяжестью уремии. Популяционные исследования выявили когнитивные нарушения у 30 % пациентов на гемодиализе, при этом примерно у 10 % из них — тяжелой степени тяжести. Уремическая энцефалопатия может манифестировать как комплекс ментальных расстройств и/или моторных нарушений. Ментальные нарушения включают в себя депрессию, повышенную тревожность, когнитивные нарушения и расстройства памяти. Наиболее серьезные формы генерализованных нарушений характеризуются расстройством сознания, делирием, психозами, судорогами, комой и в конечном счете смертью.
Серьезные двигательные нарушения возникают редко. Обычно уремическая энцефалопатия манифестирует мелкоразмашистым тремором, астериксисом и гиперрефлексией. Астериксис характеризуется повторяющимся неритмичным снижением мышечного тонуса антигравитационный мускулатуры (наиболее часто — рук). От тремора он отличается тем, что не является осцилляциями, то есть нет устойчивого временного шаблона, а также тем, что в данном случае происходит именно снижение тонуса мускулатуры. Также могут наблюдаться миоклонии — они похожи на астериксис, однако возникают во время активации антигравитационный мускулатуры. По этой причине некоторые рассматривают астериксис как негативную форму миоклонии. Астериксис и миоклонии могут быть вызваны при вытягивании ладоней вперед. Но есть и более чувствительный прием для их определения — высунутый язык или вытянутый указательный палец, опирающийся на твердую поверхность. Астериксис и миоклонии встречаются у пациентов с почечной недостаточностью, которые получали различные медикаменты, в частности метоклопрамид, фенотиазины, антиэпилептические препараты, включая габапентин, а также опиоиды, особенно меперидин.
Диагноз уремическая энцефалопатия основывается на клинике и подтверждается положительной динамикой течения энцефалопатии после начала адекватной терапии. Люмбальная пункция, ЭЭГ, визуализационные методы исследования служат в основном для исключения другой этиологии заболевания у пациентов, у которых уремический генез энцефалопатии вызывает сомнения. Показатели при анализе спинномозговой жидкости часто выходят за пределы нормы, может наблюдаться плеоцитоз (обычно менее 25 клеток в 1 мкл) и повышение концентрации белка в ликворе (обычно не более 100 мг/дл). ЭЭГ также покажет патологию, но без специфических изменений.
Визуализация мозга чаще всего выявляет его атрофию и увеличение желудочков. Тем не менее иногда, в ограниченном числе случаев при МРТ головного мозга можно обнаружить специфические изменения в области базальных ганглиев, хотя подобные признаки могут сопровождать и метаболический ацидоз, и метаноловую интоксикацию. Изменения, лучше всего заметные в режимах Т2-WI/FLAIR, представляют собой гиперинтенсивные четко очерченные границы скорлупы (латерально — наружная капсула, медиально — внутренняя капсула, внутренняя и наружная мозговые пластинки) с обеих сторон и в целом по форме несколько напоминающие вилку. По сути это является отображением диффузного вазогенного отека базальных ганглиев из-за нарушения процессов ауторегуляции.
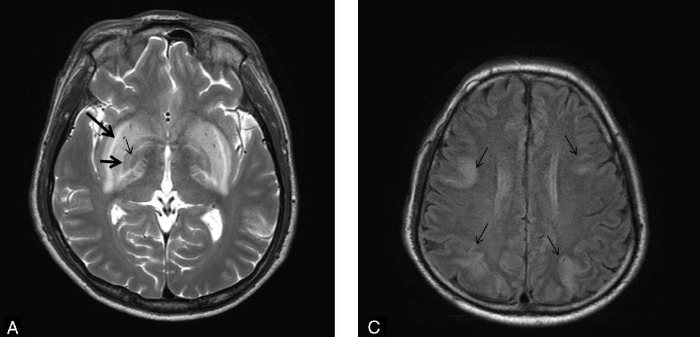

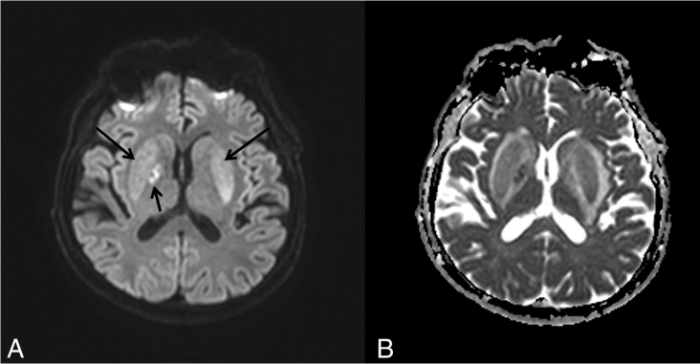
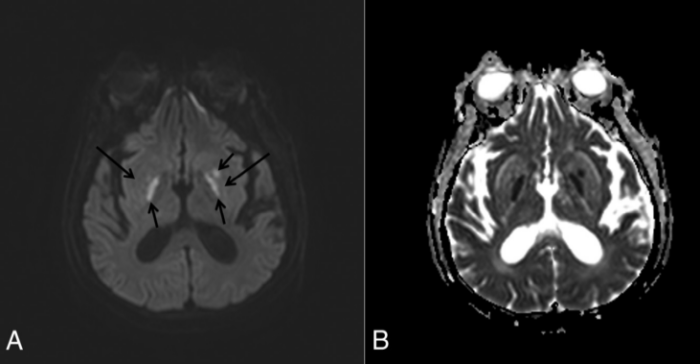
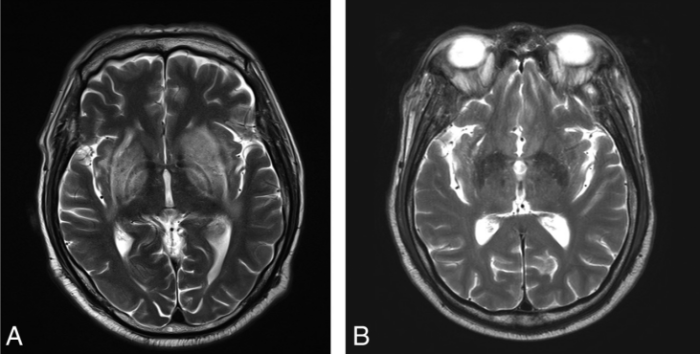
Дифференциальный диагноз уремической энцефалопатии проводится с гипертензивной энцефалопатией (задней обратимой лейкоэнцефалопатией), синдромом системного воспалительного ответа у септических пациентов, системными васкулитами, болезнями малых и больших сосудов и субдуральной гематомой. Судорожная активность может возникать вторично при уремической энцефалопатии, гипертензивной энцефалопатии, церебральной эмболии или выраженных водно-электролитных нарушениях.
Многие пациенты, находящиеся на гемодиализе, страдают от обструктивного апноэ сна вне зависимости от наличия у них ожирения. При этом у них наблюдается и обструктивное, и центральное апноэ сна. Не менее распространенным осложнением почечной недостаточности является синдром беспокойных ног (синдром Экбома), чаще возникающий у женщин. Это заболевание может быть результатом снижения дофаминергической модуляции кортикальной возбудимости, а также следствием уменьшения влияния пирамидной системы и повышения возбудимости нейронов спинного мозга. Существуют данные, что центральную роль в развитии синдрома беспокойных ног играет дефицит железа или патология транспорта железа в ЦНС. Железо является кофактором фермента тирозингидроксилазы, служащего лимитирующим фактором в биосинтезе дофамина.
Источники:
- Seifter J. L., Samuels M. A. Uremic encephalopathy and other brain disorders associated with renal failure //Seminars in neurology. – © Thieme Medical Publishers, 2011.
- Kim D. M., Lee I. H., Song C. J. Uremic encephalopathy: MR imaging findings and clinical correlation //American Journal of Neuroradiology. – 2016.
