Метаболические эффекты прекращения курения
Абстракт | Несмотря на широкую осведомленность о негативном воздействии табака на здоровье, курение продолжает оставаться основной причиной предотвратимой смертности в США. Исследовательские данные показывают, что прекращение курения часто сопровождается постепенным набором веса и повышением чувствительности к инсулину. Однако, как бы парадоксально это ни звучало, ожирение, развивающееся после прекращения курения, может способствовать инсулинорезистентности. Более того, привес после отказа от курения является главной причиной, по которой курильщики, особенно женщины, не могут бросить курить или возвращаются к курению спустя непродолжительное время. В этом обзоре авторы обсуждают метаболические эффекты отказа от курения и освещают перспективы развития программ для прекращения курения и разработки методов лечения, уделяя при этом особое внимание уменьшению набора веса после отказа от курения.
Сокращение потребления табака или полное прекращение курения требует особого внимания в области здравоохранения на глобальном уровне. По оценкам ВОЗ, каждый год приблизительно 6 миллионов человек преждевременно умирают от болезней, связанных с курением, при этом большая часть смертности приходится на страны со средним и низким уровнем дохода [1].
В 2008 году ВОЗ представила практический и экономически эффективный способ уменьшения потребления табака во всем мире под названием MPOWER [1]. В список шести мер MPOWER входят:
- контроль потребления табака и политика профилактики (M — monitoring),
- защита людей от потребления табака (P — protection),
- оказание помощи в прекращении употребления табака (O — offering help),
- предостережения о вреде табака (W — warning),
- запрет на рекламу, пропаганду и финансирование (E — enforcing bans),
- и повышение налогов на табачные продукты (R — raising taxes) [1].
Из 6 миллионов смертей от курения более 5 миллионов являются результатом прямого употребления табака и более 600 тысяч — результатом пассивного курения [1]. Курение связано с повышенным риском многих состояний, среди которых различные виды новообразований, сахарный диабет 2 типа (СД2), сердечно-сосудистые заболевания, хроническая обструктивная болезнь легких (ХОБЛ), врожденные пороки развития, негативное воздействие на репродуктивную функцию мужчин (например, эректильная дисфункция), остеопороз, переломы шейки бедра и позвоночника, а также общее ухудшение здоровья [2‒5]. Побочные эффекты табака у курящих женщин (снижение фертильности, преждевременные роды и внематочная беременность) встречаются чаще, чем у некурящих [5, 6], поскольку курение снижает уровень эстрогена в организме [7]. Более того, в 2015 году было показано, что курение и никотин связаны с повышенным риском несчастных случаев и суицидов. Связь с суицидом, вероятно, осуществляется через влияние никотина на уровень серотонина [8]. Некоторые канцерогенные эффекты никотина также были освещены в обзоре, опубликованном в 2014 году [9]. Помимо этого, пассивное курение связано с серьезными негативными последствиями, такими как низкая рождаемость у женщин, подвергающихся пассивному курению, синдром внезапной детской смерти и СД2 [10]. В 2012 году сообщалось о том, что пассивное курение связано как с СД2, так и с ожирением, тогда как активное курение связано только с СД2 [11].
Кроме того, курение приводит к значительным финансовым затратам для общества. В период с 2009 по 2012 год курение обошлось США в $289–332,5 млрд. (≈20 трлн. ₽), причем 46–53 % этой суммы пришлось на медицинское обслуживание взрослых, а остальное было потрачено из-за снижения производительности труда [5]. Таким образом, негативное воздействие курения приводит к снижению качества жизни и гибели людей и может привести к личным и государственным финансовым нагрузкам. Следовательно, отказ от курения является личной (для курильщиков), национальной и глобальной необходимостью. Один из наиболее значительных успехов в понимании связи между табачным дымом и сердечно-сосудистыми заболеваниями был достигнут в 1992 году в результате исследования, в котором использовались методы оценки инсулин-опосредованного поглощения глюкозы для того, чтобы показать, что курильщики имеют более высокую инсулинорезистентность (и компенсаторную гиперинсулинемию), чем некурящие [12]. У курильщиков также повышен уровень триглицеридов в плазме и понижен — холестерина ЛПВП [12]. С тех пор эти данные были воспроизведены в многочисленных исследованиях [13‒19] и подтвердили мнение о том, что резистентность к инсулину приводит к дислипидемии [20] и эндотелиальной дисфункции [21] у курильщиков. Курение также является основным фактором риска неалкогольной жировой болезни печени [22]. Будучи вариантом нормы для некоторых людей и животных, избыточное отложение жира в печени может привести к воспалению печени и рубцеванию, а в тяжелых случаях — к печеночной недостаточности [23‒25].
Ключевые моменты
- Как правило, существует обратная связь между курением и ИМТ
- Ожирение, возникшее после прекращения курения, может способствовать инсулинорезистентности
- Главная причина нежелания бросить курить или рецидива курения после прекращения — это страх увеличения массы тела после прекращения курения, особенно у женщин и у людей с избыточным весом
- Дальнейшие программы прекращения курения и методы лечения должны быть разработаны с акцентом на снижение веса после отказа от курения
- Преимущества прекращения курения перевешивают риски
Потеря веса, вызванная никотином
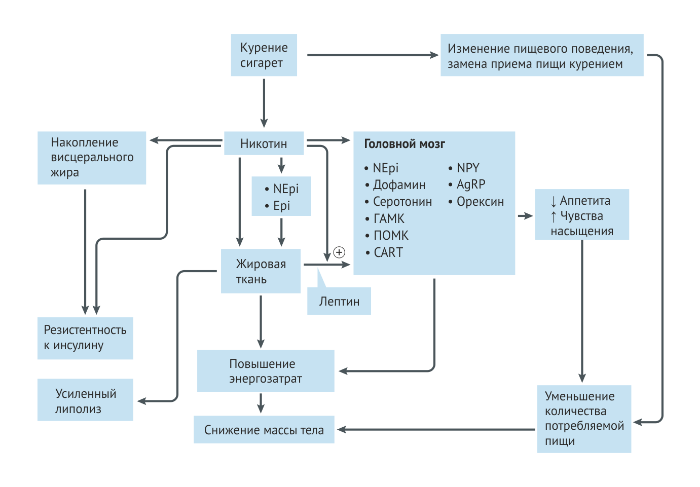
Чтобы понять влияние прекращения курения на обмен веществ, мы должны сначала понять влияние курения и никотина на массу тела и метаболические показатели. Курение и никотин непосредственно влияют на метаболизм глюкозы и массу тела в результате изменений в обмене веществ, активации липопротеинлипазы, расщепляющей триглицериды с образованием свободных жирных кислот, активации симпатической нервной системы и других изменений, приводящих к увеличению потребления энергии и потере веса [26]. Употребление никотина снижает аппетит и ускоряет обмен веществ, что приводит к потере веса у грызунов и людей [27]. Таким образом, употребление никотина может привести к снижению массы тела (Рис. 1) и другим метаболическим и эндокринным эффектам. К некоторым механизмам, с помощью которых никотин вызывает потерю веса, относят: прямую стимуляцию рецептора меланокортина-4 (MC4-R), что приводит к снижению потребления пищи [28] и к снижению уровня лептина в сыворотке [29, 30]; повышенную стимуляцию симпатической нервной системы, что приводит к увеличению уровней адреналина и норадреналина [31] (Рис. 1); активацию липолиза [32] (Рис. 2) и другие изменения [30‒32].
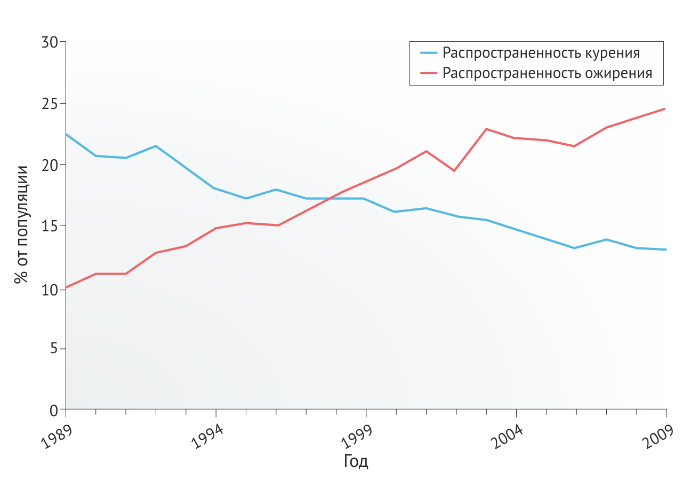
Снижение распространенности курения сопровождается увеличением распространенности ожирения, хотя причинно-следственная связь до сих пор не была показана (Рис. 3). Существует обратная дозозависимая связь между курением и ИМТ, причем некоторые курильщики имеют ИМТ ниже нормы [33]. С другой стороны, существует положительная корреляция между количеством выкуренных сигарет и накоплением абдоминального жира [34]; многие люди ценят способность никотина снижать массу тела [35]. В целом как активное, так и пассивное курение увеличивает риск СД2 [10]. Хотя использование электронных сигарет приводит к потере веса у мышей [36], пока не проводилось исследований по изучению влияния электронных сигарет на массу тела или гликемические показатели у людей.
Никотин-индуцированная потеря веса является результатом снижения передачи сигналов чувства голода в гипоталамусе и увеличения энергозатрат из-за повышенной двигательной активности, увеличения термогенеза в бурой жировой ткани, увеличения в ней экспрессии UCP1 и UCP3 и изменений в процессах утилизации субстратов энергии [29, 37]. На биохимическом уровне никотин вызывает потерю веса в результате инактивации 5'-АМФ-активируемой протеинкиназы (AMPK), контролирующей энергетический баланс клеток гипоталамуса [37].
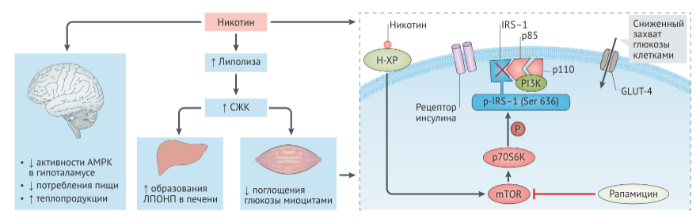
GLUT-4 — инсулинзависимый транспортер глюкозы 4; Н-ХР — Н-холинорецептор; PI3K — фосфатидилинозитол-3-киназа; p85 — регуляторная α-субъединица PI3K; p110 — каталитическая субъединица PI3K.
Отказ от курения
Прибавка в весе после отказа от курения
Широкая осведомленность населения о негативных последствиях курения привела к уменьшению количества курящих людей среди представителей всех этнических групп в США [38]. Согласно статистическим данным, опубликованным в 2014 году, процент курящего взрослого населения США снизился с 20,9 % (2005 г.) до 17,8 % (2013 г.) [39]. При этом наилучшее состояние здоровья было отмечено у тех, кто отказался от курения как можно раньше [40]. Хотя потребление табачной продукции в целом снизилось, использование электронных сигарет, напротив, стало более распространено, особенно среди подростков [5, 41].
Научно обоснованные рекомендации для курильщиков, решивших бросить, предлагают различного рода стратегии по отказу от курения и могут быть полезны в преодолении данной зависимости [42], однако в реальных условиях курение было и остается тяжелым бременем, от которого сложно избавиться. Несмотря на то, что около 70 % курящих людей (как подросткового возраста, так и взрослых) заявляют о своем желании перестать курить, ежегодно только около 7 % из тех, кто пытается бросить курить самостоятельно, удается достичь устойчивого результата [43].
Имеющиеся в настоящее время на рынке продукты для прекращения курения (включая лекарственные средства и заменители табака) повышают шансы курильщика на преодоление зависимости при условии его личной заинтересованности в результате, но в действительности эффективность подобных средств остается довольно низкой [44]. Основной причиной, по которой зависимые от курения люди продолжают испытывать тягу к табаку, является действие никотина, вызывающее сильное привыкание [43]. При этом основным препятствием на пути избавления от зависимости оказывается прибавка в весе после отказа от курения, из-за чего курильщики, особенно женщины, не могут решиться на отказ от привычки или же возвращаются к курению снова вскоре после отказа [45]. Поэтому далее в нашем обзоре будут рассмотрены метаболические эффекты, вызванные отменой курения, с акцентом на увеличение массы тела.
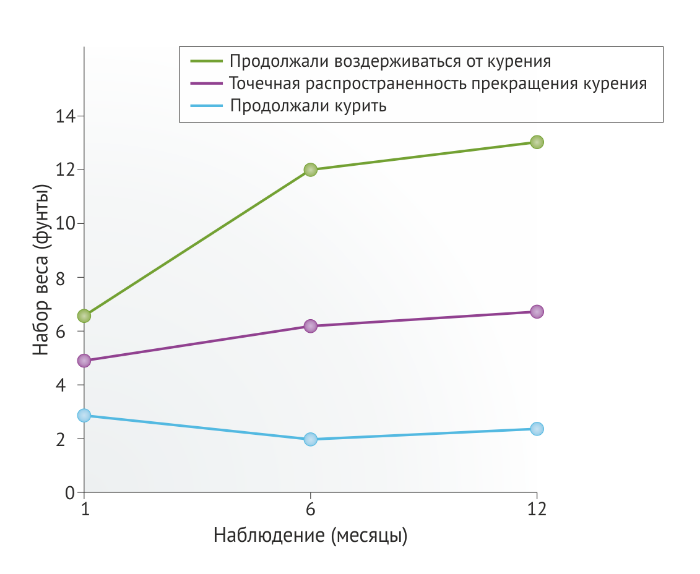
Во вставке 1 обобщены результаты метаанализа, проведенного в 2015 году и отражающего увеличение веса у взрослых людей после отказа от курения [46]. По данным другого исследования [47], вес людей, зависимых от курения, был в среднем на 4‒5 кг меньше в сравнении с некурящими людьми, однако после отказа от привычки курильщики набирали около 4,5 кг за 6‒12 месяцев и значения массы их тела выравнивались с показателями кривой вес-возраст, наблюдаемой для некурящих людей (Рис. 4) [31]. Такое увеличение массы тела у бывших курильщиков может продолжаться вплоть до десяти лет после отказа от курения (Рис. 5) [31, 48]. Набор до 69 % веса в первые 3 месяца после прекращения курения объясняется повышением количества потребляемых за сутки калорий в среднем на 227 ккал [48]. Около 13 % людей, бросивших курить, набирали более 10 кг веса в год, причем наибольшая прибавка веса наблюдалась в первые месяцы после отказа от курения, а затем вес продолжал расти в течение шести месяцев и более [48]. Увеличение массы тела в период отказа от курения сопровождается, соответственно, и увеличением процента жировых отложений в организме [31]. В США к факторам риска, ассоциированным с набором веса после прекращения курения, относят: принадлежность к афро-американской этнической группе, возраст до 55 лет; предшествующую сильную табачную зависимость (курение > 25 сигарет в день), низкий социально-экономический статус, наличие факторов генетической предрасположенности (продемонстрировано в исследованиях на близнецах) [31]. Кроме того, следует учитывать, что многие курильщики уже имеют избыточный вес на момент начала их попыток бросить курить [33].
-
Поиск данных (до января 2015) производился по пяти электронным базам данных. В обзор были включены популяционные проспективные когортные исследования, включавшие изменение веса с момента бросания курения до трех месяцев спустя, что в итоге составило 35 исследований с суммарным количеством в 63 403 участников, бросивших курить, и 388 432 курильщиков.
-
У бросивших курить наблюдалась четкая связь отказа от курения с набором веса; среднее увеличение массы тела у них составило 4,10 кг (ДИ 95 %, 2,69–5,51; P < 0,001 по сравнению с теми, кто продолжил курить), в то время как среднее увеличение ИМТ составило 1,14 кг/м² за пятилетний период (ДИ 95 % 0,50–1,79; P = 0,137 по сравнению с теми, кто продолжал курить).
-
Эти данные свидетельствуют о том, что набор веса является главным неблагоприятным последствием прекращения курения.
-
Однако набор веса не нивелирует благоприятные эффекты прекращения курения. Поэтому врачам следует продолжать рекомендовать пациентам прекращение курения для улучшения здоровья и устранения или ослабления неблагоприятных последствий для здоровья. Кроме того, клиницистам и исследователям стоит сосредоточиться на разработке и внедрении успешных программ по контролю веса для пациентов на любой стадии попыток прекратить курение.
Результаты еще одного метаанализа, включающего 62 исследования, говорят об увеличении веса у курильщиков, которые воздерживались от курения как минимум в течение 12 месяцев [49]. Оказалось, что прибавка в весе после отказа от курения была гораздо большей, чем предполагалось ранее. Участники исследования, бросившие курить без помощи лекарственных средств (включая заменители никотина), в среднем набрали 1,1 кг за первый месяц и 2,3 кг за второй; вес продолжал расти и достигал прибавки 4,7 кг по прошествии 12 месяцев после отказа от курения. У 13 % человек прибавка в весе составила более 10 кг; при этом у 16 % бросивших курить, напротив, отмечалось снижение веса после прекращения курения [49]. Использование фармакологических препаратов не помогло умерить набираемый после отказа от курения вес. Таким образом, прибавление веса было сходным по динамике и у тех людей, кто не принимал никаких средств, и у тех, кто использовал заменители никотина, такие как бупропион или варениклин.
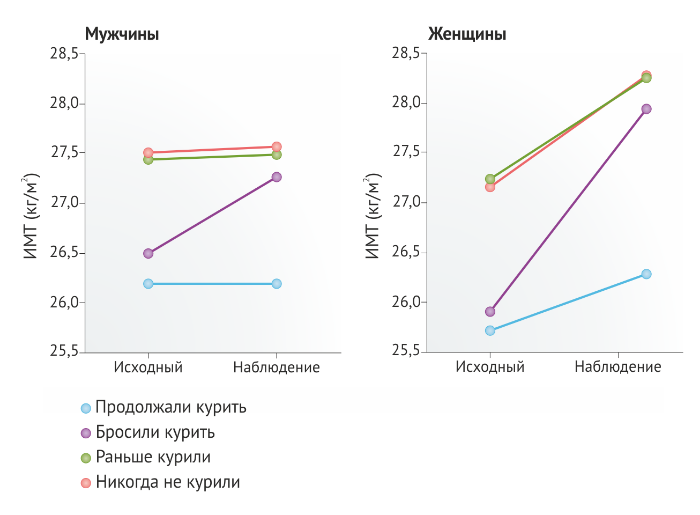
Хотя в среднем вес курящего человека меньше, чем у некурящего, тем не менее, процент людей с избыточным весом или ожирением среди курильщиков (включая тех, кто пользовался консультационными услугами горячей линии по вопросам отказа от курения [50]) в целом совпадает с распределением в некурящей популяции. Согласно исследованию с участием 595 человек, получивших консультацию по горячей линии, 206 человек имели нормальный вес (34,6 %), 182 — избыточный (30,6 %) и у 207 человек избыток веса соответствовал состоянию ожирения (34,8 %) [51]. Причем ожирением страдали в основном женщины, и их больше, чем мужчин, заботил вопрос прибавки веса после отказа от курения. Кроме того, что уже имеющие проблемы с лишним весом курильщики выражали опасения по поводу набора веса после прекращения курения, именно люди данной категории, в отличие от лиц без ожирения, сомневались в том, что смогут поддерживать свой вес в определенных рамках после отказа от привычки, и более негативно воспринимали перспективу еще большей прибавки в весе [51].
Набор пяти лишних килограмм после отказа от курения мог стать поводом для возвращения к привычке и причиной нежелания возобновить попытки бросить курить [33]. Несмотря на это, по результатам другого исследования, участниками которого стали 595 человек, обратившихся в службу горячей линии, не было отмечено стойкой взаимосвязи между исходным весом курильщика перед началом мероприятий по борьбе с привычкой и успехом в соблюдении терапевтических предписаний по отказу от курения, хотя отказ от курения и сопровождался набором веса [52]. В течение шести месяцев наблюдения у участников исследования было отмечено увеличение веса как во время активного лечения от зависимости, так и после него [52].
Проведенное в Оксфордшире (Великобритания) проспективное когортное клиническое исследование эффективности использования никотиновых пластырей против плацебо с последующим восьмилетним наблюдением показало, что отказавшиеся от курения участники за весь срок наблюдения набрали 8,8 кг веса [53], продолжавшие курить испытуемые набрали за тот же период времени 2,2 кг, а те, кто бросал и периодически снова возвращался к курению, набрали 3,3 кг. Испытуемые, которым удалось отказаться от курения, но не сразу (продолжали курить, согласно первой проверке через год после начала эксперимента, но по истечении срока восьмилетнего наблюдения более не являлись подверженными привычке курить), набрали 8,3 кг веса. Для курильщиков наблюдалась обратная линейная корреляция количества набранных килограммов со значением ИМТ (курильщики с более низким ИМТ набирали больше веса, чем те курильщики, чей ИМТ был выше), тогда как для курильщиков, отказавшихся от курения, график взаимосвязи увеличения веса с ИМТ имел вид J-образной кривой, причем наибольшие темпы набора веса наблюдались в первые шесть месяцев после отказа от курения [53].
Было изучено влияние половой принадлежности и количества выкуриваемых в день сигарет на набор веса в течение года после отказа от курения [54]. Так, в рамках одного из исследований была определена взаимосвязь между полом, возрастом и количеством выкуриваемых в день сигарет до отказа от курения и последующим изменением массы тела. Согласно результатам, участники, отказавшиеся от курения минимум на 40 недель, прибавили 4,6 кг веса, а те, кто прекратил курить на срок 20 недель и менее, прибавили 1,2 кг [54]. При этом наиболее молодые участники эксперимента (нижний терциль) набирали больший вес, чем самые возрастные участники эксперимента (верхний терциль). Среди заядлых курильщиков увеличение веса было наиболее выраженным у представительниц женского пола, тогда как среди тех, кто был подвержен привычке не так сильно (выкуривали меньше сигарет), больший вес набирали мужчины. Таким образом, полученные данные указывают на то, что молодые женщины, крепко привязанные к табакокурению, составляют группу с наибольшим риском набора веса после отказа от курения.
В одном из исследований был выявлен ряд факторов, связанных с набором веса после прекращения курения [55]. Было зафиксировано существенное увеличение ИМТ: если на первичном приеме значения ИМТ составили в среднем 23,5 ± 3,6 кг/м², то через три месяца после начала лечения зависимости от курения этот показатель увеличился до 23,9 ± 3,8 кг/м². Уровень триглицеридов и ЛПВП в плазме крови у испытуемых, а также количество ежедневно выкуриваемых ими сигарет и результаты теста Фагерстрома на никотиновую зависимость достоверно коррелировали с увеличением значений ИМТ после начала испытуемыми терапевтических мероприятий (при этом результат теста Фагерстрома послужил наиболее надежным показателем). Результаты данного исследования показывают, что курильщики, у которых по результатам теста Фагерстрома была выявлена сильная никотиновая зависимость, были более склонны к набору веса в период отвыкания от курения, чем те курильщики, чья зависимость от никотина была слабее. Также были определены прогностические факторы, по которым можно судить о наборе веса у лиц, обладающих стойкой продолжительной табачной зависимостью и приступивших к лечению для отказа от этой привычки [56]. Набор веса был зафиксирован в первые три месяца отказа от курения, после чего вес стабилизировался. Через год после прекращения курения у мужчин отмечалась прибавка в весе, в среднем составившая 3,9 кг, а у женщин — 3,3 кг. Также вновь была отмечена положительная корреляция высокой степени никотиновой зависимости с прибавкой в весе при отвыкании от курения [56]. Более того, по результатам данного эксперимента было отмечено, что мужчины более склонны набирать вес при отказе от привычки, что противоречит результатам прочих исследований [46, 53], которые указывали на то, что набору веса при отвыкании от курения в большей степени подвержены женщины.
У испытуемых старшего возраста (старше 43 лет), решивших вернуться к курению, набор массы продолжался [56]. Можно сделать вывод, что, согласно этому исследованию [56], курильщики мужского пола возрастом выше среднего с сильной никотиновой зависимостью набирают при отказе от курения больше веса, чем прочие категории курильщиков.
Механизмы, лежащие в основе увеличения массы тела после отказа от курения.
Были предложены несколько теорий, которые объясняют механизм повышения аппетита после прекращения курения. Одна из них заключается в том, что анорексигенный эффект никотина инвертируется при прекращении его попадания в организм [57]. Вероятно, при прекращении курения система внутреннего подкрепления замещает вознаграждение от никотина подкреплением от приема пищи [58]. Недостаток никотина приводит к увеличению удовольствия, получаемого от приема пищи. Системы поощрения, активирующиеся в клетках головного мозга при усиленном потреблении пищи, богатой сахарами и жирами, сходны с системами, активными при курении сигарет [59].
Кроме того, прекращение поступления никотина в организм приводит к повышению порога достижения удовольствия, что может повлечь за собой увеличение употребления человеком различных продуктов, богатых углеводами и сахарами [60]. Помимо этого, никотин и курение сами по себе оказывают влияние на пищевое поведение, предотвращая бесконтрольное потребление пищи и переедание; эти эффекты пропадают вместе с отказом от курения. Среди курильщиков, имевших в анамнезе компульсивное переедание, процент бросивших курить оказался ниже, а прибавка в весе — больше по сравнению с теми курильщиками, кто не имел подобных эпизодов бесконтрольного переедания [61]. Также была обнаружена взаимосвязь запрета на курение (как в общественных местах, так и дома) с отказом от этой привычки и косвенно с развитием ожирения как следствием замещения потребности в никотине приемом пищи (компенсаторное поведение) [62].
В одном исследовании у 14 участников, добившихся полного отказа от курения, был измерен ряд гликемических параметров спустя три часа после проведения глюкозотолерантного теста [63]. Кроме того, что масса тела участников эксперимента, прекративших курить, увеличилась на 4 кг, а масса жировой ткани — на 22 %, у них также были отмечены гиперинсулинемия и резистентность к инсулину натощак; чувствительность к инсулину после проведения глюкозотолерантного теста не изменилась. Секреция β-клеток поджелудочной железы, определенная при инсулиногенном индексе (показатель секреции инсулина в раннюю фазу), равном 40, оказалась повышенной на 31 %. Кроме того, повысились количество потребляемых углеводов и концентрация нейропептида Y в плазме крови натощак, что указывает на роль нейропептида Y как гормона, опосредованно влияющего на увеличение массы тела при отказе от курения. Тем не менее, изменений касательно чувствительности к инсулину при проведении перорального теста на толерантность к глюкозе или изменений уровня пептида Y, глюкагоноподобного пептида 1, лептина, грелина или висфатина установлено не было [63]. Таким образом, авторы исследования пришли к выводу о том, что отказ от курения влечет за собой временные изменения метаболизма, включающие в себя увеличение секреторной функции β-клеток.
Сопутствующим социальным фактором, делающим вклад в процесс набора веса после отказа от курения, может быть социально-экономическое положение человека. У большинства курильщиков социально-экономическое положение ниже, чем у некурящих людей [64]. Низкий социально-экономический статус коррелирует с низкой физической активностью и высококалорийным питанием с высоким содержанием жиров, что также влияет на увеличение массы тела при отвыкании от курения [31].
Интересное исследование, опубликованное в 2013 году, показало, что отказ от курения привел к выраженным изменениям в составе микробиома кишечника [65]. Состав микрофлоры кишечника людей, бросающих курить, сравнивали с таковым у контрольной группы, куда входили как курящие, так и некурящие. Методы исследования включали в себя анализ полиморфизма длины рестрикционных фрагментов и высокопроизводительное секвенирование [нового поколения — прим. ред.]. По результатам исследования у бросающих курить были отмечены изменения в составе микрофлоры кишечника по сравнению с показателями контрольной группы; изменения касались количественного соотношения фирмикутов и актинобактерий с бактероидами и протеобактериями: доля первых в кишечной микрофлоре увеличивалась, а вторых — уменьшалась [65]. Было подтверждено и увеличение разнообразия микробиома в целом. Исследование состава микробиома производилось при помощи флуоресцентной гибридизации in situ (FISH) [66], и вновь существенные изменения микрофлоры у лиц, бросивших курить, выражались в увеличении количества фирмикутов и актинобактерий и уменьшении — бактероидов и протеобактерий [66]. Такие результаты указывают на роль курения как средового фактора, влияющего на состав кишечной микрофлоры у человека. Наблюдающиеся изменения состава микробиома кишечника также сходны с теми различиями кишечной микрофлоры, что наблюдаются у худых и тучных людей и мышей. Таким образом, данные изменения могут частично объяснять набор веса людьми после отказа от курения.
Программы контроля веса
На данный момент отсутствуют данные о наличии эффективных способов бросить курить и при этом ограничить набор веса, связанный с прекращением курения [33]. В систематическом обзоре базы данных Cochrane говорится, что обучение пациентов способам контроля веса оказалось неэффективным [67]. Однако персонализированные программы с обратной связью по индивидуальным целевым значениям контроля веса и индивидуальным расчетам потребления и трат энергии смогли дать некоторые результаты у пациентов, обеспокоенных набором веса после прекращения курения [67]. Обеспокоенность набором веса до прекращения курения не ограничивала суммарный набор массы тела после избавления от привычки; поначалу, в первые 1‒2 месяца, происходил меньший набор веса, но спустя 12 месяцев этот результат исчезал [45].
Мета-анализ 2012 года показал, что при помощи консультаций и обучения способам контроля веса удалось ограничить набор веса после курения у некоторых пациентов, причем это не влияло на успешность прекращения курения [49].
Набор веса спустя 12 месяцев составил 4–5 кг, бóльшая часть этого веса была набрана в первые три месяца. Анализ данных выявил, что до 21 % тех, кто прекращал курить, теряли вес в течение года после прекращения, однако 48 % бросивших курить набирали до 5 кг массы тела [49]. Важно то, что эти данные были получены из исследований с участием добровольцев, использовавших различные способы ограничения набора веса после прекращения курения. Одна из гипотез относительно контроля массы тела в процессе прекращения курения утверждает, что потеря веса происходит независимо от уверенности пациента в прекращении привычки. Многие люди просто не могут или недостаточно хотят концентрироваться на каких-то еще изменениях образа жизни во время прекращения курения. Успешный контроль веса достигался в тех программах по прекращению курения, которые содержали ряд советов относительно диеты. Бросающие курить часто различались по используемому подходу: сперва прекращение курения, потом контроль веса или прекращение курения и контроль веса одновременно [33].
В пилотном исследовании с использованием многомерной модели логистической регрессии с контролем ковариантности и дополнительных факторов, таких как возраст, пол, уровень образования, степень зависимости от никотина, ИМТ и степень беспокойства относительно набора веса, посещаемость первого собеседования увеличивалась, если предлагалась программа контроля веса (88,1 % против 71,6 %). Кроме того, на протяжении шести месяцев больше участников воздерживались от курения (21,4 % против 10,1 %) [68]. Участники, получавшие советы относительно контроля веса, в 5 раз чаще посещали первую сессию исследования и в 3 раза чаще воздерживались на протяжении хотя бы шести месяцев после начала терапии по сравнению с теми, кому не предлагались советы относительно контроля веса. Активное информирование курильщиков, обеспокоенных массой тела и имеющих избыточный вес или ожирение, о программах по контролю веса после прекращения курения может помочь им сделать первый шаг и завершить программу по прекращению курения.
Другим подходом является устранение обеспокоенности, связанной с набором веса после прекращения курения, а не с набором веса как таковым, поскольку именно такая обеспокоенность является более сильным предиктором рецидива курения, чем сам факт увеличения веса [69]. В одном исследовании курящие женщины были разделены на три группы: группа с консультированием по вопросам прекращения курения, группа с консультированием по прекращению курения и контролю веса и группа с консультированием по прекращению курения, набору веса и обеспокоенности набором веса [70]. На протяжении года наблюдения от курения воздерживался 21 % участниц из группы с консультированием по обеспокоенности набором веса по сравнению с 13 % из группы с консультированием по контролю веса и 9 % в группе с консультированием по прекращению курения [70]. Женщины в группе с консультированием относительно обеспокоенности набором веса также набирали меньший вес после прекращения курения (2,48 кг) по сравнению с женщинами, проходившими консультации по контролю веса (5,36 кг) и со стандартной группой, получавшей советы только относительно прекращения курения (7,6 кг) [70]. Следовательно, снижение обеспокоенности по поводу набора веса после прекращения курения важнее, чем снижение набора веса во время и после прекращения курения [31].
Фармакотерапия
Для профилактики или снижения набора веса после прекращения курения были разработаны несколько фармакотерапевтических подходов, таких как прием бупропиона, никотин-заместительная терапия, флуоксетин и варениклин (частичный агонист α4β2 никотиновых холинорецепторов) [71]. Однако стало ясно, что эти препараты скорее задерживают, чем предотвращают набор веса после прекращения курения [71]. По окончании приема препаратов пациенты набирали тот же вес, какой они имели бы к этому же времени, если бы не проходили фармакотерапию [31]. Тем не менее, запаздывание набора веса после прекращения курения может повысить мотивацию курильщиков, т. к. это дает обеспокоенным пациентам время сперва сконцентрироваться на прекращении курения, а потом переключиться на контроль веса. Так, бупропион снижает порог «насыщения» никотином, уменьшает эффекты пищевого подкрепления и ограничивает набор веса [72]. В исследовании 2010 года комбинация бупропиона и мероприятий по прекращению курения и ограничению набора веса показала более высокий уровень воздержания от курения на протяжении 6 месяцев, чем стандартные консультации по бросанию курения или плацебо (34 %, 21 % и 12 % соответственно). Однако у женщин не было обнаружено межгрупповых различий в наборе веса спустя 3, 6 или 12 месяцев после прекращения курения [72].
В РКИ с продленной (24 недели) против стандартной (8 недель + 16 недель плацебо) трансдермальной никотин-заместительной терапией (пластыри) с коррекцией по полу, исходной частоте курения и предшествующей частоте курения участники, бросившие курить, набирали в среднем 4,9–5,4 кг [73]. По сравнению с участниками, получавшими терапию на протяжении 8 недель, участники группы с терапией на протяжении 24 недель набирали меньше веса как к концу исследования, так и между 8 и 24 неделями; кроме того, исследуемые в этой группе тщательней соблюдали курс терапии, что также привело к ограничению набора веса [73]. Поэтому продление никотин-заместительной терапии также может ограничивать набор веса после прекращения курения.
В исследовании, проведенном в Японии, сравнивалась эффективность трансдермальной никотин-заместительной терапии и варениклина в ограничении набора веса после прекращения курения. Участники исследования, получавшие варениклин, набирали 0,9 кг по сравнению с 2,8 кг у тех, кто получал никотин в пластырях. Анализ при помощи MANOVA показал, что принимавшие варениклин набирали значимо меньше веса, чем получавшие никотин-заместительную терапию. Эти результаты подтверждают, что варениклин может быть более эффективным в ограничении набора веса после прекращения курения, чем никотин в пластырях, благодаря избирательной активации α4β2 никотиновых холинорецепторов.
Эффективность метилфенидата в форме OROS-системы (OROS‒MPH — пероральная осмотическая система контролируемого высвобождения) в ограничении набора веса после прекращения курения изучалась у взрослых испытуемых с синдромом дефицита внимания и гиперактивности (СДВГ) [75]. Так как у взрослых с СДВГ повышен риск курения и набора веса или ожирения, терапия при помощи OROS‒MPH часто приводила к снижению массы тела. Поэтому OROS‒MPH может помочь и в ограничении набора веса после прекращения курения. Испытуемые, получавшие OROS‒MPH, теряли 1,6 % массы тела в среднем к 11 неделе после прекращения курения, в то время как испытуемые в плацебо-группе в среднем набирали 1,3 % веса [75].
Употребление фруктов и овощей
Включение рекомендаций употребления фруктов и овощей в диетическую часть программ по бросанию курения может помочь в прекращении курения и привести к меньшему набору веса у бросивших курить. В исследовании, посвященном диете 373 803 участников из 10 европейских стран, участвовавших в Европейском проспективном исследовании взаимосвязи раковых заболеваний и питания, после поправки на множественные ковариаты у бросивших курить была обнаружена обратная взаимосвязь между исходным потреблением фруктов и овощей и изменением массы тела [76]. Также была обнаружена слабая позитивная связь между потреблением овощей и изменением веса у куривших женщин. Кроме того, была показана обратная взаимосвязь между потреблением фруктов и изменением веса у женщин, которые никогда не курили. Таким образом, исходное потребление фруктов и овощей может помочь в предотвращении набора веса после прекращения курения. Фрукты и овощи ограничивают набор веса благодаря низкой энергетической плотности и высокому содержанию пищевых волокон [76].
В кластерном РКИ, проведенном в Большем Глазго с января по август 2008 года, курильщики в группе с коррекцией рациона набирали больший средний вес, чем участники группы, не получавшие консультаций относительно питания после прекращения курения; набор веса на восьмой месяц составил 3,9 и 2,7 кг соответственно [77]. Стоит отметить, что опытная группа потребляла больше овощей, фруктов и злаков для завтрака, чем контрольная. Кроме того, в опытной группе большее число участников продолжали воздерживаться от курения, чем в контрольной. Таким образом, коррекция рациона только улучшала диетические привычки испытуемых, но не меняла массу тела. Улучшение частоты отказа от курения в опытной группе может быть связано с посещением консультантов, которые помогали снизить связанную с набором веса тревожность исследуемых и вдохновляли их на прекращение курения несмотря на набор веса.
Контроль веса после прекращения курения: выводы
Во время прекращения курения происходит снижение скорости метаболических процессов без параллельного увеличения физической активности [31]. В результате положительный энергетической баланс приводит к набору веса. Пользу могут принести изменения поведения, помогающие контролировать набор веса после прекращения курения путем сосредоточения усилий на снижении потребления калорий, повышении физической активности или и того, и другого. Вмешательства в контроль веса имеют доказанную эффективность в аспекте ограничения набора веса после курения только на протяжении первых 6 месяцев. Таким образом, программы контроля веса не ослабляют эффективность программ по прекращению курения при одновременном проведении [31].
Гестационный вес
Отказ от курения связывают с чрезмерным набором веса во время беременности [78]. Отказ курильщиков от вредной привычки приводит не только к увеличению их собственного веса. Потомство матерей, отказавшихся от курения, также рискует обладать излишним весом. В результате японского проспективного группового исследования, в котором приняло участие 2 663 матери (данные собраны от 83,7 % участников) и их дети, рожденные в период с 1991 по 2006 год, была обнаружена связь между стажем курения матери и весом младенцев и детей [79]. Матери, курившие во время беременности, рожали младенцев, масса тела которых была на 120‒150 грамм меньше нормы. Помимо этого, в возрасте 3 лет ИМТ у мальчиков, рожденных от куривших матерей, был значительно выше, чем у сыновей некурящих женщин. Дети, рожденные от матерей, отказавшихся от курения до или на ранних сроках беременности, не показали каких-либо признаков уменьшения веса в младенчестве или ожирения в детстве [79].
По данным Национального института детского здоровья и развития человека (NICHD), изучавшего уход за новорожденным и развитие подростков, дети, матери которых курили в течение года до рождения ребенка, были более предрасположены к повышенному ИМТ [80]. Матери, курившие за год до рождения ребенка, также были более предрасположены к рождению крупных детей с большим ИМТ, превышающим показатели некурящих матерей на 1‒6 пунктов. Образование матери и вес ребенка также сильно связаны с большими показателями ИМТ. Основываясь на этих данных, женщинам рекомендуется отказываться от курения минимум за 3 месяца до беременности для уменьшения вероятности набора веса для себя и своего потомства [80].
Кроме того, повышение налогов на сигареты оказалось связано с уменьшением количества курящих среди матерей европеоидной и негроидной расы с низким уровнем образования; однако вес их детей превышал средние показатели [81]. Согласно данному исследованию, при увеличении налога на каждый $1 количество курящих уменьшалось на 2,4 % среди европеоидных матерей и 2,1 % среди негроидных; более того, вес детей при рождении повысился на 5,4 грамма и 4,0 грамма соответственно, что может иметь положительный долгосрочный эффект.
Метаболические заболевания
Стаж курения и ИМТ
Исследование методом поперечных срезов 2008–2010 годов, в котором приняли участие 4 656 человек из Южной Кореи в возрасте от 19 до 70 лет, показало, что и у курильщиков, и у тех, кто бросил курить, наблюдалось больше висцеральной жировой ткани (ВЖТ) по сравнению с теми, кто никогда в жизни не курил [82]. Повышенные значения ВЖТ были связаны с бóльшим количеством выкуриваемых сигарет до прекращения, бóльшим стажем курения и меньшим периодом воздержания от курения. Наиболее высокие показатели ВЖТ у бывших курильщиков наблюдались в течение первых двух лет с момента отказа от курения. Значительных отличий значений ВЖТ у бросивших курить более 20 лет назад по сравнению с никогда не курившими обнаружено не было.
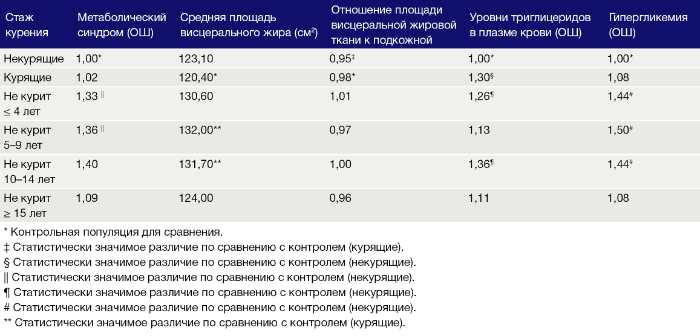
В Hitachi Health Study изучали распространенность метаболического синдрома среди мужчин из Кореи, в целях чего у 5 697 испытуемых проводилась КТ брюшной полости [83]. В этом исследовании использовались диагностические критерии, установленные Национальной образовательной программой по холестерину (National Cholesterol Education Program Adult Treatment Panel III), указывающие на то, что метаболический синдром — это комбинация как минимум трех из пяти условий: резистентность к инсулину, ожирение, гипергликемия, атерогенная дислипидемия и повышенное артериальное давление [84]. После ранжирования по возрасту, употреблению алкоголя и расходу энергии была установлена взаимосвязь между стажем курения и метаболическим синдромом с некоторыми его компонентами (Табл. 1) [83]. Бывшие курильщики, без учета лиц, воздерживающихся от курения более 15 лет, обладали выраженным висцеральным ожирением, повышенным содержанием висцеральной и подкожной жировой ткани и более высоким уровнем триглицеридов в плазме крови по сравнению с некурящими.
Данные результаты могут быть объяснены действием адипонектина, адипоцит-специфичного протеина, вовлеченного в метаболические процессы, например, в регуляцию гликемии и катаболизм жирных кислот [85–89]. Имеется обратная связь между уровнями адипонектина и повышенным риском развития метаболического синдрома [90]. При изучении 28 курящих мужчин, успешно отказавшихся от курения на 2 месяца с помощью трансдермальной никотиновой терапии, все участники были поделены на 2 группы: поддерживающие вес (n = 10) и набирающие вес (n = 18) [91]. В группе набирающих вес уровни адипонектина в плазме крови повысились спустя неделю после начала трансдермальной никотиновой терапии; на 9-ой неделе уровни адипонектина были заметно снижены. Помимо этого, в группе набирающих вес значительно повысилась инсулиновая резистентность, в соответствии с определением оценки гомеостатической модели (индекс HOMA; метод, использующий оценку функции β-клеток и инсулинорезистентности) [92]. Однако не было обнаружено никаких значительных изменений в уровне адипонектина или индекса HOMA в группе поддерживающих вес. Результаты данного исследования показывают, что набор веса после отказа от курения связан с понижением уровня адипонектина и повышением риска метаболического синдрома [91].
Курение может способствовать развитию резистентности к инсулину и сахарного диабета 2 типа (СД2), а также вносить вклад в изменение липидного профиля в атерогенную сторону [93]. Даже в том случае, когда курильщики, возможно, весили бы меньше, чем если бы они не курили, у них сохранялось высокое содержание висцеральной и подкожной жировой ткани [82, 94, 95], что повышает риск развития сердечно-сосудистых заболеваний. По приблизительным оценкам, примерно 20 % курильщиков страдают от ожирения, хотя эта цифра зависит от исследуемой популяции.
Идея совместного лечения табачной зависимости и ожирения довольно заманчива. Антагонист каннабиноидных рецепторов римонабант используется для лечения как ожирения [96], так и никотиновой зависимости [97], а также эффективен в борьбе с метаболическим синдромом [98]. Однако римонабант обладает побочными эффектами, оказывающими влияние на психику, из-за чего не получил одобрения FDA [96]. Эффективность бупропиона при отказе от курения и потере веса может быть связана с повышением уровней дофамина и норадреналина в ЦНС [99], что схоже с эффектом самого никотина. Несмотря на то, что никотин контролирует употребление пищи и, таким образом, массу тела, для использования его в целях контроля веса необходимо большее понимание того, как именно никотин функционирует в головном мозге.
Секреция инсулина и резистентность к инсулину. Никотин может оказывать влияние на функцию β-клеток напрямую или косвенно через парасимпатические ганглии [63]. Результаты исследований на животных и экспериментов in vitro показывают, что никотин оказывает токсическое действие на β-клетки [100–102]. Высокое содержание никотина в организме кроликов снижает опосредованную глюкозой секрецию инсулина, в то время как низкие дозы стимулируют секрецию инсулина [103]. Активация α2 подтипа 5-AMP-активированной протеинкиназы в адипоцитах мышей необходима для возникновения никотин-индуцированной инсулиновой резистентности [104].
В 2015 году авторы использовали гиперинсулинемические-эугликемические блокаторы, связанные со стабильными изотопными метками, для оценки продукции глюкозы в печени и непрямой калориметрии для измерения утилизации субстрата. Это было частью исследования, в котором приняли участие здоровые курильщики, выкуривающие от половины до двух пачек в день. Они участвовали в восьминедельной программе отказа от курения с помощью психологического консультирования и приема бупропиона перорально (фаза 1) [105].
Этот этап включал в себя 16-недельный поддерживающий период без консультаций и бупропиона, на протяжении которого участники либо воздерживались от курения, либо курили в том же объеме или больше (фаза 2) [105].
Отказ (фаза 1) снижал количество выкуриваемых за день сигарет и уровень монооксида углерода, а также метаболитов никотина; во время фазы 2 не было никаких дальнейших изменений. Отношение массы висцеральной жировой ткани к периферической изменялось в сторону увеличения в течение фазы 1 (обратная корреляция с уровнями монооксида углерода), но затем заметно снизилось на протяжении фазы 2. Нескорректированный базальный уровень продукции глюкозы в печени снижался на протяжении 24 недель; изменения в уровне продукции глюкозы в печени напрямую коррелировали с изменениями в уровне монооксида углерода. Изменения веса были прямо связаны с уровнями никотиновых метаболитов на протяжении фазы 2 и исследования в целом. После 24 недель изменения в уровнях монооксида углерода и никотиновых метаболитов обратно коррелировали с изменениями в нескольких измерениях употребления глюкозы, ее окисления и дыхательного коэффициента. Это исследование продемонстрировало, что отказ от курения порождает временное ухудшение центрального перераспределения жировой ткани, за которым следует гораздо более выраженное его улучшение наряду с множеством других благоприятных метаболических эффектов.
Как было доказано, чувствительность к инсулину увеличивается при отказе от курения, что проявляется совместно с нормализацией фосфорилирования субстрата-1 инсулинового рецептора (IRS-1) по Ser 636 [106]. При исследовании клеточных культур было установлено, что никотин стимулирует два пути, которые, в свою очередь, активируют фосфорилирование IRS-1 в положении Ser636 посредством p44/42 митоген-активированной протеинкиназы (MAPK) и мишень рапамицина в клетках млекопитающих (mTOR). Эти результаты говорят о том, что никотин индуцирует резистентность к инсулину в скелетных мышцах путем активации mTOR, что может быть изменено при отказе от курения.
Отказ от курения может также уменьшать хроническое повреждение [поджелудочной железы — прим. ред.], возникающее при СД2. Влияние отказа от курения на микроальбуминурию (определено как отношение альбумина к креатинину в 30–300 мкг/мг) у пациентов с впервые выявленным СД2 было оценено в одном исследовании [107]. Из 500 лиц с впервые выявленным СД2 и микроальбуминурией 196 участников были проинформированы об отказе от курения и управлении весом. На протяжении исследования ≈ 62 % участников бросили курить, и на протяжении года, во время которого осуществлялся контроль, уровень распространенности микроальбуминурии снизился на 72,6 % среди некурящих и на 22,5 % среди тех, кто продолжил курить [107]. Исследователи сделали вывод, что отказ от курения у пациентов с впервые диагностированным СД2 приводит к улучшению метаболических параметров, кровяного давления и снижению микроальбуминурии [107].
Выводы
Отказ от курения может облегчить течение заболеваний, вызванных курением и никотином [108], а также привести к набору веса. Набор веса после отказа от курения часто недооценивается при самостоятельной оценке [33]. Проведенное в 1997–2004 годах Национальное опросное исследование в области здравоохранения, которое было посвящено национальному индексу смертности, показало, что курильщики с нормальным весом обладают более высоким риском смерти от всех связанных с курением заболеваний вместе, чем бывшие курильщики, имеющие лишний вес или ожирение [45]. Набор веса после отказа от курения, таким образом, менее вреден, чем курение. Лица с ожирением, бросившие курить, обладают повышенной потребностью во вмешательствах для стабилизации набора веса [53]. Курильщики с ожирением, особенно женщины, нуждаются в более эффективных методах лечения и управления весом в совокупности с уменьшением сопутствующего чувства беспокойства и тревоги наряду с отказом от курения [51]. Для достижения наибольшего результата при отказе от курения рекомендуется использовать методы подсчета переедания на протяжении первых 6 месяцев [31].
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- Telegram
