Новые препараты в лечении СПКЯ: фокус на метаболизм и эндокринные нарушения
Новые фармацевтические препараты, нацеленные на устранение метаболических и эндокринных нарушений при синдроме поликистозных яичников, меняют терапевтическую стратегию. В данной статье рассматриваются инновационные лекарственные препараты, в том числе агонисты рецепторов глюкагоноподобного пептида 1, ингибиторы натрий-глюкозного котранспортера 2, кисспептин, антагонисты рецепторов нейрокинина 3 и артемизинины, описываются их механизмы и потенциал для изменения лечения этого расстройства.
Синдром поликистозных яичников (СПКЯ) - комплексное эндокринологическое и метаболическое расстройство, от которого страдают женщины репродуктивного возраста. Ключевыми особенностями синдрома являются гиперандрогения и инсулинорезистентность, что приводит к ановуляции, бесплодию и нарушениям метаболизма. Существующие на данный момент методы лечения (изменение образа жизни, гормональные препараты и средства, повышающие чувствительность к инсулину) в первую очередь направлены на купирование симптомов. Тем не менее, эти методы не способны разрешить патологические механизмы, лежащие в основе СПКЯ, а их эффективность сильно варьируется у разных пациенток. К данному моменту назрела серьезная потребность в инновационных и фундаментальных стратегиях терапии, влияющих на метаболическую и гормональную дисфункцию при СПКЯ. Достижения в сфере разработки препаратов и персонализированной фармакотерапии предоставляют потенциал для изменения подходов к лечению данной комплексной патологии.
Нарушение обмена веществ - ключевой параметр СПКЯ; в него входят ожирение, инсулинорезистентность, дислипидемия, повышенный риск развития сахарного диабета 2 типа и сердечно-сосудистых заболеваний. Изначально разработанные как средство терапии первой линии при сахарном диабете 2 типа агонисты рецептора глюкагоноподобного пептида 1 (ГПП-1), получили одобрение для применения при ожирении, а также они обладают широким спектром метаболических положительных эффектов (кардио- и нефропротекция). Миметики ГПП-1 приобретают потенциал многообещающих препаратов для лечения метаболической дисфункции и при СПКЯ. В перечень положительных эффектов на обмен веществ входят: уменьшение голода, усиление чувства насыщения при приеме пищи, модуляция моторики ЖКТ, а также анорексигенное действие [1, 2]. Среди агонистов рецептора ГПП-1 следует отметить лираглутид: в ходе клинических испытаний при СПКЯ этот препарат снижал массу тела и объем жировой ткани, нормализовал гиперандрогению, менструальный цикл и повышал вероятность забеременеть [1]. Читатель мог видеть в новостях сообщения о подобном эффекте у семаглутида — т.н. ozempic babies (прим. ред.) Несмотря на все преимущества лираглутида в вопросе снижения массы тела и улучшения репродуктивного статуса женщины, у препарата наблюдаются такие побочные эффекты со стороны ЖКТ, как тошнота и рвота [1].
В отчете 2024 г. об исследовании, проведенном на мышах, предполагается, что конъюгат ГПП-1 и эстрогена превосходит комбинацию агонистов рецепторов ГПП-1 и глюкозозависимого инсулинотропного полипептида (GIP), агонистов рецепторов ГПП-1, GIP и глюкагона, а также метформин по эффективности устранения метаболических осложнений, связанных с СПКЯ [2]. Примечательно, что эти препараты способствуют адекватной работе цикла яичников при ановуляции (данные на животных), не стимулируя прямые эстрогенные утеротрофические эффекты, что потенциально способствует улучшению фертильности [2].
Ингибиторы натрий-глюкозного котранспортера 2 (SGLT2), изначально разработанные как средства для снижения уровня глюкозы, стали терапевтическими средствами с продемонстрированной эффективность при хронической почечной недостаточности и лечении сердечной недостаточности. Новые данные свидетельствуют об их потенциале для устранения ключевых симптомов СПКЯ, в том числе за счет снижения массы жировой ткани и уровня андрогенов в крови, снижения инсулинорезистентности и улучшения состояния сердечно-сосудистой системы [3]. И эмпаглифлозин, и дапаглифлозин показали многообещающие результаты в доклинических моделях СПКЯ [4,5]. Эмпаглифлозин продемонстрировал метаболические и репродуктивные преимущества, аналогичные таковым у метформина на крысиных моделях [4], а дапаглифлозин снизил степень образования адипоцитов и их морфологию в белой жировой ткани в модели мышей с ожирением и СПКЯ [5]. Несмотря на эти обнадеживающие результаты, исследования ингибиторов SGLT2 при СПКЯ характеризуются ограниченностью, при этом большинство исследований сосредоточены на сахарном диабете и ожирении. В будущем необходимо проведение клинических исследований для оценки эффективности и безопасности ингибиторов SGLT2 при различных фенотипах СПКЯ.
Все достижения в лечении СПКЯ за последние 5 лет по большей степени нацелены на эндокринные пути для устранения гормонального дисбаланса, который является центральным в патофизиологии этого расстройства. Дисрегуляция оси гипоталамус-гипофиз-яичники рассматривается как один из патофизиологических механизмов СПКЯ и характеризуется изменением выделения гонадотропин-рилизинг-гормона (ГТРГ) и нарушением секреции гонадотропина. Кисспептин — основной регулятор оси женских половых гормонов — модулирует секрецию ГТРГ. Терапия на основе кисспептина в значительной степени перспективна для устранения нарушения нейроэндокринной регуляции, которая характерна для СПКЯ. Согласно результатам доклинических исследований на мышах, таргетная модуляция сигналинга кисспептина способна восстановить динамику импульсов лютеинизирующего гормона (ЛГ) и снизить избыток андрогенов, что подтверждает гипотезу о том, что кисспептин играет центральную роль в патофизиологии СПКЯ [6]. Клинические исследования также показали, что экзогенное введение кисспептина вызывает выделение гонадотропина у женщин с СПКЯ, хотя степень эффективности такового варьируется в зависимости от лежащего в основе фенотипа [7]. Фармакотерапия, направленная на тонкую настройку активности кисспептина (либо путем влияния на агонисты рецепторов для стимуляции овуляции, либо — на антагонисты для подавления гиперсекреции ЛГ), представляет собой новую стратегию лечения. Однако для оптимизации режимов дозирования, оценки долгосрочной безопасности и определения специфичных для пациента реакций на прием средств, содержащих кисспептин, необходимы дальнейшие исследования.
Нейрокинин B и рецептор нейрокинина 3 (NK3R) - критические модуляторы высвобождения гонадотропина при СПКЯ. Фезолинетант, антагонист NK3R, продемонстрировал потенциал в снижении гиперандрогении и нормализации уровня ЛГ в крови у женщин с СПКЯ [8]. Помимо влияния на репродуктивную систему, блокаторы NK3R продемонстрировали многообещающие результаты, улучшая метаболические параметры, в том числе снижая массу тела и останавливая накопление жировой ткани. Взаимодействие между кисспептином и нейрокинином B, по-видимому, влияет на секрецию фолликулостимулирующего гормона и секрецию ЛГ, а антагонизм по отношению NK3R способствует выделению ЛГ (как реакция на кисспептин) [9]. Однако эффективность лечения антагонистами NK3R остается изменчивой, что, вероятно, отражает гетерогенность фенотипов СПКЯ. Эти различия подчеркивают важность персонализированных стратегий лечения, адаптированных к индивидуальным фенотипам СПКЯ.
Исследования, опубликованные в 2024 году, подчеркивают способность производных артемизинина (известного противомалярийного средства), таких как артеметер и дигидроартемизинин, купировать симптоматику СПКЯ [10]. Доклинические исследования показали, что лечение артемизинином восстанавливает нормальное функционирование эндокринной системы и яичников в мышиных моделях СПКЯ. Также, в ходе пилотного клинического исследования на людях было выявлено практически полное исчезновение гиперандрогенемии, поликистозной морфологии яичников и восстановление менструального цикла[10]. В ходе исследований механизма было показано, что артемизинины напрямую воздействуют на лонпептидазу 1 (LONP1) в митохондриях, усиливая ее взаимодействие с CYP11A1, который является ферментом, катализирующим первый этап синтеза андрогенов [10]. Это взаимодействие способствует опосредованной LONP1 деградации CYP11A1, тем самым подавляя выработку андрогенов в яичниках.
Сфера исследований СПКЯ развивается и, как следствие, существует настоятельная необходимость в инновационных и всесторонних стратегиях терапии, в которых учитывались бы как эндокринные, так и метаболические нарушения, характерные для этого расстройства. Традиционные подходы, такие как гормональная терапия и сенсибилизаторы инсулина, обеспечивают купирование симптоматики, однако часто не влияют на патофизиологию заболевания. Новые фармакологические средства, такие как агонисты рецептора ГПП-1 и ингибиторы SGLT2, демонстрируют многообещающие результаты - смягчают проявления метаболической дисфункции. Препараты на основе кисспептина и нейрокинина B нацелены на регуляцию оси половых гормонов. Модулируя взаимодействие LONP1–CYP11A1, производные артемизинина представляют собой новый путь подавления синтеза андрогенов. На рисунке 1 представлен обзор этих новых методов лечения и их потенциальных преимуществ.
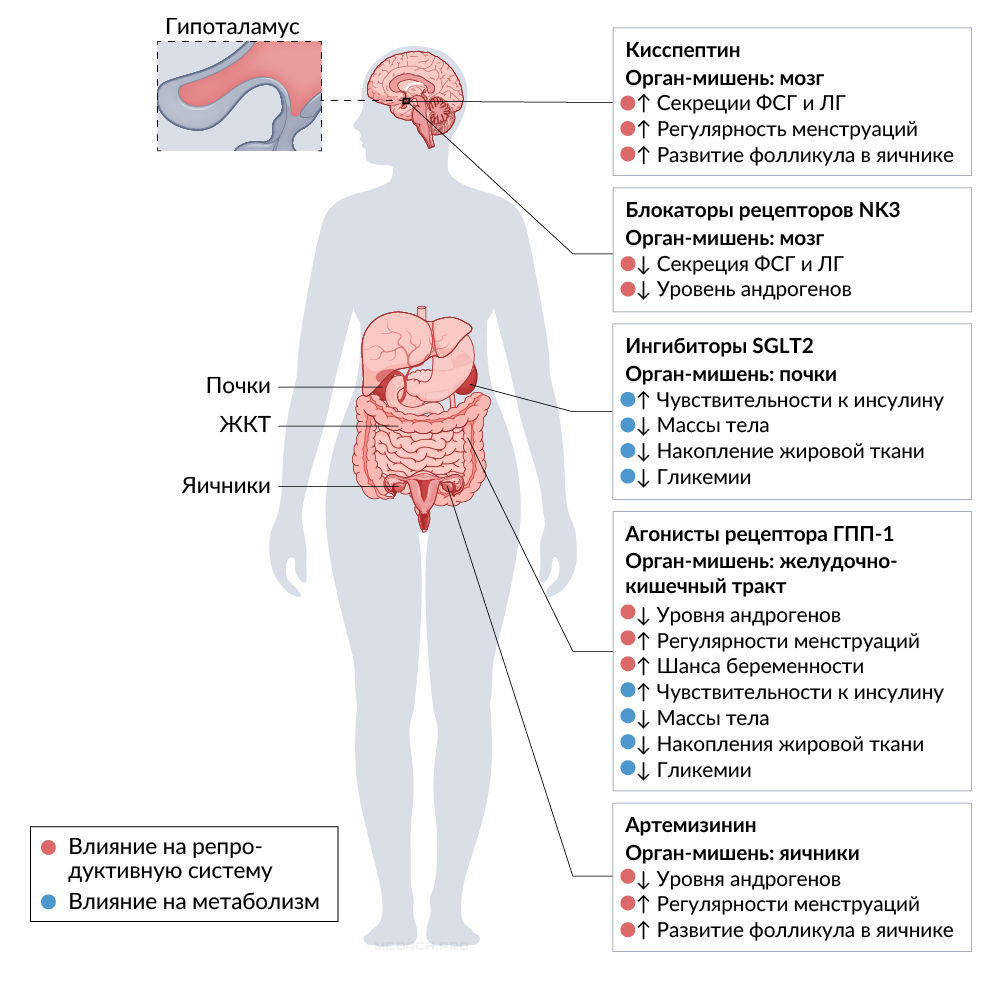
ГПП-1 - глюкагоноподобный пептид 1;
SGLT2 - натрий-глюкозный котранспортер 2;
NK3R - рецептор нейрокинина 3.
Несмотря на перечисленные достижения, остаются проблемы оптимизации терапевтических комбинаций, минимизации побочных эффектов и адаптации лечения к гетерогенным фенотипам СПКЯ. В будущем приоритет должен отдаваться крупномасштабным клиническим испытаниям для подтверждения долгосрочной эффективности и безопасности этих новых методов лечения, одновременно делая акцент на молекулярных механизмах патологии у пациенток разных групп. Интегрированный подход, основанный на фенотипе, может произвести революцию в клиническом ведении СПКЯ и улучшить качество жизни женщин, страдающих этим заболеванием.
