Крестцовый отдел вегетативной нервной системы является симпатическим

В течение столетия считалось, что черепные и крестцовые висцеральные нервы позвоночника — родственные образования. Согласно этому, крестцовые преганглионарные нейроны, как и ганглии, расположенные в области малого таза и контролирующие функции прямой кишки, мочевого пузыря, половой системы, считаются парасимпатическими. В этой публикации раскрываются 15 фенотипических и онтогенетических особенностей, которые отличают пре- и постганглионарные нейроны краниального отдела парасимпатической системы от симпатических нейронов грудопоясничного отдела у мышей. Каждая из особенностей доказывает, что крестцовый отдел неотличим от грудопоясничного. Таким образом, парасимпатическая нервная система получает импульсы исключительно от черепных нервов, а симпатическая нервная система от спинномозговых, в том числе от торакальных и крестцовых. Это упрощенное, двухкомпонентное строение, предлагает новую концепцию нейрофизиологии тазового дна, а также эволюции и развития вегетативной нервной системы.
Отнесение крестцового отдела к парасимпатической вегетативной нервной системе — как и связь черепного отдела с крестцовым — имеет древнюю, хотя и простую историю: это убеждение, уходящее корнями в работу Уолтера Гаскелла [1], было документально оформлено Лэнгли [2], и с тех пор стало общепринятым [3]. Аргументом послужили некоторые сходства крестцового отдела с краниальным: (I) анатомическое — область иннервации, в отличие от грудопоясничного отдела, менее рассеяна, отличается от него отсутствием иннервации конечностей, а также недостатком проекций на паравертебральный симпатический ствол [1] (II); физиологическое — влияние на некоторые органы противоположно грудопоясничному отделу [4]; и (III), фармакологическое — повсеместная чувствительность к антагонистам мускариновых рецепторов [2]. Однако, не хватало анализа клеточного фенотипа. В этой статье исследователи определили дифференциальные генетические признаки и взаимосвязи парасимпатических и симпатических нейронов, как пре-, так и постганглионарных. Когда они рассмотрели крестцовый отдел вегетативной нервной системы мышей с такого ракурса, то обнаружили, что его лучше отнести к симпатической, а не к парасимпатической системе.
Черепные парасимпатические преганглионарные нейроны образуются в прогениторной области заднего мозга “pMNv”[5], экспрессирующей гомеоген Phox2band и, ко всему прочему, формирующей бранхиомоторные нейроны [6]. Постмитотические предшественники мигрируют дорсально [7] с образованием ядер (таких как дорсальное двигательное ядро блуждающего нерва) и через дорсолатеральные точки выхода выступают в качестве ветвей некоторых черепных нервов, иннервирующих парасимпатические и энтеральные ганглии. В противоположность этому, симпатические преганглионарные нейроны грудного и верхнего поясничного отдела (далее просто “грудного”), предположительно, имеют общее происхождение с соматическими мотонейронами [8, 9]. Подразумевается, что они образуются в прогениторной области pMN (дорсальнее р3) — то есть из прогениторных клеток, которые экспрессируют основной фактор транскрипции OLIG2 типа спираль-петля-спираль (bHLH) [10]. Симпатические преганглионарные предшественники затем отделяются от соматических мотонейронов, формируя интермедиолатеральный столб у млекопитающих [11], затем вступают в вентральные корешки спинномозговых нервов вместе с аксонами соматических мотонейронов, и с помощью белых соединительных ветвей образуют синапсы на нейронах паравертебральных и превертебральных симпатических ганглиев.
Исследователи стремились сравнить генетический состав и взаимосвязи нижних поясничных и крестцовых преганглионарных нейронов (ниже просто “крестцовых”) с черепными (парасимпатическими) и грудными (симпатическими). В качестве представителя черепных преганглионарных нейронов они избрали дорсальное двигательное ядро блуждающего нерва, скопление нейронов, заметное уже на 13–14 день эмбрионального развития (E13.5) и экспрессирующее везикулярный переносчик ацетилхолина (VAChT) (рис. 1В). Грудные и крестцовые преганглионарные нейроны, которые образуют медиолатеральный столб спинного мозга, несмотря на их возможную холинергическую природу на данном этапе не экспрессируют VAChT. Для того, чтобы определить их локализацию, был использован общий маркер — синтаза оксида азота (NOS) [12] (рис.1, A и B), который отсутствовал в дорсальном двигательном ядре блуждающего нерва на E13.5 (рис.1В) или позже. Таким образом, экспрессия NOS характерна для грудных и крестцовых, но не для черепных преганглионарных нейронов.
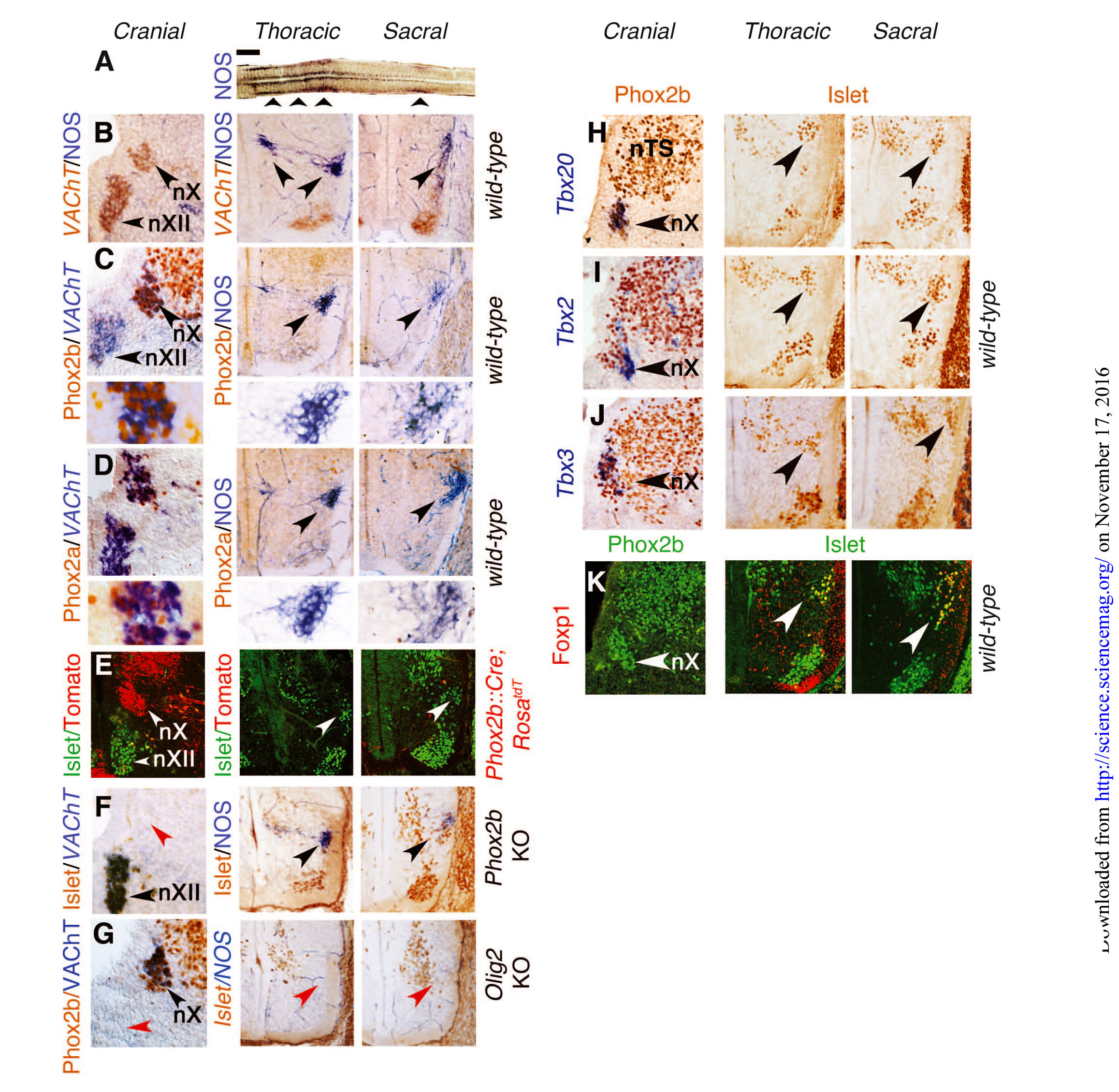
В отличие от черепных (парасимпатических) преганглионарных нейронов, грудные (симпатические) преганглионарные нейроны не только не экспрессируют Phox2b или его паралог Phox2a на E13.5, но также образуются из Phox2b-негативных прогениторов, а вместо Phox2b их дифференцировка (рис. 1, от C до F, левый и средний столбцы) зависит от OLIG2 (рис. 1G). Крестцовые преганглионарные нейроны в этом плане схожи с грудными (рис. 1, от С до G, средний и правый столбцы). На E13.5, экспрессия факторов транскрипции Tbx20, Tbx2 и Tbx3 семейства T-box была выражена в черепных (парасимпатических) нейронах, но отсутствовала как в грудных (симпатических), так и в крестцовых преганглионарных нейронах (рис. 1, от Н до J). Фактор транскрипции Foxp1 семейства F-box — определяющий фактор преганглионарных нейронов грудного отдела [13] — экспрессировали крестцовые, но не черепные преганглионарные нейроны (рис. 1К). Различия в экспрессии Phox2b, Tbx20 и FoxP1 между черепными и всеми спинномозговыми преганглионарными нейронами грудного и крестцового отделов, также наблюдается на E16.5. В целом, онтогенез и транскрипционные характеристики крестцовых преганглионарных нейронов были неотличимы от грудных, а, следовательно, и от симпатических нейронов.
Грудные и крестцовые преганглионарные нейроны располагаются в медиолатеральной области спинного мозга, их аксоны выходят вентрально, в то время как топография черепных преганглионарных нейронов менее систематизирована, а их аксоны выходят дорсально. Эти сходства крестцового отдела с грудным, а также их отличия от краниального противоречат представлению о краниосакральном сходстве с момента его первого описания [1].
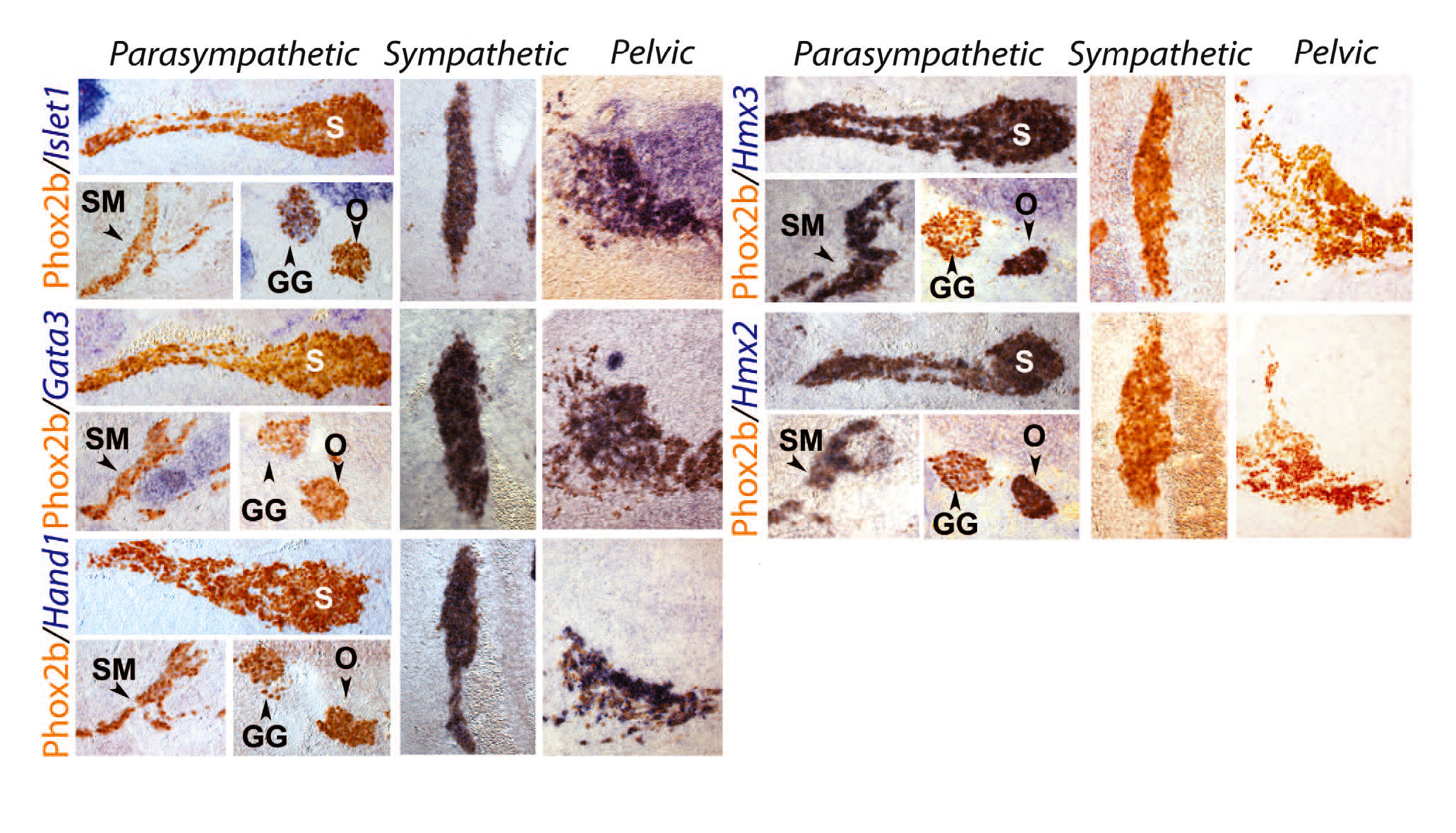
Крестцовые преганглионарные нейроны проводят импульс в тазовое сплетение и считаются парасимпатическими [14]. Поскольку часть тазовых ганглионарных нейронов получает импульсы от верхних поясничных (частично исследовались на крысах [15]) и, следовательно, от симпатических преганглионарных нейронов, тазовый ганглий считается смешанным — симпатическим и парасимпатическим [16]. Такое определение представляет проблемой для клетки, которые получают двойную иннервацию от поясничного и крестцового отделов [17]. Симпатическая идентичность грудных и крестцовых преганглионарных нейронов, которая раскрывается в этой публикации, лишает этот вопрос актуальности. Несмотря на это, учёные искали свойственный клеткам критерий, который бы подтвердил симпатический характер всех тазовых ганглионарных клеток, в генах, экспрессия которых различна в симпатических ганглионарных клетках в отличие от парасимпатических нейронов в любом другом месте вегетативной нервной системы. Нейромедиаторные фенотипы не соответствуют симпатическому или парасимпатическому отделам вегетативной системы, поскольку холинергические нейроны тазового ганглия включают в себя как «парасимпатические», так и «симпатические» ганглионарные клетки, как это определено их взаимосвязью [14], а истинные симпатические нейроны паравертебрального ствола являются холинергическими [18]. Тем не менее, исследователи обнаружили, что три фактора транскрипции, которые в обязательном порядке экспрессируются в симпатоадреналовой системе — Islet1, Gata3 и Hand1 — не выявлялись в таких парасимпатических ганглиях, как в крылонебные, подчелюстные или ушные (рис. 2), [хотя Islet1 экспрессируется в реснитчатом ганглии, а Gata3 в сердечных ганглиях, которые, таким образом, отклоняются от каноничной парасимпатической молекулярной сигнатуры]. С другой стороны, было обнаружено, что два паралогичных гомеобоксных гена Hmx2 и Hmx3 являются специфическими маркерами всех парасимпатических ганглиев, в отличие от симпатических ганглиев и мозгового вещества надпочечников (рис. 2). Все клетки тазового ганглия были Islet1+, Gata3+, Hand1+, Hmx3- и Hmx2- на E13.5 (рис. 2) и га E16.5 (рис. S8), равно как и меньшие отдельные ганглии тазовых органов (рис. S8). Таким образом, все они имели симпатическую транскрипционную сигнатуру. Кроме того, ганглий Ремака у кур, который классически считался парасимпатическим, отобразил Islet1+, Hand1+, Hmx3- сигнатуры, и, соответственно, оказался симпатическим.
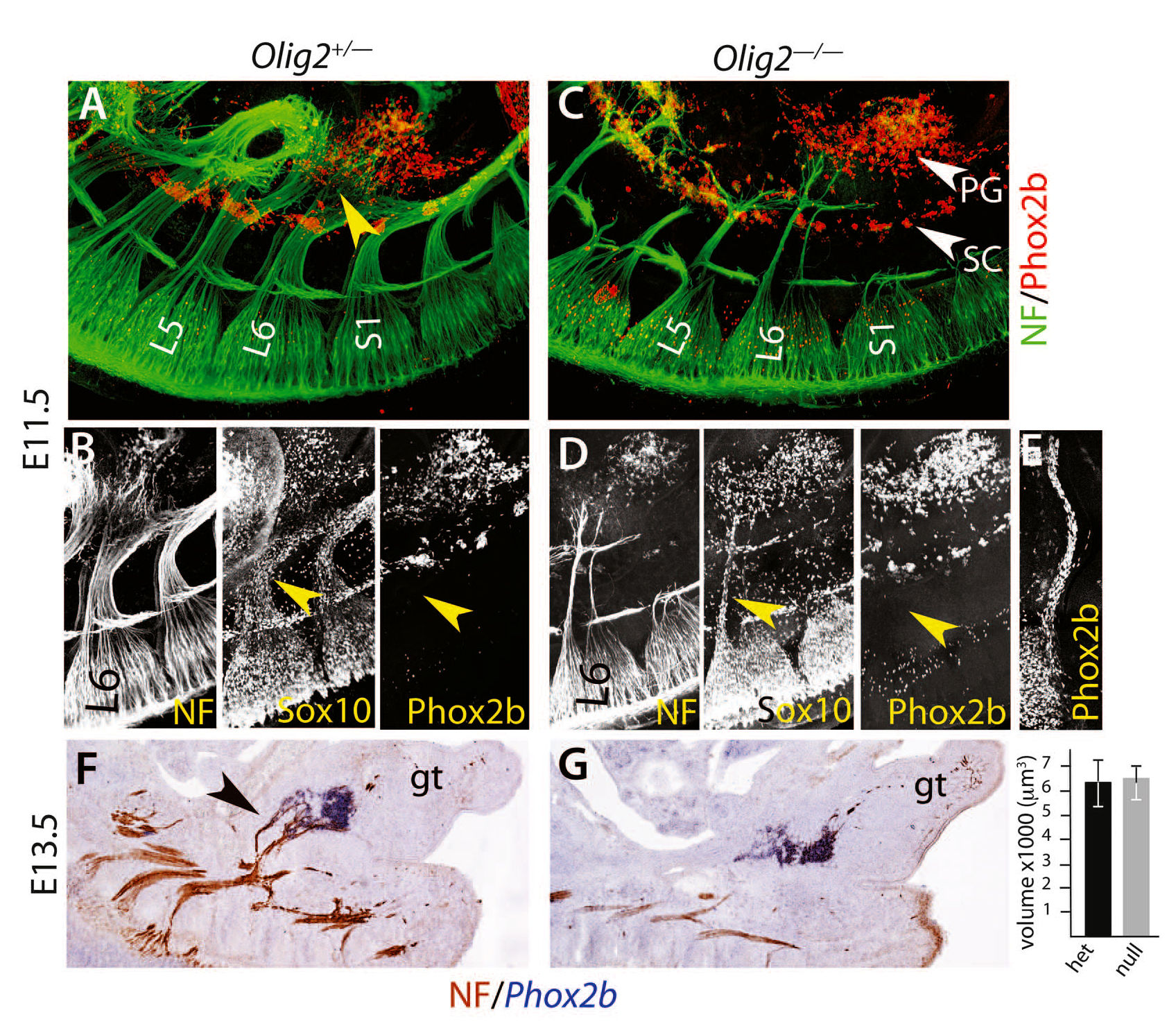
Наконец, опираясь на различия в режимах развития симпатических и парасимпатических ганглиев был проверен тазовый ганглий. Парасимпатические ганглии, в отличии от симпатических, возникают в результате миграции предшественников шванновских клеток Sox10+/Phox2b+ вдоль их будущего преганглионарного нерва по направлению к месту формирования ганглия и не образуют его, если эти нервы отсутствуют [24, 25]. На E11.5 пояснично-крестцовое сплетение, которое дает начало тазовому нерву, распростерло волокна, которые достигли бокового и рострального краев зачатка тазового ганглия и большинство из которых уже расположилось далеко впереди него (рис. 3А и видео S1). Эти волокна были покрыты клетками, экспрессирующими Sox10+, но (рис. 3B), в отличие от черепно-мозговых нервов, которые образуют парасимпатические ганглии на той же стадии, но не экспрессируют Phox2b (рис. 3E). Удаление всех моторных волокон у OLIG2-/- эмбрионов оставило только два тонких, предположительно, сенсорных, выступа от крестцового сплетения (рис. 3C), а также сильно уменьшило количество клеток с Phox2b+ (рис. 3D и рис. S10). Несмотря на эту массовую атрофию, тазовый ганглий оказался интактен (рис. 3C видео S2). Это было количественно проверено на E13.5 (рис. 3, F и G).
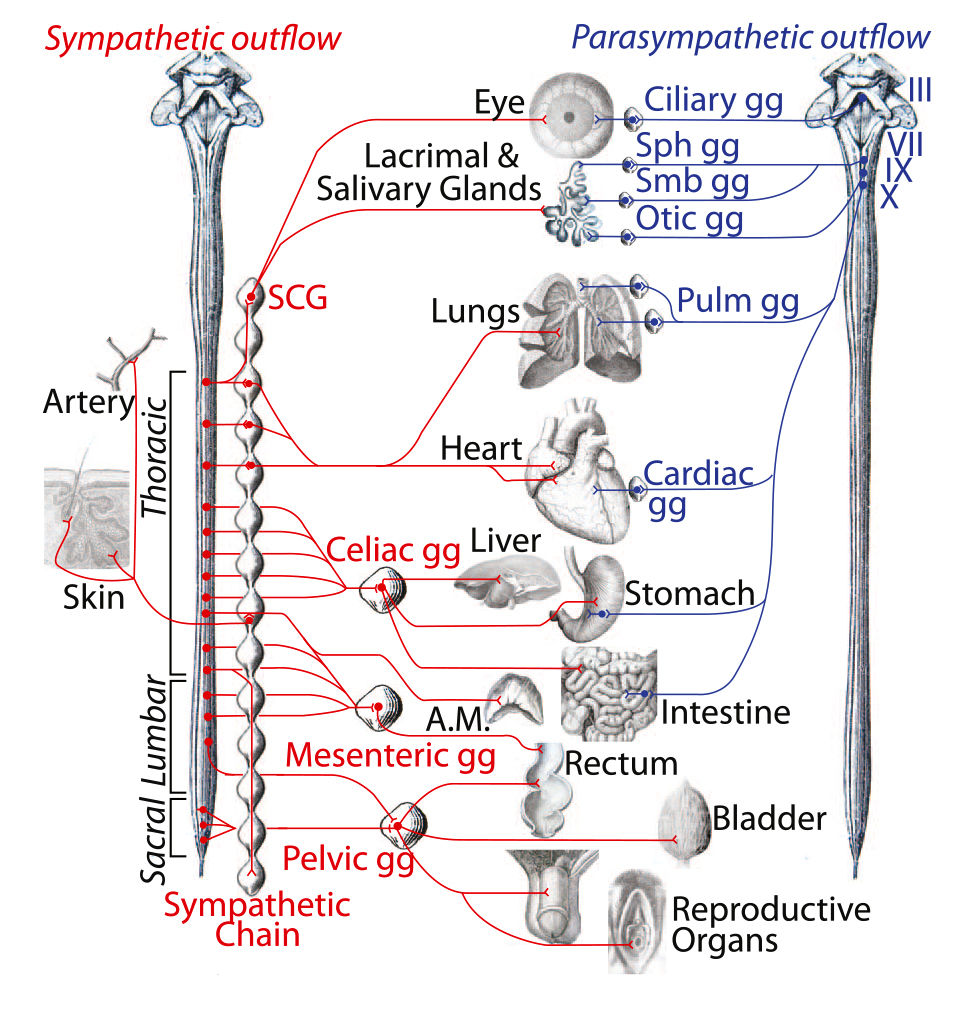
Хотя на 50% это клетки постганглионарного тазового нерва, тазовый ганглий формируется раньше и независимо от нерва, как и подобает симпатическому ганглию, а не парасимпатическому. Таким образом, крестцовый отдел вегетативной нервной системы является нижним форпостом симпатического отдела (рис. 4), а сама вегетативная нервная система разделена на краниальную и спинальную части, в соответствии с определенными эволюционными теориями [26]. Это новое понимание анатомии учитывает многие данные, которые противоречили предыдущим. Например, хотя обычно схемы представляют крестцовый путь к прямой кишке как дисинаптический, т.е. вагус-подобный [3], на самом деле он преимущественно [27, 28] трисинаптический, т.е. симпато-подобный [29]. Несмотря на догму об антагонизме между поясничным и крестцовым отделами, проявляющемся действием на мышцу-детрузор мочевого пузыря, в эксперименте торможение поясничного отдела отсутствует [4] или имеет сомнительную функциональную значимость [30]. Синергизм поясничного и крестцового отделов, проявляющийся расширением сосудов во внешних половых органах [29] показывает преемственность действия, а не антагонизм, как предлагает старая модель нервных импульсов грудопоясничного и крестцового отделов.
Симпатическая идентичность всех крестцовых и тазовых вегетативных нейронов, которую раскрывают новые данные, представляет собой основу для открытий в области нейроанатомии и физиологии таза.
Дополнительные материалы к статье
Источники
- W. H. Gaskell, J. Physiol. 7, 1–80.9 (1886).
- J. N. Langley, The Autonomic Nervous System: Part I (W. Heffer, Cambridge, 1921).
- E. Kandel, J. Schwartz, T. Jessell, S. Siegelbaum, A. J. Hudspeth, Principles of Neural Science, Fifth Edition (McGraw-Hill Professional, 2012).
- J. N. Langley, H. K. Anderson, J. Physiol. 19, 71–139 (1895). 5. J. Briscoe et al., Nature 398, 622–627 (1999).
- A. Pattyn, M. Hirsch, C. Goridis, J. F. Brunet, Development 127, 1349–1358 (2000).
- S. Guthrie, Nat. Rev. Neurosci. 8, 859–871 (2007).
- Prasad, M. Hollyday, J. Comp. Neurol. 307, 237–258 (1991).
- A. Markham, J. E. Vaughn, J. Neurobiol. 22, 811–822 (1991).
- W. A. Alaynick, T. M. Jessell, S. L. Pfaff, Cell 146, 178–178.e1 (2011).
- P. E. Phelps, R. P. Barber, J. E. Vaughn, J. Comp. Neurol. 330, 1–14 (1993).
- C. R. Anderson, Neurosci. Lett. 139, 280–284 (1992).
- J. S. Dasen, A. De Camilli, B. Wang, P. W. Tucker, T. M. Jessell, Cell 134, 304–316 (2008).
- J. R. Keast, Int. Rev. Cytol. 248, 141–208 (2006).
- J. R. Keast, Neuroscience 66, 655–662 (1995).
- Kuntz, R. L. Moseley, J. Comp. Neurol. 64, 63–75 (1936).
- W. C. De Groat, A. M. Booth, J. Krier, in Integrative Functions of the Autonomic Nervous System, C. M. Brooks, K. Koizumi, A. Sato, Eds. (University of Tokyo Press, Tokyo, 1979), pp. 234–245.
- U. Ernsberger, H. Rohrer, Cell Tissue Res. 297, 339–361 (1999).
- K. Huber et al., Dev. Biol. 380, 286–298 (2013).
- K. Tsarovina et al., Development 131, 4775–4786 (2004).
- E. Doxakis, L. Howard, H. Rohrer, A. M. Davies, EMBO Rep. 9, 1041–1047 (2008).
- L. Huber, M. Ferdin, J. Holzmann, J. Stubbusch, H. Rohrer, Dev. Biol. 363, 219–233 (2012).
- C. L. Yntema, W. S. Hammond, J. Exp. Zool. 129, 375–413 (1955).
- V. Dyachuk et al., Science 345, 82–87 (2014).
- Espinosa-Medina et al., Science 345, 87–90 (2014).
- S. Nilsson, in Autonomic Nerve Function in the Vertebrates, Zoophysiology, vol. 13, D. S. Farner, Ed. (Springer-Verlag, New York, 1983), chap. 2.
- C. Olsson et al., J. Comp. Neurol. 496, 787–801 (2006). 28. K. Fukai, H. Fukuda, J. Physiol. 362, 69–78 (1985).
- W. Jänig, The Integrative Action of the Autonomic Nervous System: Neurobiology of Homeostatis (Cambridge Univ. Press, Cambridge, UK, 2006).
- W. C. de Groat, W. R. Saum, J. Physiol. 220, 297–314 (1972).
- A. Pattyn, X. Morin, H. Cremer, C. Goridis, J. F. Brunet, Nature399, 366–370 (1999).
