Влияние электронных сигарет на сердечно-сосудистую систему

Neal L. Benowitz and Joseph B. Fraiman
Аннотация
Безопасность для сердечно-сосудистой системы (ССС) является важным фактором в дискуссии о рисках и пользе электронных сигарет (ЭС).
ЭС выделяют ряд веществ, которые могут оказывать негативные эффекты на состояние ССС, в их числе никотин, оксиданты, альдегиды, твердые частицы и ароматизаторы. На сегодняшний день большинство представленных у человека эффектов ЭС на ССС соответствуют известным свойствам никотина. Фармакологические и токсикологические исследования подтверждают биологическое правдоподобие того, что никотин способствует развитию острых нарушений ССС и ускоренному атерогенезу. Тем не менее, эпидемиологические исследования, оценивающие шведский бездымный табак, в котором присутствует никотин, но не продукты горения, в большинстве случаев не обнаружили повышенного риска развития инфаркта миокарда или инсульта среди пользователей такого табака. Однако, в этих же исследованиях предполагается, что никотин может способствовать появлению острых нарушений работы ССС, особенно тех, в основе которых лежит ишемическая болезнь сердца. Эффекты альдегидов, твердых частиц и ароматизаторов из ЭС на ССС установлены не были. Хотя использование ЭС может быть связано с некоторыми рисками для ССС их пользователей (в особенности тех, у которых уже есть заболевания ССС). На основании количественного и качественного сравнения состава аэрозоля ЭС и дыма сигарет можно сказать, что эти риски ниже, чем те, которые вызваны курением обычных сигарет. Таким образом, использование ЭС вместо обычных сигарет может положительно повлиять на общественное здоровье.
- На определение рисков и пользы использования электронных сигарет (ЭС) для населения значительное влияние оказывает относительная безопасность ЭС в сравнении с обычными сигаретами.
- Влияние токсических химических веществ на человека тяжело поддается измерению из-за большого количества типов ЭС, различных жидкостей-наполнителей (далее просто жидкости) и индивидуальных режимов использования ЭС.
- Продукты выделения ЭС, представляющие наибольшее воздействие на ССС, включают в себя никотин, оксиданты, альдегиды (особенно акролеин) и твердые частицы.
- Никотин может способствовать развитию острых кардиоваскулярных событий, в особенности у людей, уже страдающих сердечно-сосудистыми заболеваниями, главным образом, путем стимуляции симпатической нервной системы и системного высвобождения катехоламинов.
- Сердечно-сосудистые риски при использовании ЭС, скорее всего, значительно меньшие, чем при курении обычных сигарет.
ЭС появились на рынке с 2007 года, но стремительный рост их использования начался с 2010 года, особенно в Европе и США. Согласно данным эпидемиологических исследований в Евросоюзе 11,6 % населения хотя бы раз пробовали ЭС, а 1,8 % пользуются на данный момент; в США используют ЭС 3,8 % населения. Подавляющее большинство владельцев ЭС являются активными или бывшими курильщиками, и лишь малая часть заявила о том, что никогда ранее не курила. Все еще ведутся дебаты о пользе и вреде ЭС для общественного здоровья, и в разных странах господствуют разные мнения по этому вопросу.
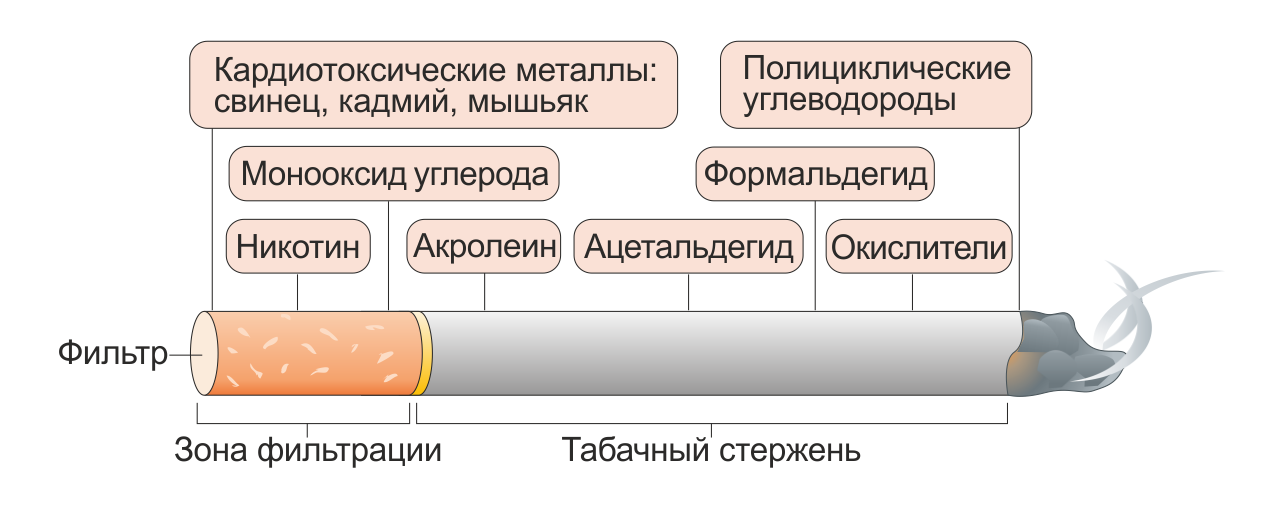
Наибольший вред, вызванный курением табака, обусловлен продуктами его горения (Рис. 1). Устойчивое употребление табака обусловлено зависимостью к никотину. Многие ведущие исследователи и политические деятели в области контроля за потреблением табака поддерживают концепцию того, что наиболее важной целью в борьбе с отрицательными эффектами курения табака является снижение или полный отказ от его употребления. ЭС выделяют никотин без вредных продуктов горения и потенциально могут помочь курильщикам отказаться от сигарет. Тем людям, которые не могут или не хотят бросать, ЭС могут быть полезны как минимум в снижении воздействия образовавшихся в процессе горения токсинов, что в итоге приведет к меньшему вреду для организма, особенно если курильщики смогут полностью заменить продукты горения никотина продуктами ЭС. В 2016 году использование ЭС с целью снижения вреда здоровью было рекомендовано Royal College of Physicians в Объединенном Королевстве.
Некоторые клинические исследования и долгосрочные эпидемиологические исследования предполагают, что ЭС могут способствовать прекращению курения, но высококачественные клинические исследования с использованием современных ЭС пока не доступны. Тем не менее, как было определено при исследовании концентрации многочисленных метаболических биомаркеров, замена сигарет, содержащих табак, на ЭС уменьшает воздействие токсинов и канцерогенов, присутствующих в сигаретах. Несмотря на эти предварительные исследования, доказывающие пользу ЭС, другие работы выступают против использования ЭС, ссылаясь на многочисленные опасения, включая: долгосрочные отрицательные эффекты ЭС на здоровье; одновременное использование ЭС и курение табака, приводящее к меньшему количеству людей, отказавшихся от обычных сигарет; становление курения нормой в обществе; игнорирование законодательства о запрете курения в общественных местах; отвлечение внимания курильщиков от проверенных методов по борьбе с зависимостью; потенциальную причину распространения курения сигарет среди несовершеннолетних.
Анализ влияния ЭС на здравоохранение должен учитывать влияние ЭС на число курящих и отказавшихся от курения и прямой эффект воздействия ЭС на здоровье. В этой статье авторы представляют обзор потенциально неблагоприятных эффектов ЭС на состояние ССС, описывая компоненты дыма ЭС, уровень воздействия токсинов и потенциальные механизмы токсического воздействия на ССС в сравнении с обычными сигаретами. Кроме того, авторы рассмотрели доступные данные о влиянии ЭС на ССС человека с целью оценить вероятный вред и предоставить актуальные рекомендации клиницистам для лечения пациентов с сердечно-сосудистыми заболеваниями (ССЗ), которые хотят использовать ЭС в качестве поддержки в борьбе с курением.
Источник: Nature reviews cardiology
Устройство ЭС и компоненты жидкости-наполнителя
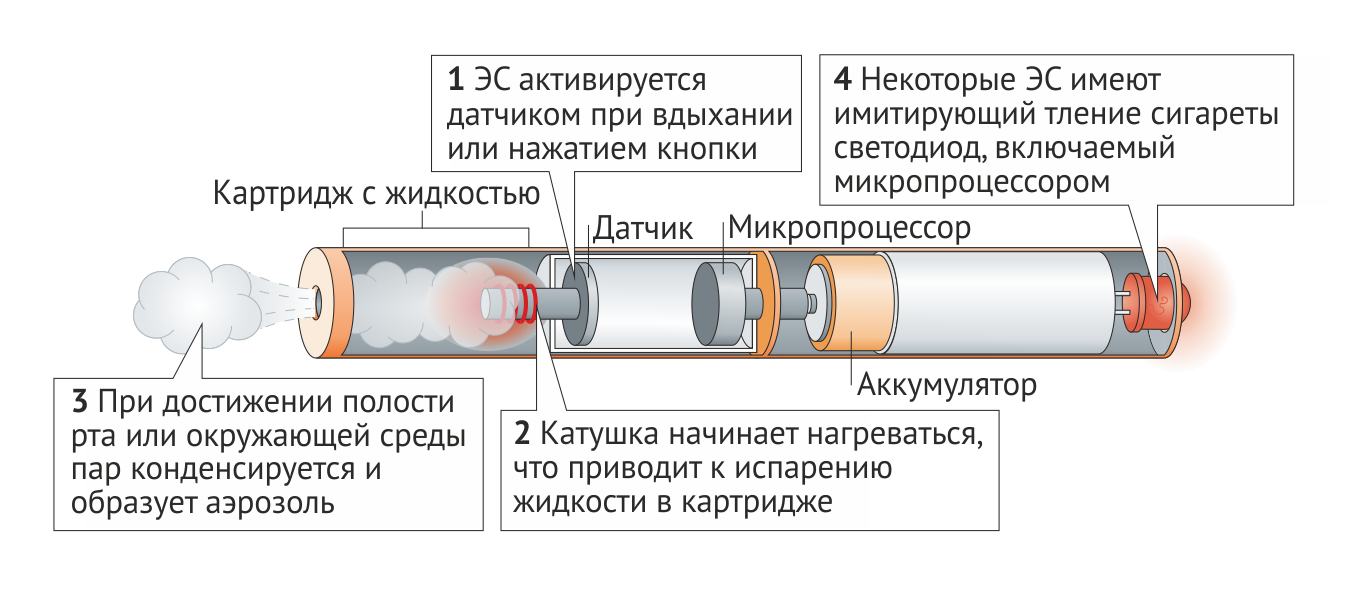
ЭС образуют пар или аэрозоль, который поставляет никотин для вдоха, не вызывая горение табака. ЭС различаются по размеру и механизму действия, но все состоят из картриджа или резервуара, заполненного жидкостью (содержащей пропиленгликоль и/или растительный глицерин, никотин и ароматизаторы), нагревательного элемента и аккумулятора (Рис. 2). Фитиль, обычно изготавливаемый из кремнезема или хлопка, доставляет жидкость из резервуара к нагревательному элементу (обычно это металлическая катушка). Некоторые ЭС внешне напоминают обычные сигареты, тогда как другие имитируют курительные трубки, сигары или кальяны.
Как правило, ЭС классифицируют как устройства первого поколения (выглядят как сигареты), второго поколения («танки») и третьего поколения («моды»). В устройствах третьего поколения возможно изменять температуру, напряжение и мощность атомайзера (Испарителя. — прим. пер.), а также пользователи могут модифицировать их по индивидуальному образцу. Усовершенствованные ЭС обычно имеют увеличенные аккумуляторы для выделения большего количества аэрозоля и доставке более высоких доз никотина, чем у ЭС первого поколения. Некоторые устройства имеют резервуары для жидкости (с возможностью многоразового пополнения или без нее), тогда как при использовании других моделей пользователю необходимо пропитывать фитиль жидкостью перед использованием.
Обычно жидкости содержат никотин в концентрации 3–48 мг/мл. При использовании устройств с более высокими напряжением аккумулятора и температурой зачастую используются растворы с низким содержанием никотина, так как в таком случае может быть произведен больший объем аэрозоля. ЭС обычно имеют один или несколько нагревательных элементов, обладающих разными характеристиками сопротивления, которые могут оказывать влияние на температуру, количество и состав аэрозоля. Как правило, жидкости ароматизированы, в продаже доступны тысячи различных видов ароматизаторов, самые распространенные из которых имеют вкус фруктов, конфет, кофе, ментола и табака.
ЭС активируются в момент ингаляции или при нажатии кнопки, активирующей датчик, ответственный за нагрев петли, что приводит к испарению жидкости, которой пропитан фитиль (Рис. 2). Пар выделяется в среднем в течение 3–4 секунд. При достижении полости рта или окружающей среды пар конденсируется и образует аэрозоль. Режимы использования ЭС и обычных сигарет отличаются друг от друга.
Курильщики обычно совершают 10–12 затяжек от одной сигареты за 5–6 минут, в течение дня примерно каждые 30–60 минут выкуривается новая сигарета в зависимости от индивидуального потребления сигарет в день. В связи с тем, что при использовании ЭС не происходит горение, пользователи ЭС делают меньшее количество затяжек за один раз, это приводит к более равномерному использованию ЭС в течение дня. Результаты исследования постоянных пользователей ЭС показали высокую вариабельность количества затяжек в течение дня — в среднем 120–225 затяжек в день. Количество вдыхаемого аэрозоля также может варьироваться в зависимости от особенностей устройства ЭС и концентрации никотина в жидкости. Владельцы ЭС третьего поколения с низким содержанием никотина вдыхают в несколько раз большую дозу аэрозоля по сравнению с владельцами более ранних устройств с высоким содержанием никотина — вероятно, это связано с попытками поддерживать желаемый уровень никотина в организме. Таким образом, нельзя рассматривать ЭС как одно определенное устройство, а уровень воздействия никотина и токсинов при использовании одной ЭС нельзя распространять на другие устройства.
В связи с тем, что при использовании ЭС горение табака не происходит, ЭС не выделяют ни монооксид углерода, ни большинство из тысяч продуктов горения, обнаруженных в сигаретном дыму. К основным компонентам жидкостей относятся пропиленгликоль и растительный глицерин в качестве растворителей, никотин и ароматизаторы. В жидкости могут присутствовать в незначительной концентрации примеси, полученные при экстракции никотина из табака или образовавшиеся в ЭС. Примеси, полученные из табака, могут включать в себя специфические нитрозамины, являющиеся канцерогенами; алкалоиды, такие как норникотин, никотирин, анабазин и анатабин, некоторые из которых в высоких концентрациях имеют психоактивный эффект. Примеси, образовавшиеся в ЭС, включают в себя металлы, содержащиеся в нагревательном элементе, припое и фитиле, такие как кадмий, хром, свинец, никель, серебро, олово и силикаты. Как правило, эти вещества представлены в низких концентрациях и, скорее всего, не оказывают существенного токсического влияния на организм. Тем не менее, пороговая доза токсичности остается неопределенной, а присутствие металлов в наночастицах, которые могут быть абсорбированы организмом, является предметом для беспокойства.
Источник: Nature reviews cardiology
Пропиленгликоль и растительный глицерин
При нагреве до высокой температуры пропиленгликоль может подвергаться термической дегидратации и образовывать такие продукты, как ацетальдегид, формальдегид, пропиленоксид, ацетол, аллиловый спирт, глиоксаль и метилглиоксаль. Растительный глицерин превращается в акролеин, глицидол и формальдегид. Как будет рассмотрено далее, наибольшее значение в отношении ССЗ имеет акролеин, в меньшей степени — формальдегид и ацетальдегид. Образование данных альдегидов во многом зависит от температуры, которая, в свою очередь, зависит от мощности, подаваемой на атомайзер. При повышении напряжения с 3,3 В до 4,8 В объем испаряемой жидкости увеличивается двукратно, общее количество образовавшихся альдегидов — трехкратно, а выделение акролеина возрастает в десять раз.. Таким образом, при низком напряжении аккумулятора концентрация образующихся альдегидов относительно невелика по сравнению с их выделением при курении обычных сигарет, однако при высоком напряжении батареи число альдегидов приближается к показателям сигаретного дыма и даже может превышать их. Повторное использование ЭС также может увеличить образование альдегидов: считается, что это связано с накоплением продуктов полимеризации, разрушающихся при нагревании.
Важным вопросом при экстраполяции результатов лабораторных исследований о влиянии компонентов аэрозоля на риск развития заболеваний является то, как часто ЭС используются в режиме, при котором выделяется высокая концентрация альдегидов. Farsalinos и соавт. предположили, что при высокой температуре вкус выделений становится настолько неприятным, что владельцы ЭС не будут использовать устройства, настроенные на такую температуру. Исследование на людях, оценивающее воздействие акролеина, с использованием биомаркеров мочи показало, что акролеина у использующих ЭС ниже, чем у курящих и сравнима с теми, кто не курит вообще. Хотя тот факт, что в моче не обнаруживается повышенный уровень метаболитов акролеина, не говорит об отсутствии биологического эффекта на организм, но это значит, что воздействие и, вероятно, вред акролеина от ЭС значительно ниже, чем у обычных сигарет.
ЭС выделяют как высокореактивные короткоживущие свободные радикалы, так и стабильные, долгоживущие. Химическая природа этих радикалов остается неизвестной. Концентрация свободных радикалов при использовании ЭС в 100–1000 раз ниже, чем в сигаретном дыме, однако эти показатели могут значительно изменяться в зависимости от типа ЭС. Установлено, что ежедневное воздействие свободных радикалов при регулярном использовании ЭС выше, чем при загрязнении воздуха, которое является фактором риска развития ССЗ. Таким образом, несмотря на то, что вред, наносимый свободными радикалами ниже при замене обычных сигарет на ЭС, нельзя исключать возможность развития неблагоприятных эффектов при регулярном использовании ЭС.
Частицы, выделяемые ЭС, по своим размерам распределяются бимодально, включая и наночастицы, и субмикронные частицы, последние из которых своим размером схожи с частицами сигаретного дыма. Считается, что наночастицы, которые состоят из металлов и химических веществ с низкой летучестью, образуются из катушки при ее нагревании или при пиролизе компонентов жидкости, находящихся в непосредственном контакте с поверхностью катушки. Субмикронные частицы образуются преимущественно из жидкого пропиленгликоля и растительного глицерина и быстро испаряются в воздухе (период полураспада — 11 секунд). Химическая природа частиц, выделенных из ЭС и обнаруженных в сигаретном дыме, различна. Частицы сигаретного дыма состоят из многокомпонентной смеси сотен потенциально токсичных, полулетучих органических веществ (сигаретная смола) и твердых углеродсодержащих материалов.
Сигаретный дым присутствует в окружающей среде в течение длительного времени, так как его период полураспада составляет 20 минут. Частицы сигаретного дыма схожи с частицами, образующимися при горении других органических материалов, таких как древесина, и обладают доказанным кардиоваскулярной токсичностью. При использовании ЭС пропиленгликоль и растительный глицерин в составе растворенных частиц попадают в легкие, где, как предполагается, быстро всасываются, попадают в кровоток и метаболизируются. Неизвестно, являются ли эти частицы токсическими, но даже если и так, то их токсичность, вероятно, ниже, чем у сложных углеродсодержащих частиц сигаретного дыма. Токсичность наночастиц, выделяемых ЭС, остается неизвестной.
Ароматизаторы
Большинство жидкостей ароматизированы, и на данный момент доступны тысячи разных вкусов. Ароматизаторы могут содержать спирт, смеси терпенов и альдегидов, а также химические вещества с известной токсичностью, такие как диацетил и бензальдегид, способные вызвать повреждение легких. Было обнаружено, что циннамальдегид, обнаруженный в ароматизаторе со вкусом корицы, цитотоксичен in vitro. На данный момент отсутствуют экспериментальные данные о влиянии ароматизаторов на здоровье пользователей ЭС.
Никотин
Устройства первого поколения выделяют меньшее количество никотина, чем более поздние модели, при использовании которых доза никотина сравнима с дозой при курении обычных сигарет. В течение многих лет для исследователей и практикующих врачей роль никотина как кардиотоксического вещества представляла большой интерес, и это является важнейшим вопросом при оценивании потенциального риска ЭС для ССС. Фармакологическое действие и токсичность никотина в отношении ССС были в деталях разобраны авторами данной статьи в своей предыдущей работе.
Базисная фармакология
Никотин связывается с Н-холинорецепторами, расположенными в головном мозге, вегетативных ганглиях и мозговом веществе надпочечников. Зависимость от никотина опосредована α4β2 никотновыми ацетилхолиновыми рецепторами (н-холинорецепторами), а эффекты на ССС — α3β4 н-холинорецепторами. Связывание никотина с α3β4 н-холинорецепторами приводит к локальному (из пресинаптического окончания) и системному (из мозгового вещества надпочечников) выбросу катехоламинов. Также никотин обладает не нейрональными эффектами, которые, как правило, опосредованы гомомерными α7 н-холинорецепторами. Эти рецепторы были обнаружены на эндотелиоцитах, макрофагах, кератиноцитах и иммунных клетках, отвечающих за воспаление.
Длительное воздействие никотина приводит к снижению возбудимости н-холинорецепторов и развитию острой толерантности. С целью прогнозирования хронических эффектов никотина необходимо учитывать толерантность при экстраполировании острых эффектов. Например, острое воздействие никотина ведет к усилению ангиогенеза, а хроническое — к нарушению ангиогенеза: считается, что это связано со снижением возбудимости сосудистых н-холинорецепторов. Явление толерантности хотя бы частично объясняет нелинейную связь дозы никотина и ответа на его воздействие, что помогает ответить на вопрос, существует ли повышенный сердечно-сосудистый риск, вызванный высоким уровнем никотина в крови при лечении курильщиков никотинзаместительной терапией (НЗТ) или при использовании ЭС одновременно с курением.
Фармакокинетика: табачная продукция против ЭС
Попадая в ротовую полость, никотин находится в виде частиц сигаретного дыма или аэрозоля ЭС, а при продвижении по дыхательным путям он переходит в газообразное состояние. Никотин, содержащийся в сигаретном дыму, быстро всасывается и достигает головного мозга в течение 15–20 секунд. Хотя считается, что никотин из ЭС всасывается с такой же скоростью, объем абсорбции в различных отделах дыхательной системы может варьироваться. Так как никотин является слабым основанием, то его переход из твердофазной частицы в газообразную состояние зависит от уровня pH, вместе с тем при высоких значениях pH большее количество молекул никотина становится неионизированным и способным к диффузии.
Жидкости ЭС обычно имеют pH ≥ 7, а сигаретный дым — около 5,5. И чем больше концентрация никотина в жидкости, тем выше становится уровень pH. Таким образом, в сравнении с курением при использовании ЭС никотин легче покидает щелочные твердофазные частицы и в большем объеме всасывается в верхних дыхательных путях.
Курение сигарет приводит к периодическим скачкам и падениям концентрации никотина в крови на протяжении всего дня. Период полураспада никотина составляет приблизительно 2 часа, из-за чего регулярное курение вызывает повышение концентрации никотина на более чем 6-8 часов, после чего уровень никотина медленно снижается в течение ночи. Владельцы ЭС распределяют затяжки более равномерно в течение дня, что приводит к более низкому содержанию никотина в крови и к меньшим скачкам артериального давления. Эта отличительная черта использования ЭС может иметь большое значение при рассмотрении токсичности, так как скорость роста концентрации никотина в крови влияет на его фармакологические эффекты. Таким образом, более медленная абсорбция никотина и более низкий пиковый уровень никотина при использовании ЭС приводит к менее выраженным кардиоваскулярным эффектам, чем при курении. Примерная доза никотина, попадающего в системный кровоток при курении, составляет 1,0–1,5 мг. Количество никотина из ЭС потенциально более вариабельно, так как зависит от модели ЭС и режима использования.
Как упоминалось ранее, устройства первого поколения выделяют меньшее количество никотина, чем обычные сигареты, тогда как следующие поколения ЭС, содержащие больший объем жидкости и обладающие аккумуляторами с большим напряжением, не уступают по этому показателю обычным сигаретам. Концентрация никотина в жидкостях варьируется от 3 мг/мл до 48 мг/мл, но его поступление в организм сильно зависит от устройства ЭС и количества испаренной жидкости. При использовании современной модели ЭС человек может получить равную или большую дозу никотина из жидкости с концентрацией 3 мг/мл, чем при при использовании модели первого поколения из жидкости с концентрацией 30 мг/мл. Таким образом, при интерпретации исследований о влиянии ЭС на ССС необходимо обязательно учитывать модель устройства и концентрацию жидкости для наиболее оптимального определения уровня никотина в крови.
Эффекты никотина на ССС
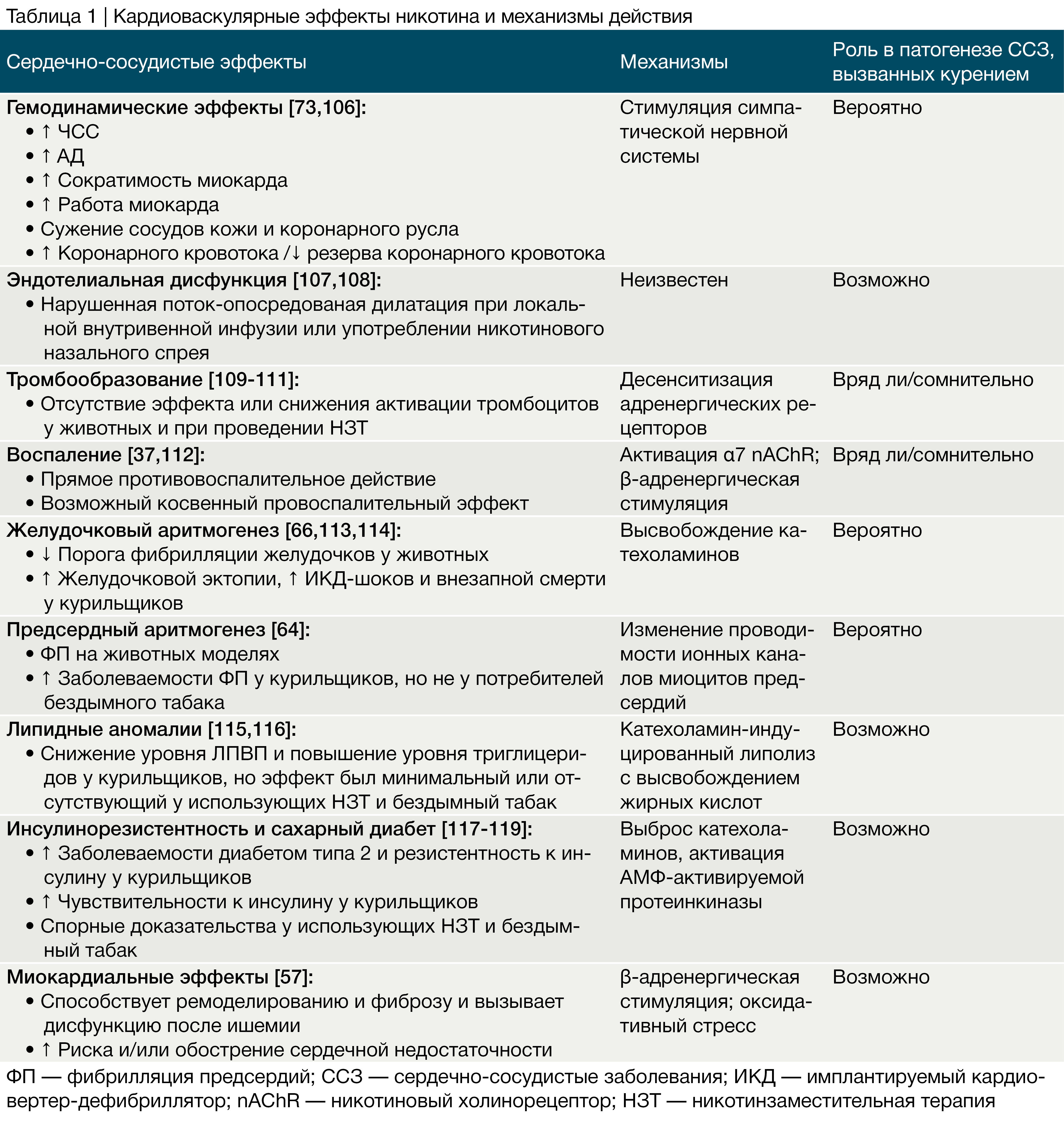
Известно, что активация н-холинорецепторов способствует изменениям гемодинамики, развитию эндотелиальной дисфункции, инсулинорезистентности, дислипидемии, аритмогенности, воспалению и изменениям в миокарде (таблица 1). Важно то, что эпидемиологические исследования заболеваний ССС, связанных с курением, не способны отличить эффекты никотина от эффектов токсических продуктов горения табака. Тем не менее влияние никотина на ССС возможно измерить путем оценивания изменений со стороны ССС пациентов, проходящих НЗТ, и анализа данных эпидемиологических исследований пользователей бездымного табака.
Данные нескольких исследований показали, что среди пациентов, страдающих от болезней ССС, НЗТ не вызвала рост риска для ССС по сравнению с плацебо. Кроме того, мета-анализ 21 клинического исследования обнаружил, что НЗТ не была связана с повышенным риском развития основных сердечных патологий в сравнении с плацебо, но была ассоциирована с менее серьезными состояниями, такими как ощущение сердцебиения и аритмия. Недостатком этих исследований безопасности НЗТ является их короткая продолжительность, а значит, и их ограниченная полезность при оценивании роли никотина в атерогенезе.
В некоторых регионах мира, например в Швеции, широко распространено использование снюса (форма снаффа), который представляет собой бездымный табачный продукт, содержащий малое количество канцерогенных нитрозаминов и обеспечивающий организм такой же концентрацией никотина, что и обычные сигареты. Согласно данным когортного исследования жителей Швеции, употребление снюса не вызывало повышение риска развития инфаркта миокарда или инсульта, но было связано с небольшим риском развития фатального инфаркта миокарда. Крупное американское проспективное исследование обнаружило небольшое, но значительное повышение риска развития острых нарушений ССС у пользователей бездымного табака (снаффа и жевательного табака). Еще одно шведское исследование показало, что отказ пользователей снюса, перенесших инфаркт миокарда, от привычки приводил к снижению смертности в последующие два года на ~50 %. Согласно данным кросс-секционного исследования, толщина внутренней и средней оболочек стенки сонной артерии (является биомаркером степени атеросклероза) была повышена среди курильщиков и не изменена среди пользователей снюса. Кроме того, была обнаружена связь между употреблением снюса и повышенным риском сердечной недостаточности, однако его употребление никак не влияло на развитие фибрилляции предсердий.
В мета-анализе 2016 года, исследовавшем связь между употреблением бездымного табака и риском развития ССЗ, сообщается об общем повышении риска развития ишемической болезни сердца и смерти от инсульта среди постоянных потребителей. Впрочем, были отмечены некоторые географические особенности — увеличение риска ишемической болезни сердца не наблюдалось в европейских странах, но было выражено в Азии.
Состав продуктов бездымного табака может отличатся. Например, в азиатских регионах они содержат больше нитрозаминов и других токсичных компонентов, что обосновано различиями в производстве и использовании. Наиболее подходящими для исследования изолированных эффектов никотина могут служить самые чистые формы табака, такие как шведский снюс.
Учитывая, что, в отличии от курения обычных сигарет, употребление чистых форм бездымного табака обычно не связано с повышенным риском инфаркта миокарда или атеросклероза, никотин вряд ли является основным фактором развития атеросклероза.
Связь между потреблением бездымного табака, увеличением частоты фатального инфаркта миокарда и увеличением смертности после перенесенного инфаркта миокарда позволяет предположить, что никотин скорее может способствовать развитию острых сердечно-сосудистых состояний и смертности от них уже при наличии ишемической болезни сердца.
Так или иначе, экстраполяция кардиоваскулярных эффектов использования НЗТ и бездымного табака ограничена при прогнозировании потенциального вреда электронных сигарет. Связано это прежде всего с тем, что поглощение никотина в ходе курения сигарет и электронных сигарет происходит быстрее, чем при использовании вышеупомянутых методов, которые, следовательно, могут давать менее неблагоприятные сосудистые эффекты.
Источник: Nature
Кардиоваскулярная токсичность сигарет
Курение сигарет является значительным фактором в развитии сердечно-сосудистых исходов по всему миру. Изучение риска для ССС из-за курения и его участие в патогенезе заболеваний важны для понимания потенциальных рисков использования электронных сигарет.
Риск возникновения острых коронарных и цереброваскулярных событий, включая инфаркт миокарда и инсульт, заметно повышается при курении [5, 60, 61]. У курильщиков ускоряется атерогенез, вовлекающий в процесс коронарные, сонные, мозговые артерии, аорту и периферические сосуды. Курение также усугубляет стенокардию и перемежающую хромоту, вызывает стенокардию вазоспастического генеза и повторное стенозирование после реваскуляризации коронарных или периферических артерий [40].
Прочие кардиоваскулярные эффекты курения табака включают прогрессирование и обострение сердечной недостаточности и гипертонической болезни.
Результаты эхокардиографических исследований с участием курильщиков свидетельствуют о распространенности среди них гипертрофии левого желудочка и диастолической дисфункции — факторы риска развития сердечной недостаточности, независимые от патологии коронарных сосудов и употребления алкоголя [62]. Также курение вызывает аритмию, включая фибрилляцию предсердий и внезапную сердечную смерть [63–66].
Острый инфаркт миокарда у курильщиков связан с более высоким шансом тромбообразования при менее выраженном атеросклерозе и ранним началом по сравнению с некурящими [67]. Другие неблагоприятные сосудистые эффекты курения включают нарушение заживления ран, эректильную дисфункцию, расстройства репродуктивной системы и макулодистрофию.
Важно отметить, что соотношение между количеством выкуриваемых за день сигарет и смертностью от ССЗ является нелинейным [68]. Влияние относительно низких доз сигаретного дыма достаточно чтобы вызвать существенное повышение риска смертности от ССЗ; однако при повышении уровня воздействия достигается плато уровня риска. Это нелинейное соотношение доза-эффект подразумевает как потенциально ограниченное снижение риска развития ССЗ через ограничение потребления у активных курильщиков, так и прогнозирование кардиоваскулярных рисков, исходя из эффектов воздействия на организм токсических веществ, полученных из табака.
Механизмы развития ССЗ, индуцированных курением
Множественные параллельные механизмы способствуют развитию индуцированных курением поражений ССС, включая окислительные процессы, повреждение и дисфункцию эндотелия, усиленное тромбообразование, хроническое воспаление, гемодинамические нарушения, неблагоприятное влияние на липиды крови, инсулинорезистентность и сахарный диабет, снижение доставки кислорода эритроцитами, аритмогенез.
Более углубленное обсуждение данных патогенетических механизмов выходит за рамки этого обзора и было широко рассмотрено ранее [5, 35, 60, 69–71].
Сигаретный дым является сложной смесью продуктов сгорания, которая состоит из болем чем 7000 химических веществ [5]. Составляющие сигаретного дыма, которые вероятнее всего вносят наибольший вклад в развитие ССЗ, — это летучие органические вещества, окисляющие соединения, твердые частицы, тяжелые металлы и никотин (Рис. 1). Окислительные вещества в сигаретном дыму содержат реактивные виды кислорода и азота; одна затяжка сигаретного дыма содержит около 1017 свободных радикалов [72].
Предполагается, что оксиданты, присутствующие в газовой фракции дыма, являются основными факторами, содействующими атерогенезу и тромбогенезу [69, 70]. Оксиданты повреждают эндотелиальные клетки, уменьшая биодоступность оксида азота, истощают эндогенные антиоксиданты, индуцируют воспаление и вырабатывают высокоатерогенные окисленные ЛПНП. Сигаретный дым также может содержать высокий уровень монооксида углерода (СО), который более прочно связывается с гемоглобином, чем кислород, тем самым приводя к функциональной анемии. Снижение доступности кислорода из-за воздействия СО может способствовать развитию стенокардии, застойной сердечной недостаточности, перемежающейся хромоты, ХОБЛ, увеличению желудочковой эктопии и снижение фибрилляции желудочков в самом начале [73]. Тромбоцитоз может возникать в качестве ответа на функциональную анемию, которая способствует увеличению вязкости крови и тромбообразованию, связанному с курением.
В сигаретном дыму также представлено множество органических соединений, включая реактивные альдегиды, такие как акролеин и полициклические углеводороды. Акролеин, как было доказано, вызывает повреждение сосудов, дисфункцию эндотелия, активацию тромбоцитов, дислипидемии и нейрогенное воспаление при моделировании у животных [74]. Более того, акролеин может дестабилизировать атеросклеротические повреждения, ускорять атерогенез и индуцировать развитие дилатационной кардиомиопатии. Токсикологические исследования эффективности и уровня воздействия с моделированием риска у животных свидетельствуют о том, что акролеин является основным фактором болезней, вызванных курением, в том числе и ССЗ [75].
Формальдегид и ацетальдегид в высоких дозах также могут оказывать вредное влияние на ССС животных. Кроме того, полициклические углеводороды могут ускорять развитие атеросклероза в некоторых животных моделях [76], но их вклад в развитие связанных с курением сердечно-сосудистых заболеваний пока неясен.
Частицы сигаретного дыма состоят из капель воды, никотина и различных органических веществ, содержащих твердые углеродсодержащие материалы. Воздействие твердых частиц с аэродинамическим диаметром < 2,5 мкм (твердые частицы [ТЧ] 2,5), находящихся в сигаретном дыму, приводит к окислительному повреждению, воспалению сосудов, активации тромбоцитов, повышению вязкости крови и изменениям автономного функционирования сердца [77]. Воздействие ТЧ 2,5, загрязнения атмосферного воздуха и, как следствие, пассивное курение и количество сигарет, выкуренных за день, связано с увеличением риска ССЗ [68,77]. Кроме того, тяжелые металлы, присутствующие в табачном дыму, в частности такие как свинец, кадмий и мышьяк, могут оказывать кардиотоксические эффекты путем окисления внутриклеточных белков, что в свою очередь способствует повреждению эндотелия.
Источник: Nature
Данные текущих исследований связи ЭС и ССЗ
Результаты исследований связи ЭС и ССЗ сильно варьируются в зависимости от характеристик пара и аэрозоля. Как было сказано выше, определенные виды электронных сигарет, особенно устройства первого поколения, поставляют довольно мало никотина, тогда как при использовании современных устройств можно получать никотина столько же, или даже больше, чем при курении обычных сигарет.
Исходя из этого, кардиоваскулярные эффекты ЭС, связанные с никотином, зависят от устройства. Оптимальное исследование эффектов использования ЭС на ССС должно включать измерение уровня никотина в крови; впрочем, в нескольких исследованиях сообщается об этом методе сбора данных.
Другие потенциальные сердечно-сосудистые токсиканты, такие как акролеин и тяжелые металлы, а также число частиц и их размеры, варьируются в зависимости от конструкции устройства, состава и сопротивления катушек, вольтажа батареи и того, как устройство используется. ЭС с высоким вольтажем аккумулятора и сопротивлением катушек генерируют высокие температуры, которые значительно влияют на действие альдегида и общий объем аэрозоля, что в свою очередь приводит к большей подверженности действию оксидантов и твердых частиц, потенциально увеличивая кардиоваскулярный риск.
В идеале, подробная информация об устройстве ЭС и схемах использования, а также биомаркеры воздействия токсиканта, должны быть включены в исследования сердечно-сосудистой токсичности, но до сих пор ни одно из имеющихся исследований не включало эти данные.
В доклинических исследованиях влияния аэрозолей ЭС культуры клеток и животных часто подвергали воздействию очень высоких доз аэрозоля, что не точно воспроизводит дозы и продолжительность влияния при периодическом вдыхании человеком. При исследовании клеточных культур трудно или даже невозможно определить уровни экспозиции и временной ход аэрозоля ЭС относительно человека. В исследованиях на животных измерение уровня никотина возможно, но воздействие свободных радикалов и распределение частиц по размерам будет сильно зависеть условий влияния (то есть, как создается аэрозоль или пар и каким образом доставляются животному, учитывая, что характеристики аэрозоля быстро меняются со временем, а свободные радикалы реактивны и нестабильны). Острые эффекты от использования ЭС могут оказаться бесполезными для прогнозирования риска развития ССЗ.
К примеру, аномальное поток-опосредованое расширение или аортальная ригидность являются достоверными маркерами будущих сердечно-сосудистых событий, а наступающая при использовании ЭС острая опосредованная стимуляция, ведущая к транзиторным нарушениям, может быть нерелевантным маркером, особенно если ЭС используются только периодически. Никотин может сужать кровеносные сосуды, приводя к временному увеличению скорости пульсовой волны аорты, что не эквивалетно ригидности стенки сосудов, развивающейся вследствии хронических заболеваний сосудов. Аналогично снижение вариабельности сердечного ритма является предиктором будущих сердечно-сосудистых событий, поскольку она отражает тонус симпатической нервной системы, который лежит в основе повышенного риска развития ССЗ [78]. Никотин, как известно, повышает тонус симпатической нервной системы и снижает вариабельность сердечного ритма [79], но вызванное данным веществом изменение тонуса симпатической нервной системы не равноценно повышению тонуса симпатической нервной системы, который является проявлением основного заболевания.
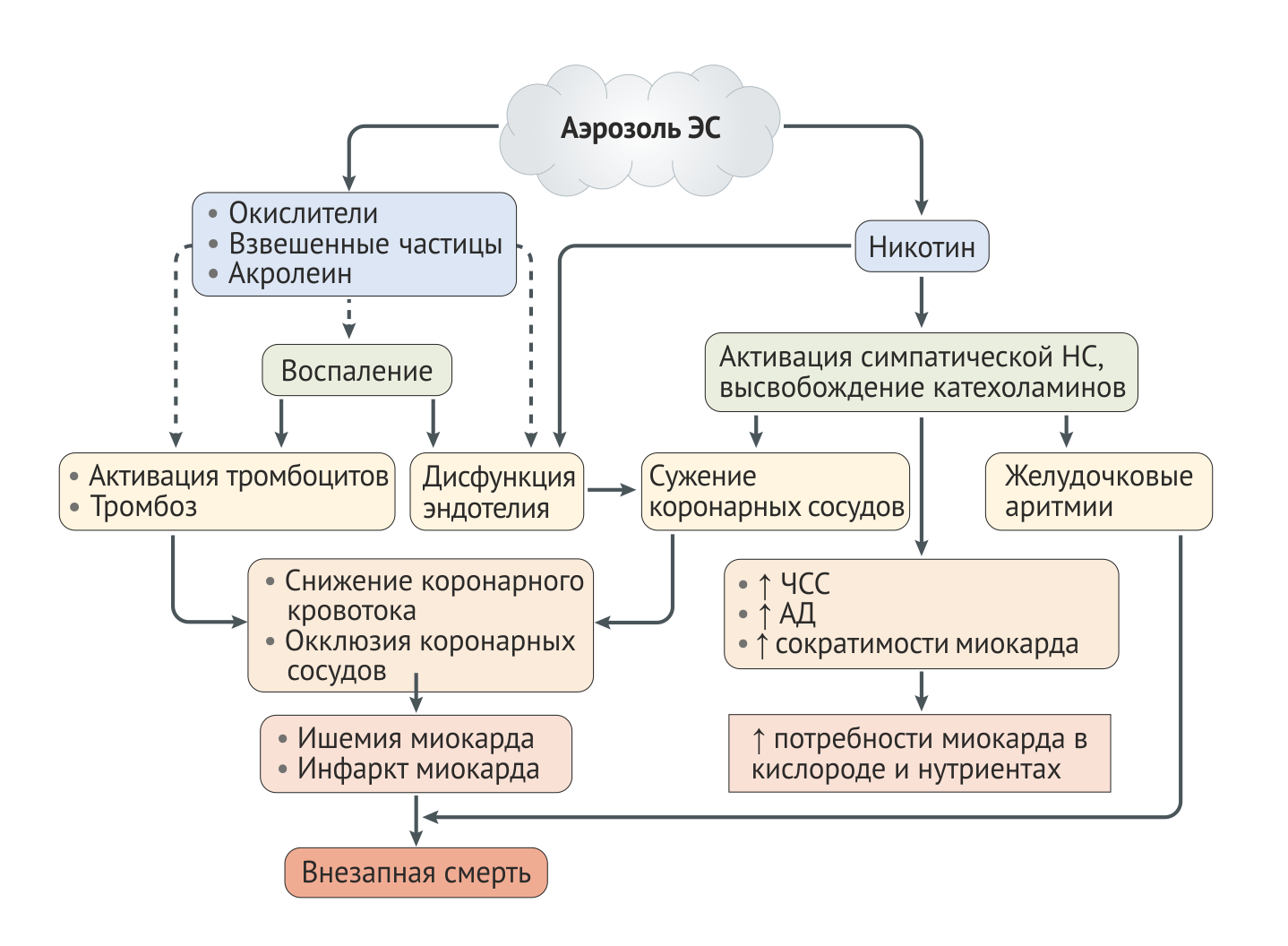
Эпидемиологические исследования рисков ССЗ, связанных с ЭС, трудно проектировать и интерпретировать, так как подавляющее большинство пользователей ЭС являются бывшими или текущими курильщиками сигарет [35]. Курильщиков, которые полностью перешли на ЭС, можно сравнивать с бросившими курение без использования ЭС при прогнозировании риска кардиоваскулярных событий, но людей, использующих только ЭС и находящихся в возрастной группе, для которой характерны наиболее острые сердечно-сосудистые события, довольно мало. Учитывая эти ограничения, любые выводы из текущих исследований ЭС должны быть интерпретированы с осторожностью. Сердечно-сосудистые эффекты, опосредуемые ЭС, по их механизмам потенциальной токсичности описаны ниже. На рис. 3 изображены гипотетические механизмы ЭС-индуцированых сердечно-сосудистых событий.
Гемодинамические эффекты
Гемодинамические эффекты ЭС согласуются с ожидаемыми эффектами никотина, как обсуждалось ранее. Любые различия эффектов во всех исследованиях вероятнее всего будут связаны с особенностями доставки никотина, используемой устройством. ЭС могут вызвать увеличение частоты сердечных сокращений, но степень этого увеличения варьируется в разных исследованиях [80]. Кроме того, многочисленные исследования ЭС также сообщали о резком повышении артериального давления среди пользователей [45, 81–83]. Тем не менее несколько других исследований сообщили об отсутствии изменений сердечного ритма и артериального давления в покое у ежедневных потребителей в периоды от 14 дней до 1 года [84–86]. Ретроспективный анализ исследования при участии курильщиков, использующих ЭС и не намеренных бросать курить, обнаружил, что у использующих ЭС с гипертонией, которые сократили или прекратили курение сигарет, значительно снизилось систолическое артериальное давление в покое. Курильщики, которые отказались от табака, но продолжали использовать ЭС, показали более значительное снижение артериального давления по сравнению с теми, кто только сократил потребление табака.
Структурные и функциональные эффекты
В нескольких исследованиях рассматривалось острое влияние использования ЭС на ригидность артерий и функцию миокарда. Vlachopoulos с соавт. сообщили об увеличении ригидности аорты при использовании ЭС в когорте из 24 человек, не имеющих факторов риска развития ССЗ, эффект был отложенным и меньшим по сравнению с курильщиками сигарет [87]. Однако, в другом исследовании (n=15) не было обнаружено изменений артериальной ригидности при использовании ЭС [88]. В электрокардиографическом исследовании диастолическая релаксация была нарушена после выкуривания одной сигареты (увеличение времени изоволюметрической релаксации), в то время как использование вволю ЭС на протяжении 7 минут — соответствует времени на одну сигарету — не влияет на диастолическую функцию [81]. Кроме того, обычные сигареты привели к увеличению частоты сердечных сокращений и артериального давления, что позволяет предположить, что пользователи ЭС меньше подвергались влиянию никотина.
В исследованиях in vitro и на людях были описаны изменения функции эндотелиальных клеток при использовании ЭС. В культуре эндотелиоцитов коронарных артерий человека табачный дым (но не аэрозоль ЭС) спровоцировал изменение в экспрессии генов, соответствующее ответу на стресс [89]. Исследование, оценивающее цитотоксичность сигаретного дыма и 11 различных жидкостей для эндотелиальных клеток вен, показало, что 5 жидкостей были цитотоксичны, вызывая гибель клеток и снижение их пролиферации, но большинство жидкостей были менее токсичны, чем сигаретный дым [90]. Важно то, что в 3 жидкостях, показавших цитотоксичность, не содержался никотин.
Кровоток-опосредованное расширение (FMD — flow-mediated dilatation. — прим. пер.), проведенное среди курильщиков и некурильщиков, было резко снижено в ответ и на использование ЭС, и на курение сигарет [91]. Кроме того, и курение, и использование ЭС резко увеличило оксидативный стресс и снизило биодоступность оксида азота (ЭС обладали значительно меньшим эффектом на оба показателя). Механизм, лежащий в основе эффекта ЭС на эндотелиальную функцию, неизвестен, но может быть связан с оксидативным стрессом либо воздействием никотина или твердых частиц.
Также было исследовано влияние использования ЭС на уровень циркулирующих предшественников эндотелиальных клеток (ПЭК) и микровезикул [92]. 10 затяжек ЭС способствовало повышению концентрации ПЭК: считается, что это является свидетельством ответа на повреждение эндотелия. Тем не менее никотин сам способен непосредственно стимулировать высвобождение ПЭК в отсутствие повреждения эндотелия, и в целом с риском развития ССЗ были связаны низкие уровни ПЭК, а не высокие [93, 94]. Antoniewicz и соавт. обнаружили минимальный эффект использования ЭС или отсутствие эффекта на уровень микровезикул, высвобождающихся в момент повреждения эндотелиальных клеток либо активации лейкоцитов или тромбоцитов. Это указывает на то, что использование ЭС не вызвало существенного повреждения эндотелиоцитов, воспалительного ответа или активации тромбоцитов. Таким образом, хотя ЭС могут иметь эффект на ПЭК, но, учитывая результаты других исследований, существует мало доказательств того, что этот эффект является предиктором риска будущих ССЗ.
В кросс-секционном исследовании 16 человек, заявивших, что используют только ЭС, и 19 некурящих человек оценивались вариабельность ЧСС и оксидативный стресс [95]. Владельцы ЭС сообщили о существенном использовании, однако показатели котинина (биомаркер воздействия никотина) были намного ниже, чем обычно определяется при исследовании пользователей ЭС, а специфические биомаркеры для исключения курения сигарет не были измерены. Участники исследования были проинструктированы о запрете использования ЭС в день обследования. Частотный анализ изменения ЧСС обнаружил сдвиг симпато-вагального баланса в сторону преобладания симпатической активности, похожий эффект наблюдается у курильщиков [95]. Окисляемость ЛПНП была повышена в соответствии с увеличенным оксидативным стрессом. Уровни C-реактивного белка и фибриногена — маркеров воспаления — не отличались у пользователей ЭС и контрольной группы. Исследователи предполагают, что ЭС оказывают влияние на вегетативную регуляцию сердца даже в отсутствие острых никотин-индуцированных эффектов, и это влияние может указывать на повышенный кардиоваскулярный риск. Тем не менее недостатки исследования, включая очень легкое употребление ЭС среди участников, неудачу в оценивании чувствительных и специфических биомаркеров курения сигарет с целью исключения одновременных курильщиков и пользователей ЭС, а значительный гендерный дисбаланс между пользователями ЭС и контрольной группой поднимают вопрос о генерализуемости наблюдений.
Воспаление
Хроническое воспаление способно ускорять разитие атеросклероза и стимулировать нестабильность бляшки, способствуя развитию острых кардиоваскулярных событий. После курения (в отличие от разового использования ЭС) более чем на 1 час возросла концентрация белых кровяных телец: лимфоцитов и гранулоцитов [96]. Как было отмечено ранее, разовое использование ЭС не ассоциировано с высвобождением микровезикул, опосредованным воспалением, а небольшое кросс-секционное исследование не обнаружило влияния использования ЭС на концентрацию С-реактивного белка и фибриногена, являющихся биомаркерами хронического воспаления [92,95].
Доклинические исследования, оценивающие воспаление в ответ на использование ЭС, в значительной степени сфокусировались на эффектах для дыхательной системы [97]. Воздействие аэрозоля ЭС на эпителиальные клетки дыхательных путей человека привело к повышению секреции воспалительных цитокинов и концентрации маркеров оксидативного стресса [98]. В противоположность этому результаты исследования экспрессии мРНК в эпителиальной ткани носовой полости пользователей ЭС показали свидетельства иммунной супрессии [99]. Любые связанные с ЭС эффекты на хроническое воспаление легких имеют значение для риска развития ССЗ, так как известно, что хроническое воспаление увеличивает риск болезней ССС.
Обзорные исследования
Долгосрочные и обзорные исследования определяли наличие неблагоприятных состояний и оценивали физическое здоровье среди пользователей ЭС и обнаружили несколько случаев развития сердечно-сосудистых событий [100, 101]. В истории болезни был описан пациент 70 лет с многочисленными жалобами на здоровье. У пациента эпизодически наблюдалась пароксизмальная форма фибрилляции предсердий, которой предшествовало использование ЭС [102]. Кроме того, в двух рандомизированных контролируемых исследованиях была исследована продолжительная эффективность ЭС как средства для прекращения курения на срок до 1 года, при этом не было обнаружено значительного роста развития неблагоприятных состояний, связанных с использованием ЭС [84,103].
Заключение
Безопасность для ССС является важным фактором в дискуссии о рисках и пользе ЭС, особенно в вопросе о использовании ЭС с целью прекращения курения у людей с ССЗ. Учитывая отсутствие экспериментальных данных о развитии сердечно-сосудистых событий среди пользователей ЭС, необходимо оценить вероятность риска ССЗ на основании данных о токсичности компонентов ЭС, уровне их влияния и механизмах их действия, а также на основании исследований, в которых использовались модельные животные, помещенные в условия, соответствующие доступной информации о вреде обычных сигарет для ССС. Как правило, потенциально токсические компоненты, за исключением никотина и твердых частиц, представлены в намного меньшем количестве в аэрозоле ЭС по сравнению с сигаретным дымом.
Важно то, что частицы аэрозоля ЭС отличаются от частиц сигаретного дыма и их токсичность неизвестна. Большая часть эффектов ЭС на ССС человека соответствует известному симпатомиметическому эффекту никотина. Таким образом, авторы статьи считают, что хотя ЭС могут представлять некоторый риск для ССС, в особенности у людей, уже страдающих ССЗ, однако этот риск меньше, чем от обычных сигарет. Если при условии надлежащего контроля и соблюдения мер безопасности использование ЭС сможет снизить распространенность курения, то, скорее всего, это приведет к улучшению здоровья ССС в популяции. Возможным недостатком увеличившегося использования ЭС является устойчивое одновременное использование ЭС и курение обычных сигарет, что может приводить к меньшему количеству людей, отказавшихся от обычных сигарет, и, таким образом, к развитию неблагоприятных эффектов для состояния ССС [4, 9, 10]. Вероятно, конечный эффект использования ЭС на преобладание курения в обществе зависит от распространения информации в сфере здравоохранения и восприятия потребителей, а также варьируется между разными странами.
Общая польза ЭС как средства для борьбы с курением до сих пор не была установлена, однако некоторые курильщики успешно бросают сигареты, используя ЭС [104]. В связи с этим авторы статьи поддерживают заявление AHA (American Heart Association — Американская ассоциация заболеваний сердца. — прим. пер.): «Если пациент провалил начальную стадию лечения, с пренебрежением относился к использованию лекарств для отказа от курения или вовсе их не принимал и желает использовать [ЭС] с целью прекращения курения, то будет разумно поддержать его попытку» [105]. Курильщикам с диагностированными ССЗ, которые бросают курить с помощью ЭС, авторы статьи рекомендуют прекратить использование ЭС, когда они будут уверены, что не вернутся к курению.
