Интерлейкин-2: механизмы регуляции и перспективы терапии

Интерлейкин-2 (ИЛ-2) — первый молекулярно-клонированный цитокин, представлялся как важнейший фактор роста Т-клеток, необходимый для их пролиферации и дифференцировки. Последующие исследования показали, что ИЛ-2 способствует генерации, выживаемости и функциональной активности регуляторных Т-клеток Foxp3+ (Treg или Т-супрессоры; Foxp3 — транскрипционный фактор, регулирующий транскрипцию генов, ответственных за дифференцировку Т-клеток и экспрессию цитокинов), и в его отсутствие наблюдается глубокий дефицит Т-супрессоров, приводящий к развитию аутоиммунных заболеваний. Таким образом, ИЛ-2 имеет двойные и противоположные функции: поддержание регуляторных Т-клеток и индукция эффекторных клеток, одновременный контроль и стимуляция иммунных реакций.
Самым ранним терапевтическим применением ИЛ-2 была стимуляция иммунного ответа у онкобольных. Не так давно появились терапевтические стратегии использования ИЛ-2, моноклональных антител к нему, или применения химических модификаций ИЛ-2 для увеличения числа и функции клеток Treg с целью лечения аутоиммунных заболеваний. Однако остается актуальной проблема одновременной генерации эффекторных клеток и клеток памяти, естественных киллеров и других лимфоидных популяций при использовании в лечении ИЛ-2.
История
Интерлейкин-2 (ИЛ-2) был выявлен как аутокринный фактор роста для культивируемых Т-клеток и был первым цитокином, клонированным в 1983 году. Вскоре была установлена его роль в стимуляции пролиферации Т-клеток и дифференцировке эффекторных и клеток памяти. Это подтолкнуло к клиническим испытаниям для оценки способности высоких доз ИЛ-2 стимулировать противоопухолевый иммунный ответ у пациентов с меланомой, раком почек и другими опухолями. Фактически, ИЛ-2 был первым биологическим продуктом, полученным с использованием технологии рекомбинантной ДНК, который был введен онкобольным и ВИЧ-инфицированным пациентам для стимуляции Т-клеток и, таким образом, заложил основу одной из великих революций биотехнологии и клинической медицины. Успех ИЛ-2 в качестве иммунотерапии опухолей был ограничен токсичностью, вызванной необходимостью введения высоких доз, проявляющейся как “цитокиновая буря” и синдром капиллярной утечки. Еще одним доказательством роли ИЛ-2 как важного фактора роста Т-клеток in vivo является использование моноклональных антител для подавления отторжения трансплантатов (таких как базиликсимаб, действующее вещество которого блокирует α-субъединицу ИЛ-2 рецепторного комплекса (IL-2Rα, который также известен как CD25 антиген) на поверхности Т-лимфоцитов).
В 1980-х и 1990-х годах в ходе некоторых наблюдений догма об основной роли ИЛ-2 лишь в качестве индуктора активации эффекторных клеток начала подвергаться сомнению. В ходе исследований было установлено быстрое возникновение аутоиммунных реакций на фоне блокирования ИЛ-2 или его рецептора CD25. Эти данные свидетельствовали о том, что значимая функция ИЛ-2 заключается в контроле иммунных реакций и поддержании иммунологической толерантности, а его отсутствие приводит к дефектному контролю эффекторных клеток, что приводит к аутоиммунной агрессии.
Функции и механизмы регуляции интерлейкина-2
ИЛ-2 необходим для выживания и реализации супрессивных функций регуляторных Т-клеток (которые определяются как CD4+, Foxp3+, CD25+, CD127), а отсутствие ИЛ-2 или нарушение его связи с рецептором проявляется численным и/или функциональным дефицитом регуляторных Т-клеток, что является причиной аутоиммунных реакций. Многие экспериментальные подходы показали, что этот цитокин имеет решающее значение для поддержания функционирования клеток Treg: в отсутствие ИЛ-2 T-супрессоры исчезают из периферических лимфоидных органов, по-видимому, потому, что дефицит этого фактора роста приводит к апоптотической гибели клеток.
Так же важна, как роль ИЛ-2 в выживании регуляторных Т-клеток, его необходимость для реализации функциональной мощности клеток Treg. Он необходим для экспрессии Foxp3 и других медиаторов Treg, подавляющих клеточную активность. Стабильная экспрессия Foxp3 реализуется за счет связи с его промотором ИЛ-2-индуцированного транскрипционного фактора Stat5. Ограниченная доступность ИЛ-2 в тканях, подвергшихся локальному воспалению, может привести к нестабильности клеток Treg, потере экспрессии Foxp3 и последующему производству патогенных цитокинов эффекторными клетками, которые могут усугубить аутоиммунизацию.
Поскольку зрелые клетки Treg не производят ИЛ-2, а он, предположительно, функционирует аутокринно, неизвестен был источник цитокина, который поддерживает на периферии регуляторные Т-клетки. Предполагалось, что стандартные (Foxp3-) Т-клетки продуцируют ИЛ-2, который затем действует на Т-супрессоры. Эта теория была подтверждена исследованиями, проведенными в условиях внутривидовой визуализации и показавшими, что регуляторные и стандартные Т-клетки локализуются вместе с антигенпредставляющими дендритными клетками, и в этих трехклеточных кластерах стандартные клетки реагируют на антиген путем секреции ИЛ-2, тогда как клетки Treg этот цитокин принимают.
Таким образом было установлено, что ИЛ-2 служит, по-видимому, обеим задачам: как стимуляции иммунного ответа, так и его контролю и сдерживанию (рис.1). Интересен вопрос о том, при каких обстоятельствах какая функция доминирует. Одно из предположений заключается в том, что доминирующая функция определяется количеством и кинетикой продукции ИЛ-2: индукция эффекторных клеток в ответ на кратковременное воздействие высоких доз цитокина и регуляторных клеток в ответ на стойкое содержание низкого уровня цитокинов. На активацию различных популяций Т-клеток также влияет кинетика экспрессии интерлейкиновых рецепторов. Рецептор поглощается клеткой после связывания с цитокином, а небольшой пул внутриклеточного IL-2Rβ стандартных CD4+ Т-клеток не позволяет им поддерживать их длительную экспрессию. Регуляторные Т-клетки, напротив, имеют крупные внутриклеточные пулы рецепторных цепей, благодаря чему способны осуществлять их экспрессию и в течение длительного времени могут представлять более устойчивое выделение ИЛ-2, чем другие популяции Т-клеток.
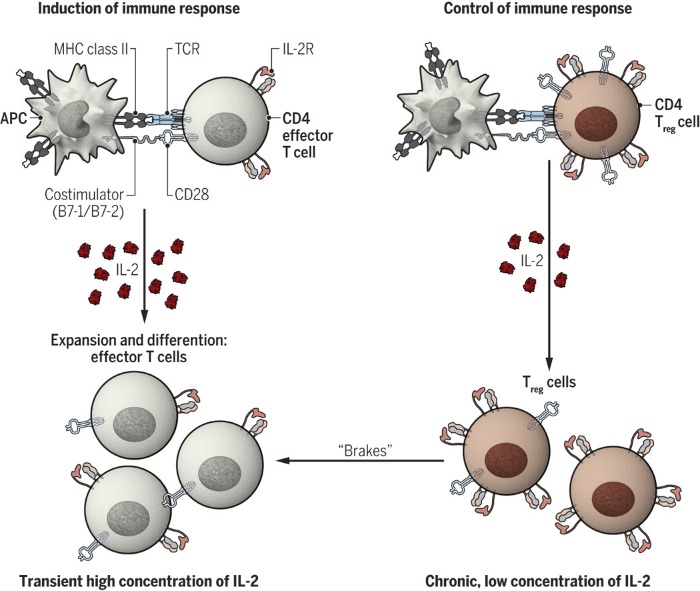
MHC — основной комплекс гистосовместимости; TCR — рецептор Т-клеток; APC —антигенпредставляющая клетка.
Генетические исследования ИЛ-2
Исследования в области генетики указывают на решающую роль нарушений регуляции ИЛ-2 как фактора риска аутоиммунных заболеваний. Редкие мутации, нарушающие аутокринный механизм регуляции ИЛ-2, могут вызывать тяжелые формы иммунной дисрегуляции. Дефицит IL2RA приводит к хроническому иммунодефициту и развитию IPEX-синдрома (иммуннодисрегуляция, полиэндокринопатия, энтеропатия и X-связанный синдром) — вариабельным аутоиммунным реакциям, развивающимся в первый год жизни и обусловленными мутацией транскрипционного активатора FOXP3. Мутации в транскрипционных факторах STAT5B, опосредующих сигналы ИЛ-2, также связаны с первичным иммунодефицитом и переменной аутоиммунизацией, что часто приводит к рецидивирующим инфекциям, экземе, хронической диарее и лимфоидной интерстициальной пневмонии. Варианты мутаций, также связанных с различными аутоиммунными заболеваниями, были обнаружены в генетических локусах, кодирующих ИЛ-2, его рецепторы, и связанные сигнальные факторы (включая STAT5A/STAT5B и PTPN2).
В локусе гена IL2RA однонуклеотидные полиморфизмы (ОНП, SNP) влияют на уровни транскрипта IL2RA, растворимость рецептора IL-2RA, его экспрессию на специфические для него типы иммунных клеток и распространенность экспрессирующих IL-2RA Т-клеток в крови.
Недавно разработанное изящное картирование генов (fine mapping) указывает на потенциальные ОНП с улучшенным разрешением. В качестве значимого примера, в локусе IL-2RA был отображен один некодирующий вариант ОНП в первом интроне, ассоциированный с риском болезни Крона. Парадоксально, но тот же ОНП каким-то образом связан с защитой от сахарного диабета 1 типа, что согласуется с ситуационно ограниченными эффектами ИЛ-2, оказывающих диссонансное воздействие на два разных заболевания.
Регулярно сгруппированные короткие палиндромные повторы (CRISPR) продемонстрировали, что изящно картированный IL-2RA вариант с риском аутоиммунизации снижает время индукции IL-2RA в нативных Т-клетках при стимуляции. В будущем такие работы будут иметь потенциал в качестве открытия изменения в ответ на стимуляцию в индукции IL-2RA может изменять риск развития таких заболеваний, как болезнь Крона и сахарный диабет 1 типа. Селективная генная инженерия может быть использована для определения этих связанных с заболеванием вариантов, для оценки механистического воздействия на регуляцию IL-2RA и создания лекарственного средства будущего, работающего непосредственно в отношении затронутых клеточных реакций. Кроме того, CRISPR дает возможность «корректировать» серьезные мутации, которые нарушают сигнализацию IL-2 или переписывать последовательности кодирующих генов, контролирующих специфическую регуляцию сигнальных компонентов ИЛ-2 для генной инженерии в терапии будущего.
Структура ИЛ-2 и его рецептора
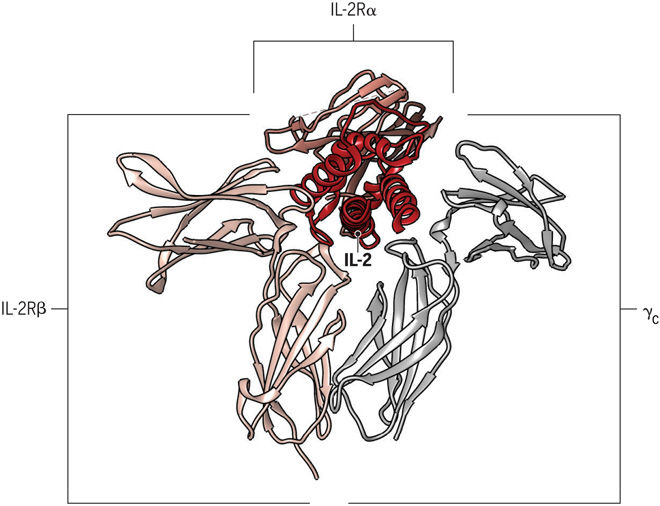
ИЛ-2 представляет собой типичный четырех-α-спиральный цитокин, который жестко регулируется на уровне мРНК с помощью сигналов от T-клеточного рецептора и CD28. ИЛ-2 связывается с клеткой через рецепторный комплекс, состоящий из трех субъединиц: IL-2Rα (CD25), IL-2Rβ (CD122) и общей γ-цепи (CD132). Высокое сродство тримерного комплекса IL-2/IL-2Rα/β указывает на его большую стабильность, чем ИЛ-2, связанный либо только с одной цепью α или β. Во время взаимодействия IL-2R тример IL-2/α/β принимает γ-цепь в четвертичный комплекс, что приводит к внутриклеточной передаче сигнала. Поскольку только часть остатка ИЛ-2 взаимодействуют как с цепями β, так и с γc, связывание ИЛ-2 может индуцировать конформационные изменения в β-цепи, что будет способствовать дальнейшему привлечению цепи γc. Для сигнализации необходимы цепочки β и γc, так как α-цепь не участвует в передаче сигналов. В отсутствие экспрессии IL-2Rα, IL-2Rβ и γc могут образовывать промежуточный аффинный рецептор, который полностью компетентен для сигнала. Структура ИЛ-2 и его рецептора является гибкой и может естественным образом существовать в разных конформациях, которые образуют либо высокоаффинный тримерный IL-2R, либо промежуточный аффинный димерный IL-2R, что приводит к активации иммунных клеток.
Терапевтические возможности ИЛ-2
Выяснение роли ИЛ-2 для регуляторных Т-клеток предполагало возможность использования цитокина для борьбы с нежелательным иммунным ответом, а также в лечении аутоиммунных и воспалительных заболеваний. Задача использования ИЛ-2 для подавления патологических иммунных реакций заключается в том, что цитокин может активировать эффекторную ветвь клеток лимфоидного ряда, тем самым снижая риск обострения болезни. Разрабатывается несколько подходов для таргетирования ИЛ-2 на регуляторные клетки.
Низкодозированный ИЛ-2
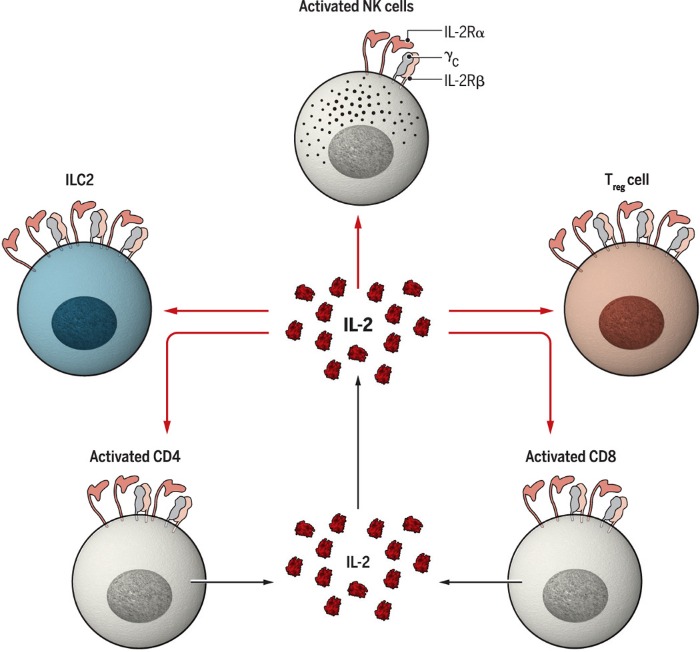
Тримерный IL-2Rαβγc обычно экспрессируется в больших количествах клетками Treg, тогда как димерный IL-2Rβγc представляется в основном на активированных CD8+ Т-клетках и NK-клетках. В настоящее время установлено, что терапия низкими дозами ИЛ-2 предпочтительно активирует клетки Treg из-за свойственной им высокой экспрессии IL-2Rα. Первые клинические испытания показали, что низкодозированный ИЛ-2 эффективен при лечении васкулита, ассоциированного с вирусными гепатитами, и хронической реакции трансплантат против хозяина (GVHD). В дальнейшем испытания были проведены в терапии системной красной волчанки и сахарного диабета 1 типа. Результаты до сих пор являются многообещающими, а биологический агент уже одобрен для клинического применения. Однако терапевтическое окно для доз ИЛ-2 слишком мало, что накладывает сложности на применение такого лечения.
Конъюгаты антитело-цитокин
Другим подходом с изменением структуры ИЛ-2 является создание антител к нему, которые при образовании комплексов с цитокином могут стимулировать экспрессию регуляторных или эффекторных Т-клеток. Этот подход был предложен после обнаружения способности цитокина связываться с различными ИЛ-2-антителами, блокирующими на цитокине сайты для связи с β-цепью рецептора и индуцирующими аллостерический эффект, изменяющий связывание цепи IL-2Rα. Экспериментально разработаны ИЛ-2-антитела JES6-1, стерически блокирующие взаимодействие IL-2/IL-2Rβ и IL-2/IL-2Rγ, индуцируя предпочтительную активацию клеток IL-2Rα. Другие антитела к ИЛ-2, S4B6, напротив, изменяют его конформацию приводя к блокировке взаимодействия ИЛ-2/IL-2Rα и стабилизации взаимодействия IL-2/IL-2Rβ, приводящей к избирательному таргетированию эффекторных Т-клеток.
Эти результаты были воспроизведены путем разработки моноклональных антител к ИЛ-2, которые, связываясь цитокином, приводят к его конформационным изменениям, требующим как большей экспрессии CD25, так и меньшего порога для ускорения пролиферации, что реализует усиление активации и увеличение пула клеток Treg. Было показано, что эти антитела/комплексы ИЛ-2 эффективны в моделях таких аутоиммунных заболеваний, как сахарный диабет 1 типа и экспериментальный аутоиммунный энцефаломиелит, а также в модели РТПХ (реакция «трансплантат против хозяина»). Разработка таких препаратов для клинического применения может быть улучшена путем непосредственного связывания антитела с ИЛ-2, в результате чего образуется единый агент, который может увеличивать период полувыведения ИЛ-2 и в то же время ограничивать его нецелевую токсичность.
Химические модификации ИЛ-2
Некоторые усилия были приложены для модификации самого ИЛ-2 с целью улучшения его терапевтического потенциала. Shanafelt и др. генерировали мутеин ИЛ-2 с ~3000-кратной селективностью для Т-клеток, чем для NK-клеток in vitro в сравнении с натуральным цитокином и продемонстрировал его активность in vivo на животных моделях. В 2012 году лаборатория Garcia выпустила CD25-независимую версию ИЛ-2 с повышенной аффинностью связывания с IL-2Rβ, которая показала превосходное сродство с цитотоксическими клетками, что привело к улучшению противоопухолевого ответа. Несколько компаний, в том числе Celgene, Roche, Amgen и другие, разрабатывают новые ИЛ-2 мутеин, которые преимущественно вызывают прирост эффекторных или регуляторных Т-клеток. Эти аналоги ИЛ-2 действуют как частичные агонисты и по-разному влияют на те или иные популяции лимфоцитов.
Другие подходы к повышению эффективности ИЛ-2 состоят в соединении цитокина с крупными молекулами-переносчиками, такими как альбумин или полиэтиленгликоль (ПЭГ), или с генетическим слиянием ИЛ-2 с Fc (кристаллизующийся фрагмент) иммуноглобулина. В настоящее время ведется разработка ПЭГилированного ИЛ-2 от Nektar Therapeutics с пониженной аффинностью к тримерному IL-2R регуляторных Т-клеток, который в большей степени поддерживает цитотоксические CD8+ клетки, обеспечивая выраженную противоопухолевую активность.
Клеточная терапия ИЛ-2
Потенциал влияния ИЛ-2 на отдельные подтипы T-клеток или NK-клеток может быть использован для создания цитокиновой системы, в которой пара рецептор-лиганд ограничена исключительно совместным взаимодействием. Генно-инженерные Т-клетки могут экспрессировать мутантную версию IL-2Rβ, на которую будет избирательно влиять специфический мутантный ИЛ-2. Это повышает вероятность выборочного влияния на отдельные популяции Т-клеток и, следовательно, в перспективе может использоваться для лечения как аутоиммунных, так и онкозаболеваний.
Выводы
История ИЛ-2 дает замечательные уроки о том, как концепции полностью меняются в ходе тщательных научных изысканий. Долгие годы ИЛ-2 считался основным фактором роста Т-клеток и был вовлечен в инициирование иммунных реакций. Более свежие результаты от разнообразных экспериментальных подходов предполагают, что основная функция ИЛ-2 заключается в поддержании стабильной работы регуляторных T-клеток в лимфоидных органах и тканях. Эти новые разработки и пересмотр взгляда на биологию ИЛ-2 стали основой новых терапевтических стратегий, использующих этот цитокин для подавления, а не для стимуляции иммунных реакций. Конечно, многое еще предстоит изучить, чтобы реализовать весь его потенциал: следует учитывать способность ИЛ-2 воздействовать на различные популяции клеток, многие из которых могут способствовать воспалительным реакциям и, таким образом, служить риском развития аутоиммунных заболеваний. Достижение оптимального баланса между активацией эффекторных и регуляторных Т-клеток также остается постоянной проблемой в терапевтическом применении этого цитокина. Однако многие текущие клинические разработки должны решить эти проблемы в ближайшем будущем.
