PRES-синдром
Синдром, включающий в себя головную боль, нарушение сознания, судороги, потерю зрения, изменения белого вещества задних отделов головного мозга при нейровизуализации и, самое главное, характеризующийся обратимостью всех этих симптомов, впервые описали Hinchey и соавторы в 1995 году, назвав его синдромом задней обратимой лейкоэнцефалопатии.
В данном отчете 7 из 15 пациентов получали иммуносупрессивную терапию (циклоспорин или такролимус) после трансплантации или в качестве лечения апластической анемии, 1 получал интерферон-α для лечения меланомы, 3 имели эклампсию, а оставшиеся 4 — гипертензивную энцефалопатию. Большинство пациентов имели резкое повышение артериального давления (АД), кроме троих, у которых показатели АД были в норме. После этого среди ученых началась полемика о терминологии, как правильно назвать данный синдром и корректно ли использовать термин лейкоэнцефалопатия.
Так как при этой патологии очаги на МРТ определяются и в белом, и в сером веществе, то пришли к новому названию — синдром задней обратимой энцефалопатии (англ. posterior reversible encephalopathy syndrome — PRES). Впоследствии развитие данного синдрома было описано при многих других состояниях, а также приеме некоторых медикаментов (химиотерапия, иммуносупрессивная или цитотоксическая терапия, аутоиммунные заболевания).
Постановка диагноза имеет важное прогностическое и терапевтическое значение, т. к. обратимость клинических и радиологически визуализируемых нарушений во многом зависит от вовремя начатой терапии или прекращения приема препаратов, вызвавших данное состояние, в то время как нераспознанный PRES может «потерять» свою обратимость вследствие цитотоксического отека и ишемии.
Клиника
Классические проявления PRES включают сильную головную боль, тошноту, рвоту, нарушение сознания, судороги и нарушения зрения. Нарушение сознания варьирует от легкой сомноленции до спутанности сознания, ступора или даже комы. Беспокойство и ажитация могут чередоваться с летаргией. Память и концентрация внимания также могут быть нарушены, хотя серьезные изменения в этой области нетипичны.
Судороги были описаны в более 70 % случаев больных с PRES из двух описанных серий (113 и 36 пациентов). Они могут быть тонико-клоническими генерализованными или парциальными, серийными и с переходом в эпистатус.
Также часто отмечается нарушение зрения в виде гемианопсии, визуального неглекта, зрительных галлюцинаций и корковой слепоты. Изменения в глазном яблоке могут выражаться в отеке соска зрительного нерва и кровоизлияниях в сетчатке. Сухожильные рефлексы часто оживлены, у некоторых пациентов выявляются слабость и нарушение координации. Также отмечается непостоянная очаговая симптоматика (парапарезы и симптомы поражения ствола мозга или мозжечка).
На ЭЭГ могут регистрироваться фокальные спайки, но в целом специфических изменений выявить не удается. Исследование цереброспинальной жидкости у 18 пациентов показало среднее содержание протеина 5,1 ммоль/л (диапазон 0,55–25,25 ммоль/л) и среднее содержание эритроцитов 1,6/мл (диапазон 0–5/мл).
Манифестирует PRES чаще всего с неспецифических симптомов, клиническая картина обычно развивается в течение 24–48 часов.
Частота основных клинических симптомов PRES (на основании двух серий исследований, всего 158 случаев):
— Судороги (75–87 %):
- Эпилептический статус (3–17 %);
- Генерализованные тонико-клонические судороги (54–64 %);
- Парциальные приступы (3–28 %);
— Энцефалопатия (28–92 %);
— Нарушения зрения (20–39 %);
— Головная боль (26–53 %).
Дифференциальный диагноз включает инсульт, венозный тромбоз, энцефалиты и некоторые другие патологии. Основной дифференциально-диагностический ряд PRES на основании данных нейровизуализации:
— Ишемический инсульт (в бассейне задней мозговой артерии или на его границе);
— Венозный тромбоз;
— Васкулиты;
— Постикальный обратимый отек головного мозга;
— MELAS;
— Острый рассеянный энцефаломиелит;
— Инфекционный энцефалит;
— Прогрессирующая мультифокальная лейкоэнцефалопатия;
— Гипоксическое повреждение головного мозга;
— Болезнь Крейтцфельдта-Якоба.
Так же, как и при PRES, в этих случаях может наблюдаться временное повышение АД. В случаях с внезапным развитием неврологического дефицита клиника может не отличаться от билатерального инфаркта в бассейне задней мозговой артерии. Изначально описанный у взрослых, PRES впоследствии был описан и у детей. Также сообщалось о рецидивах.
Радиологические особенности
Стандартные режимы нейровизуализации
Наиболее характерным паттерном PRES является относительно симметричный отек заднего белого вещества обоих полушарий головного мозга, особенно в теменно-затылочной области (рис. 1). Области шпорных борозд и парамедианных областей затылочных долей обычно не затронуты, что может позволить дифференцировать PRES от билатерального инфаркта головного мозга в бассейне задней мозговой артерии.
Тем не менее, другие области мозга также поражаются, в серии из 136 пациентов с PRES отек в основном распространялся на теменную или затылочную область (98 %), но также были затронуты и другие области, включая лобные доли (рис. 2) (68 %), нижние теменные доли (40 %) и гемисферы мозжечка (30 %), поражение базальных ганглиев (14 %), ствола мозга (рис. 3) (13 %) и белого вещества глубинных структур (18 %), включая мозолистое тело также нередки. Сообщалось и о вовлечение спинного мозга. Степень отека можно оценить по уровню слияния очагов поражения. Усиление сигнала (рис. 4), асимметричный и монолатеральный очаг поражения может поставить диагноз PRES под сомнение.
Патологические изменения в головном мозге часто видны уже на КТ, но тем не менее лучшим методом нейровизуализации остается МРТ. Наиболее частыми изменениями на МРТ являются точечные или сливные очаги на PD и T2 взвешенных изображениях. FLAIR последовательность позволяет увидеть более тонкие периферические изменения, которые отражают патологические изменения в коре мозга.
Градиент-эхо дает возможность выявить петехиальные геморрагии, гематомы и субарахноидальные кровоизлияния, которые так же были описаны при PRES. У большинства пациентов радиологические изменения регрессируют после адекватно подобранной терапии, что предполагает транзиторный отек, а не истинный инфаркт.
Последующие исследования в этой области, должны найти более специфические изменения, поскольку проведение начального дифференциального диагноза между обратимым и постоянным очагом поражении невозможно на стандартных режимах МРТ. Оптимальное время для проведения повторного МРТ для подтверждения восстановления не известно. Разрешение радиологических симптомов PRES вероятно происходит в промежутке от нескольких дней до нескольких недель.
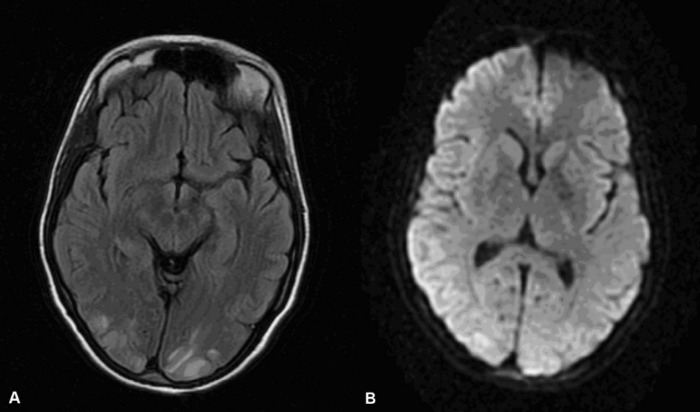
Рисунок 1 | А) МРТ головного мозга: наблюдается двустороннее повышение сигнала в затылочных областях в FLAIR-последовательностях; B) МРТ головного мозга: нормальный сигнал в тех же областях на DWI
Рисунок 2 | МРТ: наблюдается двусторонний корковый и подкорковый отек на FLAIR
Рисунок 3 | МРТ — гипертензивная энцефалопатия у 65-летнего мужчины. Наблюдается обширное повышение сигнала в стволе головного мозга на FLAIR
Рисунок 4 | T1-WI с использованием гадолиния; наблюдается небольшое усиления сигнала от коры затылочных областей
Другие режимы нейровизуализации
В большинстве случаев диффузионно-взвешенные последовательности показывают увеличение измеряемого коэффициента диффузии (ADC) в областях мозга с вазогенным отеком. Эти области с увеличенным ADC могут быть гипер-, гипо- или изоинтенсивными на DWI. Интерпретация DWI следует производить с количественной оценкой диффузии, т.к. это позволяет достоверно оценить степень поражения. Очаги с высоким значением ADC чаще всего обратимы, в то время как с низким чаще всего прогрессируют в инфаркт (рис. 5) и ассоциируются с неблагоприятным исходом.
Интересно, иногда значения ADC могут быть парадоксально нормальными в областях с высоким сигналом на Т2 или DWI. Эти так называемые псевдонормальные значения ADC могут быть результатом цитотоксического и вазогенного отека. Степень изменения сигнала на Т2 и DWI и значений ADC, по видимому, хорошо коррелируют с исходами у пациентов и может быть полезной в подборе более агрессивной терапии у более тяжелых пациентов.
Исследование 12 пациентов с PRES в режиме DTI, показало, что повышение значений ADC, сопровождалось снижением величины анизотропии в задних областях по сравнению с нормальными значениями в передних областях. Эти области ограничены зонами с нормально низкой анизотропией (корковая и подкорковая области), а их обратимость говорит о наличии вазогенного отека, поскольку предполагается, что интерстициальная аккумуляция воды увеличивает среднюю диффузию и уменьшает направленность диффузии вдоль белых волокон.
Однофотонная эмиссионная КТ и МР перфузия показали сохранную или повышенную перфузию к отечным участкам мозга у пациентов с гипертензивной энцефалопатией. Эти данные подтверждают гипотезу, что PRES начинается с гиперперфузии, в результате нарушения сосудистой ауторегуляции и резким переходом жидкости из сосудистого русла в интерстиций.
Были исследования PRES с помощью протонной магнитно-резонансной спектроскопии, которая показала обширные метаболические нарушения, включая повышение уровня холина и креатинина, небольшое снижение N-ацетиласпартата в областях, измененных на МРТ или нет. Эти данные предполагают диффузное нарушение метаболизма, возможно с последовательной активацией микроглии и нейрональной дисфункцией.
В одном клиническом случае, все метаболические изменения пришли в норму в течении 2 месяцев, однако нарушения метаболизма могут персистировать. Перфузионные МРТ-исследования, предназначенные для выявления бессимптомных пациентов, принимающих иммунодепрессанты и которые могут быть подвержены риску развития PRES, не смогли обнаружить субклинические изменения у данных пациентов.
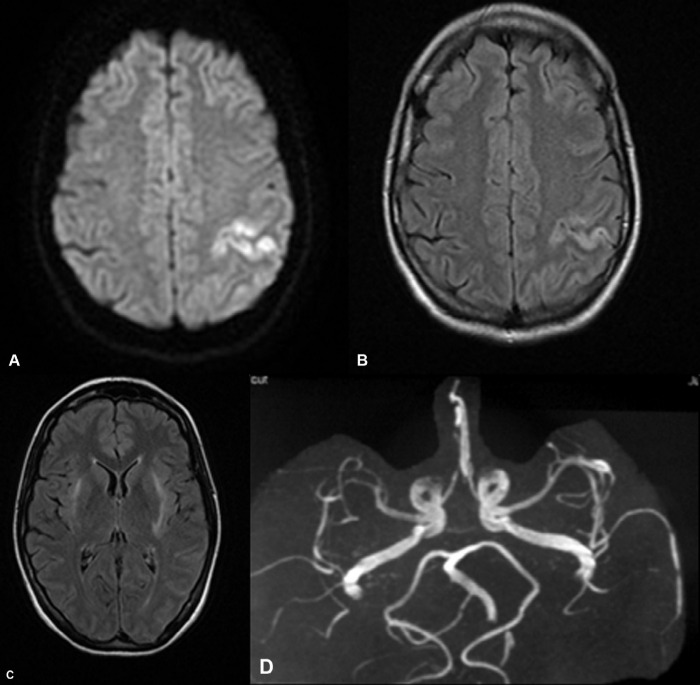
Рисунок 5 | А) МРТ: наблюдается высокий сигнал в коре лобной области на DWI со сниженными значениями ADC; B) Контрольная МРТ 2 недели спустя: наблюдается сохранение высокого сигнала от коры на FLAIR-последовательностях; C) МРТ: наблюдается двусторонний высокий сигнал в наружных капсулах и базальных ганглиях на FLAIR-последовательностях; D) МР-ангиография: наблюдаются двусторонние сужения и дилатации в ветвях средней мозговой артерии.
Основные нейровизуализационные особенности PRES:
— Теменно-затылочная локализация поражения с захватом подкоркового белого вещества;
— Часто поражается корковое вещество;
— Двусторонняя и относительно симметричная структура поражения;
— Часто ассоциируется с лобными и височными поражениями;
— Иногда — изолированное или преимущественное повреждение задней ямки;
— Гиперинтенсивный сигнал на T2-WI и FLAIR-последовательностях;
— Могут наблюдаться накопление контраста, петехиальное кровоизлияние или гематома;
— Повреждения могут быть изо-, гипо- или гиперинтенсивными на DWI;
— Интерпретация только DWI может привести к недооценке степени поражения;
— Повышенные значения ADC характерны для обратимого процесса после соответствующей терапии;
— Сниженные значения ADC характерны для необратимого процесса с развитием истинного инфаркта;
— Псевдонормальные значения ADC могут указывать на смешанный цитотоксический и вазогенный отек.
Контрастная ангиография и МР-ангиография
Диффузная вазоконстрикция, локальная вазоконстрикция, вазодилатация и даже появления ангиографического симптома «нити бус», состоящих из последовательных участков вазоспазма, могут выявляться на ангиографии у пациентов с преэклампсией и эклампсией. В последнее время PRES также связывают с вазоспазмом у пациентов с порфирической энцефалопатией, гиперкалиемией, терапией внутривнными иммуноглобулинами, циклоспорином или гемотрансфузией.
В серии случаев 47 пациентов с PRES обратимая васкулопатия была у 8 пациентов из 9 по данным катетер ангиографии, и у 30 пациентов из 43 по данным МРА. Это предполагает, что вазоспазм более распространен при PRES нежели думали раньше. Вазоконстрикция легкой или средней степени может не обнаруживаться на МРА. Время, когда выполнено исследование сосудов, может объяснить отсутствие изменений, поскольку вазоконстрикция не всегда присутствует при манифестации клинических симптомов, может начинаться внезапно, колебаться или разрешаться в течение нескольких дней.
Существует схожая патология сосудов головного мозга — обратимый церебральный вазоконстрикторный синдром (ОЦВС), который ассоциирован с различными состояниями, например послеродовыми или воздействиями вазоактивных веществ. Клинические симптомы так же схожи: внезапное начало, судороги, сильная головная боль, нарушение сознания и нарушение зрения.
Топографические особенности ишемического инсульта, как осложнения PRES, похожи на особенности ишемического инсульта, ассоциированного с ОЦВС. Наконец, очаги поражения соответствующие PRES были описаны у 6 (9 %) из 67 пациентов с ОЦВС. Эти данные свидетельствуют, что вазоконстрикция малых и средних сосудов может являться звеном патогенеза PRES, что вазогенный отек может развиваться у пациентов с ОЦВС.
Таким образом, данный радиологический феномен можно охарактеризовать как overlap-синдром между ОЦВС и PRES, что в свою очередь предполагает, что между ними существует единый клинический и патофизиологический континуум.
Этиология
С самого начала, с первого описания, PRES был связан с обширным числом заболеваний или приемом медицинских препаратов. Корреляция между клиническими проявлениями, локализацией при помощи нейровизуализации и этиологией не была в должной степени изучена. Например, преобладает ли поражение мозжечка или ствола мозга при гипертензивной энцефалопатии чаще, чем при другой этиологии PRES, еще предстоит определить.
Этиология и факторы риска, влияющие на развитие PRES:
1. Гипертензивная энцефалопатия:
— Острые или хронические почечные заболевания;
— Васкулиты:
- системная красная волчанка;
- узелковый периартериит;
- гранулематоз Вегенера.
— Эндокринные расстройства:
-
- феохромоцитома;
- первичный альдостеронизм.
- феохромоцитома;
— Порфирия;
— Термическая травма;
— Укус скорпиона;
— Кокаиновая или амфетаминовая зависимость;
— Прием безрецептурных стимуляторов.
2. Эклампсия:
— Диссекция сонной артерии;
— Гиперперфузионный синдром;
— Тромботическая тромбоцитопеническая пурпура;
— Гемолитико-уремический синдром;
— Синдром Гийена-Барре;
— Тройная Г терапия (triple h therapy).
3. Иммуносупрессивные препараты:
— Циклоспорин А;
— Такролимус;
— Сиролимус;
— Винкристин;
— Цисплатин;
— Цитарабин;
— L-аспарагиназа;
— Гемцитабин;
— Бортезомиб ;
— Бевацизумаб;
— Интратекальная химиотерапия;
— Комбинированная химиотерапия.
4. Другие препараты:
— Интерферон-α;
— ФНО-антагонисты;
— Иммунотерапия интерлейкинами;
— Антиретровирусная терапия;
— Эритропоэтин;
— Гранулоцитарный колониестимулирующий фактор;
— Внутривенные иммуноглобулины.
5. Другие причины:
— Обратимый церебральный вазоконстрикторный синдром;
— Инфекция/сепсис/шок;
— Гемотрансфузии;
— Синдром лизиса опухолей;
— Жировая эмболия;
— Гипомагниемия;
— Гиперкальциемия;
— Гипохолестеринемия.
Артериальная гипертензия
Одна из основных причин PRES является резкое, постоянное повышение АД, которое превышает порог мозговой ауторегуляции кровотока. Такая гипертензивная энцефалопатия может происходить в любом возрасте, однако большинство случаев приходится на диапазон от 2 десятилетия жизни до 4. По оценкам, около 1 % пациентов с гипертонией в какой-то момент переживают гипертонический криз (повышение систолического АД выше 180 мм рт. ст. или диастолического выше 110 мм рт. ст.).
Этот криз может потребовать неотложной медицинской помощи в зависимости от степени повреждения органа-мишени (сердечно-сосудистая система, почки, нервная система (а именно гипертензивная энцефалопатия)). Примерно 25 % всех гипертонических кризов требуют агрессивного терапевтического вмешательства с целью снижения АД, не обязательно до нормальных цифр.
Острые или хронические почечные заболевания (острые гломерулонефриты, реноваскулярные заболевания, инфаркт почки, почечная недостаточность) также являются одними из основных причин гипертензивной энцефалопатии. Связана ли большая тенденция развития гипертензивной энцефалопатии у пациентов с гипертензией ренального происхождения, чем у пациентов с эссенциальной гипертонией, еще предстоит выяснить.
Так же существуют и другие заболевания ассоциированные с гипертензивной энцефалопатии, включая аутоиммунные заболевания, эндокринные (феохромоцитома, первичный альдостеронизм, синдром Кушинга, ренин-секретирующая опухоль), порфирия, черепно-мозговые травмы, нарушения вегетативной нервной системы (синдром Гийена-Барре), укусы скорпионов, кокаиновая или амфетаминовая зависимость, взаимодействие с ИМАО, терапия 3 Г (гипертензия, гиперволемия, гемодилюция) симптоматического, связанного с субарахноидальным кровоизлиянием, вазоспазма, и прием безрецептурных стимуляторов (эфедрин, фенилпропаноламин, кофеин).
Преэклампсия, эклампсия
Ассоциация PRES с преэклампсией и эклампсией была достоверно установлена. Преэклампсия обычно переносится в течении третьего триместра (или во второй половине) беременности. Послеродовая эклампсия явление редкое и случается в течении первых 48 часов после родов, хотя так же сообщалось и об отсроченной эклампсии, развившейся в течении нескольких недель после родов. В одном из таких случаев были обнаружены не удаленные фрагменты плаценты. Также сообщалось о развитие PRES после резекции и проведении химиотерапии по поводу пузырного заноса.
Преэклампсия обычно ставится по гипертензии и протеинурии, развивающиеся после 20-й недели беременности. Ей страдают около 2–7 % первородящих с отсутствием фоновой патологии. Вопрос о лежащей в основе патофизиологии крайне дискутабелен. Текущая теория включает плацентарную дисфункцию, воспалительные заболевания, генетическую предрасположенность и иммунную дезадаптацию.
Классические проявления эклампсии заключаются в судорогах и коме, манифестирующие в третьем триместре или в раннем послеродовом периоде у женщин, которые уже имели типичную триаду преэклампсии (отеки, протеинурия, гипертензия). Однако гипертензия или протеинурия отсутствовали у 10–15 % женщин с синдромом HELLP (гемолиз, повышение уровня печеночных ферментов, тромбоцитопения) и у 38 % с эклампсией.
Недавний систематический метаанализ показал, что женщины, у которых была преэклампсия, имеют существенное повышение риска развития сердечно-сосудистых заболеваний, включая почти четырехкратное увеличение риска развития гипертонии, и примерно двукратное повышение риска развития ИБС, инсульта и венозных тромбозов в отдаленной перспективе. Механизм лежащий в основе этих осложнений до конца не ясен, является ли это результатом стойкого эндотелиального повреждения из-за преэклампсии остается неизвестным.
Другие причины
Появляются все больше данных, свидетельствующих о том, что не только артериальная гипертензия является основной причиной PRES. Хотя большинство пациентов так или иначе страдали от нее, многие из них в момент развития PRES имели удовлетворительные цифры АД, обычно ниже, чем те, которые встречаются при чистой гипертензивной энцефалопатии. Таким образом, гипертония может быть как единственной причиной PRES так и может выступать в качестве фактора риска.
Цитотоксические и иммуносупрессивные препараты
PRES чаще всего наблюдается после терапии высокими дозами иммунодепрессантов и цитостатиков в составе комбинированной терапии (цисплатин, циклоспорин, такролимус, сиролимус, цитарабин, винкристин, гемцитабин, тиазофурин, бортезомиб, сорафениб, сунитиниб). Также PRES встречается при аллогенной трансплантации костного мозга при гематоонкологических заболеваниях.
Сообщалось о случаях PRES после трансплантации органов, хоть и гораздо реже, нежели после трансплантации костного мозга.
PRES также бывает у больных аутоиммунными заболеваниями, включая системную красную волчанку, узелковый периартериит, системную склеродермию, гранулематоз Вегенера, ревматоидный артрит, тромботическую тромбоцитопеническую пурпуру и язвенный колит. В тоже время стоит помнить, что многие из них принимают иммуносупрессивную терапия.
Метаболические нарушения
Гипонатриемия, гипомагниемия, гиперкальциемия, почечная или печеночная недостаточность также могут выступать в роли факторов риска. Потеря магния происходит в следствии гломерулярный или тубулярный дисфункции у пациентов с эклампсией, или у принимающих циклоспорин и такролимус. В некоторых случаях симптомы PRES разрешаются после адекватного восполнения магния. Строгий контроль уровня магния в крови может быть рекомендован пациентам принимающим такролимус или циклоспорин.
Синдром гиперперфузии
Церебральная гиперперфузия (или реперфузия) — это редкое, но хорошо описанное осложнение каротидной эндартерэктомии или стентирования. Большинство исследований сообщает о частоте данного синдрома до 3 % от всех операций каротидной эндартерэктомии. Клинические симптомы могут развиться в любое время, как сразу после операции, так и несколько месяцев спустя, но в среднем клиника проявляется в течение примерно 5 дней. Без должного внимания это может привести к выраженному отеку мозга, внутримозговому или субарахноидальному кровоизлиянию и в конечном итоге к смерти.
Синдром гиперперфузии чаще распространен у пациентов, у которых произошло повышение мозговой перфузии более чем на 100 % после операции. Наиболее значимые факторы, влияющие на развитие реперфузионного синдрома являются окклюзия сонной артерии на противоположной стороне или недавняя каротидная эндартерэктомия там же и постоперационная гипертензия.
Отек мозга при данном состоянии также обратим и имеет схожие радиологические изменения на МРТ, что и PRES. Патогенез включает в себя нарушение ауторегуляции кровотока в результате эндотелиальной дисфункцией, опосредованной продукцией активных форм кислорода.
Патофизиология
На сегодняшний день патофизиология PRES остается дискутабельной: существуют две основные теории, объясняющие его патогенез. Ранняя теория постулирует, что PRES развивается в результате интенсивной вазоконстрикторной ауторегуляции мозгового кровотока в ответ на резкое повышение АД. Вазоспазм приводит к снижению мозгового кровотока, ишемии и впоследствии отеку в пограничных зонах артериальных бассейнов. Непосредственное наблюдение констрикции и дилатации сосудов мягкой мозговой оболочки у крыс во время гипертонического криза подтверждает эту теорию.
Ауторегуляция церебрального кровотока защищает мозг от повышения артериального давления, так как церебральная перфузия является своего рода константой организма и поддерживается в довольно широком диапазоне АД. В норме сосуды мозга обладают собственной регуляцией сосудистого тонуса. В ответ на системную гипотонию они расширяются, поддерживая мозговой кровоток на адекватном уровне, и наоборот, при высоком системном АД они сужаются.
Ауторегуляция происходит благодаря взаимодействию миогенных и метаболических механизмов. Центральную роль в поддержании гомеостаза АД играет эндотелий, продуцирующий вазодилататоры, такие как оксид азота, и вазоконстрикторы, такие как тромбоксан А2 и эндотелин.
У людей, не страдающих артериальной гипертонией, церебральный кровоток остается неизменным при значениях АД от 60 до 150 мм рт. ст. При превышении верхнего лимита может развиться гипертензивная энцефалопатия, в обратном же случае при снижении давления в мозговом кровотоке церебральная перфузия падает, что приводит к ишемии головного мозга.Длительная гипертония служит причиной сдвига кривой «мозговое давление/кровоток» вправо, предположительно это происходит из-за структурных изменений — гипертрофии и ремоделирования сосудистой стенки.
Таким образом, для развития PRES у больного с длительным стажем гипертонии требуется чуть более резкое повышение АД по сравнению с здоровым человеком. У людей, не страдающих артериальной гипертонией, симптомы энцефалопатии могут проявляться и при АД менее 160/100 мм рт. ст. У детей и молодых людей кривая «мозговое давление/кровоток» смещена чуть влево, что делает их более уязвимыми к PRES.
Вторая теория в качестве основного компонента PRES рассматривает не вазоконстрикцию, а вынужденную вазодилатацию сосудов головного мозга (срыв ауторегуляции), приводящую к экстравазации жидкости в интерстиций (вазогенный отек). На самом деле картина мозгового кровотока при острой гипертензии может состоять из соседних участков областей коры как с низкими, так и с высокими показателями кровотока.
Первоначально концепция срыва ауторегуляции предполагала пассивный характер явления. Однако позже появились данные, свидетельствующие о том, что этот процесс может быть активным, запущенным кальций-зависимыми калиевыми каналами. Это приводит к продукции активных форм кислорода и резкому повышению проницаемости гематоэнцефалического барьера, что происходит скорее за счет повышения везикулярного транспорта, а не разрыва плотных соединений.
Эклампсия на основании сходства клинических, радиологических и патологических особенностей рассматривалась как форма гипертензивной энцефалопатии. Накопление жидкости в организме, которое часто наблюдается во время беременности, может усилить предрасположенность мозга к отеку. Тем не менее некоторые соображения говорят о том, что эклампсия — несколько большее явление, чем гипертензивная энцефалопатия. Не всегда удается установить достоверную корреляцию между симптомами эклампсии и уровнем АД — у 23 % больных АД повышается минимально.
Преэклампсия/эклампсия — это мультисистемная патология, характеризующаяся нарушением сосудистой регуляции из-за действия вазоактивных веществ, выделяемых плацентой; ассоциируется с повышенной сосудистой сопротивляемостью, повышенной активацией тромбоцитов, активацией коагуляционной системы крови и эндотелиальной дисфункцией. У больных преэклампсией нарушена продукция плацентой антиангиогенных факторов: они поступают в материнский кровоток и разрушают эндотелий, что приводит к гипертензии, протеинурии и другим системным проявлениям преэклампсии/эклампсии.
Генерализованная эндотелиальная дисфункция может приводить к повышенной чувствительности к обычно циркулирующим прессорным веществам; нарушению синтеза вазоактивных соединений, что приводит к вазоспазму и снижению перфузии органов; активации тромбоцитов с кратковременной окклюзией капилляров и сосудов малого калибра; активации коагуляционного каскада и потере жидкости из сосудистого русла.
Иммуносупрессивные и цитотоксические препараты могут повредить гематоэнцефалический барьер различными способами: за счет прямого токсического действия на эндотелий сосудов, вазоконстрикции, вызванной высвобождением эндотелина, и образования микротромбов из-за повышения уровней тромбоксана и простациклина.
В силу различных факторов, включающих гипертензию и эндотелиальную дисфункцию, срыв ауторегуляции мозгового кровотока может представлять собой общий патофизиологический механизм. Не стоит забывать и об общем системном ответе, который присутствует всегда, независимо от основной причины PRES. Происходит активация Т-клеток и выработка ими провоспалительных цитокинов, которые активируют эндотелиальные поверхностные антигены, что увеличивает рекрутинг лейкоцитов и приводит к нарушению микроциркуляции. Активация и повреждение эндотелия обуславливает последующую васкулопатию и изменение реактивности сосудов.
В результате этих процессов происходит снижение фибринолитической активности эндотелия и активация коагуляционного каскада и тромбоцитов на поверхности поврежденного эндотелия, что может способствовать дальнейшему воспалению, тромбозу и вазоконстрикции.
Преимущественное поражение белого вещества теменно-затылочной области при PRES очевидно и не может быть полноценно объяснено современными теориями патогенеза. Тем не менее было выдвинуто предположение, что такое распределение обусловлено гетерогенной иннервацией симпатической нервной системой различных областей мозга.
В противоположность бассейну передней мозговой артерии, который богато иннервируется симпатической нервной системой из переднего шейного ганглия, вертебробазилярная артериальная система меньше подвержена ее влиянию. Таким образом, можно сделать вывод, что вазоконстрикция, опосредованная симпатической нервной системой, оказывает своего рода защиту от резкого повышения перфузии.
Патоморфологические изменения
Данные вскрытия пациентов, умерших от гипертензивной энцефалопатии или эклампсии, свидетельствуют о различной степени повреждения сосудов (фибриноидный некроз артериол, тромбоз артериол и капилляров) и вещества головного мозга (микроинфаркты, петехиальные кровоизлияния, отек вещества головного мозга). Классическая картина поражения состоит из колец кровоизлияний, располагающихся вокруг тромбированных сосудов. Если гипертензивная энцефалопатия развивалась у пациента с длительно текущей гипертонией, то можно обнаружить типичные проявления поражения сосудов, такие как атрофия и гиперплазия медии, гиалинизация и микроаневризмы.
Очаги поражения мозга располагаются в обоих полушариях дорсально, наиболее заметны в белом веществе и на границе с серым веществом. Они также могут находиться в базальных ганглиях, среднем мозге и коре головного мозга. Степень поражения мозга и распространенности процесса крайне вариабельна, но, как правило, она хорошо коррелирует с тяжестью неврологических проявлений и уровнем АД, особенно в терминальных стадиях.
Отек головного мозга иногда достигает того уровня, когда миндалины мозжечка пролабируют через большое затылочное отверстие. Сосудистые изменения не ограничиваются одним только мозгом, также могут вовлекаться глаза (кровоизлияния в сетчатку, отек соска зрительного нерва), почки (фибриноидное набухание артериол) и другие органы.
Однако эти данные не стоит экстраполировать на выживших пациентов, которые в своем большинстве не достигают таких экстремальных изменений. К примеру, пациенту с гипертонической энцефалопатией выполнили биопсию мозга и обнаружили отек белого вещества мозга без признаков альтерации стенок сосудов или инфарктов; характер изменений совпадал с данными МРТ, которые предполагали вазогенную природу отека. В конечном итоге пациент полностью выздоровел.
Лечение
Поздняя диагностика PRES или ее полное отсутствие могут привести к необратимому повреждению головного мозга. Терапия антиконвульсантами является стандартом лечения судорожных приступов, связанных с PRES, при этом долгосрочная терапия обычно не требуется.
Гипертензивная энцефалопатия
Гипертензивная энцефалопатия требует немедленного снижения цифр АД (необязательно до нормальных величин) с целью предотвращения повреждения органов-мишеней. Большинство экспертов рекомендуют снижать АД не более чем на 20 % от исходного уровня в течение первого часа, а целевым значением выбрать диастолическое давление 100–110 мм рт. ст.
Пациент по возможности должен быть госпитализирован в отделение интенсивной терапии, и снижение давления необходимо проводить под постоянным мониторингом АД, желательно внутривенными гипотензивными препаратами.
Стоит избегать резкого падения давления, особенно у пожилых пациентов с длительно текущей гипертонией. Несмотря на отсутствие убедительных доказательств, применение у больных гипертензивной энцефалопатией антиконвульсантов может быть оправдано.
Препараты для лечения гипертензивной энцефалопатии должны сответствовать ряду критериев: быть пригодными для внутривенного введения, иметь быстрое начало действия и короткий период полувыведения, легко титроваться, — все это обеспечивает гибкость их применения. Пока поведено недостаточно качественных исследований для определения препарата, наиболее эффективно улучшающего клинические исходы.
Стоит помнить, что пероральная терапия должна быть начата до прекращения действия энтеральной, а также должна быть произведена немедленная отмена препаратов, которые могли вызвать данное состояние.
Преэклампсия/эклампсия
Не существует определенных превентивных тактик ведения беременных. В настоящее время известно, что сульфат магния предотвращает развитие дальнейших судорог у женщин с эклампсией. Магнезия оказывает вазодилатирующее действие на сосуды головного мозга, нарушает экспрессию рецепторов к эндотелину-1 и снижает проницаемость гематоэнцефалического барьера — все это служит ключевыми звеньями в патогенезе развития PRES. Остается неясной роль сульфата магния в профилактике этих состояний, в то же время существует многолетний опыт использования в этих целях антигипертензивных препаратов (кроме, конечно, иАПФ и сартанов).
Заключение
PRES не является самостоятельной нозологической единицей, но в то же время служит полноправным клинико-радиологическим синдромом, связанным со множеством заболеваний, включая гипертензивную энцефалопатию, и приемом иммунодепрессантов. Нейровизуализационные изменения при этой патологии имеют характерный паттерн и потому могут стать ключом к постановке диагноза.
Использование МРТ, особенно методом диффузионно-взвешенных изображений (ДВИ), не только помогает установить диагноз PRES, но и имеет прогностическую ценность, что позволяет определить дальнейшую тактику лечения. Патогенез синдрома не достаточно ясен, хотя, по-видимому, его развитие связано со срывом ауторегуляции мозгового кровотока и эндотелиальной дисфункции. Ранняя постановка диагноза имеет решающее значение, поскольку быстрое и надлежащее лечение значительно улучшает клинические исходы.
Источник:
Lamy C., Oppenheim C., Mas J. L. Posterior reversible encephalopathy syndrome //Handbook of clinical neurology. – Elsevier, 2014.
