Подострый склерозирующий панэнцефалит
 Подострый склерозирующий панэнцефалит (ПСПЭ) — прогрессирующее нейродегенеративное, обычно смертельное заболевание ЦНС. Оно вызывается вирусом кори и относится к медленным вирусным инфекциям. Заболевание начинается спустя годы (обычно до 8 лет) после перенесенной кори.
Подострый склерозирующий панэнцефалит (ПСПЭ) — прогрессирующее нейродегенеративное, обычно смертельное заболевание ЦНС. Оно вызывается вирусом кори и относится к медленным вирусным инфекциям. Заболевание начинается спустя годы (обычно до 8 лет) после перенесенной кори.
Заболеваемость в развитых странах составляет 1 случай на 1 млн населения, в Индии — до 21 на 1 млн, что связано с уровнем доступности медицинской помощи. Имеющиеся эпидемиологические данные говорят о том, что вакцинация против кори обладает прямым защитным эффектом против ПСПЭ. Чаще поражаются мальчики и мужчины, обычно в возрасте до 20 лет.
Патогенез
В данный момент существует две теории относительно этиологического агента ПСПЭ: согласно одной, заболевание вызывает мутантный вирус кори, также названный вирусом подострого склерозирующего панэнцефалита; возможно, однако, что все патогенные вирусы кори способны инфицировать ЦНС, а развитие ПСПЭ в дальнейшем зависит от иммунного ответа хозяина.
Скорее всего, вирус кори попадает в структуры ЦНС во время первого инфицирования корью и персистирует до развития панэнцефалита. В большей мере поражаются нейроны и олигодендроциты, однако как именно вирус проникает в них — не вполне понятно, ведь эти клетки не экспрессируют известных клеточных рецепторов к вирусу кори. Как показали экспериментальные модели, после проникновения в нейроны вирус может распространяться на соседние структуры транснейронально.
На ранних стадиях в процесс вовлекаются затылочные области, в дальнейшем изменения распространяются на передние отделы коры, и, в последнюю очередь, на подкорковые, стволовые структуры и спинной мозг. На поздних стадиях можно наблюдать картину распространенной деструкции как белого, так и серого вещества головного мозга и признаки атрофии коры.
Гистологически наблюдаются воспалительные изменения в паренхиме и оболочках мозга, демиелинизация, множественные вирусные включения в нейронах, олигодендроцитах и астроцитах, потеря нейронов и астроглиоз.
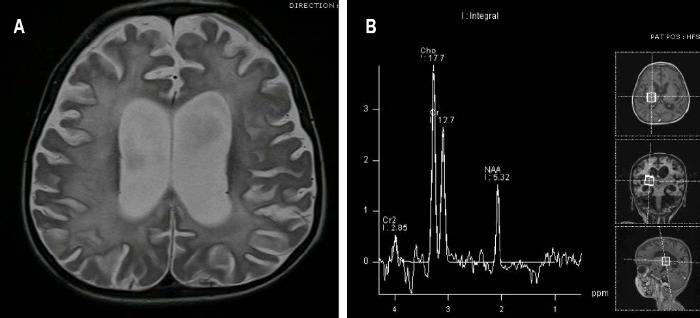
(A) T2-взвешенная аксиальная томограмма: симметричные области гиперинтенсивнности в белом веществе, которые распространяются на подкорковую область. Явления атрофии с выраженными бороздами и расширением желудочков.
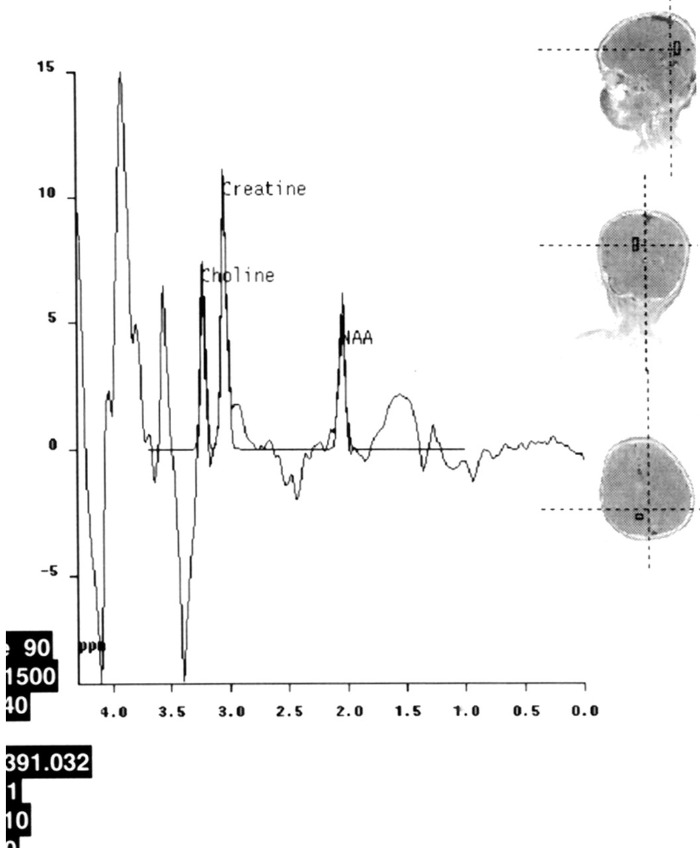
(B) МР-спектроскопия: Снижение пика N-ацетиласпартата (NAA), несколько повышен пик холина (Cho).
Клиника
В клиническом течении болезни выделяют 4 стадии:
I стадия характеризуется нарушениями поведения в виде повышенной раздражительности, тревожности, психопатоподобных реакций, падением успеваемости, утомляемостью, расстройствами речи и нарушениями сна. Часто ошибочно диагностируется как психиатрическая патология. Продолжается 2–12 месяцев.
II стадия начинается с появления двигательных расстройств (гиперкинезов), пароксизмальных эпизодов (миоклонических приступов, обычно генерализованных, абсансов, атонических падений). Стадия продолжается 6–12 месяцев.
III стадия протекает с исчезновением миоклонуса, пирамидными и экстрапирамидными расстройствами, прогрессированием деменции, постепенным ослаблением судорожного синдрома. Длится несколько месяцев.
IV стадия (терминальная) — децеребрационная ригидность, декортикация, вегетативное состояние.
В половине случаев возникают офтальмологические изменения в виде некротизирующего ретинита. Также нередки нарушения зрения в виде корковой слепоты.
Диагностические критерии Dyken для диагностики подострого склерозирующего панэнцефалита
- Типичное клиническое течение с прогрессирующими изменениями психического статуса и стереотипными генерализованными миоклоническими приступами
- Характерные изменения ЭЭГ (в виде стереотипных периодических высокоамплитудных дизритмических комплексов, которые связаны с миоклоническими судорогами.
- Повышение отношения содержания глобулинов к уровню альбумина более 20 % в ЦСЖ.
- Возрастание титров антител к вирусу кори в ЦСЖ.
- Типичные гистопатологические находки (а также результаты ПЦР) при исследовании биоптата/аутопсии.
Лучевые признаки
На ранних стадиях процесса может не выявляться никаких изменений. МРТ является методом выбора.
Сигнальные характеристики
- пораженные области демонстрируют повышение МР сигнала на T2ВИ/FLAIR изображениях;
- нередко наблюдается также их контрастное усиление в T1ВИ после внутривенного контрастирования;
- атрофия головного мозга проявляет себя выраженностью борозд, истончением извилин и равномерным компенсаторным расширением желудочков;
- при проведении МР-спектроскопии может обнаруживаться:
— отсутствие или снижение пика N-ацетиласпартата;
— повышение пика холина и мио-инозитола;
— повышение пика лактата;
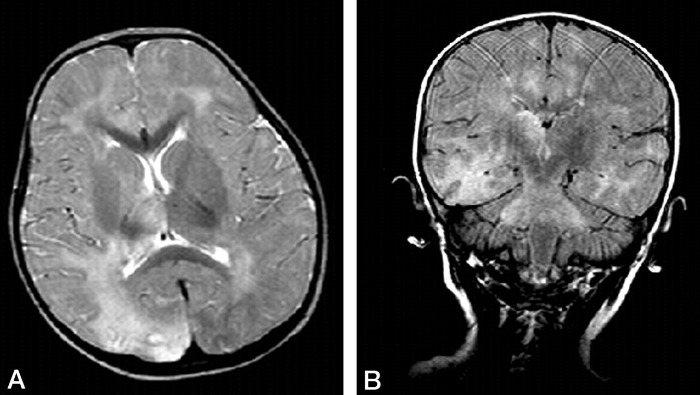
(B) Корональное FLAIR изображение демонстрирует вовлечение в процесс моста с распространением на средние ножки мозжечка.
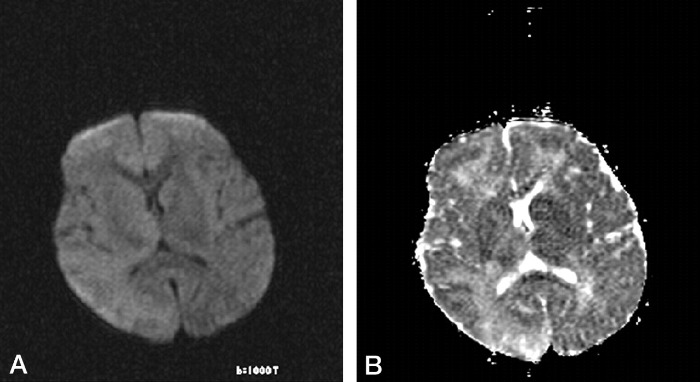
(B) ADC карта: повышение интенсивности и повышение значений ADC от пораженных областей (при измерении: 1,17, 1,18, 1,24, 1,49, 1,27, и 1,21 × 10−3 мм²/с).
Излюбленная локализация изменений: перивентрикулярное и субкортикальное белое вещество; базальные ядра, мозолистое тело, таламусы и спинной мозг поражаются реже. С прогрессированием процесса появляются признаки атрофии полушарий, мозжечка и продолговатого мозга, вплоть до тотальной потери белого вещества на терминальной стадии. Серое вещество вовлекается в сравнительно меньшей мере.
Помните, что выраженность лучевых проявлений может не коррелировать с клинической картиной.
Дифференциальная диагностика
Диагностика этой крайне редкой патологии в начальной стадии представляет большие трудности. В ретроспективном исследовании, включавшем данные о 307 пациентах, отмечено, что в 78,8 % случаев при первичном обращении выставлялся другой диагноз: эпилепсия, абсансная эпилепсия, синдром Леннокса-Гасто, метахроматозная лейкодистрофия, болезнь Вильсона-Коновалова, васкулит, спиноцеребеллярная атаксия, кататоническая шизофрения, гемипаркинсонизм, болезнь Шильдера и даже симуляция. Лист дифференциальных диагнозов с разными проявлениями ПСПЭ можно увидеть в таблице 1.
Таблица 1 | Лист дифференциальных диагнозов при диагностике ПСПЭ.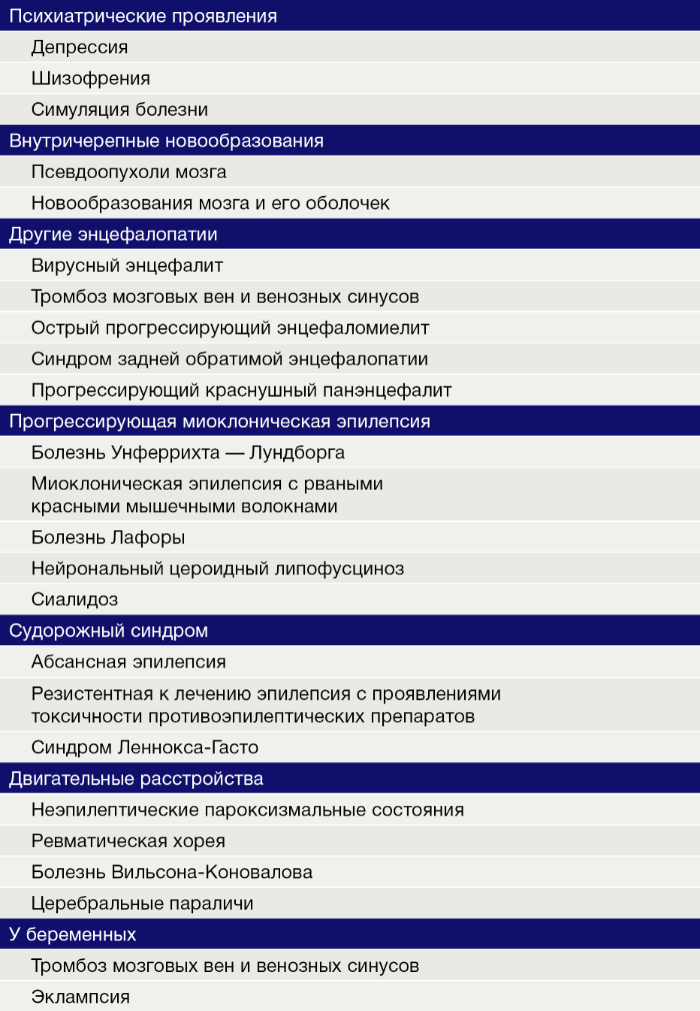
Лечение
Специфическое лечение на данный момент не разработано.
Изопринозин был одним из первых препаратов, показавших эффективность в стабилизации болезни. Однако во многих других исследованиях положительное действие препарата оказалось не доказанным. Разные исследователи применяли также интравентрикулярное введение альфа-интерферона, бета-интерферона и рибавирина, а также комбинации двух и трех препаратов. Пока, однако, не накоплено достаточно данных об их эффективности.
В качестве симптоматической терапии назначают антиконвульсанты, эффективные в отношении миоклоний (диазепам, производные вальпроевой кислоты). Для снятия спастического гипертонуса применяют миорелаксанты (толперизон, баклофен). Нарушения дыхания на заключительных стадиях заболевания являются показанием к переводу пациентов на ИВЛ.
Источники
- Garg R. K. Subacute sclerosing panencephalitis //Journal of neurology. — 2008. — Т. 255. — №. 12. — С. 1861-1871.
- Sener R. N. Subacute sclerosing panencephalitis findings at MR imaging, diffusion MR imaging, and proton MR spectroscopy //American Journal of Neuroradiology. — 2004. — Т. 25. — №. 5. — С. 892-894.
- Alkan A. et al. Early-and late-state subacute sclerosing panencephalitis: chemical shift imaging and single-voxel MR spectroscopy //American journal of neuroradiology. — 2003. — Т. 24. — №. 3. — С. 501-506.
- Jafri S. K. et al. Spectrum of MRI brain findings in subacute sclerosing panencephalitis //Asia Pacific Journal of Clinical Trials: Nervous System Diseases. — 2017. — Т. 2. — №. 4. — С. 124.
- Корниенко, В. Н.; Пронин, И. Н. Диагностическая нейрорадиология: 2 изд. в 3-х т. М.: ИП Андреева, 2008, 1: 445.
