Новые рычаги опухолевого сопротивления: Lag-3, Tim-3, TIGIT
Ингибиторы контрольных точек иммунного ответа начали применяться в клинической практике совсем недавно и произвели настоящий прорыв в онкоиммунологии, увеличивая шансы на успешное излечение или контроль опухолевых заболеваний. Тем не менее не каждое злокачественное новообразование оказывается чувствительным к уже известным ингибиторам CTLA-4 и PD-1, вынуждая искать новые пути противодействия опухолевой экспансии. В дополнение к уже известным ингибиторам иммунных чекпоинтов (контрольных точек иммунного ответа) обнаруживаются новые перспективные цели воздействия в онкоиммунологии. О некоторых новых иммунных чекпоинтах мы и поговорим.
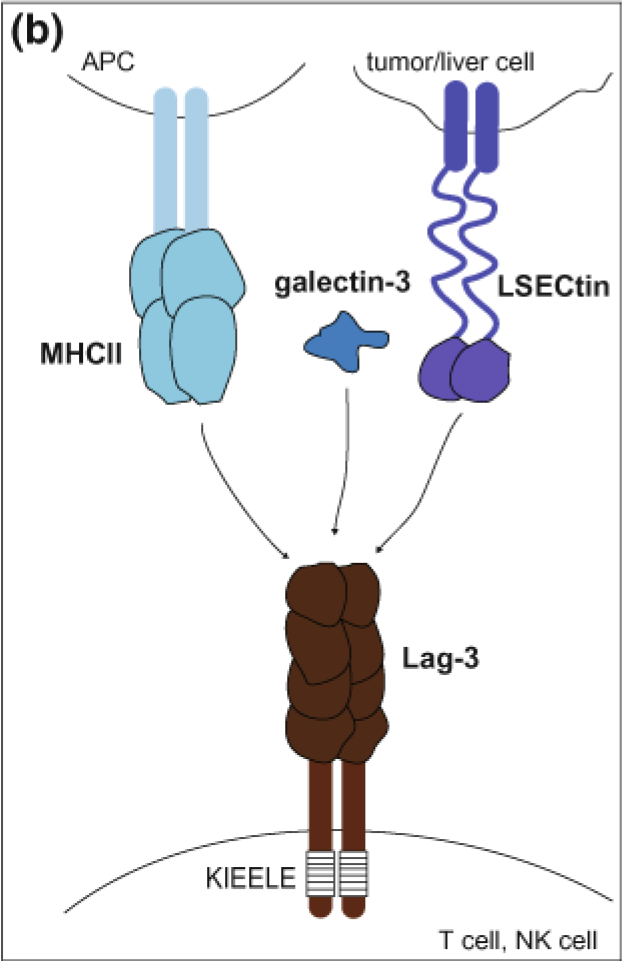
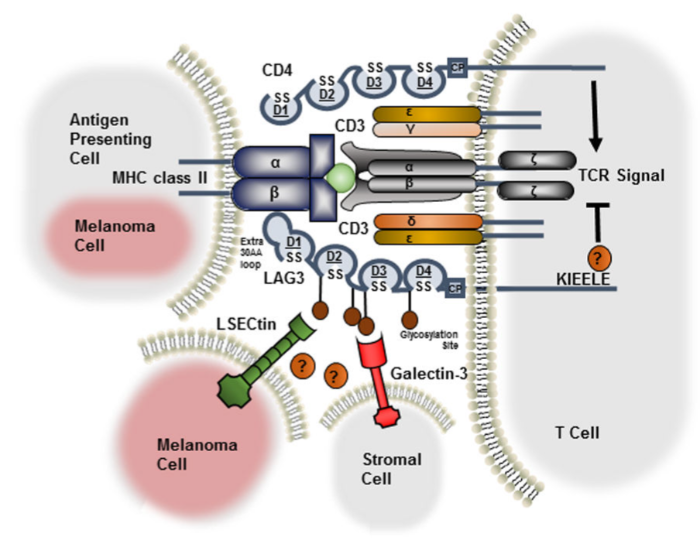
LAG-3 (lymphocyte activation gene-3), открыт более четверти века назад как молекула, гиперэкспрессированная на активированных CD4+, CD8+ эффекторных Т-клетках, CD4+Foxp3+Treg-, Tr1-, B-клетках, плазмоцитоидных дендритных клетках (pDCs) и натуральных киллерах (NK). Состоит из 4-х Ig-подобных внеклеточных доменов, межмембранного домена и цитоплазматического «хвоста», содержащего уникальный KIEELE мотив. LAG-3 структурно напоминает CD4 ко-рецептор и связывается с MHC II с большей аффинностью. Но CD8+ Т-клетки либо NK клетки не взаимодействуют с MHC II, тогда каким образом осуществляется функция LAG-3 на этих клетках?
В данном случае, лигандами для связывания являются LSECtin, входящий в число DC-SIGN (dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin) молекул, и galectin-3 — растворимый лектин, экспрессирующийся на многих клетках, в том числе и опухолевых. LSECtin экспрессируется на многих опухолях и гепатоцитах, предполагая наличие в этих тканях механизма регуляции над CD8+ и NK, экспрессирующих LAG-3.
Роль LAG-3 в клетках
В эффекторных клетках Lag-3 играет роль иммуносупрессора, его блокада или дефицит приводит к увеличению T-клеточной пролиферации и секреции цитокинов. Lag-3 дефицитные OVA (овальбумин)-специфичные CD4+ T-клетки продемонстрировали неконтролируемую экспансию при иммунизации их родственным антигеном. Схожим образом повышенная пролиферация Т-клеток у Lag-3 дефицитных доноров приводила к увеличению степени тяжести острой реакции «трансплантат против хозяина».
У CD8+ T-клеток повышается цитотоксичность и продукция цитокинов. Примечательно, что Lag-3 гиперэкспрессирован на истощенных CD8+ T-клетках как при хронических вирусных инфекциях, так и при онкологии. Lag-3 часто совместно экспрессируется с PD-1 на опухоль-инфильтрирующих лимфоцитах. Непосредственно селективная блокада Lag-3 не оказывает должного воздействия на опухоль, но, учитывая синергизм с PD-1, их совместная блокада значительно усиливает контроль над онкологическими заболеваниями, относительно терапии только блокаторами PD-1.
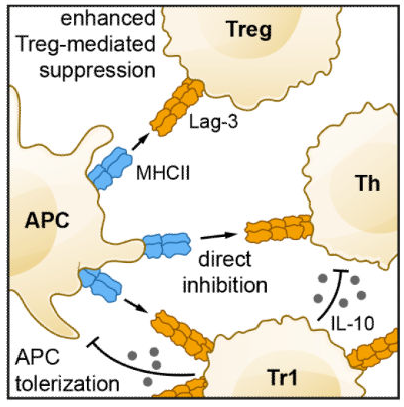
В регуляторных клетках Lag-3 сверхэкспрессируется на Tr1 клетках и Foxp3+ Tregs клетках, продуцирующих IL-10. В то время как экспрессия Lag-3 коррелирует с экспрессией IL-10, до конца не понятно, каким именно способом Lag-3 приводит к усилению супрессивной функции Tr1 клеток. В отсутствие Lag-3, Tregs демонстрируют сниженную супрессивную функцию, в отличие от инфильтрирующих опухоль Lag-3+ Treg, продуцирующих IL-10 и TGF-b1 в больших количествах. Более того, Lag-3 взаимодействие с MHC II на DCs приводит к формированию толерантного DCs фенотипа, что подавляет первичный ответ эффекторных T-клеток.
Ингибиторы Lag-3 пока что проходят клинические испытания. С результатами испытаний вы можете ознакомиться на сайте: https://clinicaltrials.gov/.
Немного о свойствах Lag-3 говорит то, что структурно KIEELE-мотив схож с мотивами так называемых сигнальных молекул, таких как PDLD (тромбоцитарный фактор роста), LckBP1 и SPY75. Данные свойства могут навести на мысль, что цитоплазматический хвост Lag-3 опосредует трансдукцию внутриклеточных сигналов и/или агрегацию молекул. [4]
Вдобавок, Lag-3 облегчает межклеточное распространение синуклеина. [5] Lag-3 рассматривается как рецептор, который плотно связывается с предварительно сформированными фибриллами a-синуклеина, но не с его мономерами. В культуре нейронов дезактивация (удаление или нокаут) Lag-3 блокирует эндоцитоз a-синуклеиновых фибрилл. Более того, одновременно и in vitro, и in vivo, отсутствие Lag-3 снижало индукцию и распространение фибрилл. У мышей, инъекция a-синуклеиновых фибрилл в дорсальный стриатум приводила к дофаминергической дегенерации и паркинсоноподобному неврологическому дефициту. Напротив, Lag-3-дефицитные мыши, которым провели инъекцию в дорсальный стриатум, продемонстрировали общую сохранность дофаминергических нейронов без видимых моторных нарушений.
Tim-3 (T-клеточный иммуноглобулин-3) —— трансмембранный протеин 1-го типа, впервые идентифицированный как специфический маркёр для Th1 и Tc1 клеток. Экспрессия контролируется Th1-транскрипционным фактором T-bet совместно с другим транскрипционным фактором NFIL3. Tim-3 в основном экспрессируется на Tregs, NK клетках, моноцитах, макрофагах и DCs. Tim представляет собой семейство генов, из которых 3 (Tim-1, Tim-3, Tim-4) определены у человека и мыши соответственно.
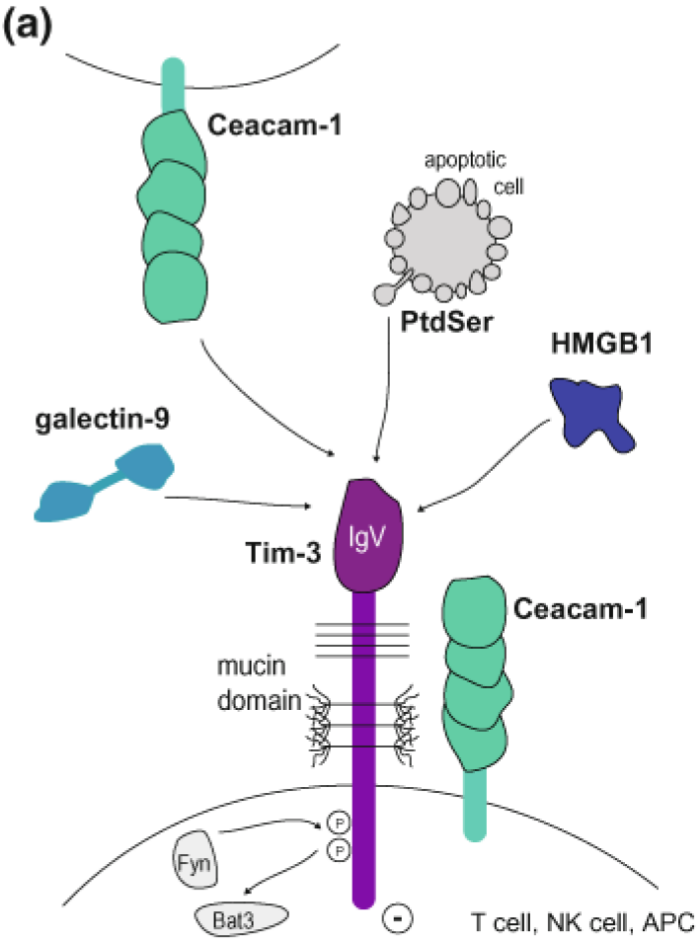
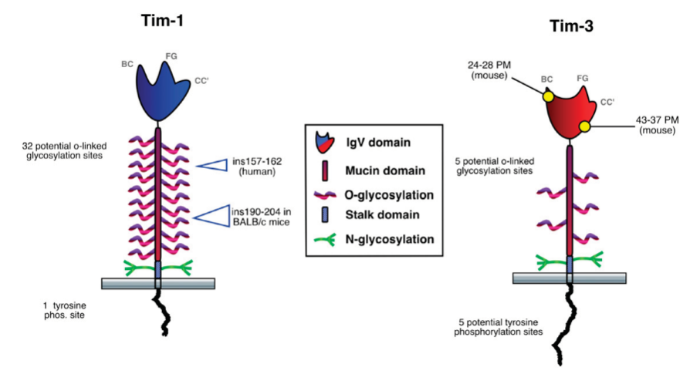
Сравнение структуры рецептора Tim-1 и Tim-3. Обратите внимание на формирующийся FG-CC’ карман, образованный вследствие меньшего расстояния между петлями FG и CC’ IgV домена именно у Tim-3. Такое свойство позволяет присоединять свойственные именно этому рецептору лиганды: galectin-9 (Gal-9), high mobility group protein B1 (HMGB1 или амфотерин), carcinoembryonic antigen cell adhesion molecule 1 (Ceacam-1)- раково-эмбриональный антиген, вовлеченный в клеточную адгезию-1 и фосфатидилсерин (PtdSer) [7].
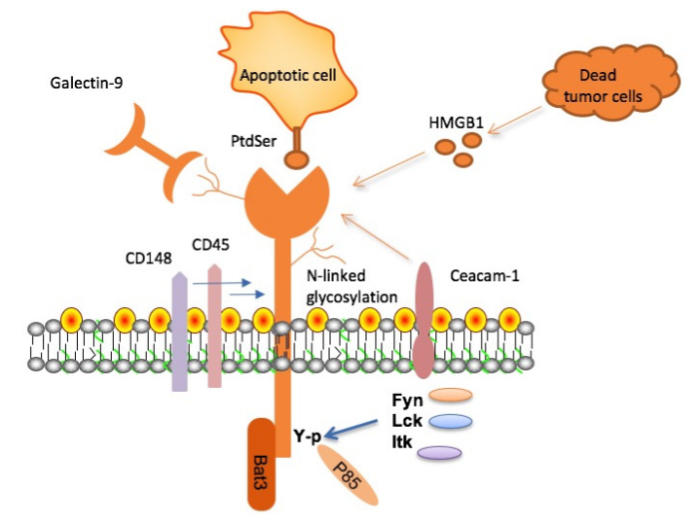
PtdSer- молекула, экспрессируемая на поверхности апоптотических телец, известна тем, что связывается с карманом в IgV домене Tim-1, Tim-3 и Tim-4. Это взаимодействие обеспечивает избавление от апоптотических телец, а также способствует презентации антигенов дендритными клетками (DCs).
Следующий лиганд — HMGB1. Tim-3 гиперэкспрессируется на опухоль-инфильтрированных DCs и активно конкурирует с нуклеиновыми кислотами, выпускаемыми умирающими опухолевыми клетками, за связывание с HMGB1. Эффективно предотвращает стимуляцию нуклеиновыми кислотами врожденной иммунной системы, снижая образование провоспалительных цитокинов.
Caecam-1 — недавно обнаруженный лиганд Tim-3, экспрессирующийся на внешней мембране эпителиальных, эндотелиальных, опухолевых клетках и лейкоцитах. Caecam-1 и Tim-3 экспрессируются вместе, формируя транс-специфический гетеродимер, который функционирует как негативный регулятор T-клеточного ответа. Взаимодействия могут быть как цис-, так и транс-; оба варианта влияют на Т-клеточную иммунную толерантность.
Tim-3 действует как негативный регулятор Th1 и CTL (цитотоксических T-клеток) ответов. Однако, цитоплазматический хвост Tim-3 не содержит классических ингибиторных сигнальных мотивов. Взамен он содержит пять консервативных тирозиновых остатков, два из которых фосфорилированы, что очень важно для связывания внутриклеточного адаптерного белка Bat3 (HLA-b связанный транскрипт 3). Фосфорилирование этих двух тирозиновых остатков приводит к активации ингибиторных сигналов. В отсутствие связывающихся с Tim-3 лигандов, Bat3 связывается с нефосфорилированными регионами цитоплазматического хвоста Tim-3, активирует Lck и сохраняет либо усиливает T-клеточный сигналлинг.
Взаимодействие с Tim-3 его лигандов (galectin-9 или Ceacam1) приводит к увеличению концентрации внутриклеточного кальция и фосфорилирования двух тирозиновых остатков (Y256 и Y263), что приводит к отрыву Bat3 с цитоплазматического хвоста Tim-3. Такое взаимодействие ведет к связыванию с SH2 доменом, содержащим Src киназы (Fyn, Lck, Itk) и способствующим негативной регуляции TCR сигналлинга через активацию сигнальных белков, таких как p85. Поскольку Fyn и Bart связываются с теми же доменами Tim-3 цитоплазматического хвоста, возможно, что переход между Tim-3/Bat3 и Tim3/Fyn запускает переход от благоприятного для TCR сигналлинга к Tim-3 ингибирующему влиянию на TCR сигналлинг.
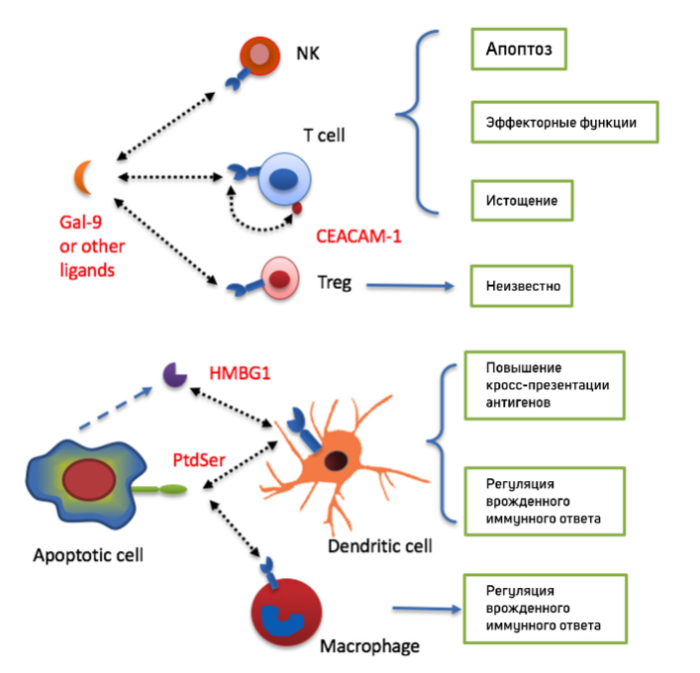
Tim-3 на клетках врожденного иммунитета
Tim-3 на NK клетках повышает их функцию, стимулирует выработку цитокинов. Гиперэкспрессия Tim-3 на NK демонстрировала повышенную цитотоксичность и выработку IFNy. Однако гиперэкспрессия Tim-3 у NK в контексте онкологического заболевания коррелирует с худшим прогнозом, снижением секреции IFNy и цитотоксической функции.
Tim-3 в DCs и макрофагах демонстрирует роль негативного регулятора иммунного ответа. В частности, в DCs связывание Tim-3 с HMGB1 ингибирует активацию дендритной клетки. В макрофагах Tim-3 снижает TLR-4 стимуляцию и смягчает иммунный ответ при сепсисе. Tim-3 способствует генерации супрессорных клеток миелоидного происхождения (MDSC) при активации пути Tim-3/galectin-9. MDSC играет роль в смягчении аутоиммунных заболеваний и выживаемости онкологических клеток, их роста.
Однако, Tim/galectin9 проявляет иммуностимулирующую функцию против внутриклеточных патогенов при заболевании легочным туберкулезом. Tim/galectin9 активирует инфицированные M. tuberculosis макрофаги, приводя к секреции IL-1b и элиминации патогена.
Tim-3 и эффекторные T-клетки
Tim-3 в Th1 и Tc1 клетках играет роль негативного регулятора. Блокада Tim-3 продемонстрирована в отягощении экспериментального аутоиммунного энцефалита (мышиная модель рассеянного склероза), а также индукции Th-1 обусловленного диабета у мышей без ожирения. Активация же Tim-3 через его лиганд galectin-9 подавляла иммунную агрессию через активацию сценария апоптоза у Th1 клеток.
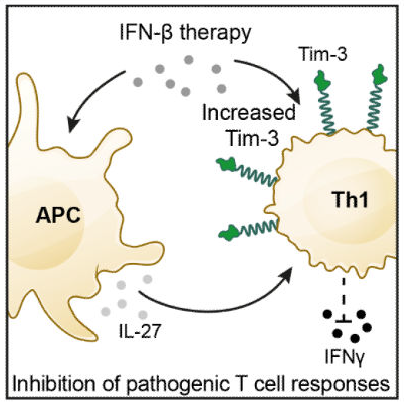
Механизм действия IFNb в терапии рассеянного склероза может быть также обусловлен повышением экспрессии Tim-3 на Th1 и секрецией IL-27, что приводит к уменьшению образования IFNy.
Tim-3 участвует в формировании иммунной толерантности, нарушение функции которого отмечается в отягощении синдрома трансплантата-против-хозяина и повышении риска выкидыша вследствие негативного воздействия на иммунную толерантность между матерью и плодом.
Экспрессия Tim-3 также коррелирует с тяжестью и распространенностью онкологических и хронических вирусных заболеваний. Гиперэкспрессия на истощенных T-клетках наблюдается у ВИЧ-инфицированных пациентов, выраженность которой на CD4+ T-клетках коррелирует с прогрессией заболевания.
Схожим образом экспрессия Tim-3 и коэкспрессия PD-1 на истощенных CD8+ клетках при инфицировании вирусом лимфоцитарного хориоменингита подавляет иммунный ответ куда сильнее, чем экспрессия PD-1 отдельно от Tim-3.
Tim-3 и регуляторные T-клетки
Tim-3 широко распространён на Foxp3+ Tregs. Tim-3 повышает функциональную способность Tregs к иммуносупрессии, относительно Tregs без экспрессии Tim-3. К тому же, Tim-3 потенцирует экспрессию других иммуносупрессивных рецепторов, таких как CTLA-4, PD-1, LAG-3, а также приводит к секреции большего числа противовоспалительных цитокинов, таких как IL-10 и TGF-b. Тем не менее популяции Tregs с экспрессией Tim-3 живут меньше и раньше подвергаются апоптозу, относительно Tregs с отсутствием Tim-3.
TIGIT (T cell immunoglobulin and ITIM domain — Т-клеточный иммуноглобулин и ITIM (тирозинсодержащий ингибиторный мотив иммунорецепторов), также называемый VSig9, Vstm3, или WUCAM). Экспрессируется на NK, Т-клетках (в основном, памяти), на фолликулярных Т-хелперах. TIGIT состоит из одного внеклеточного IgV домена, трансмембранной области первого типа и цитоплазматического хвоста, содержащего ITAM и immunoglobulin tail tyrosine (ITT)-подобный мотив.
TIGIT является частью взаимодействий сети рецепторов и лигандов, в котором он связывается с большей аффинностью к CD155 (PVR) и слабее к CD112 (PVRL2, nectin-2). Оба эти лиганда экспрессируются на АПК и разнообразных клетках негемопоэтического происхождения, включая опухолевые клетки, совместно с CD226 (DNAM-1), стимулирующим ко-рецептором этой сети, обладающий аффинностью к CD155 и CD112 в 10 раз меньшей, чем TIGIT; тогда как TIGIT в состоянии ингибировать ко-стимулирующее действие CD226 в дозозависимой манере. В дополнение, TIGIT может присоединиться к CD226 в цис- и нарушить его гомодимеризацию, повысив его ко-стимулирующую функцию.
Сеть наделена ещё и CD96 (Tactile) — коингибиторный рецептор, связывающийся с CD155 и CD112R (также является коингибиторным рецептором), который взаимодействует с CD112.
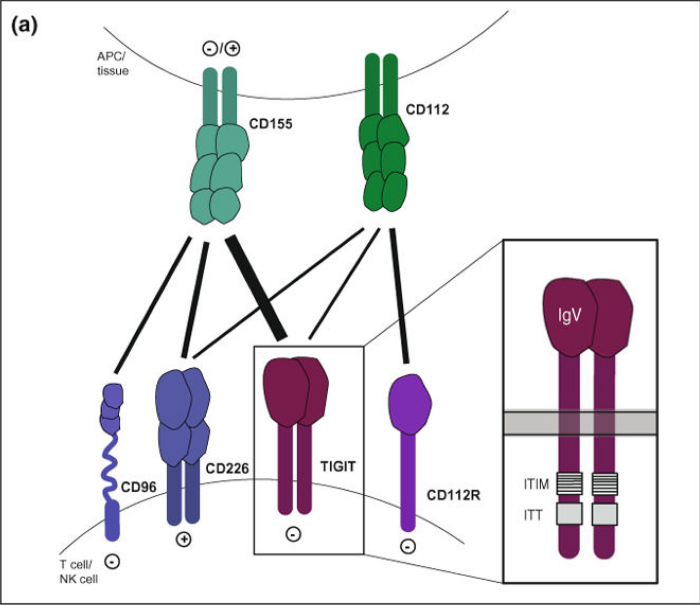
CD226, CD96 и CD112R экспрессируются на T и NK клетках. Их лиганды — CD155 и CD112 экспрессируются на АПК и в тканях. (с картинкой всё станет яснее)
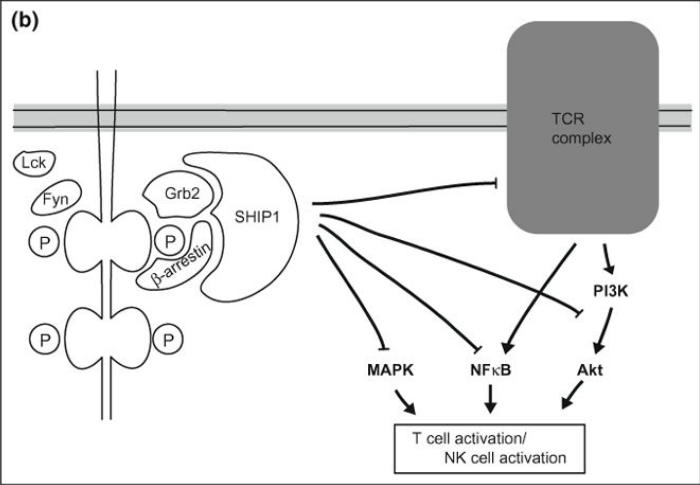
Активация TIGIT на NK индуцирует фосфорилирование тирозиновых остатков на ITIM и ITT-подобном мотиве семейством Src киназ — Fyn и Lck. Данное взаимодействие позволяет присоединить адаптерные белки Grb2 (рецептор-связанный белок фактора роста 2) и b-аррестин 2, которые в свою очередь привлекают SHIP1 (SH2 домен-содержащий инозитол-5-фосфатазу 1) к цитоплазматическому хвосту TIGIT. Активация SHIP 1 преждевременно прекращает деятельность PI3K (фосфоинозитид 3-киназа), MAPK (митоген-активированная протеинкиназа) и NF-kB (ядерный фактор-каппа B), что приводит к снижению цитотоксичности NK клетки и снижению секреции цитокинов. TIGIT- опосредованное ингибирование превалирует над ко-активатором CD226, обуславливая снижение цитотоксичности, дегрануляции и продукции цитокинов.
В эффекторных Т-клетках TIGIT приобретает двойственную роль: одновременно ингибируя продукцию цитокинов, таких как IFNy и IL-17, подавляя пролиферацию Т-клеток, TIGIT- активация приводит к повышению выживаемости T-клеток через индукцию антиапоптоптических молекул (в т.ч. Bcl-xL) и рецепторов цитокинов, обуславливающих выживание, таких как IL-2, IL-7, IL-15.
В Tregs TIGIT повышает иммуносупрессивные возможности, повышая секрецию IL-10 и Fgl2 (фибриноген-подобный белок 2), что приводит к подавлению провоспалительного Th1 и Th17 ответов, но не Th2 иммунного ответа. В целом, TIGIT+ Tregs также экспрессируют повышенные уровни определенных маркёров, таких как Foxp3, CD25 и CTLA-4. Само собой, экспрессия CD226 на Tregs приводит к дестабилизации и снижении иммуносупрессивной
способности.
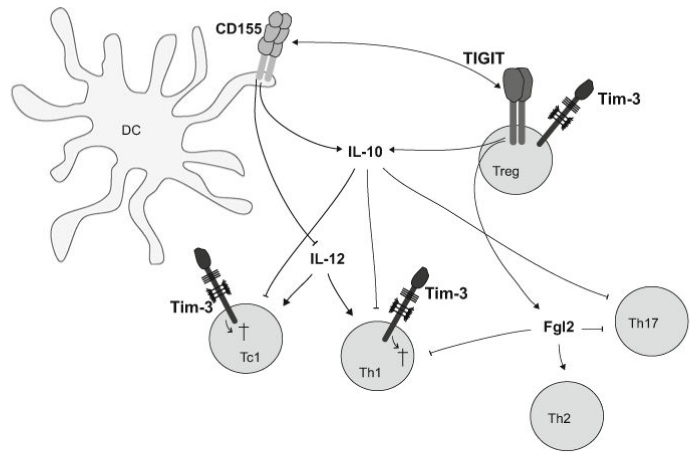
В дендритных клетках происходит следующее: TIGIT присоединяется к CD155 как гомодимер, где каждая молекула TIGIT присоединяется к одной CD155 молекуле, в результате формируя гетеротетрамер с гомодимером TIGIT в ядре. Активация TIGIT приводит к фосфорилированию ITIM мотива на цитоплазматическом хвосте CD155, привлекая тем самым SHP-2, фосфорилирующий Erk. Всё это действие приводит к снижению в IL-12p40, одновременно с повышением образования IL-10 в DCs. TIGIT тем самым подавляет T-клеточный ответ через формирование толерогенных DCs.
LAG-3, TIM-3 и TIGIT совместно с PD-1, CTLA-4 и некоторыми другими коингибиторными рецепторами иммунных клеток составляют основу истощенных Т-клеток. Гиперэкспрессия этих маркеров часто идет совместно, формируя синергию; они принимают участие в поддержании хронической инфекции, роста и выживаемости опухоли. Совместная деятельность вносит огромный вклад в поддержание пула истощенных эффекторных клеток иммунной системы.
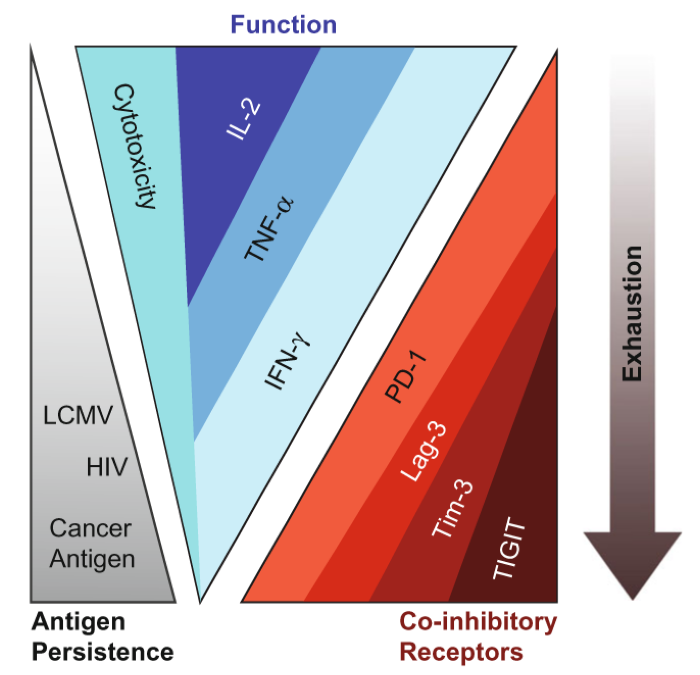
Персистирование антигенов приводит T-клетки в истощенное состояние, выраженное как в снижении продукции цитокинов, так и в подавлении цитотоксичности. Как только T-клетки становятся истощенными T-клетками, возрастает экспрессия PD-1 и апрегуляция Lag-3, Tim-3 и TIGIT.
Уже сейчас в онкологии проводится терапия с использованием таргетных ингибиторов иммунных чекпоинтов (ингибиторы CTLA-4 и PD-1), которые, тем не менее, не всегда являются эффективными. Учитывая синергию вышеописанных коингибиторных рецепторов, комбинированная терапия может повысить шансы на успешное лечение опухолевых заболеваний.
Непосредственное выключение генов Lag-3, Tim-3 и TIGIT не вызывало аутоиммунных заболеваний, если не было предрасполагающих факторов (как например, диабет 1-го типа при дефиците Lag-3 и отягощение симптоматики индуцированного аутоиммунного энцефалита у мышей с заранее запрограммированной патологией). Эти данные отличаются от аутоиммунных расстройств, наблюдаемых при терапии ингибиторами PD-1 и CTLA-4, предполагая, что комбинированная терапия позволит использовать дозировки необходимые для лечения, но не приводящие к тяжелым последствиям в виде аутоиммунных колита, пневмонита, кожных заболеваний и гепатита [1, 2].
Литература:
- Nicole Joller and Vijay K. Kuchroo «Tim-3, Lag-3, and TIGIT». Curr Top Microbiol Immunol. 2017; 410: 127–156.
- Ana C. Anderson, Nicole Joller and Vijay K. Kuchroo1 «Lag-3, Tim-3, and TIGIT co-inhibitory receptors with specialized functions in immune regulation». Immunity. 2016 May 17; 44(5): 989–1004.
- Ye, Bo MD; Li, Xuefen MD; et al «Increasing LAG-3 expression suppresses T-cell function in chronic hepatitis B: A balance between immunity strength and liver injury extent». Medicine: January 2017 - Volume 96 - Issue 1 - p e5275.
- Creg J. Workman, Kari J. Dugger and Dario A. A. Vignali «Cutting edge: molecular analysis of the negative regulatory function of lymphocyte activation gene-3». J Immunol. 2002 Nov 15;169(10):5392-5.
- Mao, X. et al «Pathological α-synuclein transmission initiated by binding lymphocyte-activation gene 3». Science 2016 Sep 30;353(6307).
- Wenwen Du, Min Yang, et al «TIM-3 as a Target for Cancer Immunotherapy and Mechanisms of Action». Int J Mol Sci. 2017 Mar; 18(3): 645.
- Kane LP «T cell Ig and mucin domain proteins and immunity». J Immunol. 2010 Mar 15;184(6):2743-9.
