Клеточная система таргетной доставки анти-PD-1 антител
На сегодняшний день иммунотерапия рака является, пожалуй, наиболее популярным и активно развивающимся разделом противоопухолевой терапии. Одна из ведущих позиций в этой области принадлежит ингибиторам иммунных чекпоинтов — регуляторным молекулам, способным стимулировать или, напротив, подавлять активность иммунной системы. Использование таких препаратов — например, ингибиторов PD-1/PD-1L, — в ряде случаев позволяет добиться весьма впечатляющих результатов. В то же время, их системное введение может осложняться «неадекватной» генерализованной реакцией иммунной системы и приводить к нежелательным побочным эффектам, например, системному выбросу провоспалительных цитокинов — «цитокиновому шторму». Возможный путь решения данной проблемы был недавно предложен коллективом ученых из США и Китая, разработавшим клеточную систему, обеспечивающую целенаправленную и локальную доставку анти-PD-1 антител в костный мозг для терапии лейкозов.
Добиться такого результата ученые смогли, объединив два типа клеток: тромбоциты и гемопоэтические стволовые клетки (hematopoietic stem cells — HSC) (Рис. 1). В ходе исследования тромбоциты, выделенные из цельной крови мышей, ковалентно связывали с моноклональными анти-PD-1 антителами (aPD-1), а затем, после предварительной химической модификации, конъюгировали с HSC. Созданный клеточный конъюгат получил название S-P-aPD-1 (HSC-platelet-aPD-1). В основе таргетного действия разработанной системы доставки лежит способность HSC к хоумингу — целенаправленному движению в определенный сегмент организма, в данном случае в костный мозг. Тромбоциты в свою очередь служат переносчиками действующего вещества, при попадании в место назначения активируются in situ под влиянием локальных сигналов и высвобождают анти-PD-1 антитела. Стоит отметить, что по словам авторов исследования, полученная система потенциально способна транспортировать и другие молекулы, в связи с чем может найти применение при лечении заболеваний, требующих таргетной доставки препарата.
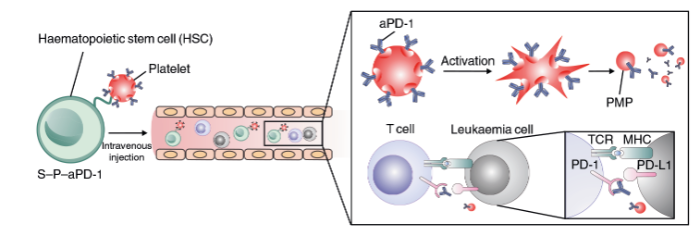
PMP - platelet-derived microparticles.
Противоопухолевую активность S-P-aPD-1 исследователи изучили на мышах, которым предварительно вводили лейкемические клетки (клеточная линия острого миелоидного лейкоза C1498), а затем оценивали прогрессию лейкемии методом биолюминесценции клеток in vivo. При этом введение животным S-P-aPD-1 не только сопровождалось снижением количества опухолевых клеток, но и оказалось значительно более эффективным по сравнению с системным введением неконъюгированных анти-PD-1 антител, о чем свидетельствовала более чем двукратная разница в выживаемости особей.
Далее авторы исследовали эффект разработанной системы доставки на клетки адаптивного иммунитета. Согласно данным проточной цитофлюориметрии, проведенной на выделенных из крови лимфоцитах, в группе мышей S-P-aPD-1 наблюдалось четырехкратное увеличение количества CD3+ лимфоцитов по сравнению с контрольной группой, и двукратное по сравнению с группой особей, которым вводили свободные aPD-1. Кроме того, применение S-P-aPD-1 сопровождалось экспансией CD8+ Т-клеток, а также ростом их цитотоксической активности.
Несмотря на впечатляющие результаты, продемонстрированные созданной клеточной системой, до ее внедрения в клиническую практику пока, вероятно, далеко, и исследователям еще предстоит найти ответы на ряд принципиальных вопросов. Так, пока неизвестно, какой эффект на иммунную систему может оказать S-P-aPD-1 в процессе циркуляции в крови пациентов, а также каковы потенциальные последствия выброса провоспалительных медиаторов тромбоцитами при активации последних.
