Наследственные опухолевые синдромы

Это партнерский материал, подготовленный при поддержке yRisk
Понятие наследственной предрасположенности к различным патологиям широко известно. На сегодняшний день наследственная предрасположенность особенно интересна в контексте формирования опухолей наследственного типа. Зная о наличии такой предрасположенности, можно реализовывать возможности предиктивной медицины и не допустить развития опухоли у пациента в группе риска. Что такое наследственные опухолевые синдромы и как наиболее эффективно диагностировать их в нашей стране, расскажем в этой статье.
По условиям возникновения все виды злокачественных новообразований можно разделить на спорадические и наследственные. Случаи спорадических опухолей составляют подавляющее число во всемирной популяции. По различным данным, от 5 до 10 % составляют случаи наследственных новообразований или наследственные опухолевые синдромы.
Наследственный опухолевый синдром — это состояние, связанное с формированием опухоли в результате наследования мутаций в генах, ассоциированных с онкогенезом. Мутировавшие гены чаще играют контролирующую роль и ответственны за течение клеточного цикла или репарацию ДНК. При этом, в отличие от спорадических опухолей, при наследственных опухолевых синдромах мутации обнаруживаются в генах клеток всего организма с момента формирования зиготы. Опухоль при наследственном синдроме развивается в более раннем возрасте (на 10–15 лет раньше спорадических опухолей), когда наследственный дефект репарации ДНК или течения клеточного цикла будет сочетаться с накопившимися за жизнь соматическими мутациями . Необходимо учитывать, что понятие наследственных новообразований не тождественно понятию семейных опухолей. В первом случае опухоль имеет известную молекулярно-генетическую причину, семейные же опухоли могут ей не обладать, но демонстрировать высокую частоту встречаемости в одной семейной линии.
Широкое распространение наследственных опухолевых синдромов связано прежде всего с постоянным накоплением генетических мутаций в популяции. Большинство опухолей наследственного типа можно рассматривать как патологии с аутосомно-доминантным типом наследования. Носительство мутаций не влияет на фертильность, что позволяет мутациям широко распространяться в популяции.
Еще одной особенностью наследственных опухолевых синдромов является более частое возникновение первично-множественных новообразований.Так, у женщин билатеральные опухоли молочных желез чаще развиваются именно в контексте наследственного рака молочной железы и яичников. По сравнению с опухолями спорадического типа, лечение наследственных опухолевых синдромов носит более длительный характер и требует больших усилий со стороны онкологов.
Одним из наиболее распространенных наследственных опухолевых синдромов является синдром Линча, или наследственный колоректальный рак без полипоза. Частота встречаемости такого синдрома в общей популяции составляет 1:500, а пенетрантность патологии — до 80 %. Согласно Амстердамским критериям II, подозревать у пациента синдром Линча можно по совокупности признаков:
— наличие как минимум трех членов семьи с гистологически подтвержденным колоректальным раком или раком эндометрия, тонкой кишки, мочеточника или лоханки почки, при этом один из членов семьи является родственником первого порядка для двух других;
— исключен семейный аденоматозный полипоз;
— заболевание имеется у представителей как минимум двух последующих поколений;
— как минимум у одного члена семьи заболевание было диагностировано в возрасте до 50 лет.
В нашей стране большое значение имеет высокая распространенность наследственного рака молочной железы и яичников. Среди всех случаев рака молочной железы наследственные составляют 5–10 %, среди случаев рака яичников — 10–15 %. Критерии, определяющие подозрение на наследственный рак молочной железы и яичников, не являются общепринятыми и варьируют в разных странах. Так, критериями NCCN (Национальной онкологической сети США) являются:
— рак молочной железы в возрасте до 50 лет;
— трижды негативный рак молочной железы в возрасте до 60 лет;
— рак яичников или рак поджелудочной железы в любом возрасте;
— рак молочной железы в любом возрасте при наличии в семье случаев рака молочной железы, рака яичников, рака простаты или рака поджелудочной железы;
— рак молочной железы в любом возрасте при наличии еврейских корней в родословной.
Диагностика наследственного опухолевого синдрома у пациентов с уже имеющейся патологией имеет высокую значимость для подбора средств таргетной терапии. Так, например, при выявлении дефектов BRCA1 и BRCA2 возможно назначение препарата Линпарза (олапариб) — ингибитора белка PARP, ответственного за репарацию ДНК.
Наследственным опухолевым синдромом с наиболее широким спектром возможных новообразований является синдром Ли-Фраумени. Этот синдром характеризуется высоким риском формирования злокачественных новообразований в детском и подростковом возрасте. Часто обнаруживаются опухоли молочной железы, головного мозга, надпочечников, лейкозы и другие новообразования. Синдром Ли-Фраумени связан с мутацией в гене TP53. Белок, экспрессируемый им, играет центральную роль в регуляции клеточного цикла. По этой причине синдром Ли-Фраумени ассоциирован с повышением риска возникновения большого количества различных новообразований.
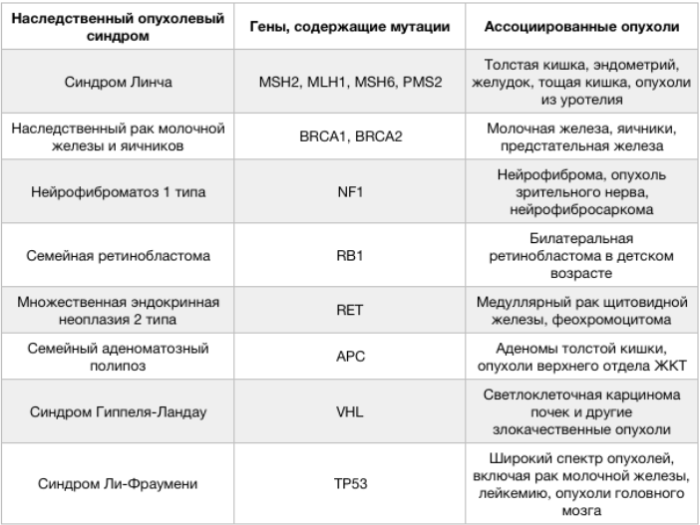
Рисунок 1. Характеристика основных наследственных опухолевых синдромов.
При подозрении на наследственный опухолевый синдром показано проведение генетического тестирования. Среди возможных методов определения генных мутаций одним из простых и наименее затратных является полимеразная цепная реакция (ПЦР). ПЦР подразумевает амплификацию, то есть образование дополнительных копий участков нуклеиновых кислот, в том числе мутировавших, что и используется в формате генетических тестирований. Метод ПЦР позволяет выявить определенный набор — «панель» — мутаций в исследуемых генах. Низкая чувствительность метода для российских пациенток с подозрением на наследственный рак молочной железы и яичников определяется тем, что ПЦР-панель на 8 мутаций в генах BRCA1 и BRCA2, используемая в России, позволяет выявить лишь половину пациенток с мутациями в этих генах. Остальные пациентки получают отрицательные результаты.
В настоящее время все более широкое распространение в диагностике наследственных опухолевых синдромов получают методы секвенирования. Секвенирование — это процесс определения нуклеотидных последовательностей ДНК и РНК. Методы секвенирования нового поколения (next generation sequencing, NGS) — это целая группа технологий определения нуклеотидных последовательностей ДНК и РНК как в формате отдельных участков генов, так и в объеме целого генома. Определение генетических мутаций методом NGS высокоэффективно: метод позволяет обрабатывать большие объемы данных за короткое время, выявлять и анализировать весь спектр имеющихся мутаций, что снижает число индивидуальных ошибок, связанных с особенностями генома пациента.
В нашей стране генетические исследования методом секвенирования нового поколения проводятся в крупных федеральных центрах, куда можно попасть по направлению врача-онколога. Кроме того, на сегодняшний день любой желающий при подозрении на наследственный опухолевый синдром может пройти генетическое тестирование методом NGS в лаборатории yRisk. Компания работает с использованием современных платформ секвенирования, позволяющих выявлять мутации, ассоциированные с наследственными опухолевыми синдромами. Чувствительность такого анализа значительно превышает данные ПЦР.
Положительный результат исследования не означает наличие у пациента опухоли на данный момент. Обнаружение опухоль-ассоциированных мутаций позволяет включать пациентов в группы риска и регулярно проводить диспансеризацию внутри этих групп. Профилактические мероприятия среди групп пациентов с наследственными опухолевыми синдромами дают возможность предотвратить появление опухоли в раннем возрасте и развитие первично-множественных опухолей, что крайне важно для сохранения высокого качества жизни. Как уже было сказано, генетическое тестирование методом NGS показано и пациентам, уже имеющим опухоль, для подбора наиболее эффективных средств таргетной терапии.
Выявление носительства опухоль-ассоциированных мутаций также позволяет планировать профилактические операции, проведение которых предотвращает развитие опухоли в дальнейшем. Так, при наследственном раке молочной железы и яичников высок превентивный эффект профилактической подкожной мастэктомии. Сохранить качество жизни после этой операции позволяет последующее эндопротезирование молочных желез. Женщинам старше 40 лет с такими мутациями рекомендуется профилактическая овариоэктомия. Профилактические операции рекомендованы и при некоторых других наследственных синдромах.
Диагностика наследственных опухолевых синдромов в современном мире имеет особую значимость. К сожалению, пока не был создан метод, позволяющий эффективно предотвращать развитие спорадических опухолей. Выявление же групп людей с наследственной предрасположенностью позволяет существенно снизить частоту злокачественных новообразований, а в конечном итоге — спасти жизнь не одной тысяче пациентов.
Источники
Parkes A., Arun B. K., Litton J. K. Systemic treatment strategies for patients with hereditary breast cancer syndromes //The oncologist. – 2017. – Т. 22. – №. 6. – С. 655.
Mork M. E. et al. High prevalence of hereditary cancer syndromes in adolescents and young adults with colorectal cancer //Journal of Clinical Oncology. – 2015. – Т. 33. – №. 31. – С. 3544.
Соколенко А. П., Иевлева А. Г., Митюшкина Н. В., Суспицын Е. Н., Преображенская Е. В., Кулигина Е. Ш., Воскресенский Д. А., Лобейко О. С., Крылова Н. Ю., Городнова Т. В., Буслов К. Г., Бит-сава Е. М., Долматов Г. Д., Порханова Н. В., Поляков И. C., Абышева С. Н., Катанугина А. С., Бахолдин Д. В., Янус Г. А., Того А. В., Моисеенко В. М., Максимов С. Я., Семиглазов В. Ф., Имянитов Е. Н. Синдром наследственного рака молочной железы и яичников в Российской Федерации // Acta Naturae (русскоязычная версия). 2010. №4. URL: https://cyberleninka.ru/article/n/sindrom-nasledstvennogo-raka-molochnoy-zhelezy-i-yaichnikov-v-rossiyskoy-federatsii (дата обращения: 10.02.2019).
Rahner N., Steinke V. Hereditary cancer syndromes //Deutsches Ärzteblatt International. – 2008. – Т. 105. – №. 41. – С. 706.
http://umedp.ru/articles/targetnaya_terapiya_raka_molochnoy_zhelezy.html
