Колоректальный рак: современное состояние проблемы
Колоректальный рак (КРР) относится к злокачественным новообразованиям, возникающим в ободочной и прямой кишке. В США и во всем мире он относится к числу наиболее распространенных типов онкопатологии. Злокачественные новообразования ободочной и прямой кишки имеют множество общих черт, но их прогноз и лечение способны значительно различаться.
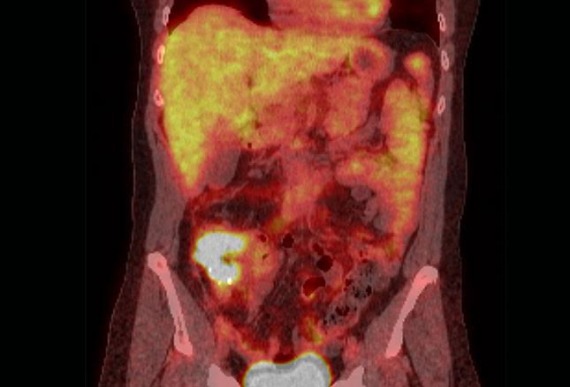
Рисунок 1 | ПЭТ/КТ— сканирование с 18F-ФДГ во фронтальной плоскости у 63-летней женщины демонстрирует рак восходящей ободочной кишки с вовлечением слепой кишки. Источник: Sharma N, Neumann D, Macklis R. Radiat Oncol. 2008; 3:25
Аденокарциномы составляют подавляющее большинство (95 %) колоректальных злокачественных новообразований [1]. Аденомы толстой кишки являются предраковыми состояниями, около 5 % из них в конечном итоге развиваются в аденокарциному [8], обычно это занимает 10–20 лет [9]. К более редким гистологическим типам относятся карциноидные опухоли, стромальные опухоли желудочно-кишечного тракта (GIST — Gastrointestinal Stromal Tumor; ГИСО), лимфомы и саркомы [1].
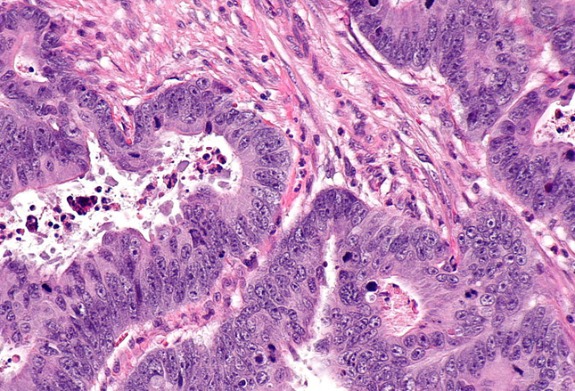
Рисунок 2 | Колоректальная аденокарцинома при большом увеличении (окрашивание гематоксилином и эозином [H&E]). Источник: Wikimedia Commons / Nephron
Механизм, с помощью которого возникает КРР, не полностью изучен, но считается многофакторным и включает в себя многоступенчатый процесс [4, 7, 10, 11]. Известно, что существует по меньшей мере три пути:
- хромосомная нестабильность;
- микросателлитная нестабильность;
- фенотип метилирования островков CpG (CIMP фенотип) [10, 11].
Хромосомные изменения в участках хромосом 5q, 18q и 17p вовлекаются в механизм заболевания, затрагивая такие гены, как APC, TP53 и DCC/MADH2/MADH4, так же как и мутации онкогена KRAS [4, 7, 10, 11].
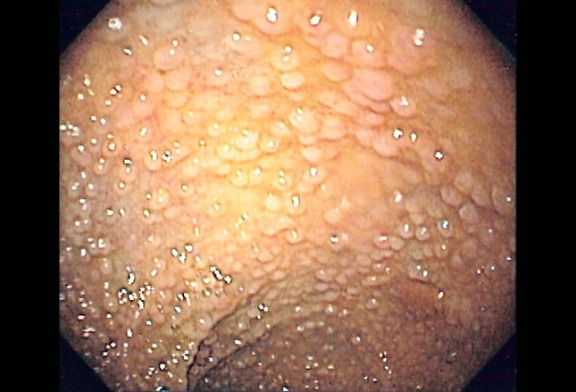
Рисунок 3 | Колоноскопическое изображение множественных аденоматозных полипов у пациента с семейным аденоматозным полипозом (САП; FAP; familial adenomatous polyposis). Источник: Samir at the English language Wikipedia
По оценкам, у 75 % пациентов заболевание имеет спорадический характер; у оставшихся 25 % прослеживается семейный анамнез заболевания [10].
Генетические, экологические факторы и определенный образ жизни повышают риск развития злокачественных новообразований [1, 5–7, 9, 10]:
- Наследственные условия и семейный анамнез: семейный аденоматозный полипоз толстой кишки (САП, FAP), наследственный неполипозный рак толстой кишки (HNPCC) или синдром Линча, синдром Туркота, синдром гиперпластического полипоза, синдром Пейтца-Егерса, MUTYH-ассоциированный полипоз толстой кишки;
- Анамнез жизни: пожилой возраст, воспалительные заболевания кишечника (неспецифический язвенный колит, болезнь Крона), колоректальные полипы/рак, рак яичников, рак молочной железы или эндометрия, сахарный диабет 2 типа;
- Факторы образа жизни: недостаток физической активности, избыточный вес/ожирение, курение.
Один из наиболее важных факторов риска, касающийся практически каждого, провозглашен МАИР (Международное агентство по изучению рака; IARC), заключившим, что высокий уровень употребления в пищу красного мяса и мясной продукции (переработанного мяса) приводит к развитию колоректального рака. Кроме того, была отмечена возможная связь с возникновением рака желудка, однако имеющиеся фактические данные не позволяют сделать определенные выводы.
Также подтверждено, что употребление алкоголя является фактором риска развития колоректального рака у мужчин и женщин; предполагается, что данная связь варьируется в зависимости от расы/этнической принадлежности, ИМТ, использования НПВП, потребления пищевых волокон и фолиевой кислоты и типа употребляемого алкогольного напитка [27].
Расовая/этническая принадлежность: негроидная раса или евреи группы ашкенази.
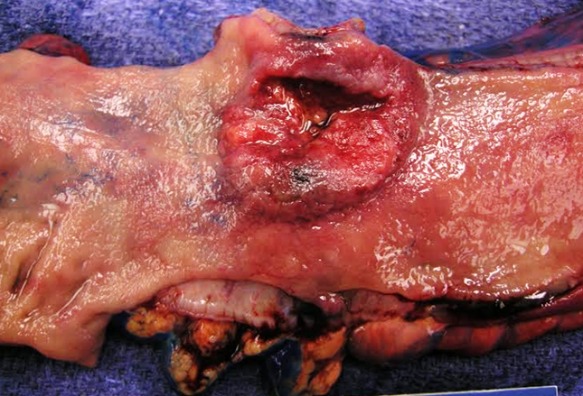
Рисунок 4 | Макропрепарат аденокарциномы толстой кишки в условиях ВЗК. Гладкая, сплюснутая слизистая оболочка не пораженной раком области типична для язвенного колита. Источник: Ali Ahmad, MD
Заболеваемость и смертность в США
В Соединенных Штатах заболеваемость колоректальным раком за последнее десятилетие ежегодно снижалась примерно по 2,6 %, а снижение смертности в период с 2006 по 2015 годы составило в среднем 2,4 % в год.
В 2018 году в рамках программы наблюдения, эпидемиологии и конечных результатов (SEER) и по оценке Американского онкологического общества (ACS) будет зарегистрировано около 140 250 новых случаев колоректального рака в США, что составит примерно 8,1 % от всех новых случаев рака в США; при этом количество летальных исходов от этого заболевания составит 50 630 (8,3 % всех смертей от онкопатологии) [3].
Колоректальный рак встречается преимущественно у пожилых людей (в возрасте 65–74 лет (24,3%), за ними следуют лица в возрасте 55–64 лет (22,6 %) и 75–84 лет (20,6 %)) [3]. Медиана возраста при постановке диагноза — 67 лет. Мужчины страдают несколько чаще, чем женщины, как и негроидная раса по сравнению с мужчинами других рас/этнических групп [3].
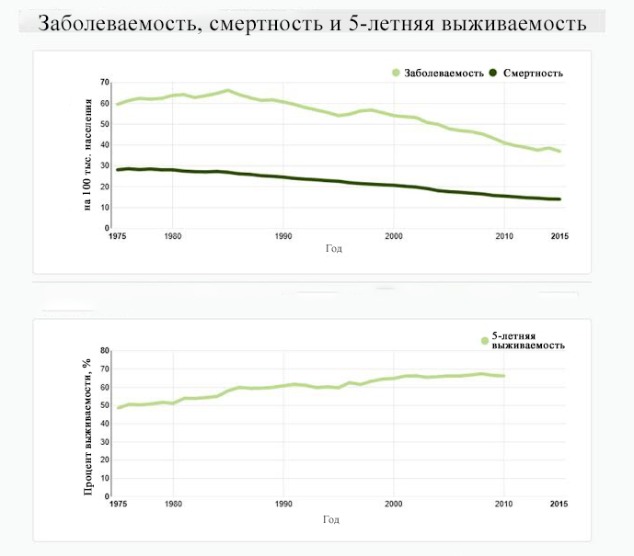
Рисунок 5 | Заболеваемость, смертность, 5-летняя выживаемость в США при КРР; адаптированный график [Национальный институт рака (NCI)/программа SEER [3]] // http://seer.cancer.gov/statfacts/html/colorect.html]
Если рассмотреть статистические данные по РФ, то рак ободочной и рак прямой кишки (с учетом ректосигмоидного соединения и ануса) будут находиться на 4 и 7 месте соответственно в структуре онкологической заболеваемости на 2017 год, при этом у мужчин они будут на 5 (6,4%) и 6 (5,3%) месте, а у женщин на 3 (7,2%) и 7 (4,4 %) месте соответственно [28].
Динамика показателей заболеваемости (стандартизированные показатели на 100 тыс. населения) населения России в период с 2007 года по 2017 годохарактеризовалась среднегодовым приростом в 1,47%, а прямой кишки (с учетом ректосигмоидного соединения, ануса) в 0,87 %.
В структуре смертности населения России от ЗНО рак ободочной кишки находится на 3-м месте с удельным весом 7,9 %. При этом динамика показателей смертности населения от рака ободочной и прямой кишки (с учетом ректосигмоидного соединения, ануса) за аналогичный период (2007-2017 гг) продемонстрировала среднегодовое снижение на 0,61 и 1,53 % соответственно.
Дебют
На ранней стадии колоректальный рак обычно протекает бессимптомно [1, 12]. По мере прогрессирования заболевания часто наблюдается нарушение функций кишечника (80 %) и кровотечения (60 %). Также имеются другие признаки [1, 5, 12, 13]:
- ректальные спазмы;
- гематохезия (кровь в кале), темный стул (мелена);
- дискомфорт в животе, спазмы, боль или вздутие живота;
- недомогание, анорексия и/или необъяснимая потеря веса;
- тазовая боль (на более поздних стадиях заболевания).
Также симптомы колоректального рака могут варьировать в зависимости от места поражения. Наиболее часто пораженными областями оказываются прямая кишка (38 %), сигмовидная кишка (20%) и нисходящая ободочная кишка (10 %), за ними следуют слепая кишка и печеночный изгиб (по 8 % каждый), поперечная ободочная кишка(6 %), ректосигмоидный переход (7 %), восходящая ободочная кишка (3%) и селезеночный изгиб (2 %) [13].
Левосторонние злокачественные опухоли обычно характеризуются болью в животе и изменением функций кишечника (по 60% на каждый), чувством тяжести (40 %), кровотечением и непроходимостью (по 20 %), потерей веса (15 %) и рвотой (10 %) [13].
Примечание: изменение функций кишечника, в англоязычной литературе – «change in bowel habits», т. е. дословно «изменения в привычках кишечника» является термином расплывчатым и сделано это намереннно. Фактически, понятие может означать множество особенностей, которые отмечает сам пациент, включая изменение частоты, консистенции или объема стула.
Общими чертами правостороннего поражения являются неопределенная, «рассеянная» боль в животе (80 %) и чувство тяжести (70 %), а также снижение веса (50%), изменение функций кишечника с диареей (40 %), рвота (30 %), кровотечение из прямой кишки (20 %) и непроходимость кишечника (5 %) [13].
Классификация ВОЗ
Гистологическая классификация опухолей толстой и прямой кишки Всемирной организации здравоохранения (ВОЗ) включает эпителиальные, неэпителиальные опухоли, вторичные опухоли и полипы [14].
Эпителиальные опухоли включают в себя следующие виды [14]:
- Аденомы (тубулярные, ворсинчатые, тубулярно-ворсинчатые, зубчатые);
- Интраэпителиальная неоплазия (дисплазия), связанная с хроническими воспалительными заболеваниями кишечника (низко- и высокодифференцированная железистые);
- Карцинома (аденокарцинома, слизистая аденокарцинома, перстневидно-клеточный рак, мелкоклеточная, плоскоклеточная, аденоплоскоклеточная, медуллярная и недифференцированная карциномы);
- Карциноид (хорошо дифференцированное нейроэндокринное новообразование) энтерохромаффино-клеточный, L-клеточный, глюкагоноподобный пептид и панкреатический полипептид (PP)/пептид YY(PYY)-продуцирующая опухоли, серотонин-продуцирующее новообразование и другие;
- Смешанная карциноид-аденокарцинома;
- Другие.
Неэпителиальные опухоли включают липому, лейомиому, GIST, лейомиосаркому, ангиосаркому, саркому Капоши, меланому и др. [14].
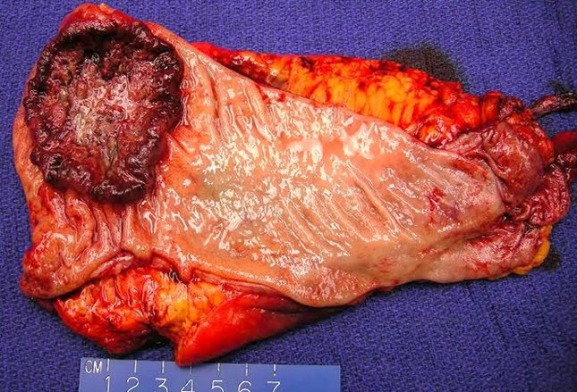
Рисунок 6 | Макропрепарат аденокарциномы изъязвленной ободочной кишки [Изображение Ali Ahmad, MD]
Среди злокачественных лимфом выделяют B-клеточную лимфому краевой зоны лимфоидной ткани, ассоциированной с слизистой оболочкой (MALT); лимфому из клеток мантийной зоны, диффузную крупноклеточную B-клеточную лимфому, лимфому Бёркитта (ЛБ), Бёркитт-подобную лимфому, или атипичную ЛБ, и пр.[14].
Среди полипов различают гиперпластический (метапластический) полип, полип Пейтца-Егерса и ювенильный тип полипа[14].
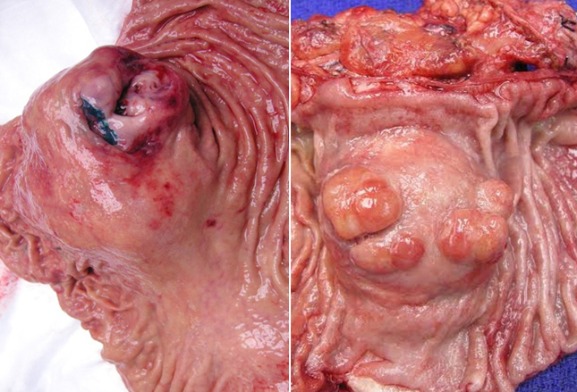
Рисунок 7 | Макропрепараты экстражелудочных ГИСО от разных пациентов [Изображение Ali Ahmad, MD]
Стадирование опухоли. Обзор изменений TNM 8
Классификация TNM Американского Объединенного комитета по изучению рака (AJCC) является международным стандартом для стадирования колоректального рака [14]. При раках ободочной и прямой кишки применяют одну и ту же логику стадирования, т. к. их категории TNM ассоциированы с аналогичными результатами выживания для обоих нозологий [15, 16].
В 2018 году вступил в силу 8-й пересмотр TNM, но ввиду минимальных изменений (уточнение определения опухолевых депозитов, изменения категории M и содержания IV стадии) их мы рассматривать не станем [25].
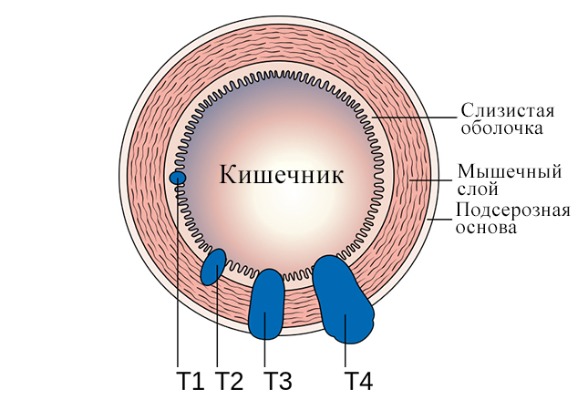
Рисунок 8 | Классификация TNM, адаптированное изображение [Cancer Research UK via Wikimedia Commons]
Скрининг
В США рутинный скрининг сыграл важную роль в сокращении заболеваемости и смертности от колоректального рака в последнее десятилетие, в первую очередь из-за профилактики, а также раннего выявления и удаления предраковых патологий [9]. Скрининговые исследования включают следующие процедуры [17–19]:
- Колоноскопия;
- Высокочувствительная гваяковая проба на скрытую кровь в кале (FOBT — high-sensitivity guaiac-based fecal occult blood testing)*;
- Фекальный иммунохимический тест (ФИТ, FIT — fecal immunochemical testing);
- ДНК-тест кала;
- Бариевая клизма с двойным контрастированием;
- КТ-колонография (виртуальная колоноскопия).
* На данный момент выяснилось, что FOBT неэффективен у женщин и мужчин с правосторонней локализацией опухоли [26].
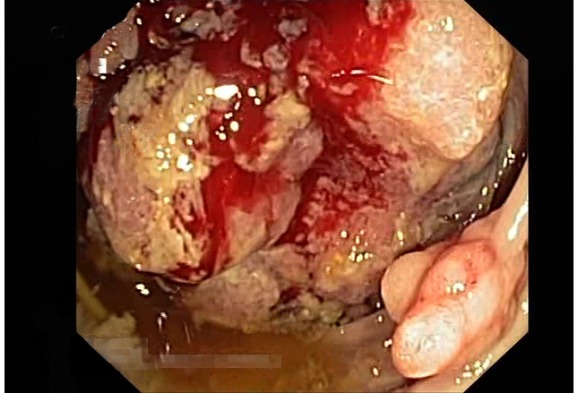
Рисунок 9 | Эндоскопическая фотография опухоли в слепой кишке у пациента с семейным аденоматозным полипозом (FAP) и раком толстой кишки [Изображение из материалов Mastalier B, Tihon C, Ghita B, et al. J Med Life. 2012;5(3):348-53]
Рекомендации USPSTF (US Preventive Services Task Force)
Рекомендации Целевой группы по профилактическим услугам США (USPSTF) по скринингу колоректального рака 2016 года рекомендуют скрининг всех взрослых людей в возрасте от 50 лет до 75 лет. У взрослых в возрасте от 76 до 85 лет решение о скрининге должно быть индивидуализировано с учетом общего состояния здоровья пациента и данных о предыдущем скрининге [17].
Рекомендации ACS и NCCN (National Comprehensive Cancer Network) по скринингу колоректального рака стратифицированы на основе риска развития этого ЗНО у пациента.
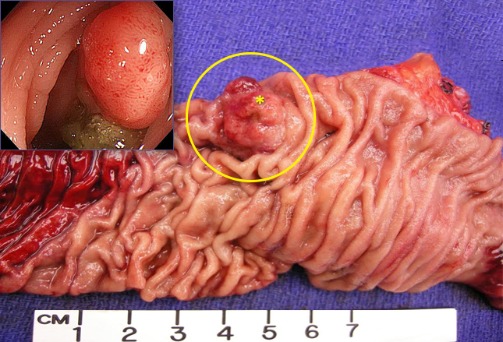
Рисунок 10 | Полип толстой кишки (звездочка) в резецированном препарате (круг). Вставка — колоноскопическое изображение полипа толстой кишки. [Изображение Ali Ahmad, MD; Wikimedia Commons/Kuyohong]
Средняя группа риска
NCCN определяет среднюю группу риска как пациентов с отсутствием в анамнезе (1) аденомы или сидячего зазубренного полипа (SSP), или колоректального рака или (2) ВЗК, а также не имеющих в семейном анамнезе колоректальной карциномы или подтвержденной аденомы [18].
NCCN рекомендует начинать скрининг в возрасте 50 лет у лиц со средним риском [18]. В 2018 году ACS (Американское онкологическое общество) пересмотрело свое руководство по скринингу колоректального рака для того, чтобы рекомендовать, группе среднего риска начинать скрининг в возрасте 45 лет; это изменение частично было вызвано новыми данными, свидетельствующими о том, что частота возникновения КРР возросла у молодых людей [19].
Скрининг-тесты в этой группе риска включают исследования, которые в первую очередь обнаруживают онкопатологию, такие как:
ежегодные высокочувствительные гваяковая проба или ФИТ,
или ДНК-тест кала каждые 3 года,
или те исследования, которые обнаруживают аденоматозные полипы и онкопатологию, такие как: гибкая сигмоидоскопия, бариевая клизма с двойным контрастированием,
или КТ-колонография каждые 5 лет,
или колоноскопия каждые 10 лет [18,19].
Существуют некоторые различия в том, как ACS и NCCN распределяют людей в группы с повышенным или высоким риском.
Группа повышенного риска
NCCN считает, что индивиды подвергаются повышенному риску, если у них имеется:
- случай аденомы, SSP, колоректального рака или ВЗК в анамнезе; или
- семейный анамнез рака толстой кишки или аденоматозных полипов [18].
ACS классифицирует ВЗК как фактор высокого риска [19].
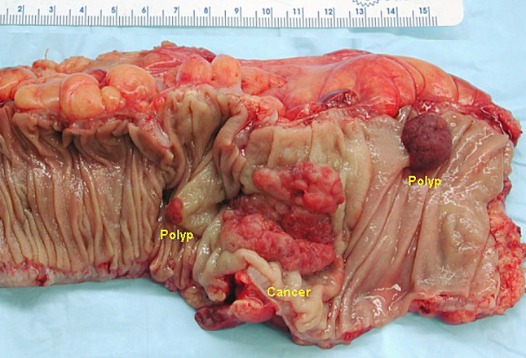
Рисунок 11 | Макропрепарат после открытой гемиколэктомии, демонстрирующий инвазивный колоректальный рак и два аденоматозных полипа [Wikimedia Commons/Emmanuelm]
Колоноскопия — это скрининговое исследование в этой группе риска; интервал между исследованиями и/или необходимость проведения дополнительной диагностической оценки зависит от клинических результатов и наличия семейного анамнеза КРР [18, 19].
Группы высокого риска
Те, у кого имеются наследственные/семейные синдромы, считаются подверженными высокому риску в обеих классификациях; такие синдромы включают синдром HNPCC (наследственный неполипозный рак толстой кишки или синдром Линча) и полипозы, такие как синдром Коудена и синдром Ли-Фраумени [18, 19].
Скрининг и наблюдение в этой группе риска осуществляются на индивидуальной основе, но обычно включают в себя генетическое тестирование (если ранее не проводилось), начало скрининга проходит в более раннем возрасте и более часто проводится гибкая сигмоидоскопия или колоноскопия и/или другие исследования [18, 20].
Клиническое обследование
У пациентов с подозрением на КРР на основании результатов клинических обследований (включая пальцевое ректальное исследование) или результатов скрининга проводят ректальное обследование путем гибкой сигмоидоскопии/колоноскопии и биопсии любых подозрительных поражений [1, 4, 7,12, 13].
Рутинные лабораторные исследования включают в себя следующие тесты:
- клинический анализ крови;
- биохимический анализ крови;
- функциональные пробы печени;
- уровень РЭА (раково-эмбриональный антиген).
Рекомендуется, чтобы пациенты с первично диагностированным КРР подвергались генетическому тестированию и/или тесту на микросателлитную нестабильность [1, 7, 15, 16].
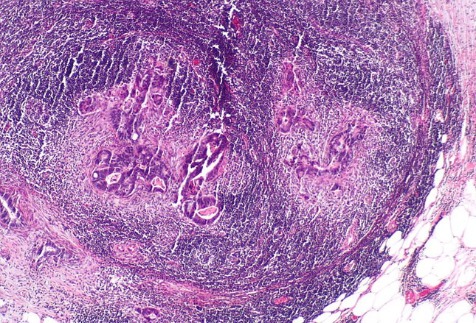
Рисунок 12 | Лимфатический узел с колоректальной карциномой (Г&Э-окраска) [Wikimedia Commons/Nephron]
Визуализирующие исследования
Визуализирующие исследования, которые способны облегчить планирование постановки диагноза и проведения терапии, включают в себя следующие методики [1, 7, 15, 16]:
- рентгенография грудной клетки;
- бариевая клизма с двойным контрастированием;
- КТ грудной клетки, брюшной полости и/или органов малого таза;
- МРТ брюшной полости и/или органов малого таза;
- эндоректальное УЗИ;
- ПЭТ-сканирование.
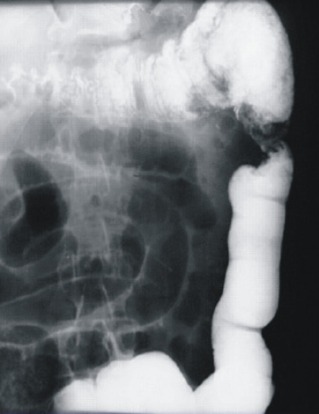
Рисунок 13 | Опухоль селезеночного изгиба ободочной кишки, ирригография [изображение из материалов Mastalier B, Tihon C, Ghita B, et al. J Med Life. 2012;5(3):348-53]
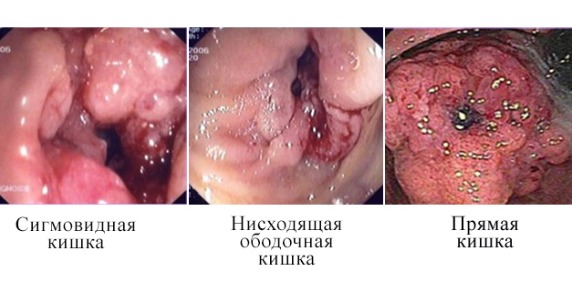
Рисунок 14 | Злокачественные поражения на разных участках толстой кишки [Radu V, Ion D, Serban MB, Ciurea M. J Med Life. 2010;3(3):314-9]
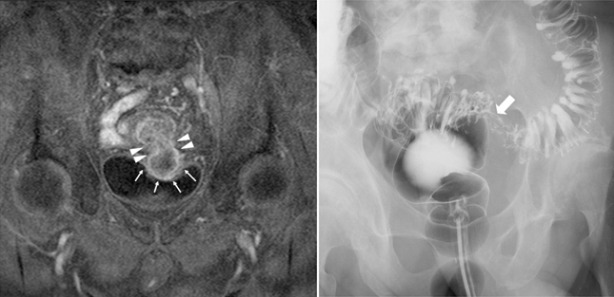
Рисунок 15 | Визуализирующие исследования — описание ниже в тексте [Yagi Y, Shoji Y, Sasaki S, et al. BMC Gastroenterol. 2014;14:90]
Усиленное T1-взвешенное МРТ-изображение (рис. 15 слева) показывает область между сигмовидной кишкой и мочевым пузырем у пациента с раком сигмовидной кишки. Солидная опухоль соединена с мочевым пузырем через свищ (что выглядит на снимке как «гантеля») и выступает в просвет мочевого пузыря (стрелки) через толстокишечно-мочепузырный свищ (наконечники стрел).
Ирригоскопия (рис. 15 справа) выявила у того же пациента опухоль как дефект сигмовидной кишки (стрелка). На опухоли наблюдается множество дивертикулов сигмовидной кишки.
Представленные выше снимки КТ (рис. 16) показывают фронтальный (слева) и аксиальный (справа) виды крупной правосторонней неопределенной массы мягких тканей, включающей в себя восходящую ободочную кишку. У пациента была обнаружена аденокарцинома слепой кишки.
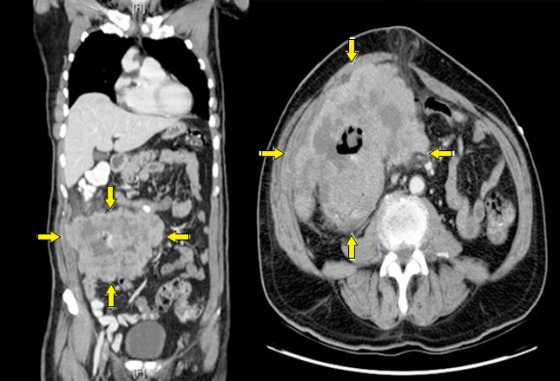
Рисунок 16 | Описание в тексте [Elyassi AR, Lin-Hurtubise K, Gagliano R. Cases J. 2009;2(1):131]
Снимок КТ (рис. 17) показывает эксцентричное утолщение стенки прямой кишки, согласующееся с диагнозом рака прямой кишки без поражения лимфатических узлов или вовлечения внутренних органов.
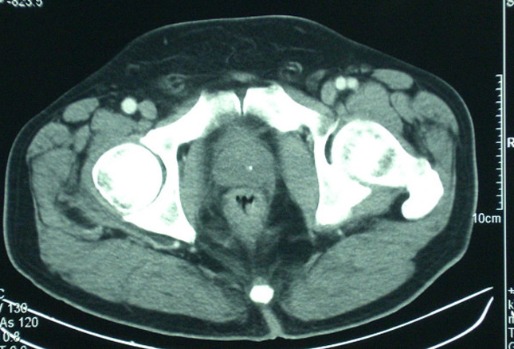
Рисунок 17 | Описание в тексте [Gallego-Plazas J, Menarguez-Pina F, Martinez-Banaclocha N, et al. Int Semin Surg Oncol. 2008;5:18]
На усиленной МРТ органов малого таза (рис. 18) — низко расположенная опухоль прямой кишки.
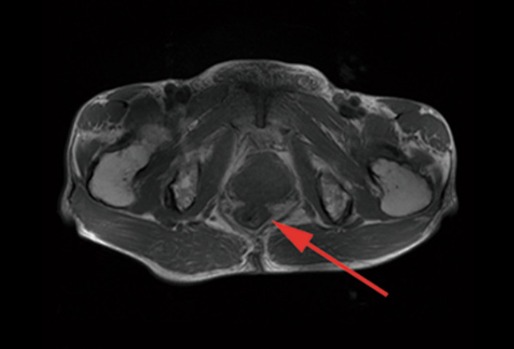
Рисунок 18 | Описание в тексте [Zhang Z, Wang J, Huang J, Yu X. World J Surg Oncol. 2014;12:82]
ПЭТ является очень полезным инструментом для постановки диагноза и оценки степени распространения КРР [7]. Комбинированный ПЭТ/КТ позволяет обнаруживать метастатические поражения. Необходимо обратить внимание на то, что некоторые гистологические типы (например, муцинозные варианты перстневидно-клеточного рака) могут недостаточно хорошо визуализироваться при ПЭТ-сканировании [7].
Лечение КРР
Оперативные вмешательства
Первичная тактика при локализованном раке толстого кишечника заключается в хирургической резекции первичной опухоли и лимфодиссекции региональных лимфатических узлов [1, 6, 15].
Хирургические варианты резекции новообразования включают следующие [1, 15]:
- полипэктомия и локальное иссечение (только небольшие очаги Т1);
- субтотальная или тотальная колэктомия (право-, левосторонняя гемиколэктомия, резекция сигмовидной кишки).
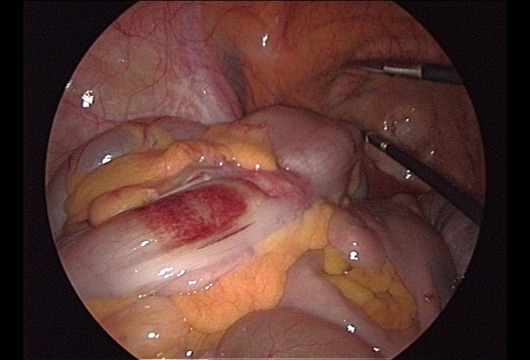
Рисунок 19 | Интраоперационное лапароскопическое изображение злокачественной опухоли сигмовидной кишки [Wikimedia Commons/Anpol42]
Рак ободочной кишки: химиотерапия
Пациентам с распространенным или метастатическим раком толстой кишки рекомендации NCCN указывают, что в таком случае может рассматриваться применение неоадъювантной химиотерапии [15].
Потенциальная ценность адъювантной химиотерапии для пациентов с раком толстой кишки II стадии остается предметом дискуссий [1, 6].
Общие схемы химиотерапии включают следующие варианты (но не ограничиваются ими) [1, 6, 15]:
- оксалиплатин/лейковорин/5-фторурацил (5-FU) — FOLFOX, или FOLFOX + бевацизумаб или панитумумаб или цетуксимаб;
- оксалиплатин/капецитабин (CapeOX), или CapeOX + бевацизумаб;
- иринотекан/лейковорин/5-FU (FOLFIRI), или FOLFIRI + бевацизумаб\цетуксимаб\панитумумаб\зив-афлиберцепт или рамуцирумаб.
Лечение рака прямой кишки
Ведение рака прямой кишки требует комплексного подхода — отчасти из-за повышенного риска локального рецидива и более неблагоприятного прогноза в целом, — и это подразумевает под собой работу многопрофильной команды специалистов-онкологов [5]. Ключевое внимание уделяется планированию операции (лечебной или паллиативной), возможному функциональному исходу, сохранению мочеполовой, сексуальной функций и возможности контролировать акт дефекации [4, 5].
Варианты тактики лечения новообразований толстой и прямой кишки включают в себя хирургическую технику, применение лучевой терапии и химиотерапевтический метод [5].
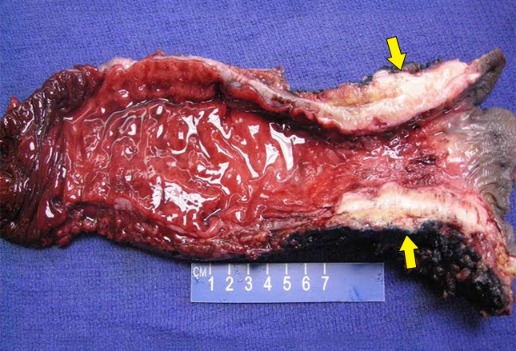
Рисунок 20 | Макропрепарат резецированной прямой кишки с ректальной аденокарциномой. Опухоль затронула мышцы сфинктера (стрелки). [Изображение Ali Ahmad, MD]
Хирургическая резекция: рак прямой кишки
Первичное лечение пациентов с раком прямой кишки — хирургическая резекция первичной опухоли и регионарных лимфатических узлов [1, 5, 16]. Степень оперативного вмешательства варьирует в зависимости от локализации и степени инвазии опухоли, а также от наличия или отсутствия признаков высокого риска (например, положительные края резекции, лимфоваскулярная и периневральная инвазия, низкодифференцированная опухоль по данным гистологического исследования) [5, 16].
Варианты хирургического вмешательства сводятся к следующим [1, 5, 16]:
- Полиэктомия и локальное иссечение для опухоли T1;
- Трансанальное локальное иссечение и трансанальная эндоскопическая микрохирургия (TEM) для клинически установленных T1N0 раков прямой кишки;
- Тотальная мезоректумэктомия (TME) с низкой передней резекцией;
- Тотальная мезоректумэктомия (TME) с брюшно-промежностной экстирпацией для пациентов, которые не являются кандидатами на сфинктер-сохранную операцию (постоянная колостомия).
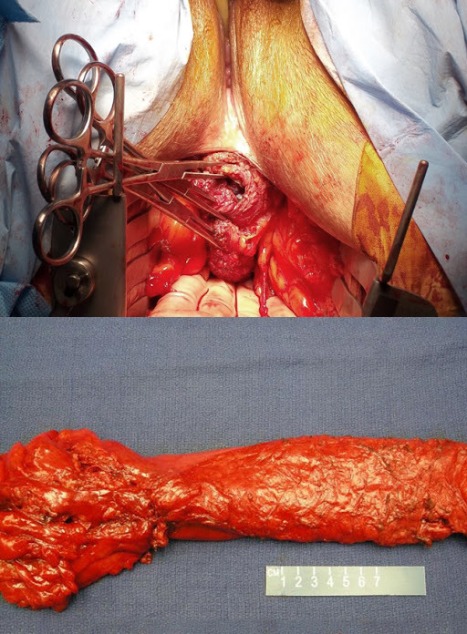
Рисунок 21 | Интраоперационная фотография промежностного доступа во время брюшно-промежностной экстирпации прямой кишки (сверху). Макропрепарат, полученный во время тотальной мезоректумэктомии (ТМЕ) при низкой передней резекции прямой кишки по поводу аденокарциномы (снизу) [Изображения Ali Ahmad, MD]
Химиотерапия и лучевая терапия: рак прямой кишки
Национальный институт рака (NCI) указывает, что неоадъювантная терапия с лучевой терапией для лечения рака прямой кишки является стандартом лечения пациентов со II и III стадией болезни, хотя послеоперационное химиолучевая терапия также может стать вариантом лечения [5].
Для пациентов с клинически установленными T3-T4 стадиями по TNM или раком с поражением лимфатических узлов (стадия II/III) предоперационная химиолучевая терапия также является стандартом лечения [5].
Предпочтительные схемы комбинированной химио-/лучевой терапии включают, но не ограничиваются ими, следующее [16]:
- Комбинация капецитабин/лучевая терапия или инфузионное введение 5-ФУ/лучевая терапия; *другим вариантом является болюсное введение 5-ФУ/лейковорин/лучевая терапия;
- FOLFOX или CapeOX или капецитабин, затем капецитабин/лучевая терапия;
- Инфузионное введение 5-ФУ/лучевая терапия, затем FOLFOX или CapeOX, затем капецитабин/лучевая терапия.
Метастазы и рецидивы КРР
Тактика лечения метастатической колоректальной аденокарциномы продолжает эволюционировать и обычно требует мультимодального подхода. Наиболее распространенными локализациями метастазов являются печень, легкие и брюшина [21].
Рак толстой кишки характеризуется высокой частотой возникновения абдоминальных метастазов, тогда как для рака прямой кишки характерны экстраабдоминальные метастазы [22]. Кроме того, гистологические подтипы также влияют на паттерн метастазирования: колоректальные аденокарциномы преимущественно метастазируют в печень, тогда как подтипы слизистой аденокарциномы и перстневидно-клеточного рака чаще метастазируют в несколько мест и в брюшную полость [22].
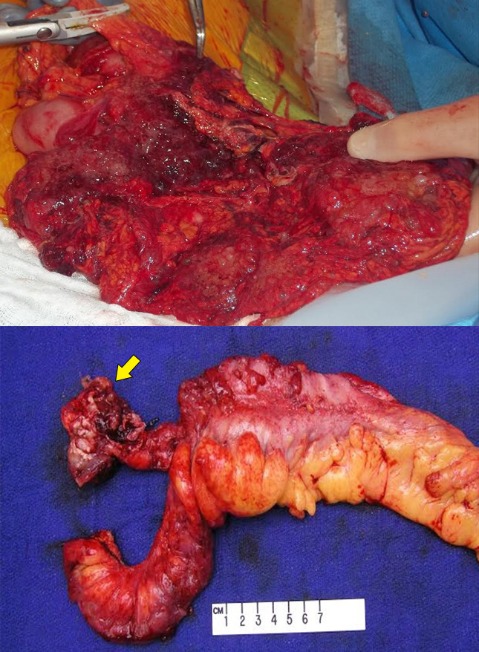
Рисунок 22 | Перитонеальные метастазы слизистого колоректального рака: интраоперационная фотография (сверху). Макропрепарат аппендикса, перфорированного слизистой аденокарциномой (снизу) [Изображение Ali Ahmad, MD]
Определенные типы слизистых опухолей перфорируют и распространяются перитонеально. В условиях высокой селективности эти поражения могут удаляться циторедуктивной операцией в сочетании с интраоперационной гипертермической внутрибрюшной химиотерапией (HIPEC, Hyperthermic Intraoperative Peritoneal Chemotherapy) [23, 24].
Для пациентов с локально рецидивирующими метастазами и/или метастазом колоректального рака только в печень/только в легкое должен использоваться мультидисциплинарный подход. Хирургическая резекция может быть применена у отдельных пациентов как потенциально курабельное лечение (с достижением полной ремиссии и предотвращением рецидивов рака) [5, 6].
Прогноз, прогностические факторы и выживание
Как и при любом ЗНО, классификация TNM диктует прогноз пациентов с раком ободочной или прямой кишки [5, 6, 15, 16].
Неблагоприятные прогностические факторы включают в себя следующие [5, 6, 15, 16]:
- обструкция (непроходимость) и перфорация кишечника;
- повышенные уровни РЭА в сыворотке крови;
- наличие признаков высокого риска (R1 — положительный край резекции, лимфо-сосудистая и периневральная инвазия, низкая степень дифференцировки опухоли).
Выживание обратно пропорционально стадии заболевания. В целом около 65 % пациентов с диагнозом КРР выживают в течение пяти или более лет [3]. Большинство смертей от этого заболевания относится к пациентам с наличием отдаленных метастазов, поэтому раннее выявление и лечение имеют решающее значение для улучшения результатов. Пятилетняя относительная выживаемость для пациентов с локализованной формой колоректального рака (ст. I–II) составляет 89,8 %; с поражением регионарных лимфоузлов (ст. III) — 71,1 %; с отдаленными метастазами (ст. IV) — 13,8 % [3].
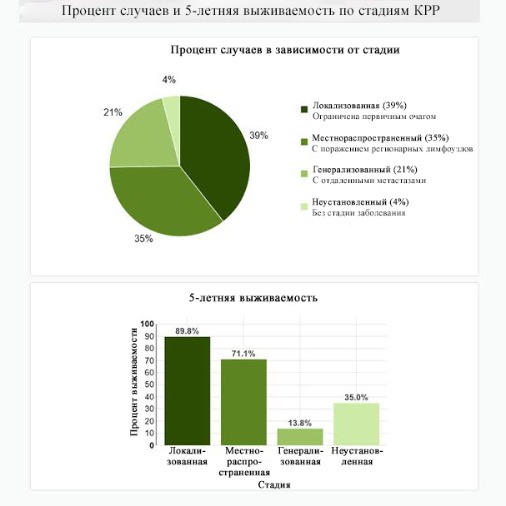
Рисунок 24 | Процентное соотношение по стадиям и 5-летней выживаемости при КРР [программа NCI/SEER [3]] // http://seer.cancer.gov/statfacts/html/colorect.html]
Клинический случай
Decipimur specie recti
Ряд подробностей будет намеренно опущен для того, чтобы сконцентрировать внимание на особенностях случая.
Пациентка К., 58 лет поступила 7 ноября с диагнозом: рак селезеночного изгиба ободочной кишки ст. IV T4bNxM1b (HEP). Состояние после симптоматического оперативного лечения 17.10.18 (формирование трансверзо-сигмоанастомоза), 2 курсов ХТ (FOLFOX-4), и с результатами ряда исследований:
- Видеоколоноскопия от 30.08.18: образование нисходящей кишки. Катаральный колит. См. рис. 1.
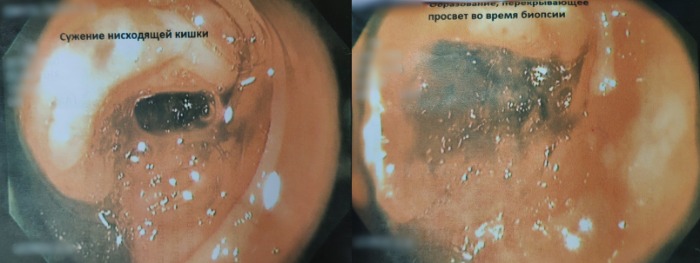
Рисунок 1 | Колоноскопия: сужение нисходящей ободочной кишки (справа); образование, перекрывающее просвет во время биопсии (слева)
- Виртуальная КТ-колоноскопия от 29.08.18 (рис. 3): в проекции нисходящего отдела толстого кишечника определяется дефект наполнения (вероятно новообразование) размерами 30х41х28 мм, возможно подпаянное к нижнему полюсу селезенки. Просвет нисходящего отдела толстого кишечника на этом уровне сужен до 4,5 мм. Контуры стенки нисходящего отдела толстого кишечника в этой области нечеткие, размытые с уплотнением и инфильтрацией параколической клетчатки. Заключение: «КТ-признаки образования нисходящего отдела толстого кишечника, спленомегалии, образования нижнего полюса селезенки (susp. киста, дифференцировать с вторичными изменениями). Косвенные КТ-признаки колита».
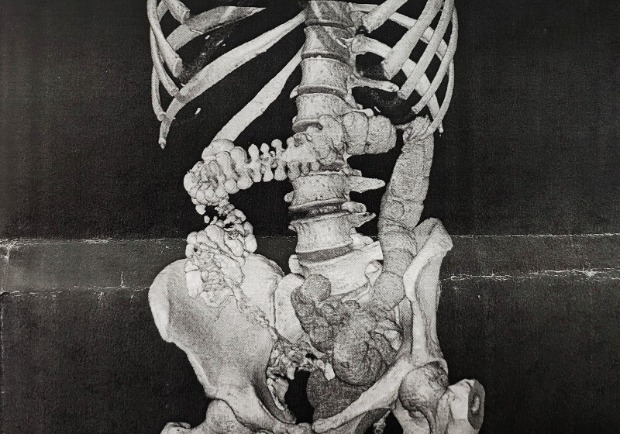
Рисунок 2 | Виртуальная КТ-колоноскопия
- ПГЗ от 30.08.18 г., заключение: умеренно дифференцированная аденокарцинома селезеночного изгиба толстой кишки.
- МСКТ органов брюшной полости от 07.11.18 (рис. 3): в области нисходящей ободочной кишки определяется массивный опухолевый конгломерат, циркулярно сужающий просвет кишки; размеры инфильтрата до 77х45 мм. Опухолевый инфильтрат тесно прилежит к селезенке и поджелудочной железе: на этом уровне определяется многокамерное кистозно-солидное образование общими размерами до 84х85 мм, визуализирующееся неотделимо от опухоли и прилежащих органов. Желудок оттеснен данным образованием кпереди. В S2 левой доли печени определяется гиподенсивный очаг тканевой плотности 8 мм в диаметре, в S6 правой доли печени определяется подобный очаг 21х22 мм. Поджелудочная железа на уровне головки и хвоста не увеличена, на уровне хвоста прилежит к вышеописанному кистозно-солидному конгломерату. Селезенка увеличена до 135х66 мм, в паренхиме ближе к воротам — гиподенсивный очаг 10 мм в диаметре. Заключение: «состояние после симптоматического оперативного лечения по поводу рака нисходящей ободочной кишки. КТ-картина кистозно-солидного конгломерата, вероятно вторичного характера, в области эпигастрия слева, прилежащего к опухоли кишки, селезенке и поджелудочной железе; невозможно исключить их инвазию. Mts в печень».
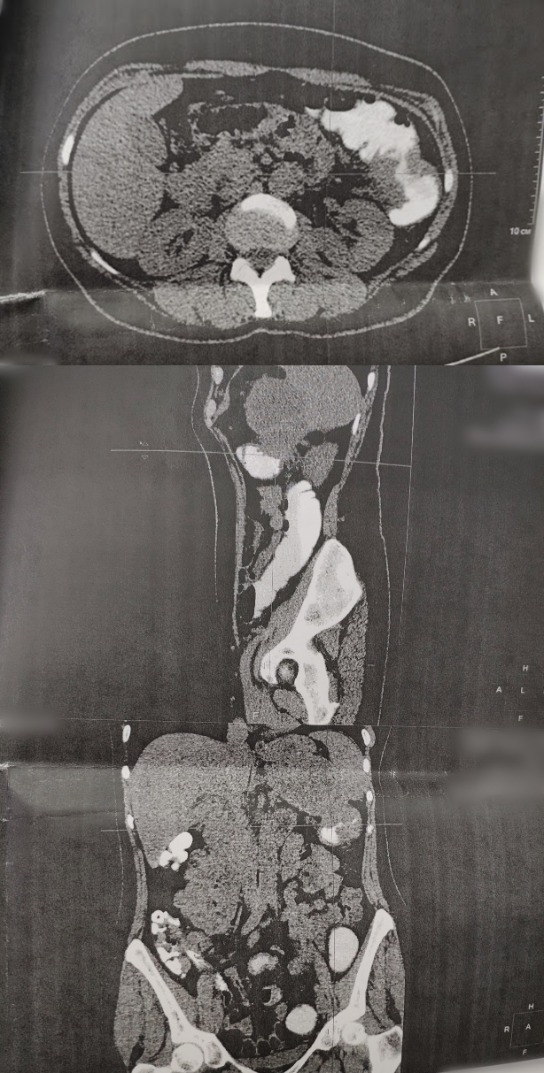
Рисунок 3 | Аксиальный срез МСКТ ОБП (сверху). Саггитальный срез МСКТ ОБП (снизу)
В результате пациентке 16.11.2018 была проведена комбинированная циторедуктивная левосторонняя гемиколэктомия с дистальной резекцией поджелудочной железы, адреналэктомией слева, спленэктомией, краевой резекцией желудка с лимфаденэктомией.
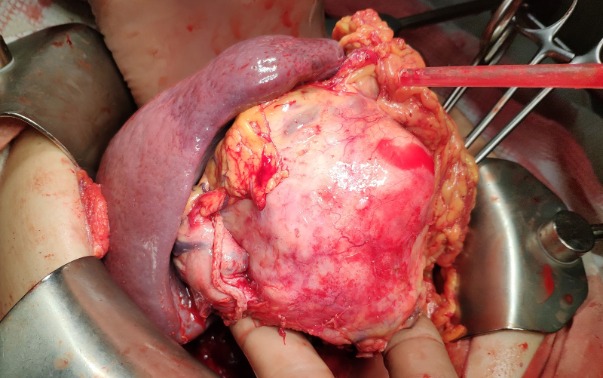
Рисунок 4 | Интраоперационная фотография макропрепарата ободочной кишки единым блоком с остальными резецированными органами
Во время проведения операции (см. рис. 4) ободочная кишка была удалена единым блоком с селезенкой, хвостом и частью тела поджелудочной железы, фрагментом желудка, левым надпочечником, брыжейкой кишки с лимфатическими узлами и частью большого сальника, и появилось подозрение на то, что у пациентки первично-множественный рак — помимо основного процесса имелись признаки новообразований хвоста поджелудочной железы и надпочечников (адренокортикальный рак). Однако гистологическое исследование расставило все по своим местам.
ГДЗ макропрепарата (после циторедуктивной операции) от 25.11.18: аденосквамозная карцинома хвоста поджелудочной железы с формированием кисты, врастанием в стенку селезеночного изгиба толстой кишки, стенку тела желудка. Инфаркт селезенки.
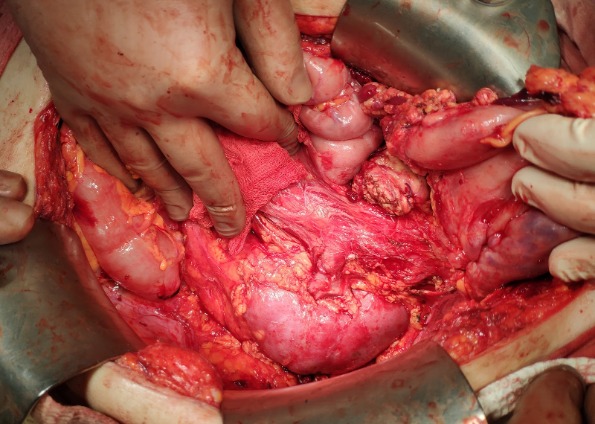
Рисунок 5 | Интраоперационная фотография после извлечения опухолевого конгломерата
Источники:
- American Cancer Society. Colorectal cancer. Available at: https://www.cancer.org/cancer/colon-rectal-cancer.html. Accessed June 5, 2018.
- World Health Organization, International Agency for Research on Cancer. GLOBOCAN 2012: Estimated cancer incidence, mortality, and prevalence worldwide in 2012. Cancer fact sheets. Available at: http://globocan.iarc.fr/Pages/fact_sheets_cancer.aspx. Accessed June 5, 2018.
- National Cancer Institute. Surveillance, Epidemiology, and End Results (SEER) Program. Cancer Stat Facts: Colon and Rectum Canc Accessed June 5, 2018.
- Cagir B, Ologun GO, Trostle DR. Rectal cancer. Medscape Drugs & Diseases from WebMD. Updated May 31, 2018. Available at: http://emedicine.medscape.com/article/281237-overview. Accessed June 5, 2018.
- National Cancer Institute. Rectal cancer treatment–for health professionals (PDQ). General information about rectal cancer. Updated: June 7, 2018. Available at: http://www.cancer.gov/types/colorectal/hp/rectal-treatment-pdq. Accessed August 1, 2018.
- National Cancer Institute. Colon cancer treatment–for health professionals (PDQ). Treatment option overview for colon cancer. Updated: April 6, 2018. Available at: http://www.cancer.gov/types/colorectal/hp/colon-treatment-pdq#section/_45. Accessed August 1, 2018.
- Dragovich T, Tsikitis VL. Colon cancer. Medscape Drugs & Diseases from WebMD. Updated July 31, 2018. Available at: http://emedicine.medscape.com/article/277496-overview. Accessed May 25, 2017.
- Carvalho B, Sillars-Hardebol AH, Postma C, et al. Colorectal adenoma to carcinoma progression is accompanied by changes in gene expression associated with ageing, chromosomal instability, and fatty acid metabolism. Cell Oncol (Dordr). 2012 Feb;35(1):53-63. PMID: 22278361
- American Cancer Society. Colorectal Cancer Facts & Figures 2017-2019. Available at: https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/colorectal-cancer-facts-and-figures/colorectal-cancer-facts-and-figures-2017-2019.pdf. Accessed August 1, 2018.
- National Cancer Institute. Genetics of colorectal cancer (PDQ). Updated: June 13, 2018. Available at: http://www.cancer.gov/types/colorectal/hp/colorectal-genetics-pdq. Accessed August 1, 2018.
- Colussi D, Brandi G, Bazzoli F, Ricciardiello L. Molecular pathways involved in colorectal cancer: implications for disease behavior and prevention. Int J Mol Sci. 2013 Aug 7;14(8):16365-85. PMID: 23965959
- Tobias J, Hochhauser D. Cancer and Its Management. 7th ed. Chichester, West Sussex, UK: John Wiley & Sons, Ltd; 2015: chapter 16.
- Porth C. Disorders of gastrointestinal function. Essentials of Pathophysiology: Concepts of Altered Health States. 3rd ed. Philadelphia, PA: Wolters Kluwer Health/Lippincott Williams & Wilkins: 2011; chapter 29.
- Hamilton SR, Vogelstein B, Kudo S, et al. Tumours of the colon and rectum. In: Hamilton SR, Aaltonen LA, eds. World Health Organization Classification of Tumours: Pathology and Genetics of Tumours of the Digestive System. Lyon, France: IARC Press; 2000: chapter 6.
- National Comprehensive Cancer Network (NCCN). Clinical practice guidelines in oncology (NCCN guidelines): colon cancer. Version 2.2018 — March 14. Available at: http://www.nccn.org/professionals/physician_gls/pdf/colon.pdf. Accessed August 1, 2018.
- National Comprehensive Cancer Network (NCCN). Clinical practice guidelines in oncology (NCCN guidelines): rectal cancer. Version 2.2018 — June 27, 2018. Available at: http://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf. Accessed August 1, 2018.
- US Preventive Services Task Force. Colorectal Cancer: Screening. Release date: June 2016 https://www.uspreventiveservicestaskforce.org/Page/Document/UpdateSummaryFinal/colorectal-cancer-screening2. Accessed August 1, 2018.
- National Comprehensive Cancer Network (NCCN). Clinical practice guidelines in oncology (NCCN guidelines): colorectal cancer screening. Version 1.2018 — March 26, 2018. Available at: http://www.nccn.org/professionals/physician_gls/pdf/colon.pdf. Accessed August 1, 2018.
- American Cancer Society. American Cancer Society recommendations for colorectal cancer early detection. Revised May 30, 2018. Available at: http://www.cancer.org/cancer/colonandrectumcancer/moreinformation/colonandrectumcancerearlydetection/colorectal-cancer-early-detection-acs-recommendations. Accessed August 1, 2018.
- National Comprehensive Cancer Network (NCCN). Clinical practice guidelines in oncology (NCCN guidelines): Genetic/familial high-risk assessment: colorectal. Version 1.2018 — July 12, 2018. Available at: http://www.nccn.org/professionals/physician_gls/pdf/genetics_colon.pdf. Accessed August 1, 2018.
- National Cancer Institute. Metastatic cancer. Updated February 6, 2017. Available at: http://www.cancer.gov/about-cancer/what-is-cancer/metastatic-fact-sheet. Accessed August 1, 2018.
- Hugen N, van de Velde CJ, de Wilt JH, Nagtegaal ID. Metastatic pattern in colorectal cancer is strongly influenced by histological subtype. Ann Oncol. 2014 Mar;25(3):651-7. PMID: 24504447
- Sammartino P, Sibio S, Biacchi D, et al. Prevention of peritoneal metastases from colon cancer in high-risk patients: preliminary results of surgery plus prophylactic HIPEC. Gastroenterol Res Pract. 2012;2012:141585. PMID: 22645605
- Brucher B, Stojadinovic A, Bilchik A, et al. Patients at risk for peritoneal surface malignancy of colorectal cancer origin: the role of second look laparotomy. J Cancer. 2013;4(3):262-9. PMID: 23459716
- AJCC Cancer Staging Manual 8th Edition
- Koskenvuo L. et al. Sex differences in faecal occult blood test screening for colorectal cancer // British Journal of Surgery. – 2018, https://onlinelibrary.wiley.com/doi/10.1002/bjs.11011
- Park S. Y. et al. Alcohol Intake and Colorectal Cancer Risk in the Multiethnic Cohort Study // American journal of epidemiology. – 2019. – Т. 188. – №. 1. – С. 67. https://doi.org/10.1093/aje/kwy208
- Злокачественные новообразования в России в 2017 году
(заболеваемость и смертность) под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. илл. 250 с. ISBN 978-5-85502-243-8.
