Эмпиема плевры. История, патофизиология и диагностика
Торакальная хирургия, как и любая другая, сталкивается с инфекцией. И если для абдоминальных хирургов частой проблемой является перитонит, то для «торакальщиков» головной болью является скопление гноя в плевральной полости — эмпиема плевры. Заболевание также называют гнойным плевритом.
В США ежегодно наблюдается около 60 000 случаев эмпиемы плевры. Они возникают или самостоятельно (первичная эмпиема), или в связи с появлением у больного пневмонии различной этиологии.
Эмпиема плевры значительно уменьшает дыхательный объем легких и поддается только хирургическому лечению. Потому для торакального хирурга эта нозология имеет исключительную важность.
Сегодня расскажем об истории и патофизиологии. В следующей статье уже остановимся на тактике ведения больных с эмпиемой плевры.
Историческая справка
Впервые гнойное поражение плевры было описано Гиппократом в 500 г. до н.э. Несмотря на столь раннее описание болезни, адекватного дренирования плевральной полости и лечения гнойного плеврита не существовало вплоть до ХХ века, пока не была разработана тактика ведения больных с эмпиемой.
Появление антибиотиков уменьшило частоту возникновения эмпиемы и изменило ее бактериологию. До антибиотикотерапии инфекции в 60–70 % случаев были вызваны Streptococcus pneumoniae. Сейчас на долю этого инфекционного агента приходится около 10 % случаев. Вместо этого повысилась распространенность Staphylococcus aureus, а развитие устойчивости к стафилококку в 1950-х годах усилило осложнения и смертность. Также возросла распространенность анаэробных инфекций и грамотрицательных организмов.
Одним из последних достижений в лечении эмпиемы плевры (и многих других болезней торакального профиля) стало внедрение видеоассистированных торакальных операций (VATS).
Возникновение эмпиемы плевры представляет собой прогрессирующий процесс, который превращает жидкий саморассасывающийся парапневмонический плевральный выпот в сложную многоцелевую фибринозно-гнойную жидкость. Потому важно разобраться в нормальной физиологии плевральной жидкости.
Нормальная физиология плевральной жидкости
В норме объем плевральной жидкости у людей невелик (< 1 мл). Она образует пленку толщиной около 10 мкм между висцеральной и париетальной плевральными поверхностями. Плевральная жидкость содержит белок в концентрациях, аналогичных интерстициальной жидкости, небольшое количество клеток (преимущественно мезотелиальные клетки, макрофаги и лимфоциты) и некоторые белки с большой молекулярной массой (например, лактатдегидрогеназа — ЛДГ). По сравнению с сывороткой крови плевральная жидкость в здоровом состоянии содержит более высокие уровни бикарбоната, более низкие уровни натрия и аналогичные уровни глюкозы. Эти параметры изменяются, когда патологические процессы, затрагивающие соседнее легкое или сосудистую ткань, вызывают иммунный ответ.
Вода и небольшие молекулы свободно проходят между мезотелиальными клетками, в то время как более крупные частицы могут транспортироваться с помощью цитоплазматических транспортных механизмов или через плевролимфатическую связь.*
*Плевролимфатическая связь плохо изучена, но, предположительно, состоит из ряда стом в отдельных областях плевры, покрывающих соединительную ткань, и ряда расширенных лимфатических каналов с регулирующими клапанами.
Патогенез эмпиемы плевры
Развитие эмпиемы проходит несколько стадий: от простого экссудата к фибринозно-гнойной стадии, а затем к стадии организации с образованием рубцовой ткани.
На ранней экссудативной стадии происходит движение жидкости в плевральное пространство из-за повышенной проницаемости капиллярных сосудов, сопровождающееся выработкой провоспалительных цитокинов. Они вызывают активные изменения в клетках плевральной мезотелиальной ткани, способствующие проникновению жидкости в плевральную полость. Первоначально жидкость представляет собой свободно текущий экссудат, характеризующийся низким содержанием лейкоцитов, уровнем лактатдегидрогеназы (ЛДГ) в два раза более низким, чем в сыворотке крови, нормальным уровнем рН и глюкозы, и не содержит бактериальных организмов. Лечение антибиотиками на этой стадии, вероятно, будет достаточным, и большинство таких случаев не требуют установки дренажа в плевральную полость.
Парапневмонические выпоты в экссудативной стадии прогрессируют до фибринозно-гнойной стадии с увеличением скопления жидкости и бактериальной инвазией через поврежденный эндотелий. Бактериальная инвазия ускоряет иммунную реакцию, способствуя дальнейшей миграции нейтрофилов, а также активации коагуляционного каскада, что приводит к усилению прокоагулянтной и подавлению фибринолитической активности. Это способствует отложению фибрина и позволяет сформироваться перегородкам внутри жидкости. Фагоцитоз нейтрофилов и гибель бактерий способствуют воспалительному процессу: высвобождается большое количество протеаз из клеточной стенки бактерий. Все это приводит к увеличению продукции молочной кислоты, повышению уровня ЛДГ (из-за гибели лейкоцитов) и изменению других биохимических показателей фибринозно-гнойного вещества (рН < 7,20, глюкоза < 2,2 ммоль/л).
Организационная стадия следует за пролиферацией фибробластов. Поскольку твердая рубцовая ткань заменяет собой мягкий фибрин, адекватное расширение легочной ткани становится невозможным. Это ухудшает функцию легких и создает очаг в плевральной полости с сохраняющимся потенциалом для развития инфекции.
Бактериология
Наиболее часто встречаются грамположительные организмы из вида стрептококковых, в том числе группа организмов S. milleri и S. aureus. S aureus часто наблюдается у пациентов, перенесших травму и хирургическое вмешательство. Грамотрицательные микроорганизмы также являются часто встречающимися аэробными бактериями при плевральной инфекции: в эту группу входят Escherichia coli, Pseudomonas spp, Haemophilus influenzae и Klebsiella spp. Эти организмы обычно являются частью смешанного роста с другими грамотрицательными организмами или анаэробами и редко встречаются в изоляции.
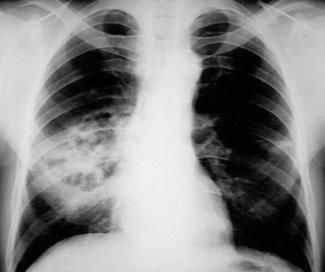
Пневмококковая пневмония, осложнившаяся некрозом и абсцессом легкого. Источник: Medscape.
Анаэробные агенты могут присутствовать в 76 % случаев. Анаэробы вызывают эмпиему без других сопутствующих аэробных микроорганизмов примерно в 14 % случаев с положительными результатами посева. Анаэробная инфекция часто имеет нетипичное клиническое начало: с субфебрильной лихорадкой и постепенной потерей веса.
Лучевая диагностика
Плевральный выпот может быть выявлен на обзорной рентгенограмме органов грудной клетки. Эмпиему следует подозревать у пациентов, организм которых не отвечает на соответствующую антибактериальную терапию.
Ультразвуковое сканирование является предпочтительным методом исследования. Оно дает возможность точно определить местонахождение любого скопления жидкости и помогает наметить точку для проведения диагностической аспирации. Иногда плевральная инфекция возникает из-за разрыва пищевода. Этот диагноз следует подозревать у пациентов, у которых развивается плевральный выпот вскоре после многократной рвоты. При обнаружении патологического сброса из пищевода (применяется рентгеноскопия с контрастным веществом) необходимо незамедлительно направить больного к хирургу, имеющему опыт лечения разрывов пищевода.
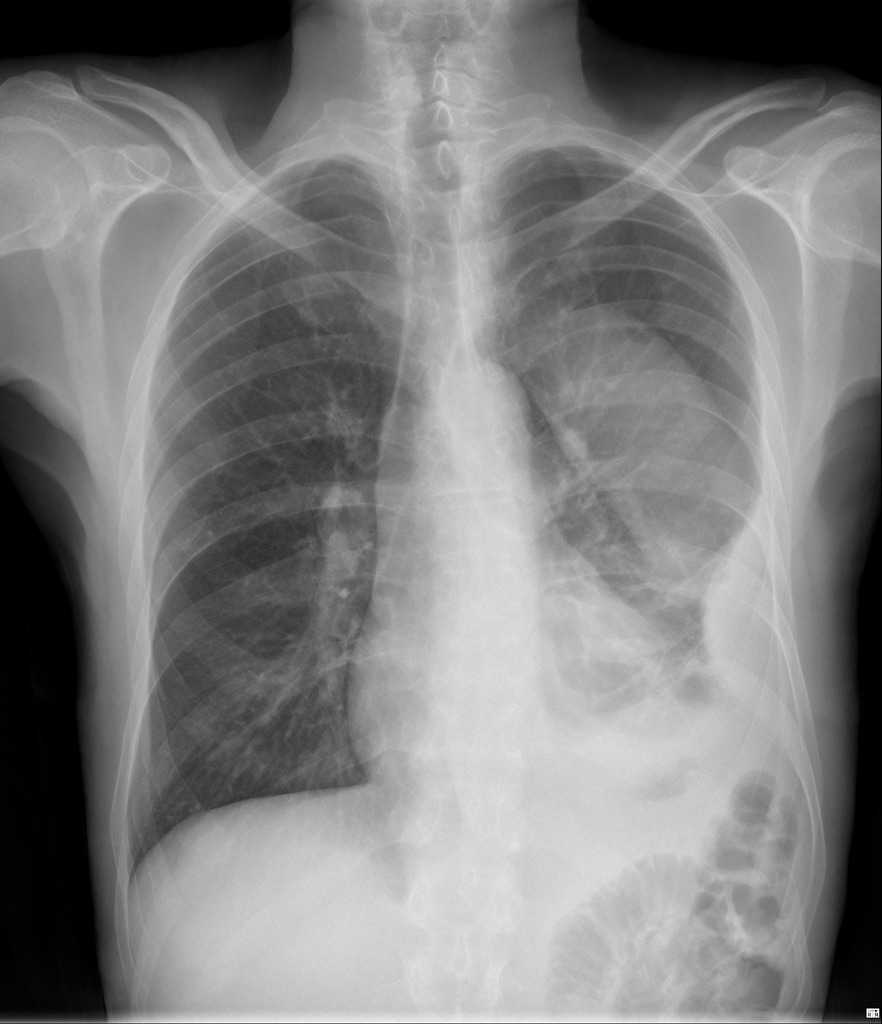
Осумкованный плевральный выпот слева с распространением по косой междолевой щели. Источник: Radiopedia.
В случае возникновения диагностических трудностей необходимо провести компьютерную томографию с контрастированием. КТ-сканирование с использованием контрастного вещества может помочь дифференцировать эмпиему плевры от абсцесса легкого. Эмпиемы обычно имеют линзовидную форму и сдавливают паренхиму легкого, в то время как абсцессы легкого часто имеют нечеткую границу и не оказывают значительного влияния на окружающую легочную ткань. Также при эмпиеме плевры наблюдается диагностический признак «расщепленной плевры» — визуализация на КТ утолщенных париетальной и висцеральной плевральных листков.
Источники
- Strange C, Sahn SA. The clinician’s perspective on parapneumonic effusions and empyema. Chest 1993;103:259–61. [IIb]
- Sahn SA. Management of complicated parapneumonic effusions. Am Rev Respir Dis 1993;148:813–7. [IV]
- Ferguson AD, Prescott RJ, Selkon JB, et al. Empyema subcommittee of the Research Committee of the British Thoracic Society. The clinical course and management of thoracic empyema. Q J Med 1996;89:285–9. [III]
- Heffner JE, McDonald J, Barbieri C, et al. Management of parapneumonic effusions. An analysis of physician practice patterns. Arch Surg 1995;130:433–8. [III]
- Light RW, MacGregor MI, Ball WCJ, et al. Diagnostic significance of pleural fluid pH and PCO2. Chest 1973;64:591–6. [IIb]
- Matsumoto AH. Image guided drainage of complicated pleural effusions and adjunctive use of intrapleural urokinase. Chest 1995;108:1190–1. [III]
- Parmar JM. How to insert a chest drain. Br J Hosp Med 1989;42:231–3. [IV]
- Wait MA, Sharma S, Hohn J, et al. A randomized trial of empyema therapy. Chest 1997;111:1548–51. [Ib]
