Мозг в банке

Излюбленный образ ученого, окруженного мозгами в банках, наконец-то сошел со страниц научной фантастики. Нет, Ми-го не прилетели с Юггота. Межуниверситетская группа исследователей из США разработала и воплотила в жизнь систему BrainEx (BEx), позволившую не только провести нормотермическое восстановление микроциркуляции и некоторых молекулярно-клеточных функций мозга спустя четыре часа после остановки, но и проводить функциональные нейрофизиологические исследования ex vivo недостижимого уровня качества, ограниченные ранее статичными методиками.
Технология представляет собой перфузионную систему, осуществляющую циркуляцию контрольного перфузата (КП), либо BEx-перфузата в условиях физиологической пульсации. Перфузаты не содержат клеток, что позволило добавить в них эхогенные частицы для сонографического контроля их динамики. Характеристики пульсовой волны можно настроить в пределах 20–40 mm Hg и 40–180 пульсаций в минуту, а температуру перфузата можно регулировать от 3 до 42°C. Более того, платформа поддерживает гомеостаз органа с помощью гемодиафильтрации и оксигенации перфузата.
Также учеными была разработана процедура хиругической эксцеребрации мозга домашней свиньи (Sus scrofa domesticus) и его сосудов выше medulla oblongata. После четырехчасового post-mortem интервала, каротидные артерии были подключены к устройству еще шесть часов.
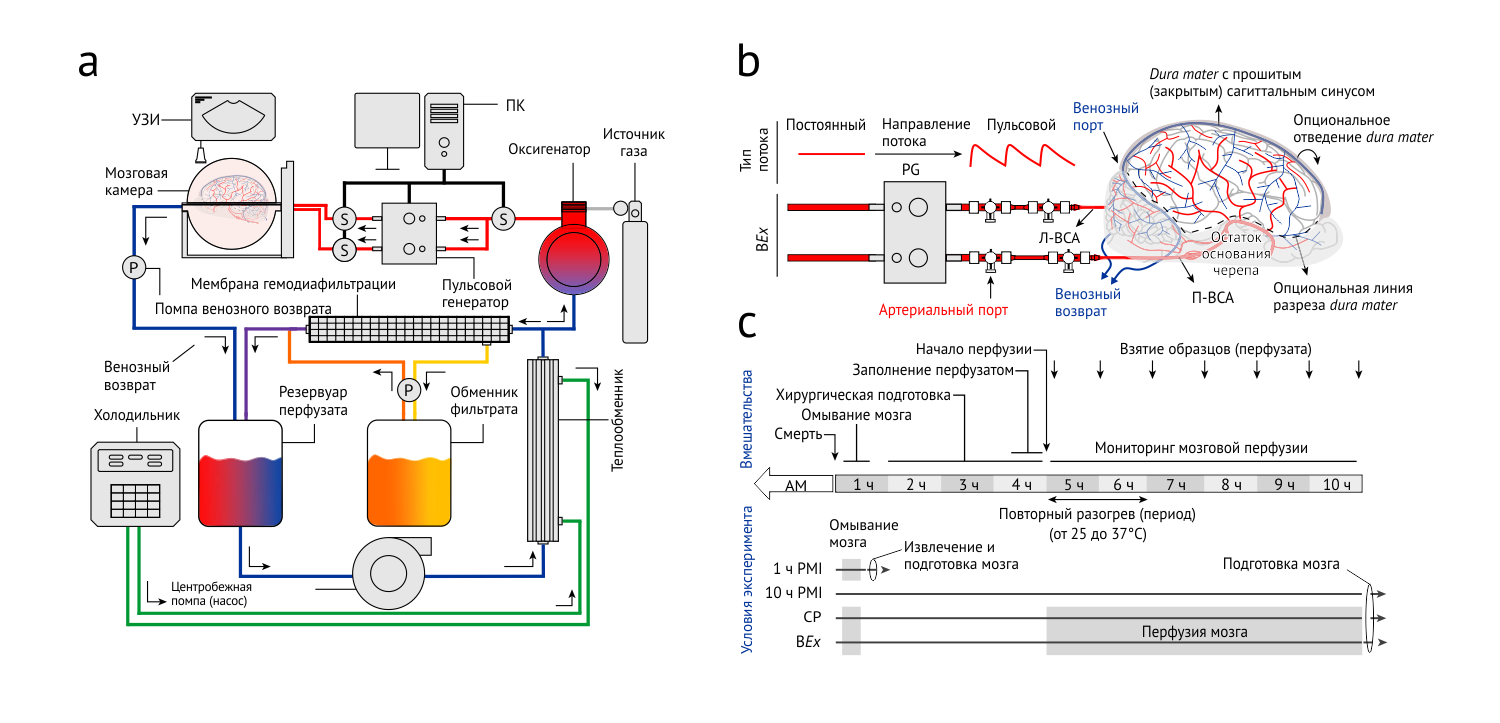
Рисунок 1 | Система BEx и ход эксперимента
А. Упрощённая схема перфузионного устройства с замкнутым контуром. S, сенсор, P, помпа.
B. Подключение свиного мозга к перфузионной системе посредством артерий. Пульсовой генератор (PG) создаёт из постоянного потока пульсовые волны. Показаны порты для взятия образцов перфузата. В данном эксперименте твердая мозговая оболочка может быть отведена медиально, для осуществления доступа к мозгу; была проведена хирургическая подготовка мостиковых корковых вен, для сохранения их интактности. П-ВСА и Л-ВСА, правая и левая внутренние сонные артерии.
С. Схематическое изображение хода и условий эксперимента. PMI, post-mortem interval (после смерти), AM, ante-mortem (перед смертью), CP, контрольный перфузат.
Само исследование включало четыре контрольные группы:
- перфузия КП;
- перфузия BEx-перфузатом;
- контроль без перфузии мозга in cranio после десяти часов;
- контроль интактного «промытого» мозга без перфузии после часа.
Эксперимент показал, что использование BEx-перфузата на основе гемоглобина, лишенного способности к коагуляции, позволяет спасти мозг от последствий аноксии, реперфузионных повреждений и остановить отек ткани, в то же время обеспечивая его энергетические нужды. Данная система позволила наблюдать сохранность цитоархитектоники, затухание процесса клеточной гибели, восстановление вазопрессорной активности сосудистых клеток и глиального воспалительного ответа, спонтанную синаптическую активность и клеточный метаболизм в отсутствие общей электрокортикографической активности мозга. Последнее, видимо, было условием возможности данного эксперимента. Вряд ли нашелся бы этический комитет, который мог бы одобрить такое исследование на «интактном сознании», пусть и животного. Все эти явления подтверждают беспрецедентную способность к восстановлению микроциркуляторной, молекулярной и клеточной активности изолированного интактного мозга крупного млекопитающего после длительного посмертия при подходящих условиях.
УЗ-допплерография подтвердила наличие полноценной гемодинамики, отвечающей на введение нимодипина (антагонист кальциевых каналов) и временное перекрытие венозного кровотока. T1-МРТ в условиях BEx-перфузии показало интактность нейроанатомических структур, выражающуюся в нормальном размере желудочков, сохранении контрастности между серым и белым веществом и четкой разграниченности прочих анатомических ориентиров и сохранности их размеров, в отличие от контрольных групп.
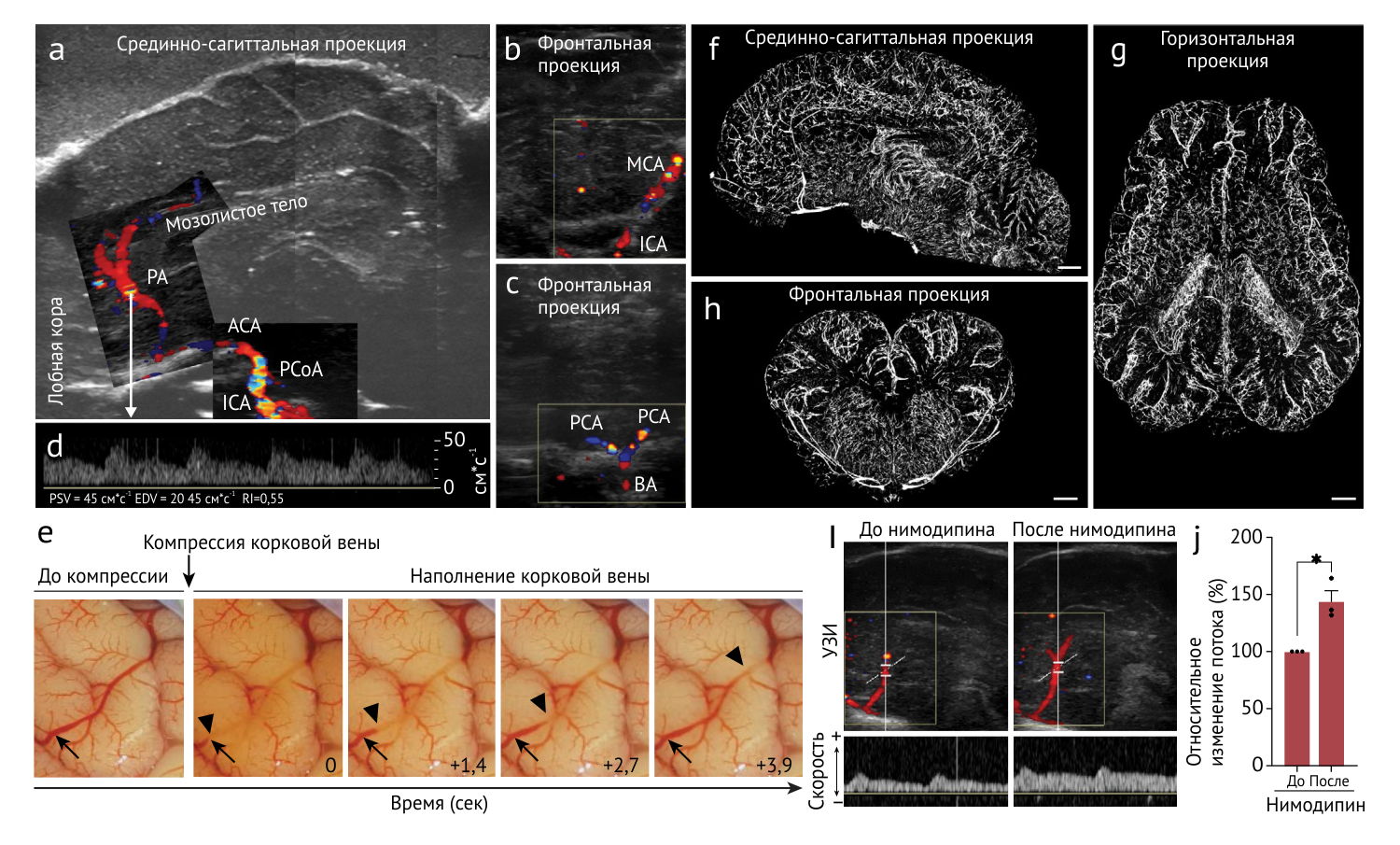
Рисунок 2 | Восстановление микроциркуляции и сократительной способности сосудов
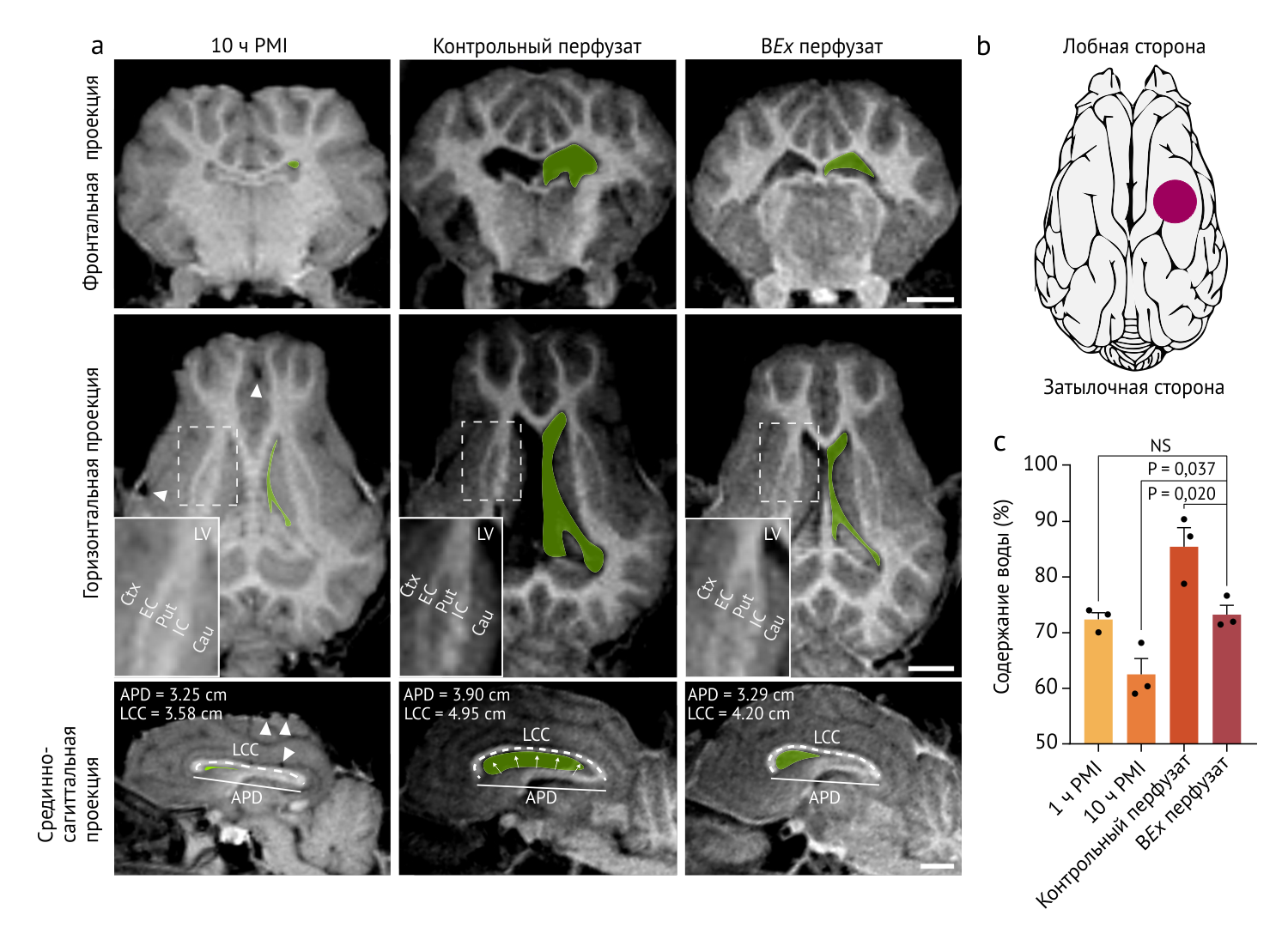
Рисунок 3 | МРТ мозга
К сожалению, гистологическое исследование ультраструктуры поля CA1 гиппокампа, особо чувствительного к сосудистым катастрофам, выявило наличие признаков вакуолизации, цитоплазматического лизиса и повреждения мембран во всех группах. Впрочем, митохондрии в условиях BEx-перфузии оказались интактны. Большинство нейронов также оказались интактными, в отличие от мозга после 1 часа post-mortem. Перфузат также содержал антиапоптотические агенты, эффективность воздействия которых была оценена с помощью локализации активированной каспазы-3. Все контрольные группы продемонстрировали увеличение процента позитивных на actCASP3 ядер.
Окраска на астроцитарные и микроглиальные маркеры (GFAP и IBA1) показала сходные результаты с мозгом после 1 часа post-mortem в отличие от остальных групп, что свидетельствует в пользу сохранности данных структур. Ранние исследования показали, что введение липополисахарида in vivo (агониста TLR-4 и иммуногенного агента) в неокортекс приводит к активации глии и высвобождению провоспалительных цитокинов [1,2]. Для проверки воспалительной активности этот липополисахарид был введен в префронтальную кору мозга с BEx-перфузией, контрольной перфузией и мозга после контрольного десятичасового отсутствия перфузии. В первом случае наблюдалось значимое увеличение количества ИЛ-1α, ИЛ-1β, ИЛ-6 и ИЛ-8. Эти наблюдения указывают не только на интактность глиальных структур, но и на их функциональную полноценность.
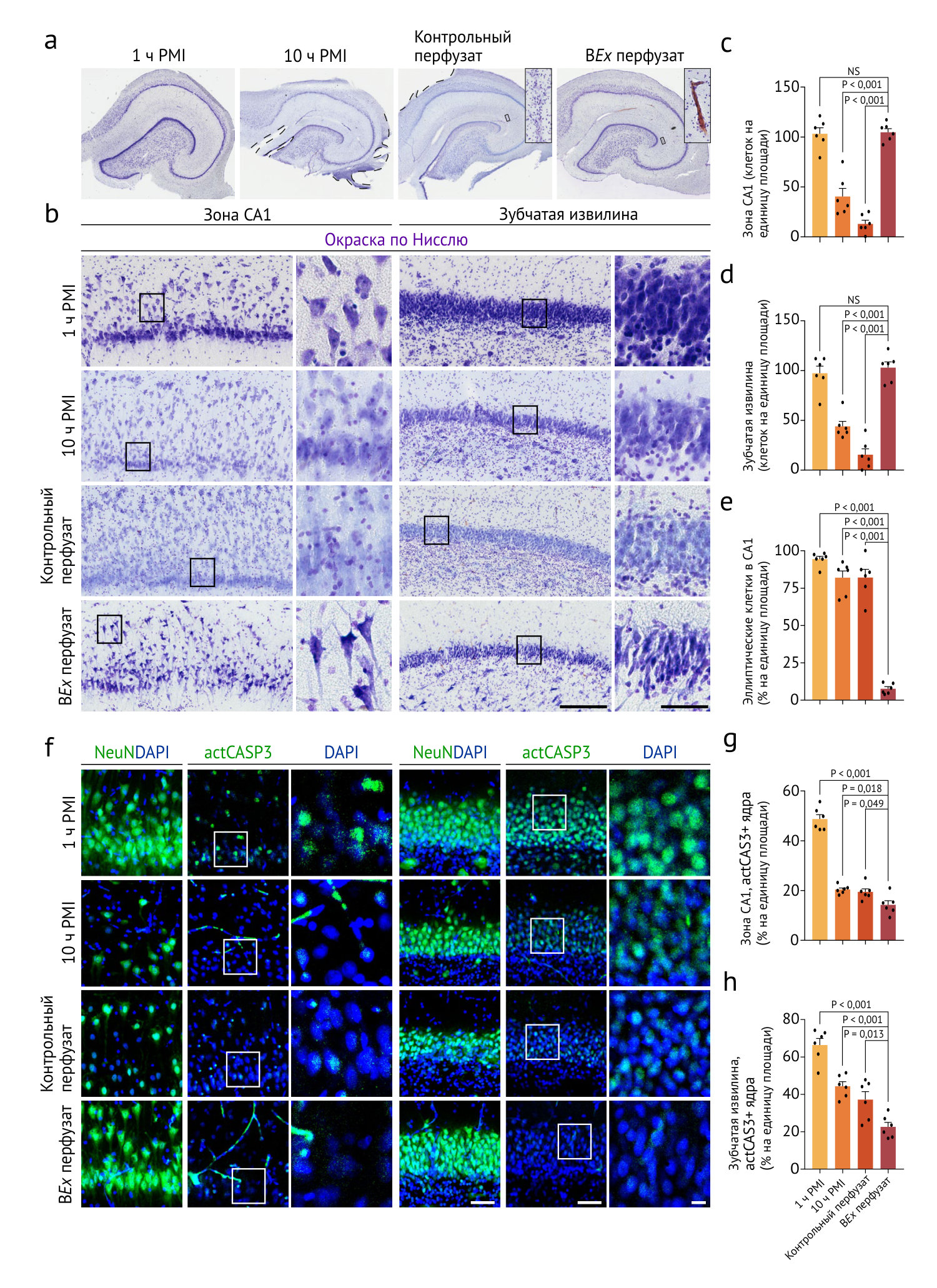
Рисунок 4 | Анализ цитоархитектурной целостности, нейронов и активации каспазы 3
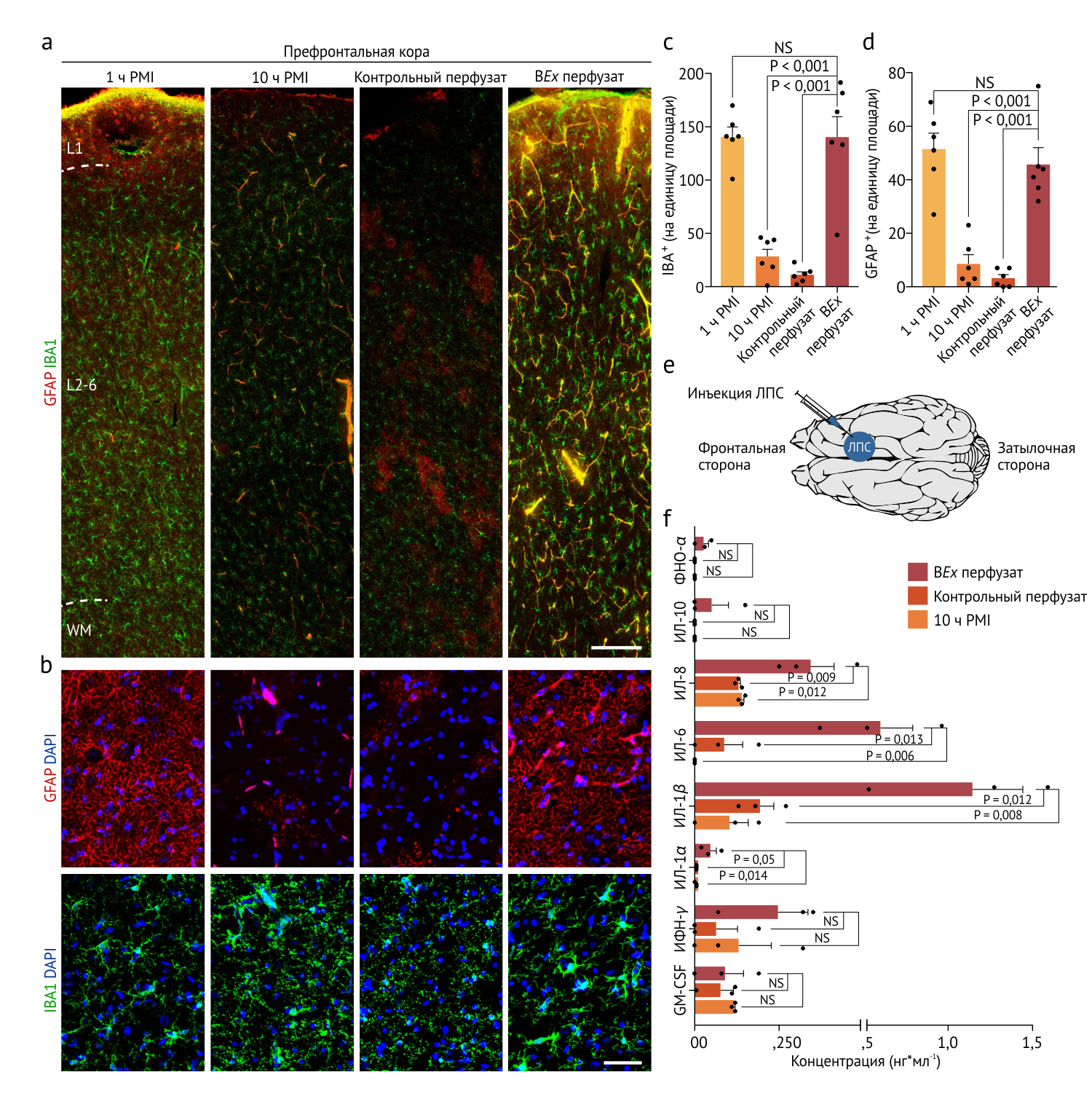
Рисунок 5 | Анализ глии и воспалительного ответа
Электронная микроскопия гиппокампа указала на сохранность пресинаптической везикулярной структуры в сравнении со всеми контрольными группами. Тесты с электрической активностью клеток продемонстрировали постоянство во времени емкости нейронов Cm = 125 ± 43 pF, входного сопротивления Rin = 195 ± 63 MΩ, постоянной времен τm = 32,3 ± 8,4 ms (периода, спустя который потенциал действия падает до потенциала покоя), и потенциала покоя Vm = −71,2 ± 7,0 mV [3]. Организация и/или суммация синаптической активности отдельных нейронов была неадекватна, чтобы быть зарегистрированной с помощью электрокортикографии (интракраниальный вариант ЭЭГ)
Сравнивая образцы венозного и артериального перфузата в экспериментальной группе в течение всего эксперимента, обнаружился физиологический артериовенозный градиент концентрации глюкозы, кислорода, двуокиси углерода и pH [4]. Расчетный показатель расхода кислороды и глюкозы на 100 г массы составил около 2 мл/мин и 6,5 г/мин соответственно, а расчетный артериовенозный градиент лактата — 1 ммоль/л. Более того, венозная концентрация ионов натрия и калия пришла в физиологическую норму спустя 1 час перфузии, возможно указывая на восстановление Na+/K+ гомеостаза
Все эти результаты потрясают. Они явно указывают на то, что смерть мозга — длительный и последовательный процесс, не ограниченный единовременным моментом времени. А это означает, что в соответствующих условиях мозговая ткань менее деликатна, чем мы раньше представляли, а значит возможны такие вмешательства, которые позволят расширить терапевтическое окно при различных сосудистых катастрофах. Сама технология тоже удивительна. Ранее мы были ограничены живыми животными и определенной исследовательской рутиной, допускающей достаточно узкий круг вмешательств. В данном же случае мы получили готовую платформу для нейрофизиологических и фармакологических исследований, открывающую огромное количество недоступных ранее способов изучения мозга, в том числе в режиме реального времени. Разумеется, еще очень далеко до вархаммеровских сервочерепов или киборгов, управляемых мозгом животного. Да и такая задача вряд ли стояла перед исследователями. Но мы определенно приблизились к новым возможностям для нейрореанимации — камнем преткновения современной реаниматологии и неврологии. Также, возможно, данная технология может быть использована в будущем для сохранения мозга, вместо крионики, впивающей микрокристаллы льда в ткани при последующей разморозке. Но каково будет видеть такой «живой мозг» в банке?
Источники:
- Shin, W. H. et al. Microglia expressing interleukin-13 undergo cell death and
contribute to neuronal survival in vivo. Glia 46, 142–152 (2004). - Park, K. W., Lee, H. G., Jin, B. K. & Lee, Y. B. Interleukin-10 endogenously
expressed in microglia prevents lipopolysaccharide-induced
neurodegeneration in the rat cerebral cortex in vivo. Exp. Mol. Med. 39, 812–819
(2007). - Kowalski, J., Gan, J., Jonas, P. & Pernнa-Andrade, A. J. Intrinsic membrane
properties determine hippocampal differential firing pattern in vivo in
anesthetized rats. Hippocampus 26, 668–682 (2016). https://doi.org/10.1002/hipo.22550. - Lam, T. I. et al. Intracellular pH reduction prevents excitotoxic and ischemic
neuronal death by inhibiting NADPH oxidase. Proc. Natl Acad. Sci. USA 110,
E4362–E4368 (2013).
