Обнаружен новый метод редактирования генома. Кажется, он круче, чем CRISPR

CRISPR, чрезвычайно мощный инструмент для редактирования генома, открытый в 2012 году, все еще нельзя назвать безупречным. Иногда он меняет гены, которые не должны быть изменены, и редактирует генетический материал, взламывая обе цепи двойной спирали ДНК и оставляя клетку “чистить беспорядок” - те самые дефекты, которые ограничивают ее использование в биологических, медицинских и агрохимических фундаментальных исследованиях, а также создают угрозу безопасности в этическом аспекте медицины. Однако новый участник гонки по усовершенствованию CRISPR обещает обойти некоторые из его самых больших недостатков. «Это огромный шаг в правильном направлении», - рассказывает химик Гарвардского университета Джордж Черч (George Church), пионер CRISPR, в научной работе в журнале Nature.
CRISPR (произносится «криспер») означает кластеризованные регулярные межпространственные короткие палиндромные повторы, которые являются отличительной чертой системы бактериальной защиты, с которой и работает технология редактирования генома CRISPR-Cas9. В области инженерии генома термин «CRISPR» или «CRISPR-Cas9» часто используется более свободно для обозначения различных систем CRISPR-Cas9 и -CPF1 (и других), которые могут быть запрограммированы для прицельного редактирования определенных участков генетического кода. С помощью этих систем исследователи могут постоянно модифицировать гены в живых клетках и организмах и в будущем могут сделать возможным исправление мутаций в конкретных точках генома человека для лечения генетически обусловленных заболеваний. В настоящее время доступны другие системы, такие как CRISPR-Cas13, которые нацелены на РНК и предполагают альтернативные пути использования, а также разработаны уникальные характеристики, которые активно используются для чувствительных диагностических инструментов, таких как SHERLOCK. CRISPR были впервые обнаружены у архей, а затем и в бактериях, Франциско Мохикой (Francisco Mojica), ученым из Университета Аликанте в Испании. Он предположил, что CRISPR являются частью бактериальной иммунной системы, защищающей бактерию от вторжения вирусов. Они состоят из повторяющихся последовательностей генетического кода, прерываемых последовательностями «спейсера» - остатками генетического кода от прошлых паразитов. Система служит своего рода генетической памятью, которая помогает клетке обнаруживать и уничтожать возбудителя (так называемый «бактериофаг»), когда они возвращаются. Теория Мохики была экспериментально продемонстрирована в 2007 году группой ученых во главе с Филиппом Хорватом (Philippe Horvath).
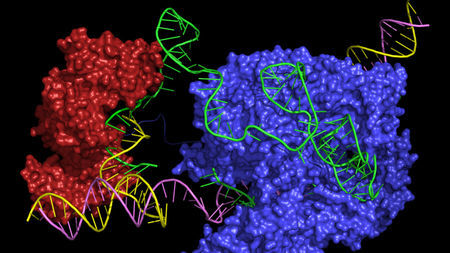
Новый способ модификации ДНК, где «редактор», соединяет два фермента, Cas9 (синий) и обратную транскриптазу (красный), с направляющей РНК (зеленый), которая доставляет комплекс в определенное место на двойной спирали ДНК (желтый и фиолетовый), а также содержит код для вставки нового фрагмента ДНК в этом месте.
В январе 2013 года лаборатория Фэн Чжан (Feng Zhang) опубликовала первый протокол работы с CRISPR с целью редактирования генома в клетках мыши и человека. Спейсерные последовательности CRISPR транскрибируются в короткие последовательности РНК («CRISPR RNAs» или «crRNAs»), способные направлять систему в соответствии с последовательностями ДНК. Когда целевая ДНК обнаружена, Cas9 - один из ферментов, вырабатываемых системой CRISPR - связывается с ДНК и разрезает ее, отключая целевой ген. Используя модифицированные версии Cas9, исследователи могут активировать экспрессию генов вместо разрезания ДНК. Эти методы позволяют исследователям изучать функцию конкретно заданного гена. Исследования также показывают, что CRISPR-Cas9 может использоваться для и модификации ошибок в последовательности из трех миллиардов оснований в геноме человека в целях лечения определенного генетического заболевания. CRISPR-Cas9 оказывается эффективной и, что немаловажно, способной к настраиванию альтернативой другим существующим инструментам редактирования генома. Поскольку сама система CRISPR-Cas9 способна разрезать нити ДНК, нет необходимости в сочетании CRISPR с отдельными расщепляющими ферментами, как это делают при работе с другими протоколами. Они также могут быть легко сопоставлены с индивидуальными «направляющими» последовательностями РНК, предназначенными для того, чтобы привести их к соответствующим ДНК-мишеням. Десятки тысяч таких последовательностей РНК уже созданы и доступны для ученого сообщества и исследователям по всему миру. CRISPR-Cas9 также может использоваться для одновременного нацеливания на несколько генов, что является еще одним преимуществом, отличающим его от других инструментов редактирования генов.
CRISPR-Cpf1 отличается несколькими важными способами от ранее описанного Cas9, что имеет значительные последствия для исследований и терапии. Во-первых, в своей естественной форме ДНК-режущий фермент Cas9 образует комплекс с двумя небольшими РНК, обе из которых необходимы для активности процесса “нарезки”. Система Cpf1 более проста, так как для нее требуется только одна РНК. Фермент Cpf1 также меньше стандартного SpCas9, что облегчает его доставку в клетки и ткани. Во-вторых, и, что возможно, наиболее важно, Cpf1 режет ДНК иным способом, чем Cas9. Когда комплекс Cas9 разрезает ДНК, он разрезает обе цепи в одном и том же месте, оставляя «тупые концы», которые часто подвергаются мутациям, после того как они воссоединяются. С комплексом Cpf1 разрезы в двух нитях смещены, оставляя короткие выступы на открытых концах. Ожидается, что это поможет с точной вставкой, что позволит исследователям более эффективно и точно интегрировать фрагмент ДНК. В-третьих, Cpf1 отсекает фрагмент на большом расстоянии от сайта распознавания, а это означает, что даже если целевой ген мутирует в месте разреза, он, вероятно, все еще может быть повторно разрезан, что дает множество возможностей для повторного правильного редактирования. В-четвертых, система Cpf1 обеспечивает новую гибкость при выборе целевых сайтов. Как и Cas9, комплекс Cpf1 должен быть сначала присоединен к короткой последовательности, известной как PAM (Protospacer adjacent Motif - последовательность, прилегающая к протоспейсеру), а также следует выбрать мишени, которые соседствуют со встречающимися в природе последовательностями PAM. Комплекс Cpf1 распознает разительно отличающиеся друг от друга последовательности PAM от последовательностей Cas9. Это может быть преимуществом при работе даже с геномом человека.
Редактирование при помощи CRISPR позволяет ученым быстро создавать модели клеток и организмов, которые исследователи могут использовать для ускорения исследований таких процессов, как онкологические или психические заболевания. Кроме того, CRISPR в настоящее время разрабатывается в качестве экспресс-диагностики. Чтобы способствовать развитию такого рода исследований во всем мире, Фэн Чжан и его команда обучили тысячи исследователей использованию технологии редактирования генома CRISPR с помощью прямого обучения и обмена опытом с академическими лабораториями и университетами по всему миру.
CRISPR vs Prime Editing
CRISPR, так громко представленный в 2012 году, по прошествии более чем шести лет интенсивных исследований и улучшений все еще нельзя назвать совершенным. В контексте медицинских исследований работа с CRISPR может допускать этически непозволительные огрехи, вроде как замены тех участков, которые не должны быть изменены.
Новый метод, получивший название «праймированное редактирование», может позволить вставлять или удалять конкретные последовательности в мишенях генома с меньшим количеством побочных эффектов.. «Такие редакторы предлагают большую гибкость таргетинга (определения мишеней) и большую точность редактирования», - говорит Дэвид Лю (David Liu), биохимик из Брод-института в Кембридже, штат Массачусетс, лаборатория которого возглавляла новое исследование и ранее разработала популярное усовершенствование CRISPR, называемое базовым редактированием.
Праймированное редактирование - это самый последний из инструментов, разработанных для устранения ограничений, встречающихся у CRISPR и точной настройки процесса генетического редактирования. Он использует во многом тот же механизм, что и традиционный CRISPR, чтобы точно определять местоположение определенной генетической последовательности и направлять туда молекулярные инструменты. Механизм работы праймированного редактирования (разрезания и репарации) - это то, чем праймированное редактирование действительно отличается от CRISPR. Каждый главный редактор (prime editor, PE) содержит несколько ферментов, соединенных в одну длинную цепь. После того, как главный редактор определяет генетическую мишень, он делает разрез одной нити ДНК, а не двух, как это было раньше при работе с CRISPR. Затем еще одна часть молекулы PE находит только что отсеченный конец ДНК и “удлиняет” его, производя отредактированную последовательность ДНК из имеющейся матрицы. Праймированное редактирование позволяет избежать недостатков обеих техник путем сильной модификации белка Cas9 и направляющей РНК. Измененный Cas9 рассекает только одну часть двойной спирали вместо того, чтобы разрезать обе. Новый тип РНК-гида, названный “pegRNA”, содержит удлиненную РНК-матрицу для новой последовательности ДНК, которая будет добавлена в геном в целевом местоположении. Для этого требуется второй белок, присоединенный к Cas9: фермент обратной транскриптазы, который может сделать новую цепь ДНК из матрицы РНК и вставить ее в необходимый сайт. Обратные транскриптазы получили свою известность в качестве класса ферментов, наиболее известного в роли механизма, посредством которого ретровирусы, такие как вирус иммунодефицита человека, способны интегрироваться в геном клетки-хозяина.
С созданием новой последовательности ДНК, клетка восстанавливается, обрезая старый фрагмент ДНК и запечатывая новый. Когда клетка осознает, что существует несоответствие между отредактированной последовательностью и цепью напротив нее, она отредактирует ранее не измененную цепочку, чтобы обе половины спирали приняли новое изменение. «Это очень элегантная техника, которая имеет довольно широкое применение», - говорит Ле Конг (Le Cong), профессор генетики Стэнфордского университета.
Дэвид Лю, его постдок Эндрю Анзалоне ( Andrew Anzalone) и его коллеги проверили результаты работы своих главных редакторов на нескольких клетках человека и мыши, выполнив более 175 различных правок. В качестве доказательства принципа работы они создали, а затем исправили мутации, которые вызывают серповидно-клеточную анемию и болезнь Тея-Сакса, аберрации ДНК, которые предыдущие системы редактирования генома, такие как CRISPR, либо не могли исправить, либо делали это крайне неэффективно. Изменения произошли в большом проценте случаев и вызвали относительно небольшое количество нецелевых изменений. В своей статье команда утверждает, что технология «в принципе может исправить около 89% известных патогенных генетических аберраций в геноме человека». Большинство систем CRISPR основаны на молекулярном комплексе, соединяющем направляющую РНК, которая размещается в определенном месте в геноме с ферментом Cas9, который разрезает обе цепи ДНК. Во время попыток клетки восстановить ДНК, ее механизм восстановления может вводить или удалять нуклеотиды. Исследователи могут воспользоваться неудачным восстановлением, чтобы выбить гены, которые, скажем, вызывают некое заболевание. Они также могут использовать неэффективный процесс восстановления для добавления ДНК - и даже целого гена. Но двухцепочечные разрывы - это «вандализм генома», как говорит Джордж Черч. Когда клетка пытается восстановить разрыв, она вводит и удаляет вставки и делеции, иногда создавая нежелательные, и даже опасные мутации. Ранняя работа Лю, “базовое редактирование”, не разрезает двухцепочечную ДНК, а вместо этого использует прицельный аппарат CRISPR с целью доставки дополнительного фермента в нужную последовательность, где он заменяет один нуклеотид на другой. Многие генетические заболевания вызваны одним изменением нуклеотидов, поэтому редактирование базы предлагает мощную альтернативу для биотехнологии и медицины.
Однако у этого метода есть ограничения, и он также может становиться причиной нецелевых мутации. Лю, который уже создал компанию по новой технологии “Prime Medicine”, подчеркивает, что, чтобы получить место в наборе инструментов для редактирования, он должен быть надежным и полезным во многих лабораториях. Доставка большой конструкции РНК и ферментов в живые клетки также будет затруднена, и никто еще не доказал, что она может работать в модели на животных. Федор Урнов (Fyodor Urnov), директор Института инновационной геномики в Беркли, Калифорния, рецензирующий соответствующую статью для Nature говорит, что она принесла «один из тех самых -yay, science!- моментов». «Праймированное редактирование вполне может стать способом, благодаря которому будут устранены вызывающие многие заболевания мутации,» - говорит Федор Урнов. Но, добавляет он, еще слишком рано, чтобы быть уверенным. Техника «только что появилась в этом году».
Источники:
- Anzalone, A. V. et al. Nature https://doi.org/10.1038/s41586... (2019).
- Komor, A. C. et al. Nature 533, 420-424 (2016).
- BiologyHealth doi:10.1126/science.aaz9297
