Биологические принципы метастазирования

Метастазы являются причиной большинства случаев смерти от злокачественных опухолей, однако этот сложный процесс остается наименее понятным аспектом биологии канцерогенеза. По мере того как объем исследований, касающихся метастазирования, продолжает расти быстрыми темпами, понимание биологических программ, которые лежат в основе распространения и метастатического роста раковых клеток, появилось только в недавнее время. В этом обзоре мы суммируем клеточные и молекулярные механизмы, вовлеченные в метастазирование, с акцентом на карциномы, поскольку именно в этих опухолях данные процессы наиболее изучены, а также выдвинем на первый план общие принципы метастазирования, о механизмах которых на данном этапе уже можно говорить уверенно.
Другие статьи из серии
1) Hallmarks of Cancer: http://medach.pro/post/885
Знаменитая статья Дугласа Ханахана и Роберта Вайнберга. Её выход ознаменовал переворот в онкологии, так как были предложены шесть ключевых признаков рака: самообеспеченность митогенными сигналами, избегание апоптоза, инвазия в тканях и метастазирование, неограниченный репликативный потенциал, поддерживаемый ангиогенез и нечувствительность к сигналам, подавляющим рост. В том или ином виде все эти шесть признаков присутствуют в любом злокачественном новообразовании.
2) Hallmarks of Cancer. The Next Generation: http://medach.pro/post/895
Спустя 10 лет после выхода оригинала, Дуглас Ханахан и Роберт Вайнберг выпустили продолжение, которое собрало в себя все достижения онкологии за прошедшее время. Предложенные ими признаки не только были подтверждены во множестве исследований, но даже были расширены. Теперь ученые предложили использовать помимо шести признаков рака еще два фактора возникновения и два проявляющихся признака. Отдельное внимание в статье было отведено так называемому микроокружению опухоли, понятие которого было предложено в первой части, вышедшей в 2000 году.
3) Emerging hallmarks of cancer metabolism: http://medach.pro/post/1067
Своего рода спин-офф Hallmarks of Cancer. Но здесь акцент именно на биохимию злокачественных опухолей и более детально обсуждаются вопросы метаболизма, которые поднимались в оригинальных Hallmarks of Cancer
Введение
Количество онкологических заболеваний, возникающих у людей, превышает 200 различных нозологий. Такое разнообразие отражает различия в нормальных клетках, приобретенные соматические мутации, измененные транскрипционные сети и влияние локального тканевого микроокружения. Предпринимались попытки свести эту сложность к набору принципов, называемых «ключевыми признаками рака» (Hallmarks of cancer). Несмотря на значительные успехи в изучении, диагностике и лечении рака, подавляющее большинство пациентов с любым запущенным метастатическим онкологическим заболеванием сталкивается с неизлечимой болезнью, которая (за редким исключением) не поддается современной терапии. Иными словами, подавляющее большинство смертей, связанных с раком (около 90 %), вызвано как раз метастазированием, а не первичными опухолями.
Распространение раковых клеток из первичного очага и последующий рост новых опухолевых колоний в тканях — это многоступенчатый процесс, известный как метастатический каскад. Эта последовательность событий включает в себя локальную инвазию первичных опухолевых клеток в окружающие ткани; интравазацию этих клеток и их внедрение в систему кровообращения (важно также выживание клеток при гематогенном транзите); остановку и экстравазацию через стенки сосудов в паренхиму отдаленных тканей; образование микрометастатических колоний в этой паренхиме; последующий рост микроскопических колоний до размеров выявляемых клинически метастатических очагов (последний процесс называют колонизацией). Патогенетические механизмы, приводящие к первичному образованию опухоли, изучены подробно, этому посвящено большое количество исследований, тогда как биологические основы метастазирования остаются плохо изученными. Кроме того, существует относительно немного принципов, которые бы обобщали наше понимание того, как возникают различные типы метастазов, а также объясняли закономерности «поведения» этих типов и связь с «поведением» первичной опухоли. Тем не менее за последние 15 лет был достигнут значительный прогресс в освещении различных аспектов реализации метастатической программы, особенно в отношении карцином, которые в совокупности составляют 80 % случаев злокачественных опухолей и, таким образом, являются причиной большинства случаев смертей от онкозаболеваний.
В данном обзоре мы суммируем важные достижения, которые выявили механизмы, лежащие в основе распространения и метастатического роста клеток карцином. Исходя из этого растущего с каждым годом комплекса исследований, мы предполагаем, что на данный момент начали намечаться некоторые ключевые биологические принципы, которым подчиняются определенные аспекты метастатического каскада, в то время как для других этапов обобщающие положения остаются, к сожалению, менее изученными.
Диссеминация клеток карцином
Процесс диссеминации включает в себя начальные этапы каскада «вторжения-метастазирования», позволяющие клеткам злокачественной опухоли приобретать признаки, которые наделяют их способностью покидать первичный очаг и перемещаться в отдаленные ткани (рис. 1А). В обзоре мы описываем эти процессы в контексте детально изученных карцином. Одним из центральных процессов, обеспечивающих эти этапы, является клеточная биологическая программа, называемая эпителиально-мезенхимальный переход (epithelial-mesenchymal transition — EMT), — программа развития, которая обычно реализуется во время эмбриогенеза (и у взрослых для заживления любых повреждений эпителиальных тканей). Этот механизм используют клетки карцином, что наделяет их множеством злокачественных признаков, связанных с потерей эпителиальных свойств и приобретением вместо них определенных мезенхимальных признаков.
Эпителиально-мезенхимальный переход
Программа EMT наделяет эпителиальные клетки (как нормальные, так и неопластические) свойствами, которые имеют решающее значение для инвазии и метастазирования, такими как повышенная подвижность, инвазивность и способность разрушать компоненты внеклеточного матрикса. Фактически, EMT — это группа клеточно-биологических программ, которые имеют общие черты, но отличаются определенными деталями в зависимости от участка ткани, степени злокачественности и сигнальных путей отдельных опухолевых клеток. Эти сложные программы координируются рядом основных EMT-индуцирующих факторов транскрипции, в частности Snail, Slug, Twist и Zeb1, которые были детально исследованы в экспериментах. Также были описаны другие факторы транскрипции, способные индуцировать компоненты программы EMT, но их роль в патогенезе рака остается менее изученной. Хотя традиционные модели онкогенеза предполагают, что метастазирование является довольно-таки поздним событием в ходе многоэтапного развития опухоли, некоторые исследования показывают, что приобретение EMT-ассоциированных признаков и процесса распространения может в действительности происходить относительно рано, настолько рано, что проявляется даже в некоторых предраковых состояниях.
.
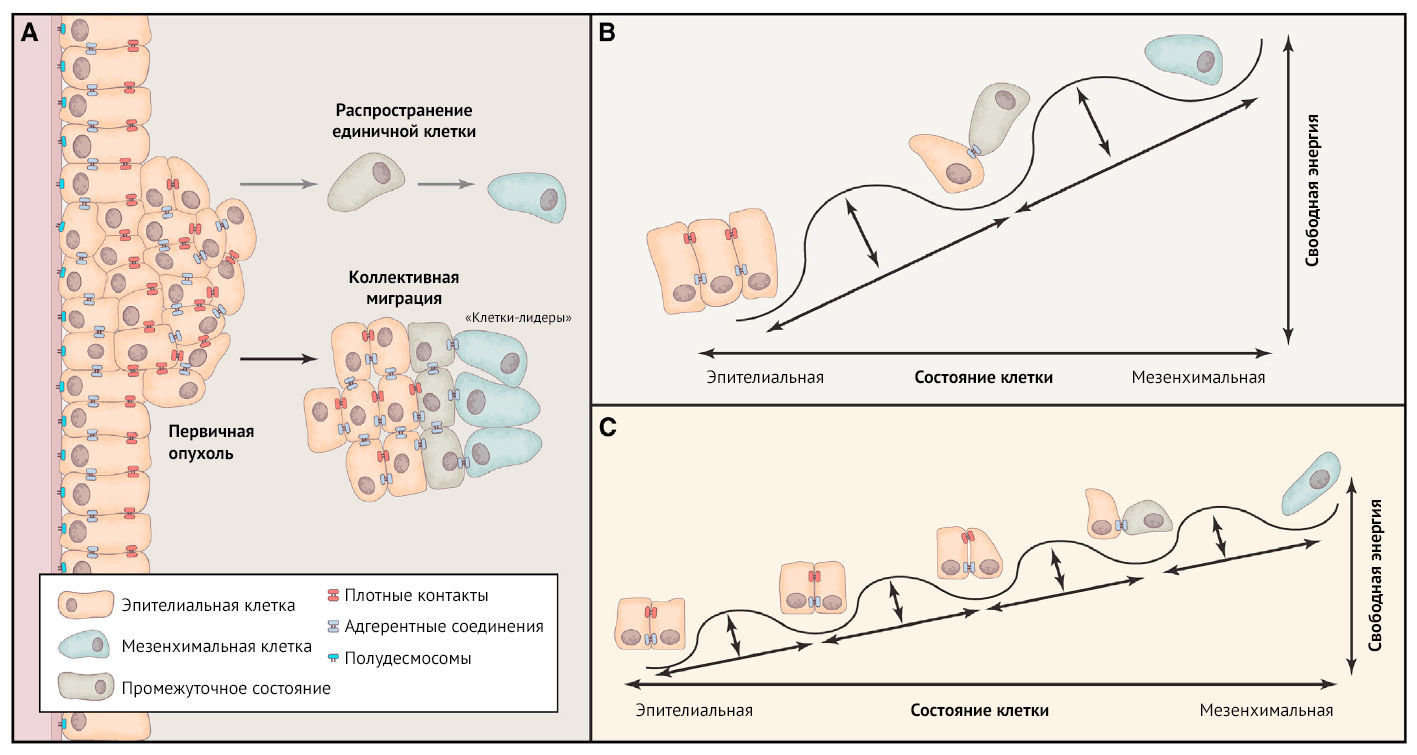
Дополнительное значение имеет тот факт, что клетки некоторых типов карцином приобретают способность инициировать опухоль после индукции программ EMT. Например, клетки рака молочной железы, колоректального рака, рака яичника, поджелудочной железы, предстательной железы и почек, а также некоторых других видов рака. Способность инициировать опухоль, которая обычно выделяется в качестве определяющего признака раковых стволовых клеток (cancer stem cells — CSC), как правило, измеряется при помощи имплантации популяций опухолевых клеток в лабораторных мышей. Такие тесты показывают, что CSC почти всегда присутствуют в виде относительно небольших субпопуляций опухолевых клеток, находящихся в отдельных опухолях среди более крупных популяций раковых клеток, которые не обладают способностью инициировать опухоль.
Пребывание «рассеивающей» клетки карциномы в состоянии CSC, по-видимому, имеет решающее значение для прогрессирования через каскад инвазионного метастазирования, поскольку рассеянные по организму опухолевые клетки должны быть наделены способностью инициировать появление опухоли, чтобы функционировать в качестве основателей новых метастатических колоний. Кроме того, было обнаружено, что приобретение мезенхимальных признаков, обусловленное программой EMT, повышает устойчивость клеток карциномы к различным типам цитотоксического лечения, включая радио- и химиотерапию. Это объясняет такое часто наблюдаемое явление: опухоли с CSC имеют тенденцию быть более устойчивыми к терапии, чем их аналоги без CSC. Хотя программа EMT может быть изображена работающей подобно бинарному переключателю (некий «вкл-выкл»), то есть раковые клетки находятся либо в эпителиальном, либо в мезенхимальном состоянии, на самом деле она гораздо более сложна. Программы EMT, активированные в клетках карциномы, обычно приводят к приобретению определенной мезенхимальной черты, позволяя в то же время сохранить некоторые эпителиальные черты, таким образом, клетки карциномы обладают смешанным эпителиально-мезенхимным фенотипом (рис. 1B и 1C).
Программы EMT, по-видимому, почти всегда запускаются в клетках карциномы гетеротипическими сигналами, которые эти клетки получают от близлежащей опухолевой стромы. Так, в ходе прогрессирования опухоли строма, которая состоит из множества фибробластов, миофибробластов, эндотелиальных, миелоидных и лимфоидных клеток, рекрутированных из тканей хозяина, все чаще приобретает вид стромы, которая обычно образуется во время заживления раненых эпителиальных тканей. Такая «реактивная» строма продуцирует различные сигнальные молекулы, в том числе TGF-b, Wnt и некоторые интерлейкины, которые воздействуют на соседние клетки карциномы, заставляя последние активировать свои ранее неактивные программы EMT. Эта активация, как правило, обратима, и действительно, клетки карциномы, которые активировали программы EMT, могут возвращаться через мезенхимально-эпителиальный переход (MET) в фенотипическое состояние, в котором находились их предки до индукции программы EMT.
Хотя программа EMT, по-видимому, имеет решающее значение для инвазии и распространения большинства, а возможно, всех типов карциномы, до настоящего времени не было сформулировано никаких правил, позволяющих прогнозировать экспрессию ее разнообразных компонентов в различных типах ткани. Среди нерешенных фундаментальных проблем:
- природа гетеротипических сигналов, которые сходятся на клетках карциномы и «сотрудничают», чтобы активировать ранее молчащие программы EMT в этих клетках;
- степень, в которой эти программы активируются на разных стадиях прогрессирования рака;
- степень, в которой программы дифференцировки нормальных клеток влияют на экспрессию различных компонентов программы EMT;
- роли различных EMT-TF, упомянутых выше, в сотрудничестве друг с другом для реализации различных типов программ EMT;
- влияние соматических мутаций, протекающих во время первичного образования опухоли, на активацию и экспрессию программ EMT;
- роли внутриклеточных и внеклеточных сигнальных путей в поддержании экспрессии уже активированных программ EMT.
Инвазия путем коллективной миграции
Хотя EMT является значимым способом распространения клеток карциномы, его точная роль в «поведении» первичной опухоли остается мало изученной. Например, инвазия первичных опухолевых клеток обычно включает в себя коллективную миграцию крупных когезивных групп клеток в соседние ткани, а не рассеяние отдельных опухолевых клеток (рис. 1А). Организация этих групп, по-видимому, вступает в противоречие с поведением клеток, которые прошли через ЕМТ и утратили «сплоченность» (ту, что опосредована адгезивными соединениями). Таким образом, встает вопрос о том, действительно ли программа EMT является центральной для распространения клеток карциномы (как изложено выше), или она представляет собой только одну из нескольких возможных программ, которые позволяют осуществлять распространение.
Коллективная миграция с участием групп клеток, которая обычно наблюдается на границах инвазивных карцином, лучше всего изучена на карциномах молочной железы и легких, в то же время аналогичные инвазивные группы, несомненно, участвуют в инвазии и других типов карцином. Клетки, находящиеся в этих инвазивных группах, продолжают экспрессировать ключевые эпителиальные маркеры, такие как E-кадгерин, который помогает поддерживать когезию между отдельными эпителиальными клетками в этих когортах. Более того, поликлональная природа метастатических колоний некоторых видов рака молочной железы повышает вероятность того, что они возникли из генетически гетерогенных скоплений диссеминированных клеток, а не развились клонально из отдельных диссеминированных клеток. Вопрос состоит в том, представляет ли коллективная миграция альтернативу ЕМТ и являются ли два данных клеточно-биологических сценария взаимоисключающими.
Подробный гистопатологический анализ инвазивных групп предполагает, что EMT действительно участвует в коллективной миграции. Сами когорты устроены сложно, а клетки инвазии на передних краях прокладывают путь для больших популяций клеток-последователей, к которым они остаются прикрепленными через особые клеточные соединения. В некоторых случаях тщательное изучение показало, что определенные мезенхимальные клетки являются ведущими клетками на инвазивных «фронтах» во время коллективной миграции. Такие «лидеры вторжения» могут высвобождать различные протеазы, которые разрушают внеклеточный матрикс, что в противном случае препятствовало бы дальнейшему прогрессу группы в целом. Кроме того, клетки-лидеры могут также обладать подвижностью, связанной с EMT, чтобы обеспечить поступательное движение всех клеток инвазивной группы. Таким образом, сплотившись, клетки на инвазивных краях могут проложить путь для клеток-последователей, которые составляют основную часть клеточных «фаланг». Нерешенным является ключевой вопрос этой модели: может ли произойти коллективная инвазия, если активация программ EMT полностью заблокирована? Необходимо также упомянуть, что другие исследования сообщают о наличии связанных с раком фибробластов (а не клеток карциномы), которые подверглись EMT, в роли клеток-лидеров на инвазивных краях карциномы. Необходимы дополнительные экспериментальные доказательства для уточнения событий, происходящих на инвазивных краях карциномы, и природы вовлеченных нормальных и неопластических клеток.
Важная роль программы EMT в метастазировании
Недавно были проведены два исследования с целью опровергнуть существенную роль программы EMT в процессе метастазирования. В обоих случаях положение, что EMT происходит во время продолжающегося метастазирования, не было подтверждено представленными результатами, оставляя открытым вопрос о том, действительно ли EMT критически важен для метастатической способности всех типов клеток карциномы. Кроме того, отчеты об этих результатах выходят в то время, когда само определение ЕМТ подвергается пересмотру. Таким образом, программы EMT все чаще рассматриваются как процесс, а клетки находятся в спектре множества промежуточных состояний, лежащих между эпителиальным и мезенхимальным полюсами. Поэтому вероятно, что в некоторых случаях метастазирующие карциномы могут проявлять явные мезенхимальные свойства, которые способствуют распространению метастазов, тогда как в других случаях они могут и не иметь того же набора признаков, связанных с EMT.
Фактически, большое количество исследований подчеркивает существование особого состояния, так называемого «частичного EMT», и его связь с ускорением прогрессирования опухоли и метастазирования. Напротив, индукция полностью мезенхимального состояния, достигаемая экспериментально посредством введенных высоко экспрессированных факторов транскрипции, и приводящая к завершению всей программы EMT, лишает клетки способности инициировать опухоль и, таким образом, способности образовывать метастатические колонии. Иными словами, фенотипическая пластичность клеток карциномы, представляющих середину эпителиально-мезенхимального пласта, по-видимому, имеет решающее значение для образования метастатических колоний и их последующего интенсивного роста. Однако эти исследования не объясняют «поведение» карцином яичников, распространение которых по перитонеальному пространству происходит по принципам, сильно отличающимся от принципов, характерных для большинства солидных опухолей.
Циркулирующие опухолевые клетки
Отдельные инвазивные клетки карциномы и инвазивные группы, возникающие из первичных опухолей, могут рано или поздно проникнуть либо в сосудистую сеть соседних нормальных тканей, либо в сеть новообразованных сосудов, которая была создана в самих опухолях посредством ангионеогенеза. Интравазация обеспечивает циркулирующим опухолевым клеткам (ЦОК) возможность перемещения в отдаленные места, где они могут образовывать новые метастатические колонии. Таким способом могут перемещаться как отдельные клетки, так и многоклеточные кластеры, которые могут присутствовать в сосудистом русле, пока не встретят в отдаленных тканях микрососуды с малым диаметром, часто находящимся в пределах 8 м. Это физическое препятствие, по-видимому, гарантирует, что подавляющее большинство внутрисосудистых ЦОК останется в системном кровотоке только в течение нескольких секунд или минут после их первоначального попадания в сосудистую сеть. Хотя большинство ЦОК могут быть быстро элиминированы, результаты последних исследований сообщают, что даже кластеры ЦОК способны пролезать через сосуды капиллярного размера, так как цепочка шириной в одну клетку не распадается из-за адгезивных взаимодействий. Кластеры ЦОК, введенные экспериментально в венозное кровообращение, гораздо более «эффективны», чем отдельные клетки карциномы при посеве метастатических колоний, потому что они более устойчивы к апоптозу и могут более прочно «разместиться» в просвете сосудов. Кроме того, эти кластеры защищены от различных опасностей, таких как атаки натуральных киллеров, и после экстравазации могут использовать некоторые малоизученные механизмы пролиферации, которые способствуют их повышенной метастатической эффективности.
Тем не менее отдельные ЦОК были тщательно изучены в последние годы благодаря появлению современной аппаратуры и техническим улучшениям в процессах выявления ЦОК в крови онкобольных. В подобных исследованиях выдвигается предположение, что эти клетки представляют собой посредников между первичными опухолями и метастатическими колониями. И все же остается неясным, какие типы ЦОК (одиночные или кластерные) больше ответственны за метастазирование. Действительно, вероятность того, что одиночная ЦОК сможет стать родоначальником метастатической колонии, исчезающе мала. Однако существует мнение, что отдельные и кластерные ЦОК могут продуцироваться первичными опухолями в определенном соотношении, и в этом случае одиночные ЦОК могут служить маркерами кластеров клеток, которые ответственны за образование подавляющего большинства метастатических колоний.
Дополнительное значение здесь имеет тот факт, что ЦОК, мигрирующие либо в виде отдельных клеток, либо в составе кластеров, часто демонстрируют комбинации эпителиальных и мезенхимальных признаков, что усиливает роль программы эпителиально-мезенхимального перехода в процессе интравазации и диссеминации раковых клеток. Кроме того, в продольных исследованиях у отдельных пациентов было обнаружено, что доля мезенхимальных ЦОК прогрессивно увеличивается вместе с приобретенной устойчивостью к лечению и прогрессированием заболевания. Одна из проблем здесь связана с тем фактом, что методы обогащения ЦОК, основанные на выявлении эпителиальных маркеров на их поверхности, вполне могут пропускать клинически значимые ЦОК, которые ответственны за посев отдаленных метастазов, однако не имеют на поверхности большей части этих маркеров, что происходит вследствие развития программ эпителиально-мезенхимального перехода.
Все эти условия не умаляют достоинства некоторых уже проверенных способов использования ЦОК. Одиночные ЦОК могут действительно быть информативными для определенных диагнозов, так как присутствие ЦОК неоднократно обнаруживалось в часто встречающихся карциномах, включая рак молочной железы, предстательной железы, легкого и толстой кишки. В частности, мониторинг концентраций ЦОК с помощью жидкостной биопсии может дать очень полезную информацию о реакции опухоли пациента на различные виды терапии. Другое явно полезное применение — измерение ЦОК у пациентов, у которых были удалены первичные опухоли, чтобы определить, сохраняются ли остаточные метастатические отложения и продолжают ли клетки карциномы поступать в системный кровоток.
Кроме того, выделение, экспансия ex vivo и анализ жизнеспособных ЦОК может использоваться для определения профиля генетических мутаций и чувствительности к лекарственным средствам клеток, находящихся в первичных опухолях. Это может позволить прогнозировать реакцию пациента на различные виды терапии, особенно когда зоны поражения, подвергаемые терапевтическому воздействию, труднодоступны для биопсии (например, находятся в головном мозге). Действительно, один уже опубликованный отчет демонстрирует, что ЦОК, выделенные у пациентов с раком простаты, могут быть предвестниками приобретенной лекарственной устойчивости, наряду с такими молекулярными изменениями, которые могут способствовать резистентности к антагонистам андрогенных рецепторов. В идеале раннее выявление и определение характеристик ЦОК до появления клинически обнаруживаемых метастатических очагов можно использовать для начала лечения (или изменения его схемы) до появления опасных для жизни метастазов. В настоящее время, однако, это представляется нецелесообразным, учитывая тот факт, что даже активно растущие агрессивные опухоли имеют тенденцию выделять в кровоток относительно небольшое количество обнаруживаемых ЦОК.
Взаимодействия в ходе транзита: судьба внутрисосудистых опухолевых клеток
Клетки карциномы, которые успешно проникли в строму первичной опухоли, могут попадать в кровеносные или лимфатические сосуды. Наличие раковых клеток в дренирующих пораженный орган лимфатических узлах представляет собой важный клинический параметр, который включен в процесс гистопатологического определения стадии заболевания и, следовательно, связан с конкретными прогнозами. В то время как клетки карциномы могут стимулировать рост лимфатических сосудов в процессе лимфангиогенеза (процесса, который коррелирует с прогрессированием заболевания), нет достаточных доказательств того, что дренирующие лимфатические узлы представляют собой промежуточные «станции», которые позволяют значительному количеству раковых клеток останавливаться, прежде чем продолжить миграцию в кровоток, а затем в отдаленные ткани организма. Следовательно, эти небольшие метастатические очаги, вероятно, представляют собой тупик для раковых клеток и в основном функционируют как маркеры, которые показывают степень распространения клеток первичной опухоли. По этой причине обсуждение ниже сосредоточено на гематогенном транспорте клеток карциномы, так как это, вероятно, основной путь, который метастатические раковые клетки преодолевают для колонизации отдаленных тканей.
.
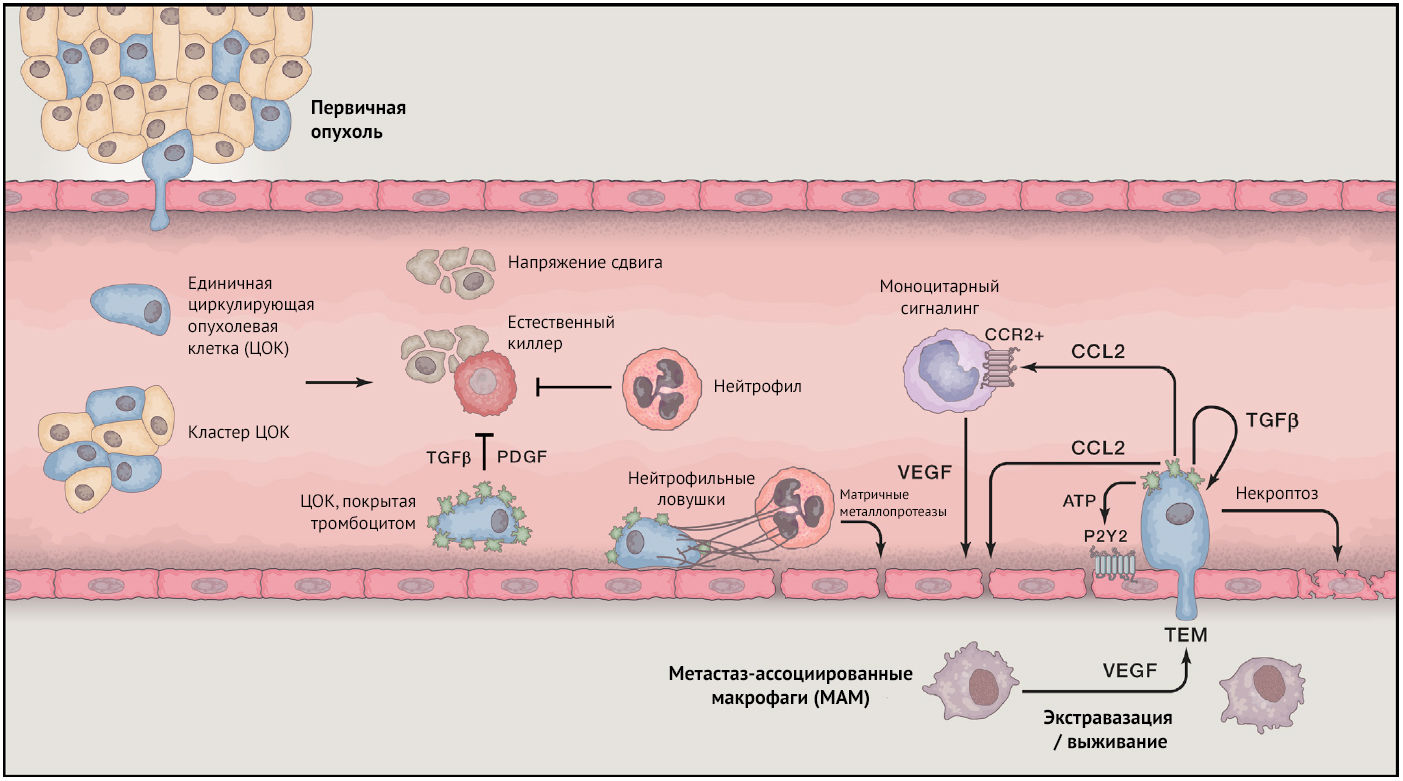
Безопасное прохождение раковых клеток в отдаленные части организма вряд ли возможно. Хотя время прохождения раковых клеток через кровоток может составлять всего несколько минут, они сталкиваются с многочисленными препятствиями на пути к паренхиме отдаленных тканей. Прежде всего, это физические аспекты, связанные с пребыванием в условиях циркуляции, которые включают отсутствие прикрепления к субстрату, гидродинамические перегрузки и гемодинамический удар. Кроме того, клетки карциномы в кровообращении уязвимы для иммунной атаки, и особенно для NK-клеток, которые нацелены на их быстрое устранение. Тем не менее определенные взаимодействия между циркулирующими клетками карциномы и другими типами клеток (тромбоцитами, нейтрофилами, моноцитами/макрофагами и эндотелиальными клетками) внутри сосудов могут облегчить ЦОК проход и экстравазацию в отдаленных местах (рис. 2).
Взаимодействия с тромбоцитами
Попав в кровоток, ЦОК быстро связываются с тромбоцитами, данное взаимодействие запускается тканевым фактором, экспрессируемым на поверхности клеток карциномы. В зависимости от скорости попадания ЦОК в кровоток это может привести к дисбалансу в нормальных процессах коагуляции, что может опосредовать определенные симптомы нарушения свертывания, которые наблюдаются у пациентов с раком, в частности микротромбы, ДВС-синдром и даже ТЭЛА. В то же время тромбоциты облегчают метастазирование для клеток опухоли. Вклад тромбоцитов в метастатический процесс был оценен еще в 1960-е годы, когда исследования показали, что экспериментальная индукция тромбоцитопении может оказывать антиметастатический эффект, в то время как высокое количество тромбоцитов связано с неблагоприятным клиническим прогнозом по различным типам карцином.
Тромбоциты содержат множество биоактивных молекул, которые могут потенциально влиять на прогрессирование онкозаболевания, и ряд недавних исследований выявил несколько механизмов, с помощью которых тромбоциты могут изменить судьбу ЦОК внутри сосудистого русла. Здесь имеет значение тот факт, что тромбоциты могут защитить ЦОК от элиминации клеточными механизмами защиты иммунной системы. Более конкретно, тромбоциты, «обволакивающие» ЦОК в сосудистом русле, могут предотвращать распознавание и лизис опухолевых клеток NK-клетками. Этот эффект может быть опосредован растворимыми факторами, которые продуцируют тромбоциты, такими как TGF- (Transforming growth factor beta, трансформирующий фактор роста бета) и PDGF (Platelet-derived growth factor, тромбоцитарный фактор роста), которые ингибируют активность NK-клеток. Также это может быть связано с физическим экранированием раковых клеток от NK-клеток путем образования защитных оболочек вокруг ЦОК и отложения фибриногена на раковых клетках. Такая защита (в частности от атаки, опосредованной NK-клетками) может представлять собой важное преимущество, которое дают тромбоциты внутрисосудистым клеткам карциномы, поскольку прометастатические эффекты тромбоцитов не проявляются у мышей, лишенных NK-клеток.
Помимо защиты циркулирующих опухолевых клеток от внешних воздействий, тромбоциты могут также изменять внутриклеточные сигнальные пути в клетках карциномы, которые в конечном итоге влияют на способность последних вызывать метастатический рост. Примечательно, что TGF-b, секретируемый дегранулирующими тромбоцитами, может действовать в связке с контактно-зависимыми сигналами, которые активируют путь NF-kB в клетках карциномы, таким образом вызывая или поддерживая экспрессию программ EMT в ЦОК. Эта прямая передача сигналов между тромбоцитами и клетками карциномы, по-видимому, может заменить отсутствие сигналов, полученных из стромы, которые в первичной опухоли приводили к индукции EMT.
При отсутствии таких гетеротипических взаимодействий ЦОК могут возвращаться посредством MET к эпителиальному состоянию их предков в первичной опухоли, теряя тем самым инвазивные признаки и способность выйти из сосудистого русла и дать начало метастатическому очагу. После активации раковыми клетками тромбоциты могут передавать сигналы и соседним эндотелиоцитам. Опухолевые клетки вызывают секрецию АТФ из активированных тромбоцитов, которые могут сделать сосудистую стенку более проницаемой, воздействуя на рецепторы P2Y2, экспрессируемые эндотелиальными клетками. Кроме того, физические взаимодействия между тромбоцитами и эндотелиальными клетками, например, опосредованные селектинами, предположительно, важны для адгезии кластеров тромбоцитов и раковых клеток к стенкам сосудистой сети. Однако остается неясным, являются ли такие адгезивные взаимодействия решающими для возможного проникновения опухолевых клеток в паренхиму различных тканей.
Взаимодействие с нейтрофилами
Нейтрофилы могут существовать в различных динамически изменяющихся фенотипических состояниях, которые могут быть обусловлены как первичной опухолью, так и другими клетками. В некоторых случаях было обнаружено, что нейтрофилы ингибируют метастазирование. Например, первичные опухоли могут «направлять» нейтрофилы посредством секреции CCL2 (CC- хемокин лиганд-2). Они, по-видимому, накапливаются в крови и легких мышей с опухолями задолго до метастазирования и, как было установлено, не дают клеткам карциномы метастазировать в легкие. Нейтрофилы, активированные терапией гранулоцитарным колониестимулирующим фактором, лишены этой способности, что позволяет нам убедиться, что нейтрофилы имеют возможность находиться в различных функциональных состояниях.
Однако молекулярная и клеточная физиология нейтрофилов, свидетельствует, что их доминирующая роль заключается в помощи метастатическому процессу. Например, нейтрофильные внеклеточные ловушки, которые образуются из деспирализованных молекул ДНК, предназначены для «ловли» патогенов в ходе иммунного ответа на инфекцию, но также могут быть использованы нейтрофилами для захвата опухолевых клеток в сосудистом русле. Таким «опутанным» ЦОК легче выживать в просвете сосуда, а также прилипать к эндотелиальным клеткам и выходить за пределы капилляра. Нейтрофилы могут напрямую взаимодействовать с опухолевыми клетками, попавшими в сосудистую сеть, продлевая их задержку в легких вкупе с гиперемией. Аналогичным образом нейтрофилы могут способствовать адгезивному взаимодействию в синусоидах печени, играя роль некой «платформы», на которой ЦОК могут закрепиться перед экстравазацией. Кроме того, нейтрофилы облегчают экстравазацию опухолевых клеток, главным образом за счет секреции матричных металлопротеиназ.
Было также обнаружено, что нейтрофилы обладают иммуносупрессивными эффектами. Часто, активированные посредством системной передачи сигналов первичной опухолью, нейтрофилы могут ингибировать как цитотоксические ответы CD8+ T-клеток, так и внутрисосудистую элиминацию клеток карциномы NK-клетками. Такая защита от врожденного и приобретенного иммунитета дает явное преимущество опухолевым клеткам в процессе транзита по сосудистому руслу организма. Наконец, некоторые из эффектов, опосредованных нейтрофилами, могут возникать в ответ на агрегацию тромбоцитов и опухолевых клеток, описанную ранее. Таким образом, высвобождение хемокинов тромбоцитами может привлекать нейтрофилы, которые затем могут усиливать распространение и метастатический рост клеток карциномы.
Экстравазация
Многие внутрисосудистые взаимодействия, описанные выше, влияют на способность ЦОК к экстравазации (выходу из сосуда) и на прохождение клеток в паренхиму отдаленных тканей. Экстравазация сопровождается процессом, который называется трансэндотелиальной миграцией. Ранее исследователи ссылались на способность АТФ, выделяемого активированными тромбоцитами, делать стенки капилляров более проницаемыми: это происходит за счет того, что эндотелиальные клетки как бы «отступают» друг от друга. Кроме того, клетки карциномы молочной железы, подготовленные TGF- в первичной опухоли, приобретают способность продуцировать ангиопоэтин-подобные белки-4 (angiopoietin-like 4 — ANGPTL4), что повышает проницаемость сосудистой сети легких, способствует трансэндотелиальной миграции клеток карциномы и приводит к увеличению способности к метастатическому росту.
Сообщалось, что некоторые другие белки, продуцируемые клетками карциномы, нарушают целостность сосудов. К ним относятся VEGF, MMPs (матриксные металлопротеиназы) и ADAM-12 (дизентегрин и металлопротеаза-12). Эти молекулы, по-видимому, облегчают как интравазацию, так и экстравазацию, что указывает на то, что наличие определенных признаков, которые были полезными в ходе первичной опухолевой инвазии, может стать преимуществом и на более поздних этапах каскада инвазии-метастазирования.
Было также продемонстрировано, что вовлечение моноцитов играет важнейшую роль в экстравазации опухолевых клеток. В частности, рекрутирование CCR2+ (CC-хемокин рецепторы 2 типа) воспалительных моноцитов в ответ на секрецию CCL2 карциномой или клетками-хозяевами может способствовать экстравазации и последующему метастатическому росту в паренхиме легких. Эти воспалительные моноциты могут дифференцироваться в макрофаги, которые способствуют метастазированию, выживанию и росту клеток карциномы в легких посредством высвобождения VEGF.
CCL2 может также воздействовать на эндотелиальные клетки для улучшения проницаемости сосудов. Хотя ингибирование CCL2-CCR2, по-видимому, представляет собой идеальную антиметастатическую терапию, прекращение анти-CCL2-терапии фактически приводит к усиленной инфильтрации моноцитами опухолей и легких с соответствующим ускорением прогрессирования заболевания. Этот факт еще раз подчеркивает динамичный и непредсказуемый характер процесса метастазирования.
Большинство экспериментальных моделей метастазирования по разным причинам были ориентированы на легкие в качестве «пункта назначения» метастатических опухолевых клеток. Необходимо понимать, что требования для успешной экстравазации и соответствующих взаимодействий, которые облегчают этот процесс, вероятно, будут весьма различаться в разных органах и тканях. Например, фенестрированные синусоиды костного мозга и печени, вероятно, позволят пассивный вход ЦОК, не вынуждая их использовать сложные механизмы, перечисленные выше. В случае головного мозга распространение клеток карцином, по-видимому, требует прохождения через гематоэнцефалический барьер, что может потребовать тканеспецифической программы по экстравазации, которая сильно отличается от тех, которые обеспечивают метастазирование в других местах. Действительно, клетки рака молочной железы, наиболее часто метастазирующие в мозг, экспрессируют на высоком уровне ряд генов, которые, как известно, облегчают прохождение через гематоэнцефалический барьер. В некоторых случаях трансэндотелиальная миграция может вообще не потребоваться, поскольку было обнаружено, что клетки карцином пролиферируют в просвете кровеносных сосудов, а это, в свою очередь, приводит к росту крупных внутрипросветных колоний опухолей, которые в конечном итоге разрывают близлежащие эндотелиальные стенки, обеспечивая себе прямой доступ к тканевой паренхиме. Наконец, недавно был описан новый механизм, используя который опухолевые клетки могут выходить из сосуда и генерировать метастазы в легких посредством индукции запрограммированного некроза (некроптоза) в эндотелиальных клетках.
Метастатическая колонизация
Рост метастатической колонии представляет собой последнюю и наиболее смертельную стадию злокачественного развития опухоли. Однако подавляющее большинство исследованных клеток карциномы, похоже, плохо подготовлены к росту в отдаленных тканях: некоторые экспериментальные данные дают оценки эффективности метастазирования после внутривенного введения опухолевых клеток всего лишь в 0,01 %. Даже те клетки карциномы, которым удалось выйти из сосудистого русла, почти наверняка либо будут элиминированы из паренхимы, либо перейдут в состояние покоя и останутся в индолентном состоянии в виде единичных диссеминированных опухолевых клеток (ДОК) или в виде небольших микрометастатических кластеров. В этом состоянии они могут пребывать в течение нескольких недель, месяцев или даже лет.
Проделав путь от первичной опухоли, ДОК попадают в новую микросреду ткани, лишенную привычных стромальных клеток, факторов роста и компонентов экстрацеллюлярного матрикса, которые ранее поддерживали жизнь предшественников ДОК. Следовательно, их неспособность продолжать пролиферацию и, как следствие, вход в индолентное состояние, часто может объясняться микросредой, к которой эти клетки плохо адаптированы. Соответственно, метастатический покой отражает неспособность ДОК адаптироваться и колонизировать данную ткань. Важно отметить, что состояние покоя также может быть вызвано определенными антипролиферативными сигналами, с которыми сталкиваются недавно прибывшие клетки в паренхиме чужеродных тканей. Сначала мы рассмотрим программы, работающие в неактивных клетках, прежде чем перейти к тем, которые позволяют осуществить колонизацию.
Программы покоя
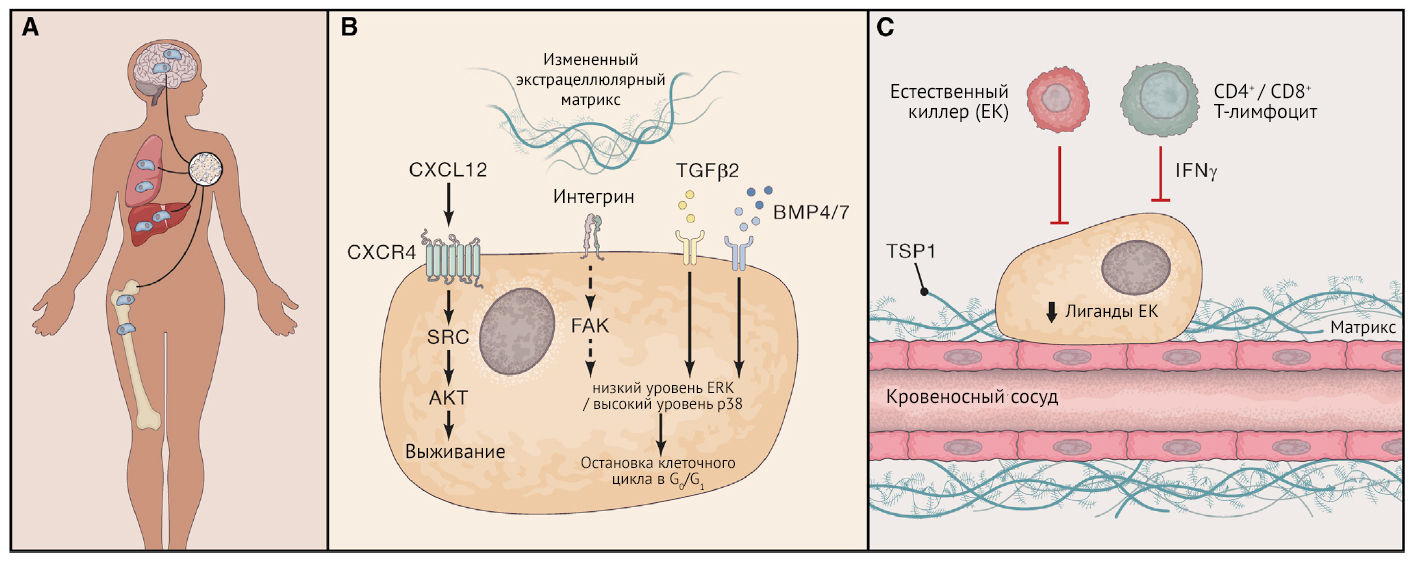
Латентная, клинически не очевидная фаза метастазирования вполне может быть результатом того, что клетки карциномы становятся неспособными к пролиферации. Причиной этого может стать неспособность индуцировать ангиогенез или же активное подавление ЦОК иммунной системой. Считается, что эти два механизма обеспечивают низкий уровень пролиферации, который балансируется продолжающейся элиминацией, что приводит к сохранению одного и того же размера микрометастатических кластеров. С клинической точки зрения пациенты, успешно излечившиеся от своих первичных опухолей, но потенциально обладающие дремлющими раковыми клетками, имеют бессимптомное минимальное остаточное заболевание (minimal residual disease — MRD) (рис. 3A). Для некоторых карцином, таких как рак молочной железы, предстательной железы и почек, этот период покоя может продолжаться в течение многих лет, даже десятилетий после успешных курсов терапии. И хотя трудно формально доказать, что метастатическая колония напрямую развивалась из ранее существовавшего дремлющего ДОК, наличие ДОК в костном мозге явно коррелирует с повышенным риском возможного рецидива. Это показывает, почему понимание биологических основ состояния покоя раковых клеток имеет первостепенное клиническое значение. Хотя бы потому, что период покоя представляет собой временное окно, в течение которого терапевтические вмешательства, направленные либо на устранение ДОК, либо на сдерживание их пролиферации, могут играть решающую роль в предотвращении возможного рецидива угрожающего жизни метастазирования.
Программы покоя (рис. 3B) могут быть запущены любым сигналом, встречающимся в новой микросреде ткани или же, наоборот, отсутствием контекстных сигналов, от которых клетки карциномы зависели ранее, находясь в первичных опухолях. Например, ДОК, которые реагируют на сигналы выживания, присутствующие в микросреде, могут сохраняться в течение длительного времени в паренхиме ткани. В одном хорошо изученном случае клетки рака молочной железы, которые поселились в костном мозге и обладали высокой активностью SRC (клеточных и саркомных тирозинкиназ) и экспрессией CXCR4 (CXC-мотива-хемокинрецептора 4), способны инициировать пути выживания в ответ на исходящий из кости CXCL12. ДОК, способные реагировать на эти сигналы выживания, могут противодействовать TRAIL-индуцированному апоптозу (TRAIL — ФНО-опосредованный лиганд апоптоза) — консервативному механизму защиты тканей, который может работать на устранение ДОК. Выживание ДОК также может быть связано с их способностью противостоять аноикису, например, посредством экспрессии рецепторов тирозинкиназы TrkB или через неканоническую передачу сигналов Wnt, опосредованную WNT2.
Даже если ДОК выигрывают от таких сигналов выживания в их новой тканевой среде, без дополнительных митогенных сигналов (в том числе взаимодействия с экстрацеллюлярным матриксом) эти клетки чаще пребывают в состоянии покоя. Так, сообщалось, что состояние покоя наступает, когда ДОК карциномы не способны взаимодействовать с интегрином b1 с последующей активацией киназы фокальной адгезии (focal adhesion kinase — FAK). Способность ДОК продуктивно взаимодействовать с матрицей, по крайней мере, в контексте карциномы легких, по-видимому, зависит от образования филоподий-подобных выступов (filopodium-like protrusions — FLP), которые покрыты интегрином b1. ДОК, которые не способны реагировать на такие адгезивные сигналы, не активируют пролиферативные программы, которые управляются в первую очередь сигнализацией FAK, а также сигнальными путями SRC и ERK. Соответственно, комбинированное ингибирование SRC и ERK путей блокирует выход ДОК из покоя и, таким образом, предотвращает реализацию их метастатической программы. Также было выявлено несколько сигналов, индуцирующих состояние покоя в микросреде определенных тканей-мишеней. Например, TGF-2, присутствующий в высоких концентрациях в костном мозге и действующий посредством стимуляции TGF--RI и TGF--RIII, обнаруживаемых с помощью ДОК, может вызывать состояние покоя у клеток плоскоклеточных карцином тканей головы и шеи. Члены семейства лигандов BMP (морфогенетические белки костной ткани) также были связаны с метастатическим покоем. BMP7, который может продуцироваться костными стромальными клетками, вызывает покой в клетках рака предстательной железы. В легких также экспрессируется ряд альтернативных лигандов BMP, включая BMP4, и они являются факторами, которые поддерживают состояние покоя в диссеминированных клетках карциномы молочной железы. Многие из этих цитокинов, вызывающих покой, приводят к активации пути МАРК р38. В сочетании с отсутствием митогенных сигналов это провоцирует эффект ERKlow / p38high в ДОК, что, в свою очередь, приводит к остановке в фазах G0/G1 клеточного цикла и переходу в состояние покоя.
.
Спящая ниша
Неактивные ДОК могут находиться в специализированных нишах (рис. 3C), которые обеспечивают их выживание, сдерживают пролиферацию и, возможно, обеспечивают устойчивость к терапевтическим агентам. Особый интерес здесь представляет идея о том, что неактивные ДОК могут занимать нишу, которая в норме предназначена для популяций стволовых клеток. Это убедительно продемонстрировано на примере клеток рака предстательной железы, которые метастазируют в кости. Было обнаружено, что клетки карциномы конкурируют с гемопоэтическими стволовыми клетками (ГСК) за место в эндостальной нише. Это происходит через сигнальную ось CXCL12-CXCR4, которая обычно используется для физиологической регуляции ГСК. Тот факт, что ДОК могут нацеливаться на нишу стволовых клеток, предполагает, что они могут быть готовы реагировать на сигналы покоя и выживания, присутствующие в микросреде ГСК.
Было обнаружено, что во многих органах, включая легкие, кости и мозг, ДОК находятся в области, окружающей сосудистую сеть, известную как периваскулярная ниша. Означает ли это их активное удержание в этой нише или просто указывает на неспособность двигаться дальше от сосудистой сети после первоначальной экстравазации, пока неясно. Альтернативный механизм подтверждается тем фактом, что факторы, присутствующие в периваскулярной нише, активно способствуют переходу в состояние покоя. Так, тромбоспондин-1, продуцируемый зрелыми эндотелиальными клетками и откладывающийся в базальной мембране микрососудов, способен удерживать ДОК в состоянии покоя. Более того, в исследовании, использующем визуализацию в реальном времени для изучения процесса метастазирования в мозг, редкие одиночные ДОК, которые достигли долгосрочного покоя, неизменно находились в периваскулярной области, что свидетельствует о важной роли этой ниши в поддержании покоящегося состояния ДОК в мозге.
ДОК должны защищать себя от иммунной атаки при нахождении в тканях в виде изолированных одиночных клеток, если они расположены вдалеке от иммуносупрессивного микроокружения первичной опухоли. Клетки карциномы молочной железы и легких, отобранные по их способности сохраняться в латентном состоянии после посева в удаленные органы, успешно избегают атаки NK-клеток посредством репрессии различных лигандов, активирующих NK-клетки. Эта программа, по-видимому, тесно связана со входом в состояние покоя. Действительно, было обнаружено, что эти клетки начинают пролиферировать, если ввести их в организм мышей, у которых нет NK-клеток, что указывает на то, что врожденный иммунитет является важным компонентом спящей ниши, которая эффективно переводит многие раковые клетки в состояние покоя.
Совсем о другом процессе свидетельствует наблюдение, что антигенпрезентирующие дендритные клетки могут защищать от метастазирования, что подразумевает роль приобретенного иммунитета в контроле метастатического процесса. Как CD4+, так и CD8+ T-клетки вовлечены в контроль спящих первичных опухолевых клеток посредством секреции IFNg, и есть доказательства того, что CD8+ T-клетки могут удерживать диссеминированные клетки увеальной меланомы в состоянии покоя. Однако в настоящее время очень мало известно о таких иммуноопосредованных механизмах сохранения состояния покоя у ДОК.
Возможные программы раковых стволовых клеток и начало метастатической колонизации
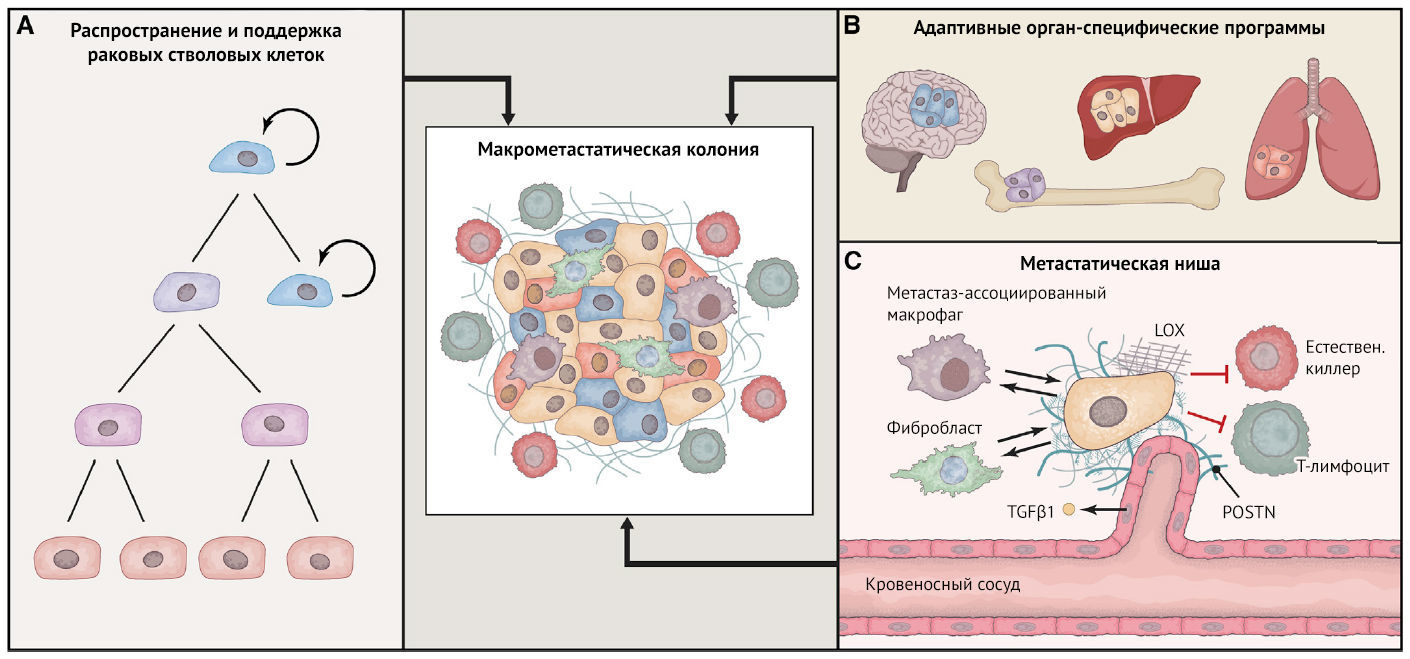
Как упоминалось выше, активация программы эпителиально-мезенхимального перехода, которая способна стимулировать физическое распространение клеток карциномы в отдаленные анатомические участки, может также придавать этим клеткам важные признаки стволовых клеток, которые, по-видимому, имеют большое значение для метастатической колонизации. Таким образом, очевидной предпосылкой успешного формирования метастатической колонии является свойство инициации опухоли, воплощенное в раковых стволовых клетках (РСК). По крайней мере, только те ДОК, которые находятся в состоянии РСК, могут служить основателями метастатических колоний. Накапливающиеся доказательства, продемонстрированные в основном на животных моделях, в значительной степени поддерживают это понятие. В модели MMTV-PyMT опухоли молочной железы было показано, что редкая популяция РСК ответственна за инициацию метастатического роста в легких, и, соответственно, способность этих опухолей метастазировать зависит от поддержания этой популяции стволовых клеток через усиленную передачу сигналов Wnt. В клетках рака молочной железы человека активация основных путей стволовых клеток, таких как передача сигналов Wnt и Notch, также важна для поддержки их колонизации в моделях мышей с ксенотрансплантатом. Некоторые другие мышиные модели аденокарциномы легких показали, что метастатическое прогрессирование связано с программой дедифференцировки, опосредованной потерей экспрессии Nkx2-1, которая напоминает программы, существующие в состояниях, подобных РСК. Таким образом, предполагается, что метастатический потенциал карциномы тесно связан с ее способностью распределять популяции РСК, которые могут повторно инициировать рост опухоли после прибытия в отдаленные ткани. Это понятие подразумевает, что состояние клетки является критическим фактором, определяющим успешное метастазирование, а точнее, пребывание в эпигенетическом состоянии, связанном с РСК. Как подробно обсуждалось выше, альтернативой метастатическому процессу, протекающему сразу после распространения опухоли, является вход ДОК в индолентное состояние, в котором они могут сохраняться в течение длительного времени, прежде чем последующие клетки в конечном итоге преобразуются в легко обнаруживаемые макроскопические метастазы. Такое постоянство может быть поддержано приобретением характеристик стволовых клеток. Таким образом, ДОК, обнаруженные в костном мозге пациентов с раком молочной железы, обнаруживают признаки РСК. В соответствии с этим клетки, которые остаются в латентном состоянии в отдаленных тканях, также показывают признаки РСК, включая экспрессию транскрипционных факторов SOX2 и SOX9. Кроме того, анализ экспрессии был применен к ДОК, выделенным из органов моделей рака молочной железы, полученных из ксенотрансплантата пациента; некоторые органы имели слабое метастатическое поражение из-за присутствия небольшого количества якобы дремлющих клеток карциномы. Эти клетки обладали характерным профилем экспрессии генов по сравнению с клетками карциномы из запущенных метастатических поражений, которые характеризовались экспрессией генов эпителиально-мезенхимального перехода, стволовых клеток и программы выживания/покоя. Самое интересное, что когда опухолевые клетки, выделенные из таких тканей с низкой мутантной нагрузкой, были имплантированы новым реципиентным животным, они сохраняли свой онкогенный потенциал и могли легко генерировать более дифференцированные карциномы. Эти исследования предоставляют дополнительные доказательства в поддержку идеи, что стволовые раковые клетки часто служат основателями метастатических колоний, даже когда такие колонии появляются только после длительной задержки.
Эта схема, подразумевающая, что программы эпителиально-мезенхимального перехода и стволовых клеток являются критически важными предпосылками успешного образования метастатических колоний, должна быть согласована с общепризнанным фактом, что метастазы карцином имеют тенденцию повторять ключевые гистопатологические признаки соответствующих первичных опухолей. Среди других признаков это обычно включает в себя значительные эпителиальные особенности. На первый взгляд, это представление кажется несовместимым с предположением, что эпителиально-мезенхимальный переход играет центральную роль в запуске метастазирования карциномы благодаря своей способности придавать мезенхимальные черты стволовым раковым клеткам. Фактически, этот парадокс разрешен многочисленными исследованиями, некоторые из которых были процитированы здесь, которые обнаружили, что ДОК карциномы, по-видимому, претерпевает обратную программу эпителиально-мезенхимального перехода в некоторый момент после распространения, то есть они проходят через мезенхимально-эпителиальный переход. Этот возврат к эпителиальному состоянию должен восстановить многие клеточные признаки, которые были утрачены во время предшествующего прохождения через эпителиально-мезенхимальный переход, и позволить реконструкцию иерархических клеточных организаций, аналогичных тем, которые присутствуют в первичных опухолях. На самом деле, такое приведение многих клеток в раннем метастатическом росте к эпителиальному состоянию может иметь важное значение для метастатической колонизации. Следует отметить, что остается неясным, почему именно мезенхимальные РСК не могут генерировать устойчиво растущие метастатические колонии в отсутствие эпителиального потомства, генерируемого такими в процессе мезенхимально-эпителиального перехода.
Механизмы колонизации
По-видимому, метастатическая колонизация, как это считается в настоящее время, зависит от двух предпосылок ДОК: они должны обладать способностью инициировать опухоль, как указывалось выше, и они должны в некотором роде создавать адаптивные программы, которые позволяют им выживать в условиях нового микроокружения паренхимы отдаленных тканей. Гипотеза «семя и почва», выдвинутая Пейджет в конце 19-го века, предложила дополнительное понятие — что определенные типы клеток карциномы в большей степени способны генерировать метастазы в определенных микроокружениях чужеродных тканей, чем в других. Пейджет лишь не высказал предположение, что даже в таких благоприятных метастатических локализациях ДОК должны по-прежнему подвергаться некоторой форме фенотипической адаптации, чтобы быстро размножаться в этих участках. Таким образом, склонность карцином предстательной железы и молочной железы к метастазированию в кость, по-видимому, подразумевает некоторую ранее существовавшую способность соответствующих механизмов ликвидации фенотипической неисправности к тому моменту легко собирать адаптивные программы, подходящие для этой ткани, тогда как другие менее предпочтительные участки ткани могут потребовать более сложной, менее готовой к адаптации программы. Конечно, в некоторых случаях на органоспецифический тропизм метастатических клеток влияет строение местной системы кровообращения. Метастазирование колоректальной карциномы в печень предпочтительно просто потому, что портальная вена, дренирующая кишечник, опорожняется непосредственно в печень. Следовательно, даже если рассеянные клетки колоректального рака по своей природе плохо адаптируются для колонизации печени, огромное количество этих клеток, попавших в печень после прохождения через воротную вену, может само по себе предопределить метастазы, которые в конечном итоге могут возникнуть в этом месте. Важно отметить, что расположение системы кровообращения объясняет лишь небольшую долю органоспецифических метастазов, обычно наблюдаемых в онкологической практике. В этом контексте часто упоминается склонность клеток рака молочной железы и простаты колонизировать костный мозг, обычно называемая остеотропным метастазированием. Ниже мы приводим конкретные примеры, иллюстрирующие природу адаптивных программ, которые кажутся важными для успешного метастатического роста.
Для начала отметим, что некоторые из этих программ могут действовать в целом, предоставляя преимущество выживания в ряде различных органов-мишеней. Например, было показано, что раковые клетки испытывают более высокий уровень окислительного стресса как в кровообращении, так и в паренхиме отдаленной ткани. Как следствие, метаболические адаптации, включая синтез антиоксидантов, могут способствовать выживанию и возможному метастатическому росту в различных местах. Адгезивные взаимодействия, которые заменяют те, что встречаются в первичной опухоли, такие как гомотипические межклеточные взаимодействия в случае распространения ДОК или взаимодействия FLP-ECM в случае одиночных ДОК, могут быть способны активировать критические пути выживания таким образом, чтобы быть независимыми от конкретных органов-мишеней и, таким образом, представлять более общие приспособления, способствующие колонизации.
Эти общие адаптивные программы могут быть не более чем прелюдией к сложным задачам по созданию более узко применимых, специфичных для ткани систем адаптации. Действительно, разнообразный набор специфических для органа метастатических программ, которые опосредуют колонизацию костной ткани, легких, печени и мозга, были описаны и изучены с механистической точки зрения. Например, в головном мозге раковые клетки встречают реактивные астроциты, которые продуцируют активатор плазминогена, что приводит к выработке плазмина, который вызывает гибель клеток карциномы. Способность клеток карциномы выживать в этой враждебной среде зависит от экспрессии серпинов, которые обычно продуцируются нейронами и защищают от клеточной гибели, вызванной активатором плазминогена. В легких клетки карциномы, экспрессирующей VCAM-1, способны активировать свою собственную передачу сигналов AKT путем физического взаимодействия с интегрином-а4 на макрофагах, которые особенно распространены в микросреде легких. Выживание клеток карциномы в клетках печени было связано со способностью использовать креатин и АТФ, присутствующие во внеклеточном микроокружении, для генерации и импорта фосфокреатина, что может дать значительное преимущество в выживании ДОК, подверженным метаболическому стрессу. Разнообразие этих механизмов выживания является четким отражением различных клеточных и молекулярных детерминант успеха реализации метастатической программы.
В более общем смысле, механизмы, которые разрешают и/или способствуют пролиферации различных типов раковых клеток в микроокружениях отдаленных тканей, остаются неясными. Можно утверждать, что наиболее понятным примером на сегодняшний день является метастатическая колонизация тканей кости, которая была изученной в случае остеолитических метастазов, образованных раком молочной железы. Клетки карциномы молочной железы продуцируют ряд молекул, включая белок, связанный с паратиреоидным гормоном (parathyroid hormone-related protein — PTHrP), IL-11 и белок MMP, которые способствуют стимуляции активности остеокластов RANKL, высвобождающие факторы роста из костного матрикса, те в свою очередь способствуют пролиферации опухолевых клеток. Получившаяся в результате самоусиливающаяся цепочка положительной обратной связи была названа «порочным кругом» остеолитического метастазирования. Напротив, клетки карциномы предстательной железы имеют тенденцию порождать преимущественно остеобластные метастазы, которые возникают в результате индуцированной дифференцировки остеобластов. Предположительно, появление макроскопических метастазов в других органах-мишенях аналогичным образом зависит от способности клеток карциномы разрушать нормальные типы клеток, находящихся в этих органах, но детали этих гетеротипических взаимодействий в значительной степени еще предстоит изучить. В одном недавнем исследовании было обнаружено, что клетки карциномы молочной железы, которые колонизируют головной мозг, извлекают выгоду из связи с астроцитами посредством сборки щелевых соединений, установленных между раковыми клетками и астроцитами.
Метастатическая колония также может начать расти, когда дремлющие ДОК начинают выходить из состояния покоя. Пробуждение ранее неактивных микрометастазов может зависеть от успешной инициации функционально-адаптивных программ, которая может быть относительно нечасто достигнута для каждого поколения клеток, что объясняет необычайно низкую частоту образования метастаз. Например, исследования показывают, что спящие микрометастазы в кости, которые каким-то образом усиливают экспрессию VCAM-1, могут переходить в активную фазу колонизации посредством рекрутирования клеток-предшественников остеокластов, экспрессирующих интегрин a4b1, рецептор VCAM-1, который обеспечивает резорбцию и инициацию в кости «порочного круга», описанного выше. Клетки карциномы в легких способны избежать перехода в состояние покоя благодаря продукции Coco, секретируемого ингибитора передачи сигналов BMP, который способствует дальнейшей колонизации. Таким образом, представляется вероятным, что непрерывная пролиферация клеток на низком уровне дифференцировки внутри отдельных микрометастатических отложений, что происходит в течение длительного времени, имеет важное значение для способности ДОК процветать в микросреде ткани, в которой они оказались. Также существуют программы, которые усиливают потенциал колонизации для определенных органов. Интересно, что несколько примеров вышеописанных программ сосредоточены на взаимодействии между ДОК и экстрацеллюлярным матриксом. Например, клетки карциномы, отобранные in vivo за их способность повторно инициировать рост опухоли при последующих ксенотрансплантациях, также могут быть ответствены за начало метастатического роста во многих органах. В этом случае способность к полиорганной колонизации была прослежена вплоть до этапа продукции матричного белка ламинина-а4 (LAMA4), который, по-видимому, является критически важным для начальной пролиферации ДОК. Аналогично, рецептор коллагена DDR1, в сотрудничестве с адаптерным белком TM4SF1, недавно был идентифицирован как сигнальная ось, которая регулирует раковые стволовые клетки и, таким образом, обеспечивает прорастание ДОК в остальных случаях клеток карциномы в других тканях. Активация таких программ может объяснять, по-видимому, синхронное появление метастазов в различных органах — так называемых «метастатических ливней» (metastatic showers), которые иногда наблюдаются у пациентов.
Метастатическое микроокружение
Вышеприведенные данные, однако, не позволяют подробно рассмотреть природу клеток в различных типах нормальных тканей, из которых впоследствии произрастают метастатические колонии. По крайней мере, в случае карциномы эти клетки по существу являются различными типами клеток с мезенхимальными чертами, которые образуют строму, связанную с тканями, вместе с экстрацеллюлярным матриксом, установленным этими клетками. Для начала, точно так же, как первичные опухоли сильно зависят от их рекрутированного стромального микроокружения, метастатический рост, по-видимому, в равной степени зависит от поддержки стромы. Действительно, переход клеток карциномы из состояния покоя в состояние интенсивного роста может быть спровоцирован изменениями в их локальной среде. Например, очевидные индуцирующие эффекты перехода в состояние покоя под действием периваскулярной ниши, отмеченные выше, по-видимому, поворачиваются вспять во время неоваскуляризации, поскольку прорастающие эндотелиальные клетки секретируют TGF-b1 и периостин, которые могут способствовать пролиферации опухолевых клеток. В соответствии с этой идеей, рост дремлющих ДОК в головном мозге также, по-видимому, зависит от ангиогенеза. В другом недавнем исследовании описывается «пробуждение» ДОК в легких, вызванное воспалением (опосредованным провоспалительными клетками), индуцированным в этой ткани. Другие исследователи предполагают, что метастатическая колонизация требует или, по крайней мере, может быть поддержана экстрацеллюлярным матриксом. Эта идея подкрепляется идентификацией конкретных компонентов экстрацеллюлярного матрикса, таких как тенасцин-C и периостин, которые управляют колонизацией тканей легких клетками карциномы молочной железы. Опухолевые клетки могут сами продуцировать эти компоненты экстрацеллюлярного матрикса или, альтернативно, они могут вызывать их секрецию резидентными стромальными фибробластами. Кроме того, отдельные, но дополняющие друг друга данные свидетельствуют о наличии связи между фиброзом и метастазированием, что позволяет предположить: местный состав фибробластов и экстрацеллюлярного матрикса может влиять на способность клеток карциномы колонизировать ткани. Жесткость экстрацеллюлярного матрикса, которая может модулироваться сшивающим коллаген ферментом лизилоксидазой (LOX), также может быть важна для создания прометастатического микроокружения. Действительно, вклад гипоксии в метастазирование может быть в значительной степени связан с продукцией LOX ниже уровня транскрипции, обусловленной индуцируемым гипоксией фактором. Метастатическая колонизация также может затрагиваться клетками как врожденной, так и адаптивной иммунной системы. Таким образом, как NK-клетки, так и CD8+ T-клетки вовлечены в подавление метастазирования. И наоборот, богатая кислородом среда в легких действует на сдерживание Т-клеточных ответов и индуцирует толерантность к безвредным антигенам, но в контексте рака это фактически обеспечивает более благоприятную среду для метастатической колонизации. Миелоидные клетки также были определены как важные вкладчики в формирование благоприятного метастатического микроокружения, где особая популяция связанных с метастазированием макрофагов может быть ответственна не только за инициацию, но и за поддержание метастатического роста, возможно, посредством стимуляции ангиогенеза. Наконец, было обнаружено, что острые воспалительные реакции запускают разрастание клеток карциномы, эффект, который в первую очередь может быть вызван нейтрофилами.
Создание поддерживающей метастатической среды может происходить до появления в сосудистом русле каких-либо клеток карциномы посредством формирования так называемой преметастатической ниши. Эта нишевая формация может включать действия VEGFR+ предшественников костного мозга, миелоидных клеток-супрессоров или нейтрофилов. Некоторые исследования также позволяют предположить, что происходящие из опухоли экзосомы — небольшие везикулы, полученные из опухолей, которые содержат ДНК, мРНК, микроРНК и белок — могут изменять преметастатическую среду при подготовке к появлению клеток карциномы. Таким образом, формирование преметастатической ниши может представлять собой одно из последствий далеко идущих системных эффектов, вызванных первичными опухолями. В более общем смысле, наличие первичной опухоли может приводить к выработке многочисленных системных сигнальных факторов, которые, воздействуя на отдаленные ткани, могут вызывать реакции, которые могут впоследствии повлиять на рост первичной опухоли, состояние преметастатической ниши и на рост ранее скрытых микрометастазов.
Генетические и эпигенетические факторы колонизации
Классическое описание этапов канцерогенеза подразумевает, что последовательное накопление генетических и/или эпигенетических изменений приводит к развитию первичной опухоли. Логическое продолжение этой концепции предполагает, что рост метастатической колонии зависит от приобретения еще одной соматической мутации или набора мутаций, которые дают возможность раковым клеткам распространяться и затем размножаться в отдаленном органе. Тем не менее спустя более 25 лет после новаторской работы по многоступенчатому прогрессированию колоректального рака, генетических мутаций, которые характерно связаны с прогрессированием до метастатического заболевания, обнаружено не было. На самом деле, даже крупномасштабные усилия по секвенированию генома еще не выявили повторяющихся генетических мутаций, которые могут адекватно объяснить образование метастатических новообразований. Это говорит о том, что ход процесса метастазирования не зависит от накопления мутаций соматического драйвера, кроме тех, которые были идентифицированы во время первичного образования опухоли.
Новые исследования обращают внимание на эпигенетические механизмы, обеспечивающие колонизацию. Согласно одной из идей, колонизация может зависеть от амплификации в метастатических клетках онкогенных сигнальных путей, которые ранее были активированы в клетках первичных опухолей, например, путем осуществления среди существующих клонов повышенной передачи сигналов через путь киназы MAP. Клетки метастатической опухоли могут также уклоняться от действия генов-супрессоров метастазирования, которые, как было предположено, специфически блокируют более поздние стадии метастазирования. Другой альтернативный механизм может включать определенные эпигенетические изменения, которые управляют метастазированием, такие как аберрантные паттерны метилирования ДНК.
В дополнение к эффектам отдельных генов, последние данные свидетельствуют о том, что клетки метастатического рака часто демонстрируют глобальные изменения в структуре своего хроматина. Таким образом, в мышиной модели патогенеза мелкоклеточного рака легкого клетки карциномы, способные к метастазированию, демонстрировали отчетливую открытую конфигурацию хроматина в дистальных регуляторных областях, которые были установлены и связаны с фактором транскрипции Nfib; это изменение структуры хроматина, в свою очередь, способствовало сдвигу в сторону реализации программы экспрессии прометастатического нейронного гена. Такие измененные эпигенетические состояния могут облегчить адаптацию ДОК к чужеродной микроокружающей среде. Несмотря на эти данные, трудности, связанные с получением и анализом метастатических образцов, привели к продолжающейся нехватке информации о генетических и эпигенетических особенностях, обнаруженных в опухолевых клетках, которые формируют метастазы в организме человека.
Подводя итог, несмотря на результаты, описанные выше, метастатическая колонизация продолжает представлять собой наиболее загадочную фазу злокачественной прогрессии и наиболее сложный этап для экспериментального моделирования. Физическое распространение опухолевых клеток из первичной опухоли в паренхиму отдаленных тканей может, по крайней мере в контексте многих карцином, быть понятным благодаря действиям одной клеточно-биологической программы — эпителиально-мехензимальному переходу. Это резко контрастирует с необычайной сложностью последнего этапа каскада метастазирования — колонизации. Эта сложность, подчеркиваемая бесчисленными гетеротипическими взаимодействиями между популяциями рассеянных клеток карциномы и составляющими их новообразованных кластеров в отдаленных тканях, усложнила попытки исследования принципов, лежащих в основе колонизации. Тем не менее мы полагаем, что масса современных данных указывает на три основных условия, которые должны быть выполнены, чтобы метастатическая колонизация была успешной (рис. 4): (1) способность распространять и поддерживать популяцию опухолевых стволовых клеток, инициирующих опухоль; (2) способность создавать адаптивные, часто специфичные для органа, программы колонизации; и (3) развитие поддерживающей микросреды.
.
Метастатическая эволюция
Многоступенчатый процесс развития опухоли и последующего распространения метастазов, по крайней мере, поверхностно, действует как линейный путь, начинающийся в первичной опухоли и заканчивающийся макроскопическими метастатическими колониями. В действительности, однако, каждый из промежуточных этапов связан с несколькими факторами, многие из которых обсуждались выше. Аналогичным образом, процессы, которые происходят после образования метастатических колоний, и механизмы, посредством которых они развиваются, были предметом исследований и обсуждений в течение последних нескольких десятилетий. Представление о том, что опухолевая прогрессия действует в соответствии с дарвиновской моделью эволюционного роста, стало широко распространенным и влиятельным в нашем мышлении о метастатической прогрессии. Недавние геномные исследования часто выявляют тесные генетические связи между первичными опухолями и метастазами при различных типах рака, подразумевая, что по крайней мере в некоторых случаях клетки, образующие метастатическую колонию, происходят из доминантной клональной субпопуляции в первичной опухоли, которой удалось завершить все этапы, необходимые как для формирования первичной опухоли, так и для последующего многоэтапного каскада инвазии-метастазирования. В этом описании еще раз подразумевается, что генетические изменения, необходимые для завершения каскада инвазии и метастазирования, уже присутствуют в геномах распространяющихся опухолевых клеток, и что завершение этого каскада зависит только от эпигенетических изменений, но в частности и от организованных программ которые дополняют ранее приобретенные генетические мутации. Неясной в такой схеме остается природа генетических и эпигенетических изменений, и как такие изменения влияют на склонность первичных опухолевых клеток к распространению. Таким образом, может быть так, что фенотипические изменения (генетического и эпигенетического характера), которые избирательно выгодны в контексте первичного образования опухоли, могут из-за этого также сделать клетки первичной карциномы более приспособленными к распространению. Если это так, то возникающие в результате метастазы могут возникать как побочные побочные продукты развития первичной опухоли. Такая логика заставляет учитывать генетические и эпигенетические факторы, существующие в первичных опухолях, которые способствуют процессу метастазирования. На сегодняшний день данным факторам пока уделяется мало внимания. Вот вам конкретный пример: какая комбинация эпигенетических программ и соматических мутаций делает клетку первичной карциномы особенно чувствительной к индуцирующим эпителиально-мехензимальный переход гетеротипическим сигналам, позволяя ей перейти в состояние высокой степени злокачественности? Важными эпигенетическими факторами могут быть природа нормальных клеток и программы дифференцировки, которые они передают соответствующему новообразованию. В настоящее время мы обладаем относительно небольшой информацией о достоверности, с которой существующие программы дифференцировки, работающие в оригинальных клетках,а также передаются опухолевым клеткам. Такие программы вполне могут представлять доминантные детерминанты метастатического распространения и могут объяснить, почему некоторые подтипы рака человека характерно распространяются с предсказуемой частотой в конкретные места образования метастатических колоний. Без ответа остается вопрос, представляющий большой интерес: является ли метастатическая способность признаком, выбранным в ходе эволюции первичной многоэтапной опухоли, или это не что иное, как абсолютно случайные последствия прогрессирования первичной опухоли?
Динамика развития опухоли и метастазирования
Метастазирование традиционно считалось относительно поздним явлением при многоступенчатом прогрессировании опухоли. Более поздние исследования, однако, предполагают, что метастазирование может часто происходить на ранних стадиях процесса неопластической трансформации, возможно, даже до того, как опухолевые клетки полностью трансформируются. По крайней мере, в некоторых случаях это объясняется наличием предопухолевых клеток, находящихся в воспалительных микроокружениях, которые способны посредством гетеротипической передачи сигналов активировать программы эпителиально-мезенхимального перехода, что приводит к экспрессии инвазивных фенотипов. В данный вывод заложено представление о том, что эпителиально-мезенхимальный переход действует как в полностью нормальных эпителиальных клетках, так и в неопластических эпителиальных клетках, предполагая, что эпителиально-мезенхимальный переход также могут функционировать во всех промежуточных клеточных состояниях, которые определяют многоэтапное развитие первичных опухолей. Кроме того, процесс образования метастазов в некоторых моделях рака молочной железы у мышей согласуется с идеей, что распространение и, следовательно, метастазирование, являются ранними событиями во время прогрессирования опухоли. Некоторые механические детали этой программы раннего распространения недавно были описаны на мышиных моделях HER2 — положительного рака молочной железы, где на ранних стадиях формирования первичной опухоли преобладает миграционная программа, прежде чем на более поздних стадиях роста опухоли устанавливаются характерные пролиферативные пути. Оба исследования предполагают возможность того, что такие рассеянные клетки могут впоследствии вызывать явные метастазы. Однако в других случаях фактическое образование отдаленных метастазов, по-видимому, является поздним событием, которое происходит через много лет или даже десятилетий после первоначальной неопластической трансформации. И хотя само физическое распространение может быть ранним событием, оно может иметь небольшое влияние на последующие ступени каскада, которые приводят к образованию макрометастатических очагов. Иными словами, неясно, способны ли когда-либо метастатические клетки карциномы развиваться в отдаленных анатомических участках до состояния метастатических колоний с высокой степенью злокачественности и порождения метастазов, и эта ситуация представляет собой модель «параллельной прогрессии» формирования метастазирования. Были предложены две общие модели метастазирования: модель параллельной прогрессии и модель линейной прогрессии. Согласно последней, клоны, способные вызывать метастазы, возникают на более поздних стадиях онкогенеза с небольшой степенью генетической дивергенции между теми клетками в первичной опухоли, которые фактически породили метастазирование, и клетками в самом метастазировании.
Однако такая генетическая дивергенция в реальной жизни может быть очень трудно измерима, учитывая клональное разнообразие, которое могло возникнуть в первичной опухоли, и тот факт, что различные генетически различные клональные субпопуляции могут быть представлены в первичной опухоли в совершенно непредсказуемых количествах. Учитывая возможность того, что небольшая субпопуляция в первичной опухоли может служить источником метастазирования, как можно с уверенностью знать, что выборка геномов первичных опухолевых клеток соответствовала геному популяции клеток, ответственны за метастазирование и характеризующих его соматические мутации? Еще одной помехой при оценке линейного метастазирования является разница во времени между резекцией и отбором образцов первичной опухоли и метастатического очага. Фактически, в большинстве исследований проводилось сравнение первичных и вторичных (метастатических) тканей, которые были резецированы синхронно, в то время как другие сравнивали метастазы, отобранные через 17 лет после резекции соответствующих первичных опухолей, и в обоих случаях было обнаружено генетическое сходство между двумя тканями. Эти исследования подтверждают скорее модель линейной прогрессии, а не модель параллельной прогрессии, которая утверждает, что метастазирование происходит как раннее событие во время канцерогенеза, после которого первичная опухоль и диссеминированные колонии развиваются независимо в местах, удаленных друг от друга. Модель параллельной прогрессии, в свою очередь, обременена собственными сложностями. Предполагается, что клетки, распространяющиеся на ранних стадиях от первичной опухоли, способны пролиферировать в достаточной степени, чтобы приобретать дополнительные мутации, которые сделали бы их полностью трансформированными и, таким образом, способными образовывать значительные опухолевые массы. Учитывая, что метастатическая колонизация является крайне неэффективным процессом и сложностью основных адаптационных программ, маловероятно, что диссеминированные пренеопластические клетки будут фактически непрерывно размножаться после их попадания в отдаленные тканевые микроокружения; в отсутствие продолжающейся пролиферации кажется неправдоподобным, что такие клетки могут приобретать посредством стохастических мутаций сложный вид мутантных аллелей, которые в совокупности необходимы для непрерывного роста и клональной экспансии. Разрешение выбора между этими моделями метастатической прогрессии еще может быть осложнено тем фактом, что метастазы, как сообщалось, являются результатом поликлональных популяций, якобы происходящих из кластеров определенных клеток, и наблюдением того, что метастатические клоны могут переноситься между различными метастатическими очагами даже у одного и того же пациента.
Вопросы терапии и резистентности
Метастатический рак чаще всего представляет собой неизлечимое заболевание, и пациенты в конечном итоге подвергаются воздействию осложнений, возникающим в результате курса лечения, что указывает на недостаток эффективных методов терапии. Кроме того, остается неясным, являются ли клетки метастазов по своей природе более устойчивыми к терапии или они реагируют на терапию со скоростью, сопоставимой с клетками в соответствующих первичных опухолях. Показатели чувствительности метастазов, безусловно, будут соответствовать известным генетическим сходствам между первичными опухолями и их производными метастазами. Любая повышенная резистентность может быть объяснена тем фактом, что метастазы возникают из особенно агрессивных субпопуляций клеток, находящихся в первичных опухолях, или, альтернативно, из-за дальнейшей эволюции в более высокие степени злокачественности после распространения в отдаленные ткани.
Терапия первичных опухолей и метастатических очагов
Текущие терапевтические стратегии для устранения метастазов, по существу, такие же, как те, которые направлены на соответствующие первичные опухоли, за исключением хирургического вмешательства, которое редко используют для удаления метастатических отложений. В то время как клетки, которым удалось колонизировать микроокружения в отдаленных тканях, часто и возможно всегда развивали адаптивные программы, обеспечивающие их надежную пролиферацию в этих вторичных участках, остается неясным, обеспечивает ли эта «эволюция», большая часть которой достигается посредством эпигенетического перепрограммирования, повышенную терапевтическую устойчивость. Альтернативой является то, что успешная колонизация отдаленных мест зависит от приобретения адаптивных признаков, которые в конечном итоге не оказывают прямого влияния на терапевтическую резистентность. Тот факт, что метастатические поражения представляют собой субпопуляции опухолевых клеток, присутствующих в первичной опухоли предполагает, что метастатические колонии могут сильно отличаться от первичной опухоли с точки зрения их клональной архитектуры и биологии. И хотя многочисленные исследования изучали генетическое и фенотипическое разнообразие опухолевых клеток, которые составляют первичные опухоли, уровень генетической и эпигенетической гетерогенности и фенотипической пластичности, который действует при метастатическом росте, все еще остается под вопросом. Огромное препятствие для лечения минимального остаточного заболевания, которое может остаться после начальной химио- или радиотерапии, связано с тем фактом, что ДОК, по-видимому, образуют предшественники возможных метастатических рецидивов. К сожалению, почти все применяемые в настоящее время цитотоксические методы лечения преимущественно убивают пролиферирующие клетки, а не те, которые вышли из активного клеточного цикла, что делает спящие клетки по своей природе более устойчивыми практически ко всем доступным в настоящее время методам лечения. Этот резкий контраст в поведении ДОК и активных ЦОК может в конечном итоге оказаться гораздо более важным для определения восприимчивости к терапевтической элиминации, чем любые генетические или эпигенетические различия, отличающие минимальное остаточное заболевание от соответствующих первичных опухолей. Еще более усложняет разработку новых агентов, направленных на спящие метастатические отложения, тот факт, что для различных типов рака можно судить об истинной эффективности только после очень длительных периодов наблюдения, когда могут возникнуть рецидивы, которых так опасаются. Тем не менее, профилактическая адъювантная терапия, направленная на неактивные ДОК и их способность вызывать клинические рецидивы, возможно, дает наилучшую возможность для предотвращения таких последствий.
Терапевтическая резистентность
Механизмы терапевтической резистентности, приобретенные метастатическими разрастаниями, могут быть близки к тем, которые имеют место и в соответствующих опухолях В контексте направленной адъювантной терапии устойчивые к лекарственным средствам клоны могут появляться в первичных опухолях и метастатических поражениях, как это наблюдалось, например, у пациентов с ER+ раком молочной железы, получающих гормональную терапию, и пациентов с EGFR мутацией немелкоклеточного рака легких, получавших лечение ингибиторами киназы. Особый интерес для настоящей дискуссии представляют механизмы резистентности, характерные для сайтов распространения. Одна из гипотез заключается в том, что метастатическая микросреда способствует появлению биологических программ, которые придают лекарственную устойчивость. Например, сообщалось, что CXCL1/2, который активно поддерживает развитие метастазов посредством рекрутирования миелоидных клеток, также может опосредовать устойчивость к химиотерапии, обеспечивая поддержку идеи о том, что определенные черты, участвующие в распространении метастазирования, также могут способствовать терапевтической резистентности. В более общем смысле, эффект химиотерапии на первичном или метастатическом очаге может вызывать секрецию различных паракринных медиаторов из окружающих стромальных клеток, которые могут способствовать устойчивости, включая CXCL1/2, IL-6 и Timp1, WNT16B и HGF. Устойчивость к целевым ингибиторам киназы также может быть вызвана множеством секретируемых факторов, которые вырабатываются клетками карциномы уже после действия лекарственного средства. Хотя такие эффекты могут действительно способствовать появлению устойчивых к лекарствам клонов клеток в первичных опухолях, они могут действовать еще сильнее в местах метастазирования. Согласно альтернативному мнению, клетки, образующие метастазы, по своей природе не более или даже менее устойчивы к терапии, чем их аналоги в первичных опухолях. Следовательно, если бы устойчивые к лекарственным средствам наследственные метастатические клоны присутствовали в исходном новообразовании, то такие клетки сделали бы эту опухоль, а также ее производные метастазы одинаково устойчивыми к терапии. Следуя такому размышлению, основное преимущество хирургического устранения первичных опухолей заключается в уменьшении количества и разнообразия опухолевых клеток, тем самым увеличивая вероятность того, что любые резистентные к терапии варианты клонов будут удалены из организма пациента. В контексте метастатического заболевания это, по-видимому, почти всегда невозможно.
Заключение: принципы и перспективы
Как указывалось в предыдущих исследованиях, за последнее десятилетие был достигнут значительный прогресс в освещении клеточных и молекулярных программ, которые стимулируют метастазирование рака. Хотя наше понимание метастазирования остается довольно неполным, мы видим, как начинает появляться ряд общих биологических принципов. Таким образом, мы предлагаем, что можно подвести итоги имеющимся данным и сделать следующие выводы.
- Метастазирование происходит в основном через последовательный многоэтапный процесс, который можно представить как каскад инвазивного метастазирования.
- В случае карциномы программа эпителиально-мезенхимального перехода позволяет первичным опухолевым клеткам выполнять большинство, если не все этапы, связанные с физическим распространением опухолевых клеток в отдаленный участок.
- Судьба распространения клеток карциномы сильно зависит от событий, которые происходят при прохождении через кровеносную систему.
- Метастатические клетки карциномы должны избежать элиминации иммунной системой и отклонять клеточные программы, которые приводят их в состояние покоя.
- Процесс активной метастатической колонизации зависит от: распространения раковых стволовых клеток, которые могут повторно инициировать рост опухоли; способности их потомства собирать адаптивные, специфичные для органа программы колонизации; от создания микросреды, способствующей метастазированию.
Процессы, которые делают возможным физическое перемещение раковых клеток из первичных опухолей в паренхиму отдаленных тканей, находятся в пределах видимости, также их относительно немного; напротив, адаптивные программы, позволяющие раковым клеткам, возникающим из различных первичных опухолей, развиваться в различных тканевых микроокружениях, могут быть большими по количеству и не легко сводиться к общему набору основополагающих механических принципов. В то время как эти принципы формулируют общие понятия, ряд ключевых деталей, связанных с этими идеями, еще предстоит установить. Например, мы начинаем понимать, что программа эпителиально-мезенхимального перехода способна затрагивать широкий спектр клеток карциномы, но на данный момент у нас совсем мало информации о функциональной роли этих различных фенотипических состояний в метастатическом процессе. Все же другие критические вопросы о метастазировании выходят за пределы пунктов, изложенных выше. С одной стороны, пока не ясно, какие именно факторы определяют интенсивность метастатического процесса и почему некоторые пациенты имеют метастатический рак, в то время как у других пациентов может пройти много лет, прежде чем болезнь перейдет к этой стадии.
.
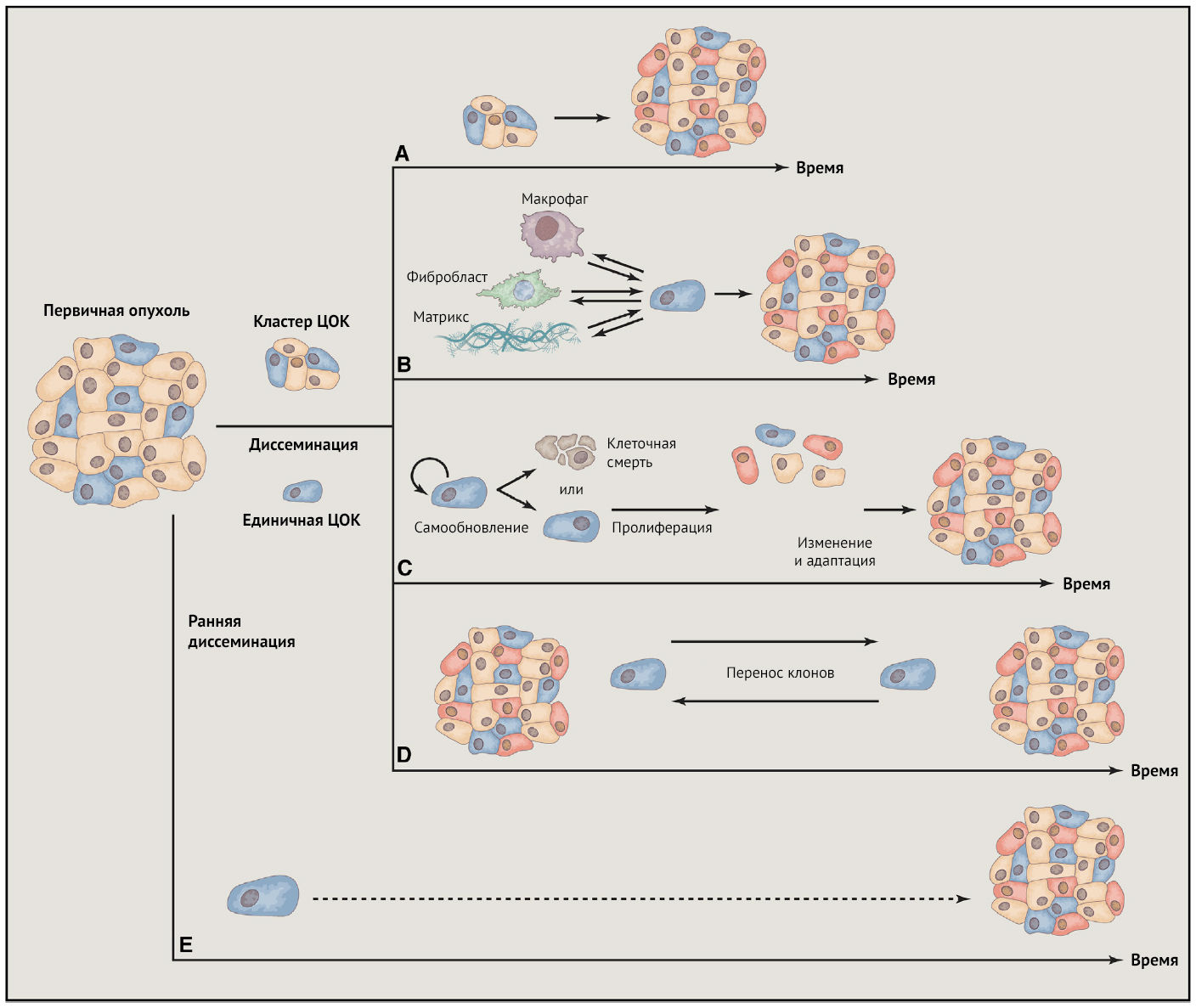
В литературе содержатся некоторые намеки, которые могли бы объяснить эту изменчивость (рис. 5), такие как различные исходные клетки первичного очага, чьи программы дифференцировки могут сильнее предрасполагать к агрессивному злокачественному образованию или распространению кластеров ЦОК, которые могут с большей вероятностью установить метастатическую колонию. Кроме того, тот факт, что у многих пациентов отмечается метастатическое распространение на несколько органов сразу, предполагает существование более универсальных, полиорганных метастатических программ, но степень, в которой действуют такие программы, пока неясна, и их биологические аспекты только начали изучаться. Наконец, клиническое и биологическое влияние различных иммунотерапевтических средств, в частности ингибиторов контрольных точек, на метастазы, несомненно, является постоянной областью интенсивных исследований, даже давая надежду на поиск и устранение метастатических отложений.
Возможно, наиболее актуальным является лучшее понимание биологических сходств и различий между первичными опухолями и их метастатическими потомками, особенно в отношении степени гетерогенности, пластичности и устойчивости, которую они проявляют. Мы считаем, что точное сравнение принципов, определяющих рост первичной опухоли, с принципами, которые определяют распространение и рост метастазов, будет иметь важное значение для разработки новых подходов и методов лечения, специально разработанных для предотвращения или лечения метастатической болезни.
