Сезонность респираторных вирусных инфекций
Во всем мире признано, что респираторные вирусные заболевания имеют сезонность. На протяжении тысяч лет словно по часам в зимний сезон ежегодные эпидемии простуды и гриппа поражают людей, проживающих в умеренном климате. Более того, эпидемии возникают благодаря вирусам, в частности таким как коронавирус, вызывающий тяжелый острый респираторный синдром (SARS-CoV), или недавно появившийся вирус, вызывающий атипичную пневмонию (SARS-CoV-2), которые наиболее активны в зимние месяцы. Механизмы, лежащие в основе сезонности респираторных вирусных инфекций, изучались и обсуждались на протяжении многих лет. Двумя основными факторами, способствующих сезонности, являются изменения параметров окружающей среды и поведения человека. Исследования выявили влияние температуры и влажности на устойчивость вирусов и скорость их передачи. Более поздние исследования подчеркивают важность факторов окружающей среды, особенно температуры и влажности, в модулировании собственных, врожденных и адаптивных иммунных реакций человека на вирусные инфекции дыхательных путей. Здесь мы рассматриваем доказательства того, что на открытом воздухе и в помещении климат связан с сезонностью вирусных респираторных инфекций. Далее мы обсудим детерминанты реакций человека в сезонности респираторных вирусных инфекций, обращая особое внимание на последние исследования в этой области.
Введение
Одно из самых ранних свидетельств зимней эпидемии респираторных инфекционных заболеваний может быть найдено в древнегреческих записях Гиппократа — «Книге эпидемий», написанной около 400 г. до н. э. С тех пор многие респираторные вирусы были идентифицированы как этиологические агенты таких эпидемий. Заметные достижения в вирусологии и иммунологии прояснили первопричину сезонности инфекций. Несмотря на значительные усилия в области здравоохранения, эпидемии вирусных респираторных заболеваний и инфекций желудочно-кишечного тракта по-прежнему широко распространены среди первоначально здорового населения и могут приводить смерти. Расходы на борьбу с простудой в Соединенных Штатах Америки составляют 40 млрд. долл. США в год и более 87 млрд. долл. США в год на борьбу с гриппом. Кроме того, вирусные эпидемии, такие как эпидемии коронавируса, который вызывает синдром тяжелого острого респираторного синдрома 2002–2003 гг., (SARS-CoV) и недавно появившегося SARS-CoV-2, происходящие в зимние месяцы, указывают на то, что зимняя среда способствует распространению различных респираторных вирусных инфекций.
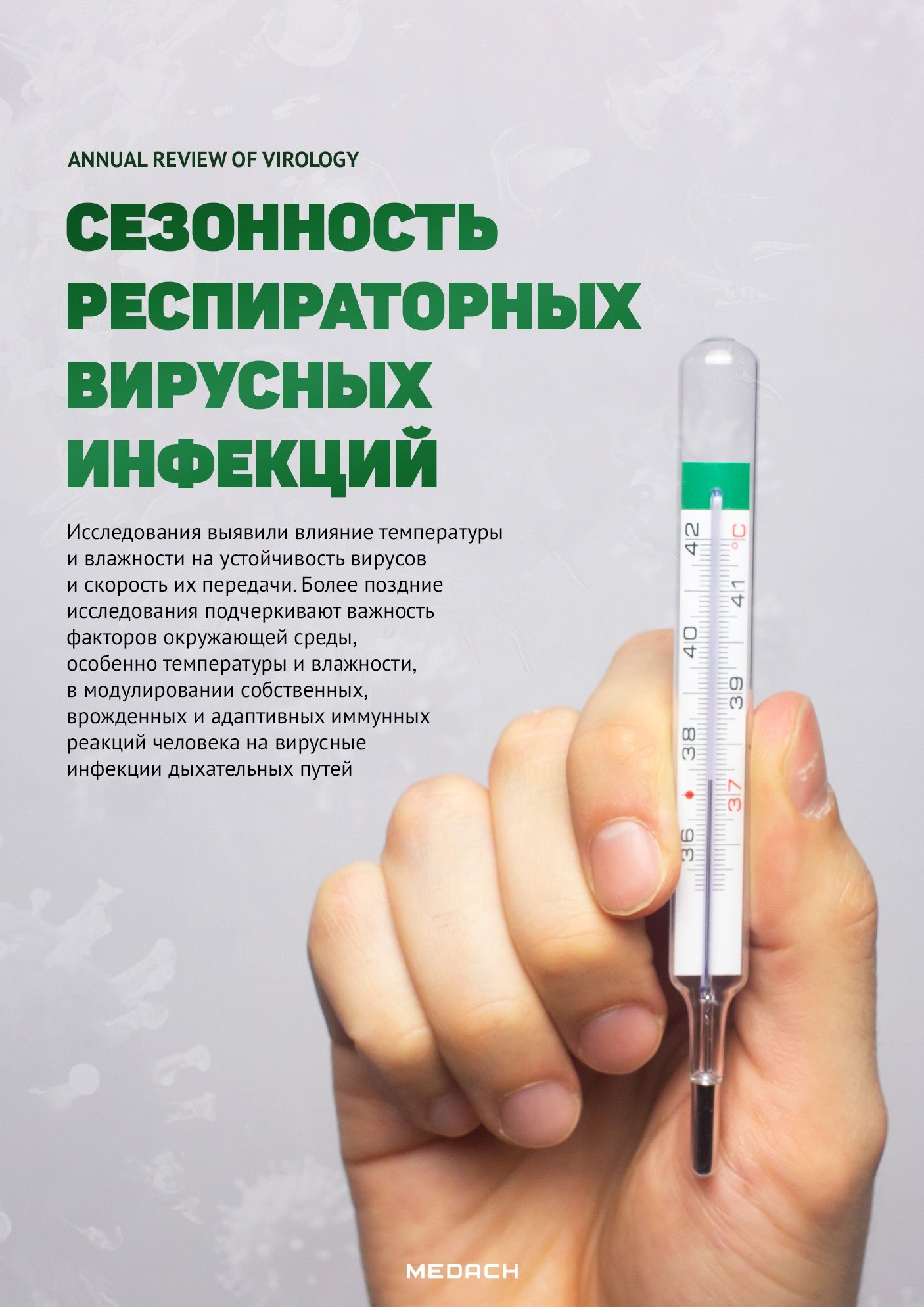
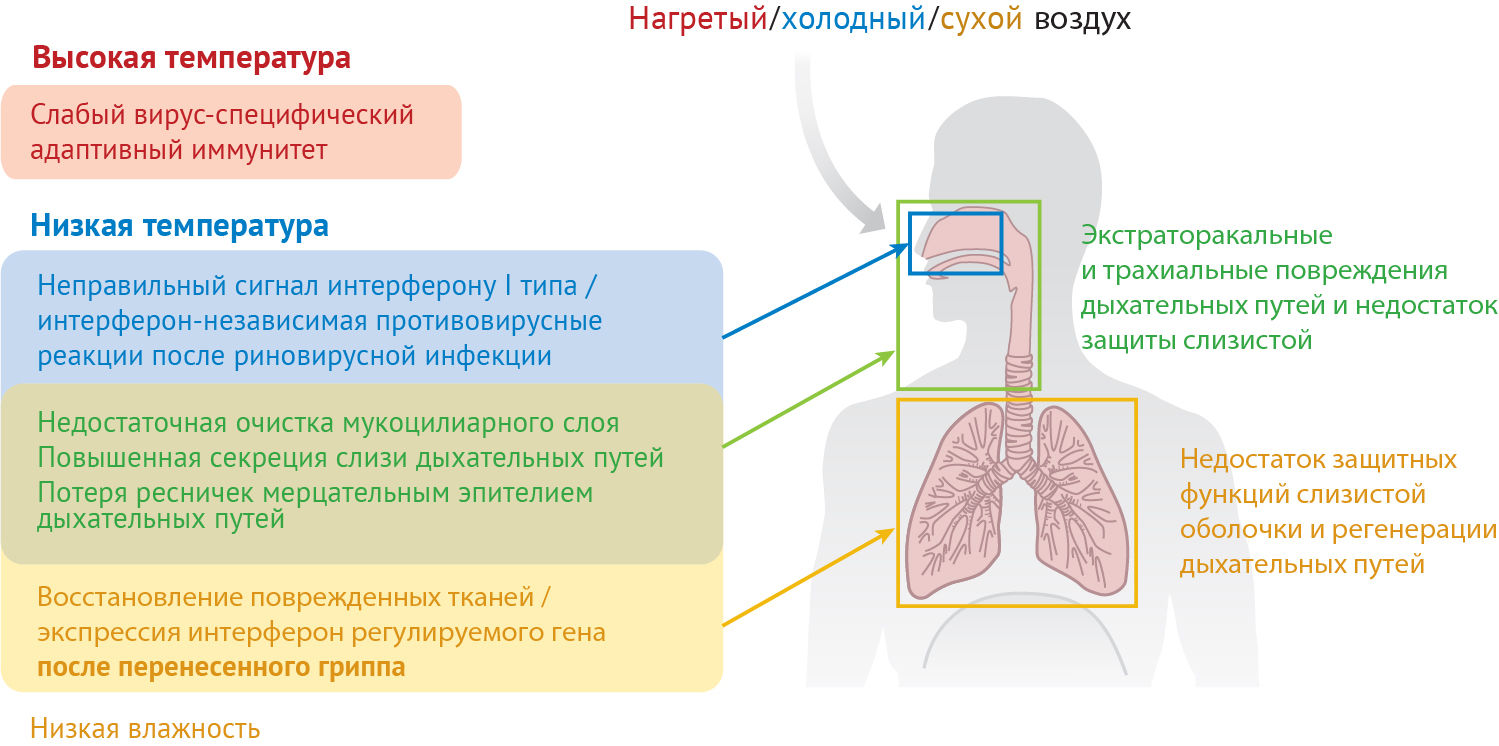
Накопленные результаты исследований указывают на возможные сезонные детерминанты в эпидемиях респираторных вирусов. К ним относятся сезонные изменения температуры, абсолютной влажности (АВ), солнечного света, витаминного статуса и поведения человека — хозяина вируса. Эти предложенные факторы можно классифицировать как сезонные изменения окружающей среды, человеческие поведенческие и вирусные факторы (рис. 1).
Экологические факторы влияют на восприимчивость человека, стимулируя защитные механизмы дыхательных путей и влияя на жизнеспособность и передачу респираторных вирусов.
Поведенческие модели людей влияют на скорость контакта между инфицированными лицами и восприимчивость отдельных лиц. Среди потенциальных факторов сезонности и в качестве критического фактора сезонного роста респираторных вирусных заболеваний были предложены колебания температуры и абсолютной влажности в течение года, особенно в контексте инфекционных эпидемий в зимний сезон. Данный обзор фокусируется на том, как сезонные факторы окружающей среды влияют на передачу инфекции и реакцию дыхательных путей человека на вирусы и как изменения в иммунной системе человека в конечном итоге приводят к тому, что имеется сезонность вспышек вирусных инфекций.
Влияние сезонного климата на микроклимат в помещении
Термин «сезонная инфекция» ассоциирует конкретную инфекцию с определенным сезоном года. Следовательно, предполагаемая связь между инфекциями и сезонным климатом рассматривается как причинно-следственная. Это было до некоторой степени верно, когда люди жили и работали на открытом воздухе с минимальной защитой даже от самых суровых климатических условиях. Промышленные революции изменили все это. Рабочие места на открытом воздухе в сельской местности были перенесены на фабрики и в офисы, что привело и к перемещению туда людей.
При повсеместном внедрении центрального отопления и все более герметичных, изолированных зданий, в закрытом помещении стал поддерживаться постоянный диапазон температурного комфорта, что привело к еще большему разрыву между микроклиматом помещения и сезонных колебаний климата. Такое разобщение особенно заметно в зимнее время, когда отопление внутри помещений вызывает значительное различие внутренней и наружной температуры и относительной влажности воздуха (ОВ), но не влияет на АВ. Показатели измерения внутренней влажности в 40 жилых квартирах в Нью-Йорке и в 6 высококачественных коммерческих зданиях на Среднем Западе составили не то менее 24 % ОВ зимой. Таким образом, в зимнее время низкая АВ на открытом воздухе переходит в низкую внутреннюю относительную влажность, в пределах комфортного диапазона температур от 20 до 24°C.
Количество контактов между людьми значительно увеличивается в рабочие дни по сравнению с выходными днями, в то время как погодные условия, такие как дождь, солнце и холод, оказывают незначительные влияния на контакт между этими людьми. Эти результаты противоречат часто озвучиваемой идее о том, что сбор в помещении из-за неприятных погодных условий оказывает соответствующее влияние на сезонность инфекций. В промышленно развитом мире большинство людей взаимодействуют, работают, спят, ездят на работу и проводят 90 % своей жизни в закрытых помещениях где объем вдыхаемого воздуха ограничен.
Это означает, что подавляющее большинство передач возбудителя от человека к человеку происходят в помещениях. Следствием этого является то, что климат в помещении и темпы изменения воздуха, модулируемые внешними сезонными условиями, являются ключевыми факторами сезонной динамики в эпидемиологии. Кроме того, воздействие внешних условий способствует изменению защиты дыхательных путей на существующий вирус. Многочисленные факторы, описанные на рисунке 1, модулируют пространственно-временное начало и прогрессирование сезонных респираторных вирусных инфекций. С учетом этого, сосредоточившись на регионах с умеренным климатом, нам предстоит обсудить важность экологических факторов для передачи респираторных вирусов и иммунной реакции организма.
Сезонность респираторных вирусов в человеческой популяции
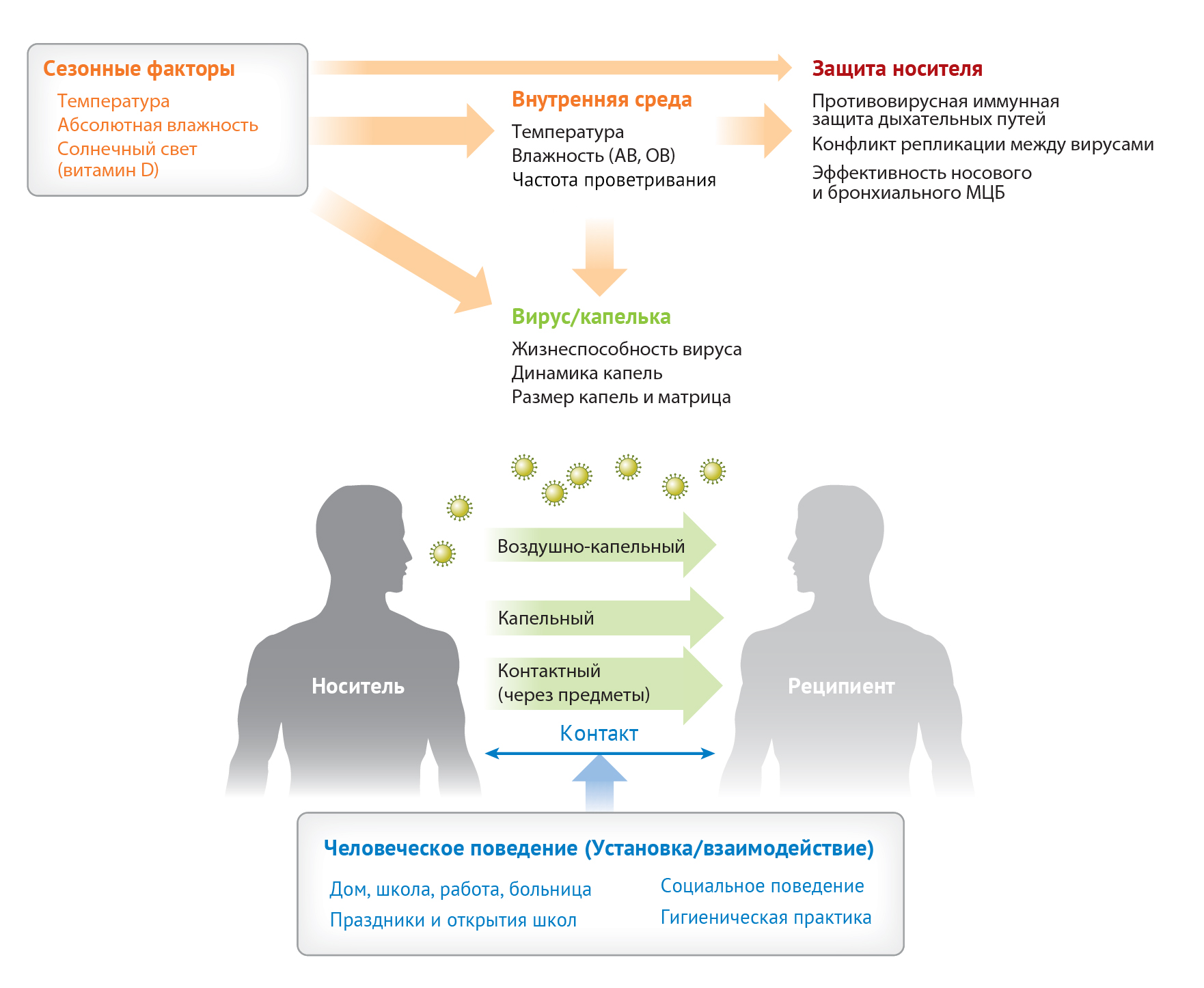
На сегодняшний день выявлено по крайней мере девять различных вирусов в качестве общих возбудителей инфекции дыхательных путей. Согласно эпидемиологическим исследованиям, проведенным в регионах с умеренным климатом, большинство респираторных вирусов склонны к сезонным вспышкам (рис. 2). Вирус гриппа, коронавирус человека и респираторно-синцитиальный вирус человека (RSV) демонстрируют пиковую активность в зимние месяцы (поэтому их иногда называют зимними вирусами). И наоборот, аденовирус, бокавирус человека, метапневмовирус человека (hMPV) и риновирус вызывают заболевания на протяжении всего года (круглогодичные вирусы). Для некоторых энтеровирусов характерно увеличение частоты заболеваемости летом (летние вирусы). Несмотря на то, что уровень заражения достигает пика весной и осенью, зимой тяжесть заболевания, вызванного риновирусной инфекцией, возрастает. Кроме того, вирус парагриппа (PIV) демонстрирует специфическую для данного типа сезонную циркуляцию (рис. 2).
Конфликты репликации среди этих респираторных вирусов могут способствовать тому, что пики их заболеваемости не будут перекрещиваться друг с другом. Эпидемиологическими наблюдениями было установлено, что пики заболевания вирусом гриппа и РСВ в один и тот же период не перекрещиваются, несмотря на то, что зимой преобладают и те, и другие. Во время пандемии гриппа в 2009 г. было установлено, что распространение риновируса задерживает наступление пандемии гриппа в Европе. Используя статистические методы анализа, недавнее исследование показало сильное негативное взаимодействие между вирусом сезонного гриппа А и риновирусом как на популяционном, так и на индивидуальном уровне. Было предложено несколько возможных механизмов, препятствующих перекресту, в том числе сбой в работе взаимодействия поверхностного вирусного рецептора к клетке, клеточной смерти или реакции интерферона макроорганизма (IFN). В качестве защитных механизмов также были предложены защитные интерфероны для борьбы с генетически близкими вирусами, такими как PIV, hMPV и RSV.
Влияние экологических факторов на устойчивость и передачу респираторных вирусов
Устойчивость респираторных вирусов
В современной литературе имеются многочисленные данные, которые говорят о корреляции устойчивости вируса гриппа, находящегося во взвешенных каплях, со степенью испарения капель и связанной с этим перенасыщенностью этими каплями воздуха. Состояние парового равновесия воздуха в помещении выражается в коэффициенте насыщения или относительной влажности (ОВ), которое применимо ко всем каплям, в том числе и к респираторными вирусами, независимо от их источника происхождения, будь то дыхательные пути или аэрозольные частицы из любой другой жидкости, а также места нахождения, в воздухе или на поверхностях.
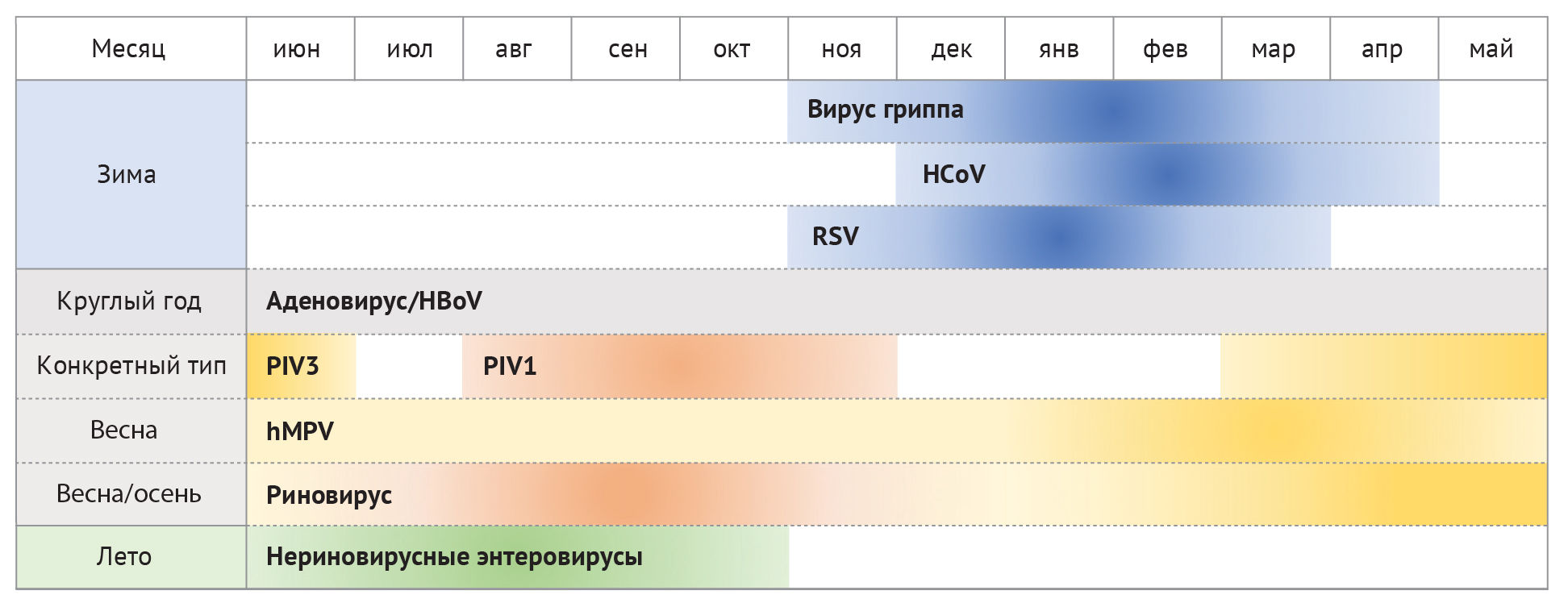
Таким образом, ОВ влияет на все способы передачи, но имеет наиболее выраженное влияние на передачу воздушно-капельным путем. Исследования передачи вируса у животных на морских свинках и хорьках показали, что равновесное состояние при высоком (> 60 %) и низком (< 40 %) уровне ОВ, по-видимому, обеспечивает жизнеспособность вирусов гриппа в капельках, в то время как при промежуточном (40–60 %) уровне ОВ вирусы становятся инактивными (табл. 1). Предполагается, что температура и влажность модулируют жизнеспособность вирусов, влияя на свойства вирусных поверхностных белков и липидные мембраны. Эксперименты на жизнеспособность различных респираторных вирусов проводились в аэрозольных камерах с контролируемой температурой и ОВ. Определенное количество вирусов было распылено в растворе, содержащем соли и белки, а скорость распада вирусов измерялась с помощью анализа осевших частиц. Полученные результаты свидетельствуют о поразительной корреляции стабильности вирусов зимой при низкой ОВ (20–50 %), в то время как при более высокой ОВ (80 %) устойчивость вирусов летом или в течение всего года повышалась. В более ранних исследованиях изучалась жизнеспособность вируса аэрозольного гриппа при различных температурах и ОВ.
Таблица 1 | Капельная передача при различных показателях относительной влажности
Эти исследования показали, что температура в зоне комфорта и низкая относительная влажность воздуха, типичные для зимы условия внутри помещений в умеренном климате, способствуют медленной инактивации вируса гриппа. Совсем недавно аналитический химический подход показал, что низкотемпературные условия способствуют упорядочению липидов на вирусной мембране, что приводит к стабильности частиц вируса гриппа.
Передача респираторных вирусов
Созданы модели передачи вируса гриппа у мышей, хорьков и морских свинок. Ранее проведенные исследования с использованием специализированного аппарата для передачи вируса между мышами продемонстрировали возможность того, что сухой и не вентилируемый воздух может увеличить возможность распространения вирусной инфекции гриппа в зимнее время. Скорость передачи между инфицированными и не инфицированными мышами, помещенными в одну клетку, была увеличена при 47 % ОВ в сравнении с 70 % ОВ, а также при условиях меньшей вентиляции. Поскольку передача гриппа между инфицированными и не инфицированными мышами осуществлялась просто за счет помещения их в одну клетку, в экспериментах использовались адаптированные для мышей вирусы гриппа. В отличие от мышей, морские свинки способны к передаче патогенных вирусов гриппа человека и обладают некоторыми сходными с человеком свойствами, такими как наличие функционального антивирусного гена Mx GTPase и рецептора сиаловой кислоты человеческого типа (α2-6) в эпителии верхних дыхательных путей.
Благодаря этим преимуществам было исследовано влияние температуры и влажности на передачу вируса гриппа у морских свинок. Четыре пары инфицированных и неинфицированных морских свинок были помещены в климатические камеры таким образом, чтобы поток воздуха был направлен от инфицированных к не инфицированным морским свинкам. Эффективность передачи оценивалась по проникновению вируса в носовые ходы от зараженных к не зараженным животным. При температуре 20°C передача вируса гриппа при высокой ОВ (80 %) не наблюдалась. Напротив, при низкой ОВ (∼20–35 %) при 20°C передача вируса была высокой. Вирусная передача обычно была более эффективна при 5°C по сравнению с 20°C. Следует отметить, что при температуре окружающего воздуха 5°C передача вируса была возможной даже при 80-процентной относительной влажности воздуха. Одним из возможных объяснений этого результата могло быть снижение резистентности слизистой оболочки и повышение стабильности вириона, оставшегося на слизистой оболочке верхних дыхательных путей при 5°C.
Другое возможное объяснение заключается в том, что при 5°C и абсолютной влажности ∼5.5 г/м3, возможность заражения намного меньше, чем при 20°C и АВ ∼14 г/м3, хотя ОВ остается прежней (80 %). В отличие от регионов с умеренным климатом, респираторные инфекции в тропических регионах имеют незначительную сезонность. Исследование, сфокусированное на этом аспекте, показало, что при 30°C при любой влажности воздуха не наблюдалось аэрозольной передачи, несмотря на то, что передача контактным путем была сопоставима как при 30, так и при 20°C. Таким образом, высокая температура окружающей среды, вероятно, сводит на нет влияние влажности на передачу гриппа в тропических зонах. На основе этих результатов Lowen & Palese предсказывают, что аэрозольная передача преобладает в течение зимнего сезона в умеренных регионах (потому что сухой и теплый климат внутри помещений позволяет вирусам гриппа сохранять стабильность в каплях, которые находятся в воздухе в течение длительного времени), в то время как контакт является основным способом распространения вируса в тропиках (потому что в теплом и влажном климате капельки испаряются меньше и легко оседают на поверхности). Эта гипотеза проиллюстрирована в таблице 1 и оказывает значительное влияние на принятие надлежащих мер предосторожности и по борьбе с респираторными вирусными инфекциями в различных частях мира и в различные сезоны.
В последнее время хорьки используются для оценки значимости условий окружающей среды по передаче вируса гриппа. В соответствии с результатами, полученными в ходе предыдущих исследований с использованием мышей и морских свинок, эффективность передачи капель из дыхательных путей между хорьками была признана наиболее эффективной при температуре 23°С и 30 % ОВ и наименее эффективной при температуре 23°С и 50 % ОВ и 5°С и 70 % ОВ. Помимо вывода о том, что низкий уровень ОВ увеличивает вероятность передачи аэрозольного гриппа, существует еще один нюанс: скорость распространения аэрозольной вирусной инфекции падает при промежуточном уровне ОВ в атмосфере. Лоуэн и др. отметили, что передача между морскими свинками была неэффективна при 50-процентном уровне ОВ и более эффективна как при низком (20–35 %), так и при высоком (65 %) уровне ОВ при 20°C. Аналогичным образом, скорость передачи между хорьками при 30 % и 70 % ОВ была выше, чем при 50 % ОВ при 20°C. Это явление согласуется с результатами, показанными при моделировании распространения аэрозольной инфекции мышей. В этом исследовании была изучена заболеваемость мышей, подвергшихся воздействию вирус-содержащей атмосферы при различных значениях ОВ при температуре ∼22–24°C. При ОВ ∼40–60 % 77,5 % подвергшихся воздействию мышей выжили, несмотря на то, что они были подвержены действию атомизированной вирусной суспензии, достаточной для того, чтобы убить всех подвергшихся воздействию мышей при ОВ 23 % . Поэтому идеальная влажность для предотвращения аэрозольной респираторной вирусной передачи при комнатной температуре, по-видимому, составляет от 40 % до 60 %.
Влияние экологических факторов на противовирусную резистентность дыхательных путей
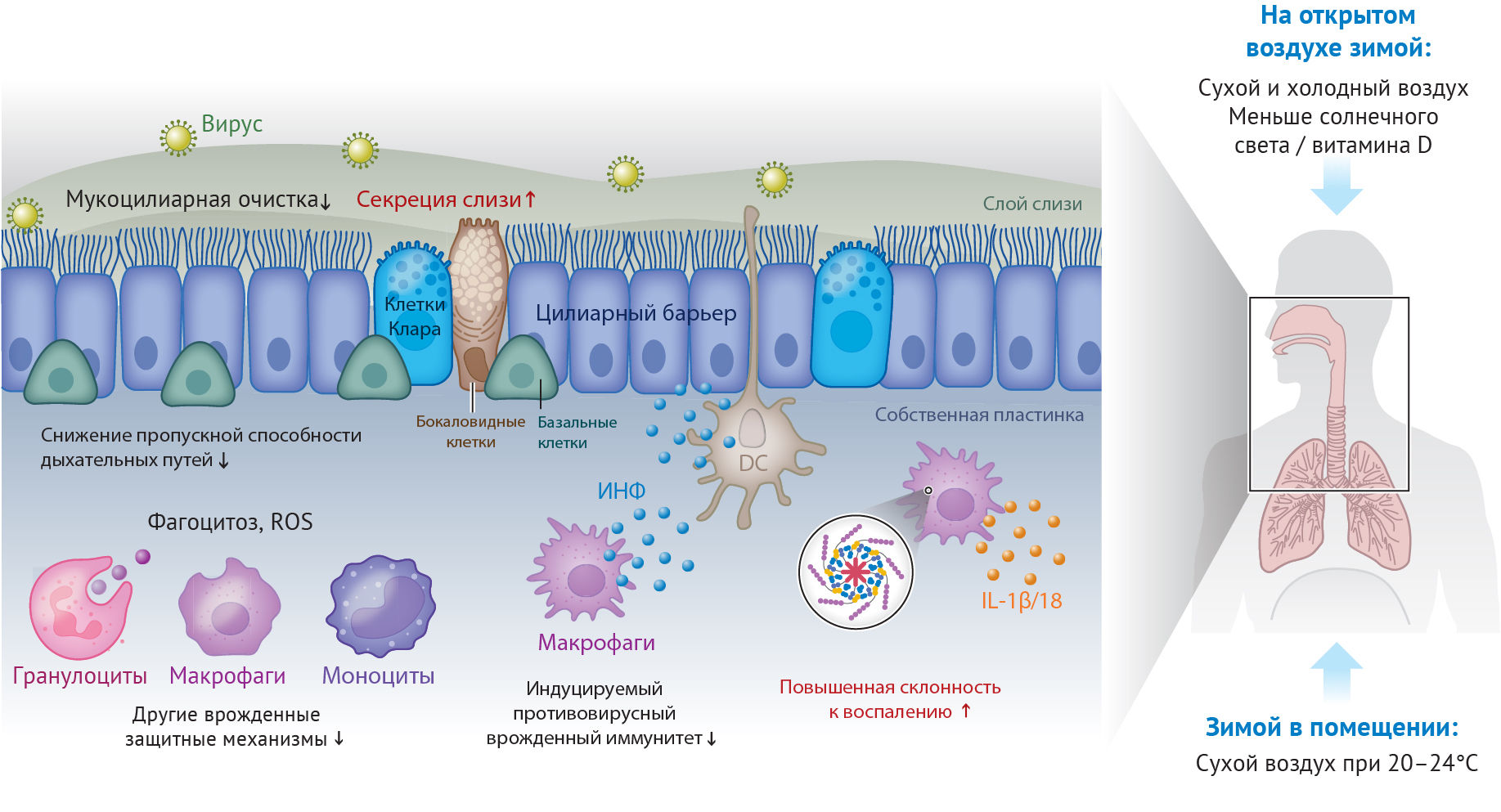
Слизистая поверхность дыхательных путей постоянно подвергается воздействию окружающей среды. Вдыхаемый воздух содержит летучие и нелетучие загрязняющие вещества и потенциально патогенные микроорганизмы. Многоуровневая защитная система дыхательных путей предотвращает заражение вдыхаемыми вирусами. Показано, что сезонные колебания температуры и влажности вдыхаемого воздуха оказывают непосредственное влияние на защитные свойства слизистой оболочки дыхательных путей на нескольких уровнях (рис. 3). В этом разделе мы сосредоточимся на факторах окружающей среды, оказывающих влияние на противовирусную резистентность дыхательных путей человека.
Внутренние барьеры
Внутренний барьер обеспечивает первую линию защиты от респираторных вирусов на слизистой оболочке дыхательного эпителия. Различный состав эпителия в различных частях дыхательных путей создает барьерную защиту, зависящую от диаметра дыхательных путей.
Эпителиальные клетки представляют собой эффективный механический барьер.
Кроме того, слизь, выделяемая из подслизистых желез в более крупных дыхательных путях, создает химический барьер на поверхности слизистой оболочки.
b. Сухой воздух приводит к повышению вязкости слизи и к снижению активности ресничек: они прижимаются к поверхности клеток и тем самым уменьшается высота перицилиарного слоя.
Выделение слизи
Вирус сначала должен найти эпителиальные клетки, чтобы вторгнуться в них. Слои слизи могут эффективно поймать вирус до того, как он попадет в клетки хозяина (рис. 4). Слизь, выделяемая из подслизистых желез, служит механическим и химическим барьером. Компоненты слизи включают в себя: 93– 97 % воды, 3–7 % твердых веществ, 1–3 % гликопротеинов, 1 % ж/б белков, 0,5–1 % липидов и 0,70–1,4 % минералов. Основными гликопротеинами в слизи дыхательных путей являются секреторные муциновые белки MUC5AC и MUC5B. Холодная окружающая среда ассоциирована с обострением хронической обструктивной болезни легких (ХОБЛ), которая проявляется в хронической обструкции воздухоносных путей, воспалении и гиперсекреции слизи. Нормальные человеческие бронхиальные эпителиальные (NHBE) клетки, содержат термочувствительные ионные каналы (TRPM8), которые являются холодовыми рецепторами и активируются при температуре ниже 27°C или при использовании охлаждающих веществ, например, ментола. Кроме того, холодовое (18°C) воздействие или ментоловая обработка культивированных клеток NHBE увеличивает секрецию MUC5AC в зависимости от количества TRPM8. В другом исследовании изучался эффект температуры, влажности и воздушного потока, имитирующих дыхание при выделении муцина из организма человека клетками эпителия носа, используя климатическую камеру для выращивания клеток. Увеличение выработки муцина наблюдалось при температуре ниже 25°С и относительной влажности 40 % по сравнению с 37°С и ОВ 80 %. Воздушный поток увеличил производство муцина при 25°C и 40 % относительной влажности, но не при 37°C и 80 % ОВ . Эти результаты свидетельствуют о том, что низкая температура и низкая влажность индуцируют гиперсекрецию муцина.
Целостность эпителия дыхательных путей
Дыхательные пути имеют слизистую поверхность I типа, которая покрыта однослойным мерцательным эпителием. Этот эпителий служит второй линией защиты после слоя слизи для обеспечения физического барьера защиты. Немедленная регенерация эпителия дыхательных путей имеет решающее значение для поддержания целостности дыхательных путей. Исследование с использованием морских свинок показало, что экспериментально поврежденные дыхательные пути восстанавливаются в течение 8–15 часов. Эпителиальные клетки на краю поврежденной зоны быстро мигрируют и сплющиваются, чтобы покрыть поврежденную зону, после чего происходит повторная эпителизация. Вдыхание сухого воздуха вызывает немедленную потерю эпителиальных ресничек дыхательным эпителием, отслоение эпителиальных клеток и воспаление трахеи морских свинок. Более того, воздействие сухого воздуха на мышей нарушает восстановление эпителиальных клеток в легких после гриппа. Нарушение целостности эпителия дыхательных путей, вызванное вдыханием сухого воздуха, может приводить к эпидемии определенных типов респираторных вирусных инфекций.
Мукоцилиарный барьер
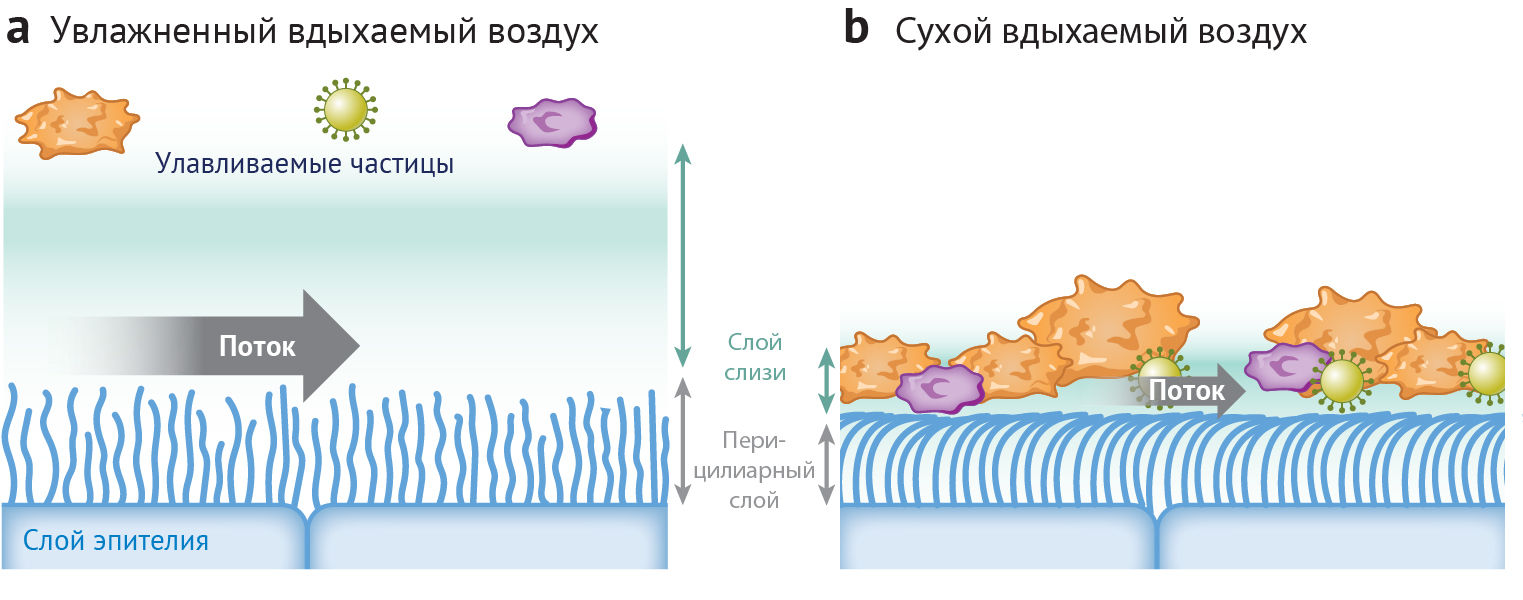
Мукоцилиарный барьер (МЦБ) служит ключевым механизмом для устранения вдыхаемых болезнетворных микроорганизмов и раздражающих агентов с эпителиальной поверхности дыхательных путей. Двойной слой слизи с различной вязкостью обеспечивает эффективную работу МЦБ (рис. 4). Вязкий слой, обращенный в просвет дыхательных путей, захватывает микрочастицы и микроорганизмы, а нижний, обращенный к стенкам воздухоносных путей (перицилиарный слой), участвует в передаче инерции от реснитчатых клеток к верхним слоям слизи для перемещения микроорганизмов в сторону движения ресничек.
Вдыхание холодного воздуха, который всегда сухой, приводит к ухудшению качества работы МЦБ. Исследование влияния температуры окружающей среды на цилиарный ритм, частоту движения реснитчатых клеток носа и трахеи, выделенных от человека, показало, что эффективность работы слизи начинает снижаться по мере понижения температуры ниже 20°С и совсем не наблюдается при 5°C. Другие исследования, посвященные МЦБ при различных физиологических показателях установили, что вдыхание холодного воздуха замедляет скорость работы МЦБ у цыплят. Более новые исследования показали, что преинкубация мышей в среде с низким уровнем ОВ (10 %) снижает эффективность работы МЦБ по сравнению с 50 % ОВ, что приводит к ослаблению очистки ВДП. Учитывая, что МЦБ зависит от количественного содержания двойного слоя слизи с двумя разными вязкостями, а также осмотического баланса, надлежащее увлажнение слизи необходимо для ее эффективной работы.
Исследование взаимосвязи между температурой и влажностью вдыхаемого воздуха и свойствами слизистой дыхательных путей выявило, что 100 % ОВ является оптимальным показателем для эффективной работы слизистых оболочек и защиты дыхательных путей у человека. Обезвоживание слизистой оболочки, вызванное вдыханием воздуха низкой влажности приводит к снижению эффективности МЦБ. Потеря влаги из верхнего слизистого слоя влечет за собой и потерю влаги в перицилиарном слое, что ведет к уменьшению его толщины и обездвиживает реснички эпителия (рис. 4).
Значимость достаточной влажности в носу, трахее и бронхах была подробно изучена на животных. У людей также был исследован носовой МЦБ. Эти исследования показали, что носовой МЦБ не повреждается сухим воздухом у молодых и здоровых людей, но скорость регенерации слизистой оболочки постепенно снижалась у 174 испытуемых (разного возраста и пола) при сокращении ОВ вдыхаемого воздуха с 70 % до 20 %. Одно из исследований показало, что на скорость регенерации слизистой оболочки влияет альтернативное одностороннее торможение дыхания носовых полостей, обусловленных особенностью носовых циклов. Вентиляция пациентов с анестезией ненагретыми (< 37°C) и не насыщенными водой анестезирующими газами приводит к снижению активности цилиарной системы, повреждению клеток и, в конечном счете, гибели эпителиальных клеток бронхов.
Индуцируемый противовирусный врожденный иммунитет
Внутренние иммунные реакции, индуцированные в ответ на вирусную инфекцию, обеспечивают защиту в пределах слизистой оболочки дыхательных путей. Многочисленные классы врожденных иммунных сенсоров распознают вирусы, связывая молекулярные структуры для инициирования противовирусного ответа, включая выработку интерферонов (ИНФ) типа I и тип III. Эти ИНФ являются ключевыми эффекторными цитокинами, которые передают сигнал через свои рецепторы на соседние клетки к запуску экспрессии сотен интерферон-стимулированных генов (ИНФСГ). Эти ИНФСГ действуют на различных стадиях цикла репликации вируса, оказывая противовирусное действие. Влияют ли факторы окружающей среды на противовирусный врожденный иммунитет человека, ранее было неизвестно. Недавние исследования показывают, что зависящие от времени года факторы окружающей среды, такие как температура и влажность, могут повлиять на врожденный противовирусный иммунитет человека, направленный против респираторных вирусных инфекций.
Известно, что в культуре тканей риновирусы реплицируются гораздо лучше при температуре 33°C, что имитирует низкую температуру в носовой полости относительно температуры ядра тела, которая в частности фиксируется и в нижних дыхательных путях (37°C).
Почему вирус обладает высокой способностью к репликации при низкой температуре? Исследование, сосредоточенное на изучении влияния температуры окружающей среды на клетки хозяина, показало, что репликация риновируса при 33°C имеет отношение к неэффективной антивирусной реакции носителя при этой температуре.
При 33°C риновирусы индуцируют выработку лишь небольшого количества интерферонов типа I из инфицированных эпителиальных клеток дыхательных путей. Более того, отключается ключевая сигнальная молекула врожденного вирусного сенсора — MAVS, необходимого для выработки ИНФ типа I из клеток носителя.
Все эти результаты показывают, что устойчивая противовирусная реакция носителя при температуре ядра тела может блокировать распространение риновируса в нижних дыхательных за счет своевременной выработки интерферонов. Кроме того, исследование показывают, что воздействие на нос более холодного воздуха в зимний период может обеспечить надежную репликацию риновируса.
В дополнение к производству ИФН, последующие исследования показали, что как апоптоз, так и противовирусная рибонуклеаза RNase L при теплой температуре дают зависящую от температуры противовирусную устойчивость к риновирусу. Эти исследования в совокупности позволяют предположить, что эффективная репликация риновируса при более низкой температуре в носовой полости при вдыхании холодного воздуха зимой частично обусловлена ослаблением врожденных иммунных реакций человека. И наоборот, поддержание носа в тепле во время зимы может повысить врожденную антивирусную устойчивость. Одной из наиболее известных связей между экологическим фактором и заболеванием гриппа является снижение уровня абсолютной влажности. Сезонным эпидемиям и повышению смертности от вируса гриппа предшествует снижение уровня АВ во время зимнего сезона в США. Как низкий уровень АВ влияет на сезонную эпидемию гриппа? Как объяснялось выше, низкий уровень АВ приводит к низкому уровню ОВ в микроклимате помещений. Подсказка на этот вопрос пришла из недавнего исследования на мышах, которые подвергались воздействию низкого уровня ОВ в пределах 10–20 %. Используя мышей с функциональным геном миксовирусной устойчивости 1 (Mx1) — ключевым ISG, который ограничивает репликацию вируса гриппа, отсутствующего в большинстве инбредных штаммов мышей, исследование показало, что мыши Mx1, помещенные в среду в 10–20 % ОВ, быстрее заражались вирусом гриппа, чем мыши, размещенные в среде с 50 % влажности . Исследование выявило, по крайней мере, три отдельных механизма, которые могут способствовать восприимчивости мышей к вирусу при низкой влажности. Во-первых, как описывалось выше, МЦБ сильно страдает при низкой влажности. Во-вторых, воздействие низкой влажности нарушает механизмы восстановления тканей дыхательных путей. В-третьих, анализ секвенирования РНК легочной ткани, собранной у мышей Мх1, показал, что воздействие сухого воздуха уменьшает выработку ИНФ после инфицированием вирусом интраназального гриппа. Вывод заключается в том, что экспрессия ИНФ была нарушена не только в эпителиальных клетках дыхательных путей, но и внутри клеток. Как именно сухой воздух влияет на реакцию выработки ИФН в дыхательные пути в настоящее время неизвестно.
Другие врожденные защитные механизмы
Прямая клиренсация патогена при фагоцитозе или выработке свободных радикалов, играет важную роль в качестве неспецифического иммунного ответа. Сезонные колебания дневного светового периода модулируют физиологическую активность различных видов млекопитающих через выработку мелатонина. Воздействие на сибирских хомячков короткого светового дня (8 ч) снизило фагоцитотическую активность и РВК-производство гранулоцитами и моноцитам по сравнению с воздействием длинного светового дня (16 ч). Напротив, короткий световой период увеличивал естественную цитотоксичность клеток-киллеров. Биосинтез витамина D также модулируется солнечным светом. В течение зимнего сезона витамин D находится в дефиците и это обычное явление. Полученные макрофаги из культуры костного in vitro, взятых от мышей с дефицитом витамина D, имеют нарушения в созревании, а также в выработке поверхностного антигена, лизосомальных ферментов и выработке H2O2. В целом, эти данные говорят о коротком световом дне как о факторе, способствующем нарушению врожденных иммунных реакций в зимний период.
Вирусно-специфический адаптивный иммунитет
Адаптивный иммунитет обеспечивает высоко специфическую и долговременную защиту от инфекционных агентов. Инициирование адаптивного иммунитета начинается тогда, когда антигенпрезентирующие клетки стимулируют молодые Т-клетки к активации и дифференцировке в эффекторные Т-клетки, которые обеспечивают противовирусные реакции на месте заражения. Т-фолликулярные вспомогательные клетки также играют важную роль в стимулировании активации и дифференцировки В-клеток для производства противовирусных антител.
Помимо респираторных вирусных инфекций, усиленные эффекторные Т-клеточные ответные реакции у мышей, размещенных при более высокой температуре, были описаны в контексте противоопухолевого иммунитета, а также в рамках трнасплонтационной болезни (ТЦБ). У мышей, размещенных при более высокой (30°C), термонейтральной температуре для мышей, рост опухоли подавлялся по сравнению с типичной температурой размещения при 22°C за счет увеличения количества антиген-специфичных CD8+ T клеток. Следовательно, у мышей, размещенных при 30°C, чувствительность к лечению рака поджелудочной железы была выше, чем у мышей, размещенных при 22°C. Аналогичным образом, трансплантация основных комплексов гистосовместимости — несовместимых клеток костного мозга — вызывает у мышей, размещенных при 30°C, тяжелую форму ТЦБ, в то время как мыши, размещенные при 22°C, устойчивы к наступлению ТЦБ при данном лечении. Эти исследования позволяют предположить, что температура тела человека может влиять на адаптивные иммунные реакции в целом, и предполагают, что вакцины следует применять при оптимальной температуре, чтобы вызвать максимальный иммунитет.
В контексте респираторной вирусной инфекции недавнее исследование показало, что высокая температура окружающей среды, имитирующая летнюю жару, ослабляет вирусный адаптивный иммунитет после инфицирования вирусом гриппа мышей. Исследование показало, что тепловое воздействие на мышей (36°C) ослабляет вирусно-специфические клеточные реакции CD8+ T и выработку антител после инфицирования вирусом интраназального гриппа. Эти ослабленные противовирусные иммунные реакции у мышей, подвергшихся тепловому воздействию, были частично восстановлены с помощью добавок глюкозы или короткоцепочечных жирных кислот, что указывает на роль диеты и микробиома в ослаблении иммунитета при тепловом воздействии. Согласно докладу Центра по контролю и профилактике заболеваний, все шесть недавних пандемий гриппа, произошедших в Северном полушарии в 1957–2009 годах, были весенне-летними. Роль аномальных температурных колебаний в пандемиях гриппа станет еще более актуальной в связи с усиливающимся влиянием глобального потепления и изменения климата.
Влияние экологических факторов на сопротивляемость респираторным вирусам дыхательных путей
Обезболивание— это способ, позволяющий повысить эффективность борьбы с инфекцией путем снижения последствий после повреждения тканей, вызванного патогенными микроорганизмами или иммунными ответами самого организма, не оказывая прямого воздействия на патогенное звено. Например, смертельные и патологические последствия инфекции гриппа у TLR7 и мышей с MAVS-дефицитом Мх1 переносились при отсутствии каспазы-1/11, не влияя на вирусную нагрузку. Данное исследование показало, что летальность гриппозной инфекции при отсутствии врожденной резистентности обусловлено воспалительно-опосредованной нейтрофильной активацией. Показано, что воздействие низкой влажности на мышей Мх1 увеличивает смертность, потерю веса и вирусную нагрузку на легкие после инфекции гриппа. Кроме того, тяжелое повреждение тканей после инфицирования вирусом гриппа наблюдалось в легочной ткани мышей, подвергшихся воздействию сухого воздуха. Следует отметить, что дефицит каспазы-1/11 спасает от летальности, которая возникает у инфицированных мышей, подвергавшихся воздействию сухого воздуха. Эти исследования показывают, что мыши, подвергающиеся воздействию условий низкой влажности, которые ухудшают противовирусную устойчивость, могут переносить инфекцию, если у них отсутствуют воспалительные каспазы. Эта концепция может быть спроецирована на другие условия, при которых ослабляется врожденная противовирусная резистентность, например, у пожилых людей. Таким образом, вмешательство в развитие воспалительных каспаз может дать возможности для борьбы с пагубными последствиями заболеваний, вызванных гриппом, путем повышения сопротивляемости болезням.
Заключительные замечания и выводы
Состояние слизистой поверхности носа и трахеи при вдыхании воздуха зависит от его температуры и содержания в нем воды. Вдыхание сухого воздуха приводит к эпителиальному повреждению, нарушению работы МЦБ и увеличению количества муцина. Плохая экспрессия ИНФ и восстановление тканей в совокупности с увеличением вирусной нагрузки увеличивает смертность после инфицирования вирусом гриппа, что было доказано в экспериментах на мышах, подвергавшихся 7-дневному воздействию низких показателей ОВ в 10–20 %. Тяжелое течение болезни после воздействия сухого воздуха сопровождается воспалением, активируются каспазы. Аналогичным образом, вдыхание холодного воздуха нарушает работу МЦБ и повышает уровень муцина. Низкая температура ухудшает выработку ИНФ типа I. Напротив, воздействие на мышей высоких температур снижает адаптивные иммунные реакции, специфичные для вируса, после заражения вирусом гриппа. Исследования на животных демонстрируют негативное влияние окружающей среды. Обследование школьников и детских садов, офисных работников и армейских новобранцев показало, что повышение влажности от низкого до среднего уровня снижает уровень заболеваемости респираторными инфекциями. Передача атипичной пневмонии SARS-CoV-2 от человека к человеку в городе Ухань, Китай, началась в декабре 2019. SARS-CoV-2 является близким родственником SARS-CoV, который распространялся зимой в 2002–2003 годах. Учитывая, что рецепторы как для SARS-CoV-2, так и для SARS-CoV, ангиотензин-преобразующий фермент 2, который, по-видимому, концентрируется в небольшом количестве в альвеолах типа II, мы предполагаем, что низкая влажность и температура окружающей среды способствуют жизнеспособности атипичной пневмонии (SARS-CoV-2), нарушению клиренса цилиарной ткани и врожденной иммунной защите, что приводит к легкой и быстрой передаче инфекции между инфицированными лицами. Так как дыхательные пути, в которых расположены альвеолярные клетки типа I и II, не являются достижимыми для капель диаметром более 5 микрометров, вероятно, что по крайней мере тяжелые случаи COVID-19 с вирусной пневмонией являются результатом воздушно-капельной инфекции. Недавнее исследование, в котором изучалась изменчивость на уровне основных репродуктивных показателей COVID-19 по всему Китаю, показало, что не только в сухих и холодных местах наблюдаются явления быстрого распространения вируса, но и в некоторых местах с высоким уровнем АВ также наблюдается более высокая вирусная передача между населением. Точная зависимость между температурой, влажностью и COVID-19. станет более очевидной по мере того, как в северных полушариях придут летние месяцы.
Сезонные изменения экологических факторов могут повлиять не только на местные механизмы защиты, но и на системные физиологические изменения. Термонейтральный температурный баланс потенцирует противоопухолевый иммунитет и возникновение у мышей GVHD. Кроме того, короткий световой день и, как следствие, недостаток витамина D ослабляют неспецифические иммунные реакции. В заключение следует отметить, что сочетание низкой влажности, температуры и недостаток солнечного света могут привести к нарушению местных и системных противовирусных защитных механизмов, что приведет к повышению восприимчивости человека к респираторным вирусам в зимний период (рис. 5).
Ряд исследований демонстрирует влияние экологических факторов на устойчивость респираторного вируса и скорость его передачи. Кроме того, несколько исследований в настоящее время показывают влияние экологических факторов на резистентность человека к респираторной вирусной инфекции и лежащие в ее основе молекулярные механизмы. В совокупности мы можем начать собирать факторы, способствующие распространению вирусов и болезней в зимние месяцы. Однако пик других респираторных вирусных инфекций приходится на весну или лето. Одним из возможных объяснений является конфликт репликации среди респираторных вирусов. Совместное инфицирование животных зимними и весенними респираторными вирусами может дать представление о неизвестных механизмах возникновения весенне-летних эпидемий. Другой нерешенной проблемой является разница в результатах наблюдений даже в высоко-контролируемой среде обитания животных (22,2°C, 50 % относительной влажности воздуха, контролируемый цикл дня и ночи) с использованием одного и того же вируса. В период проведения экспериментов в зимний период (ноябрь-апрель, 58,2 %) по сравнению с летом (май-октябрь, 34,1 %) скорость передачи вируса гриппа была выше. Таким образом, помимо температуры, освещения и влажности, могут существовать и другие контролируемые сезонные факторы окружающей среды, способствующие повышению уровня заражения вирусом гриппа в зимние месяцы.
Как мы можем использовать эти знания для предотвращения распространения респираторных инфекций и болезней в зимние месяцы? В дополнение к вакцинам и противовирусным препаратам все большее внимание уделяется мероприятиям по профилактике респираторных инфекций. Известно, что образ жизни (здоровое питание, сон более 7 часов в день) и соблюдение гигиенических требований (мытье рук, ношение масок) повышают антимикробную резистентность и предотвращают передачу инфекции, соответственно. В дополнение к этим мерам мы может рассмотреть вопрос о контроле над внутренней средой для борьбы с респираторными инфекциями. Такие мероприятия с увлажнителями воздуха осуществляются с 1960-х годов с многообещающими результатами. Совсем недавно исследование в Миннесоте показало, что увлажнение дошкольных классов в период с января по март до ∼45 % ОВ приводит к значительному снижению общего числа заболевших вирусом гриппа и снижению копий вирусных геномов, обнаруженных в воздухе и на объектах, по сравнению с контрольными классами. Такие не фармацевтические мероприятия могут сочетаться со стратегиями вакцинации для достижения лучшей профилактики респираторных вирусных инфекций.
