Инвазивный рост и микроокружение опухоли: пластичность и реципрокные взаимодействия
Опухолевая инвазия — это процесс, движимый взаимодействиями клеток и тканей, при котором физические, клеточные и молекулярные детерминанты претерпевают изменения на протяжении всего периода прогрессирования заболевания. Опухолевую инвазию запускают и поддерживают специализированные сигнальные каскады, которые контролируют динамическое состояние цитоскелета в опухолевых клетках, процессы перестройки клеточно-матриксных и межклеточных соединений с последующей миграцией клеток в соседние ткани. В данном обзоре мы описываем механизмы межклеточной и клеточно-матриксной адгезии, а также протеазные и цитокиновые системы, которые лежат в основе инвазии клеток опухоли в ткани. Мы даем объяснение, каким образом реципрокное (взаимное) перепрограммирование опухолевых клеток и окружающих их тканевых структур не только руководит инвазией и направляет ее, но и порождает различные режимы диссеминации. Обусловленная этим «пластичность» способствует образованию разнообразных путей опухолевой инвазии, повышенной гетерогенности опухоли и в конечном счете ведет к устойчивой метастатической диссеминации.
Введение
Опухолевая инвазия и метастазирование — это ключевые события, которые преобразуют локализованную опухоль в системное, метастатическое, угрожающее жизни заболевание. Начальные этапы локальной инвазии включают активацию сигнальных каскадов, контролирующих динамическое состояние цитоскелета в опухолевых клетках, а также процесс перестройки клеточно-матриксных и межклеточных соединений с последующей активацией миграции опухолевых клеток в соседние ткани (Chambers et al., 2002; Friedl and Wolf, 2003; Sahai, 2007). Метастазирование происходит тогда, когда инвазивные опухолевые клетки вступают во взаимодействие с кровеносными и лимфатическими сосудами, проникают через базальные мембраны и эндотелиальные стенки и распространяются по просвету сосуда для колонизации отдаленных органов (Fidler, 2003). Подобно клеткам первичной опухоли, метастатические клетки также способны активно размножаться, проникать в другие ткани и кровеносные сосуды, что приводит ко вторичному метастазированию (Kienast et al., 2010; Armstrong et al., 2011; Hou et al., 2011).
За последние несколько десятилетий цитологам и онкобиологам удалось изучить механизмы клеточной миграции в здоровых и злокачественных клетках, включая регуляцию клеточной адгезии и динамического состояния цитоскелета (Lauffenburger and Horwitz, 1996; Ridley et al., 2003; Sanz-Moreno and Marshall, 2010). Однако попытки определить скорость-лимитирующие механизмы, которые руководят инвазивной и метастатической миграцией опухолевых клеток, такие как доминирующий сигнальный путь, взаимодействие рецепторов с лигандами или взаимодействие протеазы с субстратом, в значительной степени потерпели неудачу. Инвазивный рост опухолевых клеток теперь принято рассматривать как разнородный и адаптивный процесс. Действительно, именно эта «пластичность» в процессах клеточной адгезии, динамической перестройки цитоскелета и механотрансдукции (клеточные процессы, которые переводят механические стимулы в биохимические сигналы — прим.пер.) во многом способствует миграции и диссеминации при различных структурных и молекулярных особенностях микроокружения и даже при неблагоприятных условиях (Friedl and Wolf, 2010; Sahai, 2007; Sanz-Moreno and Marshall, 2010).
Пластичность инвазивного роста наряду с другими ключевыми признаками рака, такими как рост, выживаемость и геномная нестабильность опухолевых клеток, приводят к морфологическим, сигнальным и генетическим различиям между первичными и метастатическими очагами у одного и того же пациента (межопухолевая гетерогенность), в пределах одного и того же очага (внутриопухолевая гетерогенность) и во времени (Choi et al., 2011; Honeth et al., 2008; Lopes et al., 2009; Shapiro et al., 2011; Stoecklein et al., 2008; Wang et al., 2009).
Такая разнородная опухолевая прогрессия является отражением реакции «активации» по соседству с растущей опухолью стромальных клеток, включая фибробласты, эндотелиальные клетки и макрофаги. После «активации» эти клетки преобразуют структуру и состав соединительной ткани, стимулируя депонирование компонентов внеклеточного матрикса (ВКМ), цитокинов и факторов роста (Egeblad et al., 2010; He et al., 2011; Picchio et al., 2008; Shapiro et al., 2011). Ремоделируя структуру ткани, высвобождая факторы роста и провоцируя метаболический стресс, реактивная строма опухоли, в свою очередь, влияет на функционирование опухолевых клеток, зачастую усиливая их рост и инвазивный потенциал и повышая резистентность опухоли к терапии и метаболическим угрозам (Alexander and Friedl, 2012; Giese et al., 2003; Sansing et al., 2011; Yao et al., 2011). Таким образом, опухолевые клетки и строма оказывают друг на друга реципрокное влияние, совместно стимулируя опухолевую прогрессию (Nelson et al., 2008; Xu et al., 2009). В данном обзоре мы обобщаем данные об известных адгезионных, протеазных и цитокиновых системах, лежащие в основе опухолевой инвазии тканей. Мы выносим на обсуждение вопрос о том, как реактивное микроокружение опухоли влияет на пластичность и способствует инвазии и метастатической диссеминации.
Механизмы клеточной миграции
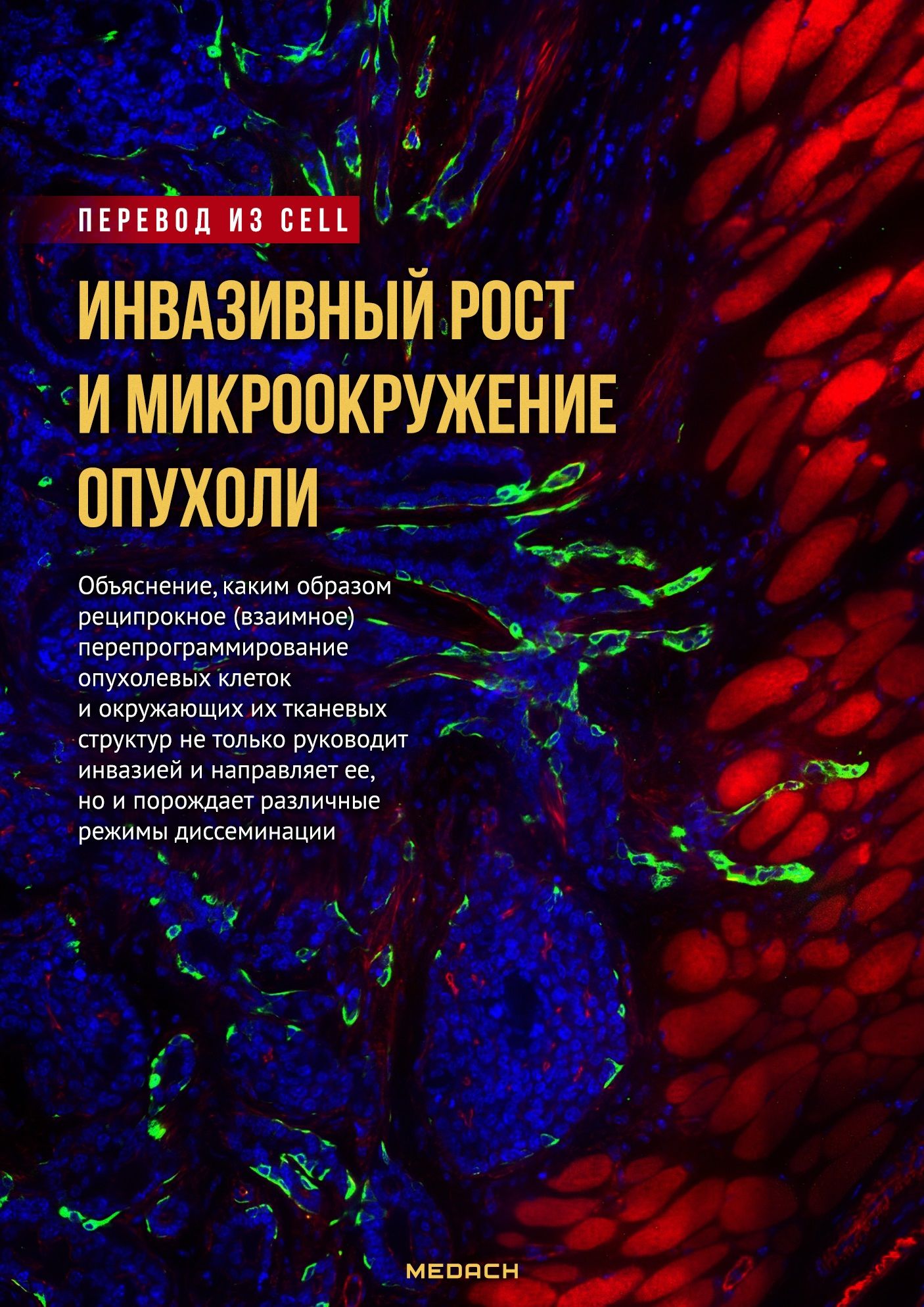
Опухолевая инвазия — это циклический процесс, при котором клетка изменяет свою форму, становится асимметричной, а затем перемещает свое клеточное тело в соседний участок пространства. В зависимости от клеточного типа и тканевого микроокружения клетки могут мигрировать двумя основными способами: индивидуально, когда какие-либо межклеточные соединения отсутствуют, или коллективно — целыми многоклеточными группами, при этом межклеточные контакты сохраняются (Friedl and Wolf, 2010) (рис. 1). Основным процессом, лежащим в основе обоих типов миграции, является динамическая перестройка цитоскелета, взаимодействующего с поверхностными рецепторами клеток, которые связываются с окружающими тканевыми структурами. Таким образом, цитоскелет служит «двигателем» клетки, а рецепторы клеточной поверхности — ее «коробкой переключения скоростей» (Ridley et al., 2003). В опухолевых клетках встречаются все те же типы и механизмы миграции, что и в здоровых. В них активируются те же механизмы, предназначенные для изменения формы клеток, генерации силы перемещения ([migration] force) и ремоделирования ВКМ (Friedl, 2004), что и в здоровых клетках. Однако опухолевые клетки отличаются тем, что у них отсутствует физиологический «стоп-сигнал», позволяющий обеспечить неподвижность и закрепление клеток в пределах своей ткани (Cox et al., 2001), что, вероятно, способствует миграции злокачественных клеток.
.
(А) Индивидуальная миграция включает в себя пять молекулярных стадий, в ходе которых происходит изменение формы клетки, ее положения, а также структуры ткани, через которую клетка мигрирует.
(B) Коллективно мигрирующие клетки формируют две главные зоны: зону 1, в которой условно выделяют «лидирующую клетку», применяющую протеолитические ферменты для деградации матрикса и формирования в нем микротрещин на пути у мигрирующей группы; и зону 2, в которой следующие за ней клетки расширяют пространство этих микротрещин, в результате чего образуются более значительные макротрещины (рисунок изменен из Friedl and Wolf, 2008).
В большинстве клеток образование выступа на переднем конце контролируется малой ГТФазой Rac или Cdc42, которые инициируют формирование псевдоподии (ложноножки) либо филоподии, взаимодействующей с субстратом ВКМ (Sanz-Moreno and Marshall, 2010). В некоторых типах клеток с низкой активностью Rac либо в средах с низкой адгезивностью возможны вариации в стадиях №1 и №2 (т. е. при формировании псевдоподии и при адгезии), при которых на переднем конце клетки образуются «пузыреподобные» либо не несущие ложноножек гладкие мембранные выпячивания. Эти выпячивания стабилизируются кортикальным F-актином и проникают между внеклеточными тканевыми структурами (Lorentzen et al., 2011; Poincloux et al., 2011). На данном этапе сила перемещения генерируется актомиозин- и интегрин-зависимыми способами вблизи заднего полюса клетки (Poincloux et al., 2011).
Физико-химические этапы при миграции одиночных клеток координируются внутри одной и той же клетки и выполняются синхронно, зачастую стремительно («пульсирующим» образом), что позволяет клеточному телу выдаваться вперед и генерировать силу перемещения в колебательном режиме (Ridley et al., 2003). При возникновении множества клеток из одного начала, например, из опухоли, «лидирующая клетка» путем протеолиза формирует «микротрещины» (microtrack) в толще локально расщепленных элементов ВКМ (зона 1). Далее следующие за ним клетки благодаря приложению механической силы и протеолитической активности расширяют или углубляют эти микротрещины, вследствие чего формируются более крупные макротрещины (macrotrack; зона 2) (Ilina et al., 2011; Wolf et al., 2007) (рис. 1В). При коллективной миграции выпячивания и сокращения актомиозиновых волокон координируются на надклеточном уровне, что опосредуется через межклеточные соединения (Hidalgo-Carcedo et al., 2011; Tambe et al., 2011) и позволяет группе клеток вести себя как «мега-клетка» (рис. 1В).
Характерные паттерны и разнообразие механизмов опухолевой инвазии
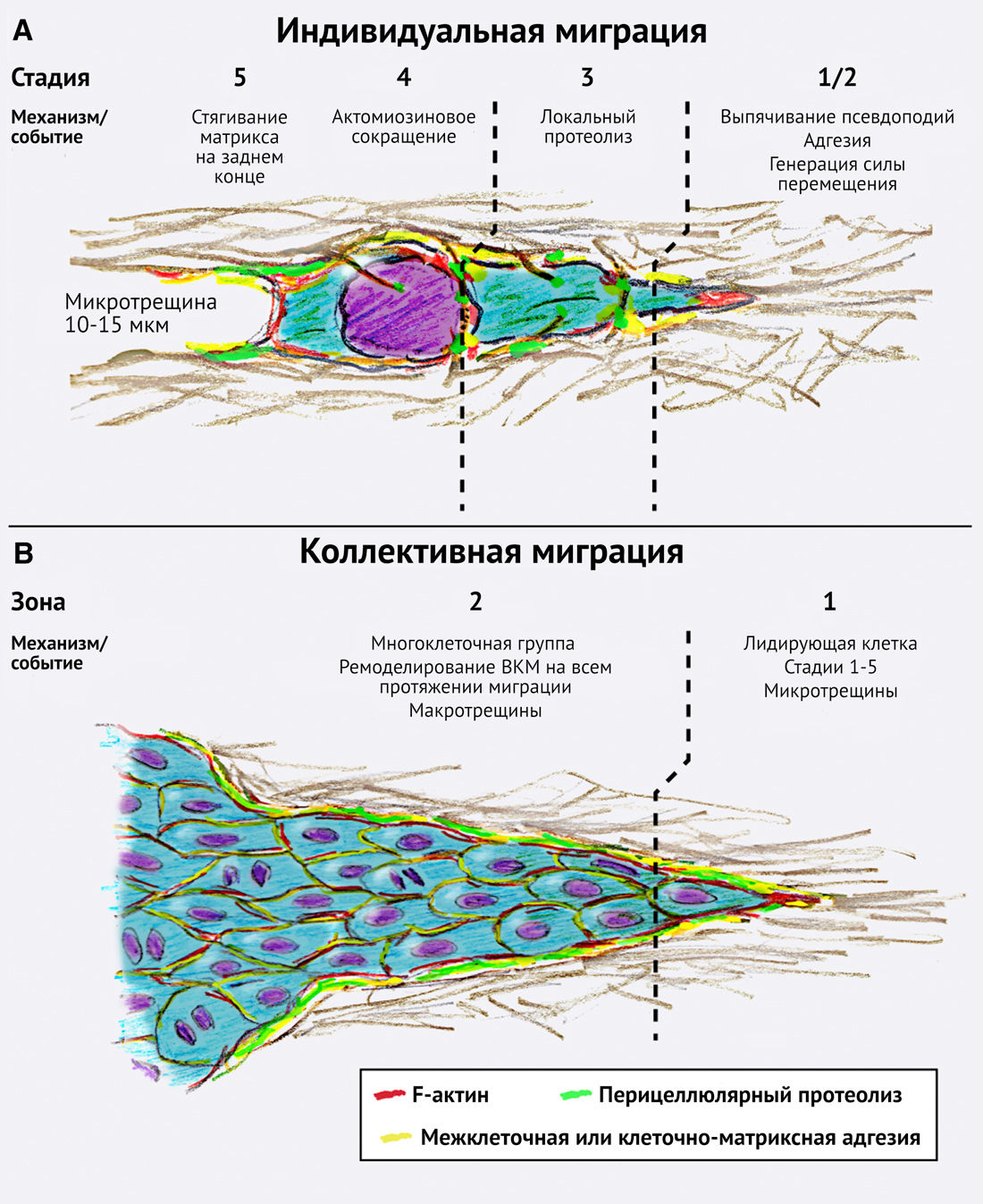
Пятиступенчатую модель клеточной миграции можно наблюдать при многих способах передвижения как здоровых, так и злокачественных клеток. Индивидуальный и коллективный типы миграции следуют парадигме активного клеточного перемещения, тогда как экспансивный многоклеточный рост приводит к пассивному перемещению клеток путем их выталкивания из очага (рис. 2).
.
Амебоидная клеточная миграция
Клетки, мигрирующие с низкой силой адгезии или высокой актомиозин-опосредованной сократительной способностью, принимают морфологически сферическую форму. Их миграция называется амебоидной благодаря сходству с передвижением такого одноклеточного организма, как амеба Dictyostelium discoideum (Friedl et al., 2001). При амебоидном движении, организуемом Rac-зависимыми филоподиями, формируются локальные либо диффузно распределенные участки адгезии, генерирующие слабую или незначительную силу адгезии к субстрату (Lammermann and Sixt, 2009). Также существует иная форма амебоидного движения, опосредуемая Rhо-зависимым блеббингом (образованием цитоплазматических выростов — прим. пер.), при которой адекватная адгезия отсутствует; перемещение клетки осуществляется путем формирования выступа на переднем ее конце, несущем «пузырьки» либо представленным гладкой мембраной, или путем боковой интеркаляции (Lorentzen et al., 2011; Paluch et al., 2006; Poincloux et al., 2011). Для амебоидных клеток характерна миграция без протеолиза ВКМ, что достигается путем изменения клеточной формы для протискивания через тканевые промежутки (Wolf et al., 2003b). Опухоли, мигрирующие амебоидным способом, зачастую развиваются из кроветворных или нейроэктодермальных ростков: это, например, лейкозы, лимфомы или мелкоклеточный рак легких; однако амебоидные движения встречаются также и в большинстве других типов опухолей (Madsen and Sahai, 2010; Wolf et al., 2003b).
Мезенхимальная клеточная миграция
Инвазивные клетки, у которых хорошо развиты адгезионные способности и система формирования цитоскелетных выступов, приобретают веретенообразную удлиненную форму с локальными клеточно-матриксными соединениями, содержащими мультимолекулярные кластеры интегрина и проявляющими протеолитическую активность по отношению к элементам ВКM (Wolf et al., 2007). Протеазы, локализованные на поверхности мембраны, способствуют образованию небольших микротрещин, через которые могут проникать другие клетки (Friedl and Wolf, 2009) (рис. 1А и 2). Мезенхимально мигрирующие опухолевые клетки происходят из опухолей соединительной ткани, в том числе из сарком мягких тканей. Также они могут происходить из любых других типов опухолей, клетки которых подверглись дедифференцировке и потеряли межклеточные контакты (Brabletz et al., 2001; Friedl and Wolf, 2009; Sanz-Moreno et al., 2008).
Групповое перемещение клеток
Групповым перемещением (multicellular streaming) принято называть движение отдельных клеток друг за другом по одному и тому же пути внутри ткани. Это происходит главным образом тогда, когда одиночные клетки благодаря хемотаксису притягиваются к определенному источнику или совместно следуют к микротрещинам, которые часто присутствуют в периферической соединительной ткани (Kulesa and Gammill, 2010). При злокачественном процессе групповое движение клеток часто рассматривается как цепная или роевидная (т. е. диффузная) инфильтрация тканей в гематологических и солидных опухолях (Kedrin et al., 2008).
Коллективная инвазия
Для коллективной инвазии необходима согласованная организация межклеточной адгезии и координации в ходе одновременной миграции клеток, что приводит к появлению многоклеточных скоплений и тяжей на границе между опухолевой массой и стромой (Friedl et al., 1995; Ilina and Friedl, 2009). Клетки при коллективной инвазии могут принимать различную форму, что зависит от их фенотипа, количества следующих друг за другом клеток, а также от структуры инвазируемой ткани. Например, группы клеток могут образовывать небольшие кластеры, солидные тяжи или цепочки; если полярная дифференцировка эпителия во время миграции сохраняется, то в таких структурах могут даже формироваться внутренние полости (Friedl and Gilmour, 2009). В большинстве случаев при коллективной опухолевой инвазии одна или несколько лидирующих клеток с мезенхимальными характеристиками образуют «наконечник» во главе стреловидного многоклеточного тяжа и непосредственно руководят продвижением и перицеллюлярным («околоклеточным») протеолизом по отношению к тканевой структуре (Gaggioli et al., 2007; Khalil and Friedl, 2010). При другом типе коллективной инвазии ярко выраженные лидирующие клетки отсутствуют, и бутоноподобный «затупленный наконечник», который состоит из множества клеток, постоянно изменяющих свое положение, продвигается вдоль всего тканевого пространства (Ewald et al., 2008). Этот тип инвазии наблюдается преимущественно в мягких тканях и в клетках с четкой эпителиальной полярной дифференцировкой. Коллективный тип миграции клеток преобладает в морфогенезе в ходе развития организма и также отмечается в большинстве опухолей эпителиального и мезенхимального происхождения (Friedl and Gilmour, 2009; Friedl et al., 1995).
Экспансивный рост
Некоторые ткани практически не накладывают физического ограничения на пролиферацию опухолевых клеток внутри них и не препятствуют расширению злокачественного очага. В процессе того как опухоль растет и развивается в этих тканях, стремительное увеличение ее объема приводит к механическому выталкиванию клеток за пределы ткани с интактными межклеточными контактами и отсутствием признаков активной миграции (Iguchi et al., 2008; Ishizaki et al., 2001). В конечном итоге этот экспансивный рост без миграции приводит к формированию сферических очагов внутри «капсулы» из ВКМ, которая образована выровненными коллагеновыми волокнами, лежащими по окружности очагов (Ishizaki et al., 2001). При экспансивном росте опухоли из-за увеличения ее объема и нарастания давления может происходить выталкивание клеток за пределы ткани, при этом миграционная активность может отсутствовать, либо, если она имеется, то это усиливает коллективную инвазию (Ilina et al., 2011) (B. Weigelin and P. F., неопубликованные данные).
Несмотря на то что данные типы миграции в экспериментальных и теоретических целях могут рассматриваться как морфологические и механистические единицы, в трехмерных (3D) тканях часто проявляются признаки нескольких типов одновременно. Сюда входят промежуточные или переходные состояния, при которых клетки могут изменять свои молекулярные профили и переключаться из одного режима миграции в другой (например, от протеолитической к непротеолитической миграции или от индивидуальной к коллективной миграции) (Friedl and Wolf, 2010; Wolf et al., 2003а). Например, когда отдельные клетки благодаря хемотаксису притягиваются к одному и тому же источнику, сначала они могут вовлекаться в групповое клеточное перемещение с короткоживущими межклеточными контактами, которые формируются лишь на небольшой период и снова рассасываются; когда экспрессия молекул межклеточной адгезии нарастает, клетки могут соединяться друг с другом и переходить в режим коллективной миграции (Kulesa and Gammill, 2010). Таким образом, различные молекулярные программы способны совместно определять морфологию клеток и механизм, посредством которого здоровые или злокачественные клетки передвигаются через ткани.
Физические и молекулярные детерминанты инвазивного роста
Молекулярные механизмы, лежащие в основе каждого из режимов миграции, зависят от набора взаимосвязанных механических и сигнальных путей, которые различаются по слаженности своей работы и силе активации в зависимости от конкретного режима миграции. Такие различия включают в себя: организацию цитоскелета; способность к ремоделированию тканевых структур; а также тип, прочность и темпы перестройки соединений между клетками и субстратом и между отдельными клетками. Стромальные сигналы модулируют все эти пути через хемокины, цитокины и факторы роста (Friedl and Wolf, 2010).
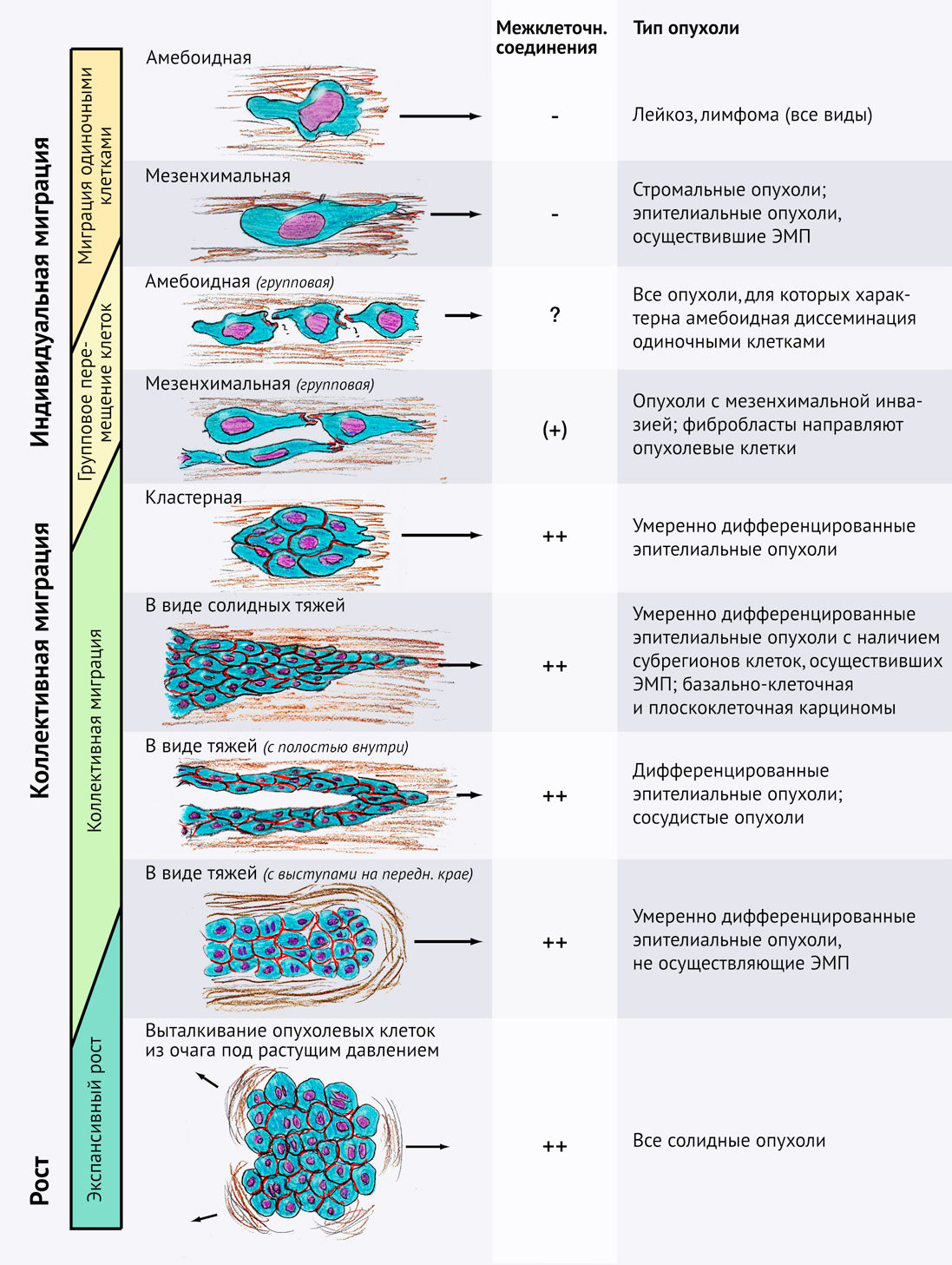
Различные типы адгезионных систем прямо или косвенно способствуют механизму взаимодействия между актиновым цитоскелетом и внеклеточным матриксом (рис. 3А) либо между каркасами клеточной поверхности (рис. 3В). Вместе эти адгезионные системы управляют миграцией.
.
(А) Рецепторы клеточной поверхности и адаптерные белки, которые контролируют динамические связи между актиновым цитоскелетом, про-миграционными сигнальными путями и внеклеточным матриксом (ВКМ).
(В) Рецепторы клеточной поверхности, обеспечивающие и регулирующие межклеточные взаимодействия. Сходные механизмы адгезии могут опосредовать гомотипическую клеточную когезию при коллективной инвазии, а также более динамичное гетерофильное взаимодействие с резидентными клетками, встречающиеся в ходе инвазии тканей.
(С) Протеазные системы, активность которых значительно повышена в ходе опухолевой прогрессии, инвазии и метастазирования.
(D) Рецепторы хемокинов, цитокинов и факторов роста, которые опознают растворимые, а также связанные с ВКМ или протеогликанами факторы и взаимодействующие с ними молекулы. Зеленым цветом представлены некоторые внутриклеточные адаптеры к актиновому цитоскелету; их названия указаны ниже обозначенных схем (на рис. А и В); описаны основные сигнальные молекулы, регулирующие перестройки актина и миграцию клеток.
Рецепторы ВКМ
Интегрины — это гетеродимерные поверхностные рецепторы, состоящие из α- и β-цепей. Вместе эти цепи опосредуют адгезию и механотрансдукцию к внеклеточным лигандам и включают в себя: интегрин α2β1, преимущественно связывающийся с фибриллярным коллагеном; αVβ3, αVβ1 и α5β1, взаимодействующие с фибронектином; а также α3β1 и α6β1, взаимодействующие с ламинином (Hynes, 2002). После связывания с лигандами цитоплазматические хвосты интегринов соединяются с белками-адаптерами (белки, не обладающие ферментативной активностью, функция которых заключается во взаимодействии с рецепторами и передаче сигнала далее — прим. пер.) цитоскелета, включая талин, паксиллин и киндлин, а также механосенсорные модуляторы винкулин и p130Cas (Geiger et al., 2009; Grashoff et al., 2010). Адаптерные и механосенсорные модуляторные белки взаимодействуют с актиновым цитоскелетом и запускают сигнальный каскад активации протеинкиназ, включая фокальную киназу адгезии (ФКА) и Src (Geiger et al., 2009; Hodivala-Dilke et al., 1999; Hynes, 2002). Нисходящие интегриновые двигательные системы дополнительно активируют малые ГТФазы Rac и Rho, которые ускоряют образование выпячиваний (выступов) клеточной мембраны и сокращение заднего полюса клетки (Ridley et al., 2003). Помимо контактов с субстратами ВКМ, взаимодействие интегрина с внеклеточными лигандами также активируется внутренним сигнальным каскадом через Rac, RAS-связанную ГТФазу Rap1 и талин (Lee et al., 2009; Ridley et al., 2003).
CD44 и его варианты, полученные в ходе альтернативном сплайсинга, обладают высоким сродством к гиалуроновой кислоте (высокомолекулярному гликозаминогликану, которого много во всех соединительных тканях) и низким — к гепарансульфату, коллагену и фибронектину (Zöller, 2011). CD44 связывается с актиновым цитоскелетом посредством адаптерных белков — эзрина, радиксина, моэзина (ЭРМ) и анкирина — и активирует внутриклеточный сигнальный каскад через Src-киназу и малые Rho-ГТФазы, включая RhoA (Zöller, 2011). CD44 и его варианты альтернативного сплайсинга также связываются с хемокинами и факторами роста; они модулируют сигнальные каскады через цис-взаимодействия с рецепторами факторов роста, включая рецепторы к фактору роста гепатоцитов (c-Met), фактору роста фибробластов (FGFR-1), рецепторы эпидермального фактора роста (EGFR) и его варианты ERBB2-4. Таким образом, CD44 обеспечивает координированную работу сигнальных систем ВКМ и факторов роста в инвазивных клетках (Couchman, 2010; Zöller, 2011). CD44 также служит ко-рецептором для других рецепторов адгезии, включая интегрины и подопланин (Zöller, 2011). Подопланин — это муцин клеточной поверхности, который соединяется с актиновым цитоскелетом через эзрин. Подопланин запускает сигнальный путь для усиления активности RhoA, что значительно повышает темпы клеточной инвазии (Martın-Villar et al., 2006; Wicki et al., 2006). Учитывая его обширные перекрестные взаимодействия с другими системами рецепторов и лигандов, остается неясным, служит ли CD44 истинным рецептором адгезии, который опосредует адгезию и механотрансдукцию в отсутствие других активных путей, либо его основная роль заключается в обеспечении ко-сигнализации (Maaser et al., 1999).
Подобно CD44, связанные с мембраной протеогликаны, такие как синдеканы, глипиканы и нейропиллин, способны через свои сахарные фрагменты формировать слабые связи с компонентами ВКМ, включая гиалуроновую кислоту, фибронектин, коллаген и эластин. Эти взаимодействия совместно с влиянием интегринов усиливают клеточную адгезию. Также протеогликаны в сотрудничестве с интегринами и рецепторами факторов роста активируют сигнальные пути с вовлечением PKC (протеинкиназы С — прим.пер.) и Src (Couchman, 2010; Theocharis et al., 2010). Синдеканы типа 2 и 4 взаимодействуют с эзрином или α-актинином соответственно, через которые связываются с актиновым цитоскелетом. Однако их непосредственный вклад в адгезию и миграцию до сих пор остается неизученным (Couchman, 2010).
Рецепторы домена дискоидина DDR1 и DDR2 избирательно взаимодействуют с фибриллярным коллагеном и активируют сигнальные пути с вовлечением STAT5, NFκB и p38 MAPK/ERK или связанных с Src киназ Syk, Shc и Src соответственно, (Neuhaus et al., 2011; Vogel et al., 2006). DDR содействуют межклеточной адгезии, опосредованной E- и N-кадгеринами (Eswaramoorthy et al., 2010; Shintani et al., 2008), и усиливают протеолитическую активность клеток при участии матриксных металлопротеиназ (matrix metalloproteinases, MMP), включая ММР-1, ММР-2, ММР-9 и ММР-10 (Ruiz and Jarai, 2011). На данный момент хорошо изучены сигнальные системы, инициируемые DDR после их взаимодействия с ВКМ; однако неизвестно, связываются ли DDR с актиновым цитоскелетом и принимают ли они непосредственное участие в механотрансдукции.
Таким образом, интегрины играют ведущую роль в активации адгезии и механотрансдукции при осуществлении внутритканевой миграции; они обеспечивают модуляцию и взаимодействия таких сигнальных каскадов, в результате которых формируются контакты между клетками и субстратом, а также запускаются сигнальные системы факторов роста посредством вовлечения CD44, протеогликанов клеточной поверхности и DDR.
Рецепторы межклеточной адгезии
Рецепторы и их каскады, благодаря которым обеспечивается взаимодействие между силами адгезии и актиновым цитоскелетом, помогают скооперировать между собой опухолевые клетки во время коллективной инвазии (Giampieri et al., 2009; Ilina and Friedl, 2009). Активация этих рецепторов также способствует одиночным и коллективным клеточным перемещениям по поверхности других клеток-резидентов в тканях, встречающихся на пути миграции (рис. 3B).
Члены семейства рецепторов адгезии кадгеринов опосредуют гомотипические взаимодействия между клетками одного и того же типа и гетеротипические — между различными типами клеток. Эти взаимодействия включают: стабильную межклеточную адгезию через адгезионные контакты (Harris and Tepass, 2010), динамическую адгезию путем временного вовлечения малых ГТФаз Rac1 и RhoA, а также динамическую перестройку клеточных соединений с участием цитоскелета (Kardash et al., 2011). Как при стабильной, так и при динамической клеточной адгезии кадгерины взаимодействуют с цитоскелетным адаптером и сигнальными белками, включая α-катенин, β-катенин и р120-катенин, которые соединяются с актином и микротрубочками цитоскелета (Berx and van Roy, 2009; Harris and Tepass, 2010; Reynolds, 2010). В зависимости от типа опухоли экспрессируются различные виды кадгеринов, принимающие участие в межклеточном взаимодействии, включая Е-, N- и Р-кадгерины, кадгерин-11 и кадгерин-13 (Berx and van Roy, 2009). В «дремлющем» эпителии с наличием полярной дифференцировки E-кадгерин подавляет сигнальный каскад, активирующий миграцию, путем ингибирования Rac1 (Kitt and Nelson, 2011), а также поддерживает межклеточную когезию, полярную дифференцировку между базальным и люминальным слоями эпителия и его стабильное развитие. Напротив, в активно пролиферирующем и злокачественном эпителии Е-кадгерин и другие кадгерины совместно координируют коллективные перемещения клеток (Friedl and Gilmour, 2009). В активно пролиферирующих эпителиальных клетках взаимодействие Е-кадгерина и интегринов вместе с последующей активацией сигнального каскада Src ускоряет динамические перестройки актина и повышает сократительную способность актомиозина, что способствует как одиночной, так и к коллективной миграции (Geisbrecht and Montell, 2002; Kardash et al., 2010; Martinez-Rico et al., 2010). Е-кадгериновый сигнальный каскад с вовлечением DDR1 ограничивает сократительную способность актомиозина по ходу межклеточных соединений, что стабилизирует эти межклеточные контакты и способствует коллективной инвазии (Hidalgo-Carcedo et al., 2011). По сравнению с Е-кадгерином N-кадгерин и кадгерин-7 проявляют более слабые адгезионные свойства (Chu et al., 2006); их действие ассоциировано с дальнейшей активизацией подвижности опухоли. Эта подвижность, скорее всего, обусловлена совместным взаимодействием N-кадгерина и кадгерина-7 с рецепторами факторов роста, включая FGFR (фибробластный) или PDGFR (тромбоцитарный), которые усиливают активность нисходящих сигнальных путей через MAPK и PI3K (Berx and van Roy, 2009). Таким образом, кадгерины демонстрируют двойственную роль в миграции: в зависимости от конкретных условий они могут способствовать активации как ингибирующих, так и стимулирующих миграцию сигнальных каскадов (Martinez-Rico et al., 2010).
Суперсемейство иммуноглобулиновых молекул клеточной адгезии (cell adhesion molecules, CAM) участвует в гомофильных межклеточных взаимодействиях в злокачественных клетках путем прямого или косвенного связывания с актиновым цитоскелетом благодаря актин-связывающим адаптерным белкам: α-актинину, анкирину и эзрину (Gavert et al., 2010; Maness and Schachner, 2007). К числу представителей семейства молекул адгезии относят L1CAM, ЕРС, NCAMs и ALCAM.
Экспрессия L1CAM повышается в клетках лидирующего края коллективно инвазирующих эпителиальных опухолей, которые характеризуются стабильным мезенхимальным фенотипом с высокой способностью к инвазии (Bergmann et al., 2010; Hung et al., 2010). Это согласуется с ролью L1CAM в функционировании лидирующих клеток и в частичном осуществлении ЭМП (эпителиально-мезенхимального перехода) во время коллективной инвазии (Gavert et al., 2011). Аналогичным образом численность копий белков ALCAM нарастает в межклеточных контактах коллективно инвазирующего эпителиального рака, что ассоциировано с повышением вероятности метастазирования (van den Brand et al., 2010).
Подобно лейкоцитам, опухолевые клетки способны создавать гетерофильные межклеточные соединения с эндотелиальными клетками и тромбоцитами, экспрессирующими ICAM-1, VCAM-1 или PECAM-1. Эти взаимодействия опосредуются через β1- и, вероятно, β2-, αVβ3- и α4β7-интегрины, которые экспрессируются опухолевыми клетками и способствуют внутрисосудистой миграции и угнетению адгезии циркулирующих опухолевых клеток (Hynes, 2002; Stoletov et al., 2010). Впоследствии интегрины могут взаимодействовать с белками ВКМ, заякоренными и иммобилизованными на встречаемых по пути клеточных поверхностях (например, на фибронектине и ламинине), и снова активировать адгезию между опухолевыми клетками (Casey et al., 2001).
Помимо механического соединения клеток между собой, белки семейства CAM усиливают активацию сигнальных каскадов интегринов и рецепторов факторов роста (например, EGFR и FGFR) через ERK, ILK или Src (Kiefel et al., 2011; Zecchini et al., 2011). Их вклад в гомотипические взаимодействия (между опухолевыми клетками) и гетеротипические (между опухолевыми и стромальными клетками) свидетельствует о том, что САМ служат универсальными звеньями в цепи механотрансдукции и сигнальных путях одиночной и коллективной инвазии.
Некоторые другие семейства рецепторов также вносят свой вклад в организацию межклеточных соединений и координацию многоклеточного образования. К ним относятся коннексины, образующие щелевые контакты (Li et al., 2008), а также эфрины и Eph-рецепторы. Эфрины и Eph-рецепторы ослабляют гомотипические и гетеротипические связи путем вовлечения других эфринов, экспрессируемых соседними опухолевыми и стромальными клетками (Astin et al., 2010), тем самым направляя миграцию опухолевых клеток в зависимости от конкретной окружающей их ткани.
Таким образом, опухолевые клетки участвуют в различных синергичных системах по обеспечению адгезии между клетками и матриксом, а также межклеточной адгезии; эти системы контролируют и уравновешивают межклеточную когезию внутри опухоли и когезию по отношению к стромальным структурам.
Протеазные системы
Как в опухолевых, так и в стромальных клетках характерной чертой множества протеазных систем является их перекрываемая (т. е. частично совпадающая) субстратная специфичность. К этим системам относят ММP, ADAM, катепсины, активатор плазминогена урокиназы (urokinase plasminogen activator, uPA) и его рецептор uPAR (Mason and Joyce, 2011; Rizki et al., 2008) (рис. 3С). Повышенная экспрессия протеаз способствует инвазивному росту и прогрессированию опухоли благодаря трем различным механизмам (Egeblad and Werb, 2002; Wolf and Friedl, 2011).
Во-первых, протеазы клеточной поверхности, такие как ММP мембранного типа (МТ) и ADAM (комплекс дезинтегрина и металлопротеиназы), осуществляют контактно-зависимый протеолиз структурных белков ВКМ, включая фибриллярные и нефибриллярные коллагены, фибронектин и ламинины, а также заякоренные на ВКМ матриксно-клеточные белки (например, тенасцин и глипикан) (Sabeh et al., 2004, 2009; Wolf et al., 2007). Протеолитическая деградация ВКМ имеет двойную роль: (1) благодаря ей образуются биологически активные эпитопы из компонентов ВКМ, что повышает адгезионную и миграционную активность (Kenny et al., 2008), и (2) она запускает структурное ремоделирование ткани, вследствие чего в ней de novo образуются промежутки, окруженные волокнами ВКM (Gaggioli et al., 2007; Sabeh et al., 2009; Wolf et al., 2007).
Во-вторых, те протеазы, которые секретируются наружу и закрепляются на клеточной поверхности, в частности MMP и ADAM, ферментативно расщепляют другие протеазы и мембранные рецепторы, включая рецепторы адгезии и факторов роста (Total and Blobel, 2007). Благодаря этому контролируется активация и «жизненный цикл» этих рецепторов, что ведет к адаптивным изменениям доступности рецепторов как на опухолевых, так и на стромальных клетках, а также концентрации протеаз в окружающих тканях.
Наконец, секретируемые протеазы, в частности ММР и плазмин, контролируют спектр несвязанных внеклеточных факторов роста путем их ферментативной активации, инактивации или деградации (Dean et al., 2008; Mu et al., 2002; Sounni et al., 2010). MMP и ADAM могут высвобождать временно связанные с ВКМ биологически активные факторы, которые благодаря этому диффузно распространяются к соседним клеткам (Shiao and Coussens, 2010).
Таким образом, в про-инвазивном микроокружении опухоли, в котором протеазы имеют важнейшее значение, наблюдается структурное ремоделирование ВКМ с сопутствующим перицеллюлярным протеолизом, а также нарушение системы протеолитического расщепления хемокинов, факторов роста и их рецепторов, что оказывает определенное воздействие как на опухолевые, так и на стромальные клетки.
Хемокины, факторы роста и их рецепторы
Переход от фиксированного, закрепленного состояния к подвижному зачастую индуцируется внеклеточными хемокинами, цитокинами и факторами роста, которые высвобождают сами опухолевые клетки или активированные стромальные клетки. Эти факторы вызывают активацию перекрываемых (redundant) и неперекрываемых внутриклеточных сигнальных систем как в опухолевых, так и в стромальных клетках (рис. 3). К хемокинам, способствующим инвазии, относят CXCL12, CXCL10, CCL21 и CCL25. Они участвуют в активации инвазивной миграции опухолевых клеток в первичном очаге и, вероятно, при метастатической диссеминации (Allinen et al., 2004; Zlotnik et al., 2011). Действие сигналов, которые стимулируют миграцию и индуцируются хемокинами и их рецепторами CXCR4, CXCR3 и CCR9, в основном опосредуются работой таких белковых систем, как Jak/PI3K/JNK, PI3K, киназы Syk из семейства Src и малые ГТФазы Rac1, RhoA и Rap1 (El Haibi et al., 2010; Lee et al., 2009; Tybulewicz and Henderson, 2009). Помимо контроля клеточного цикла и клеточной выживаемости, функция многих факторов роста, включая HGF, EGF, FGF и TGFβ, состоит в совместной регуляции важного механизма, включающего сигнальные пути ERK, JNK, Src, mTOR и PI3K, на пути к активации Rac и Cdc42 с целью усиления динамики цитоскелетных перестроек (Massague, 2008; Shapiro et al., 2011; Trusolino et al., 2010). Индуцированные опухолью окружающие ткани обладают плейотропным эффектом; они способствуют миграции клеток и повышают: (1) темпы инвазивного роста и диссеминации опухолевых клеток; (2) подвижность и активность стромальных клеток, включая фибробласты и макрофаги; (3) мобилизацию и трансэндотелиальную миграцию циркулирующих лейкоцитов и прогениторных клеток в строму опухоли; а также (4) мобилизацию клеток костномозгового происхождения в кровоток путем системного воздействия факторов роста в других органах, включая костный мозг (Orimo et al., 2005; Padua and Massague, 2009; Roussos et al., 2011; Zlotnik et al., 2011).
Таким образом, сложно организованные системы функционирования клеточной адгезии и внутриклеточных сигнальных путей совместно регулируют молекулярные и структурные перестройки в окружающих тканях в целях обеспечения опухолевой инвазии и метастатической диссеминации.
Разнообразие маршрутов инвазии
In vivo опухолевая инвазия и метастатическая диссеминация зависят от двух взаимосвязанных и дополняющих друг друга стратегий перемещения. Первая и самая простая стратегия заключается в движении клеток вдоль уже существующих тканевых структур, незанятое пространство в которых совпадает с объемом клетки (или группы клеток) или даже превышает его. Вторая стратегия состоит в активном протеолитическом разрушении тканевых структур для воссоздания de novo того пространства, которое необходимо для осуществления инвазии (Wolf et al., 2009; Wolf and Friedl, 2011).
Тканевые структуры, направляющие инвазию
В недавних публикациях исследователям с помощью двумерной (2D) и трехмерной (3D) микроскопии удалось картировать структурную организацию тканей в ходе процесса клеточной инвазии, а интравитальная (прижизненная — прим.пер.) микроскопия стала применяться для изучения экспериментальных опухолей in vivo (Pittet and Weissleder, 2011 [this issue of Cell]). Эти подходы в сочетании с гистопатологическим анализом опухолей человека убедительно свидетельствуют о том, что как одиночная, так и групповая инвазия направляются и контролируются теми структурами, которые изначально присутствуют в каждой ткани (Alexander et al., 2008; Condeelis and Segall, 2003; Grytsenko et al., 2011; Schedin and Keely, 2011) (рис.4). Концептуально тканевые структуры, задающие направление опухолевой инвазии, могут быть классифицированы как «2D» и «3D» в зависимости от того, «прилипают» ли клетки к своему субстрату с одной либо с нескольких сторон. В двумерных поверхностях, имеющих гладкую либо шероховатую структуру, формируются почти безбарьерные промежутки и расщелины, которые обычно заполнены интерстициальной жидкостью и гликозаминогликанами. In vivo большинство 2D-слоев встречается в 3D-пространстве, как, например, вторичная сопряженная поверхность (second opposing surface) и близлежащий 3D-каркас (nearby 3D scaffold); поэтому, за исключением «прилипания» к стенке более крупного по размерам сосуда, клеточная инвазия в большинстве случаев рассматривается в конститутивно трехмерной модели.
.
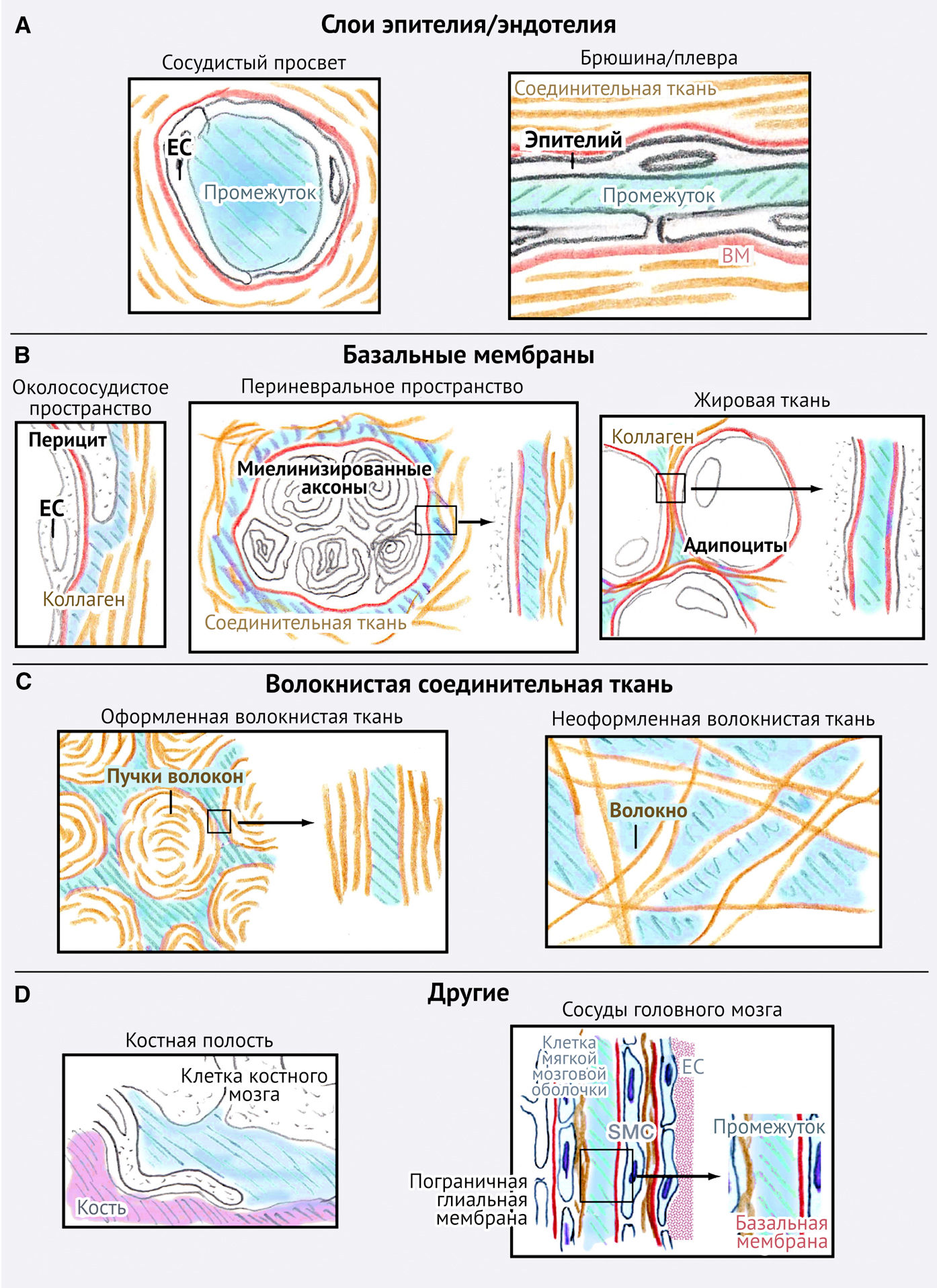
(В) Базальные мембраны, лежащие вместе с ВКМ между клеток и тканей.
(С) Богатые коллагеном интерстициальные каркасы с компактной либо неплотной структурой и организацией.
(D) Сложные структуры, сформированные из клеток и ВКМ. Солидные многомерные каркасные структуры взаимодействуют с тканевыми порами и щелевидными промежутками (обозначены голубым цветом).
Различные поверхности нашего организма покрыты слоем эпителия или эндотелия, в связи с чем клетки, находящиеся в составе данных структур, зависят, в первую очередь, от межклеточных, а не клеточно-матриксных взаимодействий. К двумерным клеточным поверхностям относят: брюшину, покрывающую все абдоминальные органы; плевру, покрывающую легкие и грудную стенку; желудочки головного мозга; а также внутренние поверхности крупных кровеносных и лимфатических сосудов (рис. 4А). С точки зрения клеточной механики данные поверхности обеспечивают высокоэффективную, почти безбарьерную диссеминацию опухолевых клеток. Это можно наблюдать в случаях перитонеального или плеврального карциноматоза, при котором опухолевые клетки способны легко распространяться по большой площади, вероятно, как за счет активной миграции, так и за счет независимого от нее пассивного дрейфа (Zecchini et al., 2011).
При рассмотрении под микроскопом соединительная ткань описывается не просто как однородная ячеистая сеть ВКМ; напротив, она состоит из сложно организованных структур, включающих разрывы, которые представлены щелевидными промежутками и «трещинами». Анатомическая функция этих промежутков, вероятно, заключается в перебросе избыточной тканевой жидкости, поддержании эластичности тканей и механическом скольжении тканевых компонентов друг относительно друга. 3D-«трещины» со своими 2D-границами формируются под воздействием более крупных анатомических структур, покрытых базальной мембраной, таких как мелкие кровеносные сосуды, миофибриллы, нервные волокна и адипоциты (рис. 4B). Похожие продолговатые расщелины образуются при организации связанных в пучки трехмерных коллагеновых волокон (рис. 4С). Эти «внутренние слои» («inner surfaces»), вероятно, анатомически соответствуют узким углублениям («артефакты сморщивания»), которые в изобилии присутствуют практически в каждой ткани после ее фиксации, и при трехмерной реконструкции они отражают 3D-организацию системы «трещин» в составе ВКМ (О. Ilina and P. F., неопубликованные данные), расположенные по ходу фибриллярных интерстициальных тканевых структур и между ними. В злокачественных очагах и опухолевых ксенотрансплантатах, изучаемых с помощью 3D-интравитальной микроскопии, эти слои часто вовлекаются в опухолевую инвазию, при этом признаки их структурных изменений или дегенерации незначительны (Alexander et al., 2008; Condeelis and Segall, 2003).
Другими тканеспецифичными структурами, которые задают вектор инвазии и задействуются преимущественно метастазирующими клетками, являются костные полости, покрытые монослоем выстилающих клеток, а также периваскулярные пространства сосудов головного мозга, локализованные между глиальными клетками и базальной мембраной гладкомышечных клеток сосудов (рис. 4D). Еще одним частным примером безбарьерной диссеминации может служить распространение по просвету мелких сосудов, что обеспечивает быстрое внутрисосудистое перемещение опухолевых клеток через капилляры в периферических тканях и синусоидах печени (Tsuji et al., 2006) (рис. 4А).
Наконец, 3D-матрикс, состоящий из хаотично организованных фибриновых и коллагеновых волокон, обеспечивает совместное функционирование 1D- (струноподобных линейных волокон) и 3D-структур с порами, имеющими сложную геометрию (Doyle et al., 2009; Wolf et al., 2009) (рис. 4С). Подобная сетчатая организация ВКМ преобладает в рыхлых соединительных тканях, например, в дерме молодых мышей, временных тканях (таких как фибриновый сгусток после ранения); также свободные от волокон ВКМ пространства (образованные астроцитами и нейрональными волокнами) можно встретить в белом вещества головного мозга (Grytsenko et al., 2011; Wolf et al., 2009). Эти сети волокон подобны коллагеновым матриксам, 3D-модели которых воссоздают in vitro, или эквивалентам базальной мембраны, часто используемым в исследованиях клеточной инвазии.
Таким образом, инвазивные клетки должны приспосабливаться к разнообразным геометрическим конформациям и молекулярным лигандным системам для адгезии и миграции in vivo. В то время как модели ВКM, воссозданные in vitro, благодаря своему независимому от клеток процессу полимеризации лишь имитируют хаотичное расположение матриксных структур, кропотливая работа в рамках клеточной и тканевой инженерии может помочь повторить многокомпонентную сложность геометрии межволоконных пространств, основанных на 2D-слоях, куда направляется инвазия in vivo (Ilina et al., 2011).
Ключевые молекулярные основы направления инвазии
Физическое пространство вокруг клеток, вероятно, влияет на изменение направления поляризации и динамического состояния цитоскелета за счет опосредованного рецепторами молекулярного распознавания соседних матриксных структур. Инвазивные опухолевые клетки способны одновременно обрабатывать сигналы от: (1) молекул ВКМ, включая коллагены, ламинины, фибронектин и эластин; (2) элементов клеточных поверхностей, включая кадгерины, САМ и протеогликаны; и (3) изменения концентрационных градиентов про-миграционных факторов — хемотаксических (растворимые) и гаптотаксических градиентов (соединенные с ВКМ). Молекулярная «разметка» при участии адгезивных и хемотаксических рецепторов влияет на направление миграции опухолевых клеток и, таким образом, опосредует хемотаксис и гаптотаксис (направленное движение вдоль градиента зон клеточной адгезии или связанных с субстратом хемоаттрактантов); также она определяет физические взаимодействия клеток с окружающей тканью. Помимо физической структуры матрикса, роль ВКМ в направлении инвазии опосредована также вспомогательными молекулярными компонентами, которые ковалентно и нековалентно связываются с клетками опухоли и депонируются в стромальных клетках.
Роль ВКМ в направлении миграции
Молекулярные и физические характеристики ВКМ оказывают сильное воздействие на адгезию, миграцию и судьбу клеток в целом, участвуя в дальнейшей инвазии и диссеминации опухоли. Наиболее распространенным (в количественном отношении) и важным компонентом соединительной ткани является коллаген I типа, который служит структурным каркасом для клеток и других белков матрикса (Grytsenko et al., 2011; Wolf et al., 2009). В активированной строме опухоли часто повышается плотность содержания коллагеновых волокон (признак десмоплазии), а также гиалуронанов, протеогликанов и гликопротеинов (например, фибрина, фибронектина и витронектина). Вместе эти молекулы прикрепляются к коллагеновому каркасу и «функционализируют» его. In vitro мезенхимальные фибробласты и опухолевые клетки мигрируют либо вдоль 2D-коллагена, либо напрямую сквозь его 3D-структуру благодаря интегринам α2β1, α1β1 или α11β1; а также вдоль фибриновых или фибронектиновых волокон (либо сквозь 3D-матрикс, состоящий из них) благодаря интегринам α5β1, αVβ3 и αVβ5 (Even-Ram and Yamada, 2005; Maaser et al., 1999).
Также интегрины участвуют в миграции здоровых и опухолевых клеток вдоль структурных компонентов базальной мембраны, взаимодействуя с коллагеном типа IV (α1β1, α2β1), ламининами (α3β1, α6β1), фибриллином (α5β1, αVβ3, αVβ6), перлеканом и версиканом (β1) (Hynes, 2002). Например, периваскулярная инвазия клеток глиомы и периневральная инвазия клеток рака поджелудочной железы зависят от функционирования ламинин-связывающих β1-интегринов (Piao et al., 2009; Ryschich et al., 2009), однако механизмы других маршрутов инвазии, зависимых от базальной мембраны, включая пери- и внутримышечное распространение, а также процесс инвазии жировой ткани остаются неизученными.
Большинство белков ВКМ после своего синтеза претерпевает ферментативный процессинг под воздействием клеточных протеаз (рис. 3C) либо энзимов, катализирующих образование поперечных сшивок. Фибриллярные коллагены гликозилируются и сшиваются друг с другом лизилоксидазами (LOX) и лизилгидроксилазами, что повышает жесткость коллагена и его устойчивость к изменению рН и протеолитической деградации (Levental et al., 2009; Paszek et al., 2005). Здоровые и неопластические клетки способны распознавать различия в физических свойствах ВКМ и мигрировать преимущественно в области с повышенной жесткостью волокон, что принято называть дуротаксисом (Lo et al., 2000). Жесткий субстрат усиливает кластеризацию интегринов и последующее образование фокальных контактов (контакты, представленные скоплением интегриновых рецепторов на мембране клеток и связывающие их с ВКМ — прим. пер.) и цитоскелетных соединений через адаптерные белки p130Cas и винкулин (Grashoff et al., 2010; Sawada et al., 2006). Это усиливает сократительную способность клеток, а также улучшает их мезенхимальные характеристики (Levental et al., 2009).
Так, например, повышение синтеза перитуморального коллагена способствует инвазивному росту и метастазированию опухолевых клеток в моделях рака молочной железы и некоторых других типах рака (Goetz et al., 2011; Levental et al., 2009; Paszek et al., 2005). Помимо регуляции клеточной инвазии, физические свойства ткани определяют судьбу здоровых клеток в отношении их способности к росту и дифференцировке (Discher et al., 2005). Центральным сигнальным каскадом, который связывает механотрансдукцию с экспрессией генов, выступает система обеспечения клеточной пролиферации; в ответ на жесткость субстрата в ее регуляцию включается Yap1 — транскрипционный фактор, активируемый в ходе реализации сигнального пути hippo (Dupont et al., 2011). Yap1 способствует росту эпителиальных стволовых клеток и их гиперпролиферации, чему противодействует сигнальный каскад α-катенина (Schlegelmilch et al., 2011). Следовательно, Yap1 можно рассматривать как кандидата на роль важного механосенсибилизирующого эффектора опухолевой прогрессии в клетках, в которых нарушена регуляция взаимодействий между кадгерином и катенином.
Направление миграции вдоль клеточных мембран
Помимо взаимодействий между клеткой и субстратом, опосредующих миграцию клеток, недостаточно изученным (но исследуемым) вопросом остается влияние межклеточных соединений на маршрутизацию клеток. Кроме эпителия, покрывающего внутренние полости тела, и эндотелия, формирующего просвет кровеносных и лимфатических сосудов, в большинстве тканей в изобилии встречаются прерывистые и неоднородные клеточные каркасы, включая сети волокон фибробластов, макрофаги и эпителиальные структуры (рис. 4). В ходе развития у рыбок данио-рерио в примордиальных амебоидных зародышевых клетках, индивидуально мигрирующих через обогащенный клетками тканевой матрикс, важную роль в миграции играют Е-кадгерин и Rho-опосредованные сокращения актомиозина (Kardash et al., 2011). Небольшая группа половых клеток из развивающегося яичника дрозофилы, которая состоит из пограничных клеток, осуществляет коллективную миграцию, опосредованную Е-кадгерином. Клетки связаны между собой E-кадгерином, а направление их миграции зависит от EGF и собственно E-кадгерина (Geisbrecht and Montell, 2002). Таким образом, функционирование межклеточных соединений можно рассматривать в качестве альтернативного механизма механотрансдукции при миграции при условии, что клеточно-матриксные взаимодействия подавлены или отсутствуют. Однако несмотря на важнейшую роль в морфогенезе, вклад межклеточных взаимодействий, контролируемых кадгерином, в процесс инвазии опухоли все еще остается неясным.
Молекулы, принимающие участие в направлении миграции
Многие хемокины и факторы роста содержат один или несколько ВКМ-связывающих доменов, которые иммобилизируют факторы в тканях, влияя тем самым на способность матрикса стимулировать миграцию. Хемокины и факторы роста содержат сайты связывания с боковыми цепями гепарансульфата (Lortat-Jacob et al., 2002), которые присутствуют в составе интерстициальных и клеточных поверхностных протеогликанов и гепарина (Hynes, 2009).
После функционализации (вследствие прикрепления боковых цепей) протеогликановый каркас имеет адгезионные участки (для взаимодействия с интегринами и другими рецепторами), а также иммобилизированные (ковалентно связанные с полимером) ферменты, активирующие миграционные сигнальные каскады при участии CCR и GFR (рецепторы факторов роста). Эти полимерные каркасы, располагаясь на таких субстратах, как матриксные волокна или базальная мембрана, участвуют в перемещении и адгезии клеток в непосредственной близости этого же самого субстрата, вдоль него. При 3D-моделировании инвазии можно спроектировать условия для морфогенеза ветвления (branching morphogenesis), который в норме способствует коллективному прорастанию эпителиальных протоков молочной или слюнной железы; однако иммобилизация FGF10 с гепарансульфатом вызывает максимальное удлинение и рост протоков благодаря вовлечению сигнального каскада с участием FGFR2. В то же время только при диффузионном пространственном распределении FGF10 не обладает про-инвазивной активностью и поддерживает только рост (Makarenkova et al., 2009). Аналогично этому, хемокин CXCL12/SDF-1 и EGF (эпидермальный фактор роста) взаимодействуют с тканевым гепарансульфатом и формируют устойчивые градиенты концентрации, что обеспечивает направленную миграцию опухолевых клеток и лейкоцитов (Allinen et al., 2004; Netelenbos et al., 2002; Wyckoff et al., 2004).
TGFβ считается главным индуктором мезенхимальной инвазии и активности стволовых клеток в злокачественных клетках. Он иммобилизируется с ВКМ через соединение с фибронектином и фибриллином благодаря латентным TGFβ-связывающим белкам, а высвобождается посредством ограниченного протеолиза, опосредованного MMP или фурином, которые выделяются активированными стромальными клетками (Mu et al., 2002). Вместе с этим интегрины взаимодействуют с латентными TGFβ-связывающими белковыми комплексами, вызывая конформационные изменения последних, что необходимо для открытия доступа молекулам TGFβ, соединенным с ВКМ, к их рецепторам (Wipff et al., 2007). Остеопонтин — это секретируемый клетками цитокиноподобный протеогликан, который связывается с CD44 и интегринами. Уровень остеопонтина повышается во многих типах опухолей, и он играет важную роль в направлении клеточной инвазии (Bellahcéne et al., 2008).
В дополнение к приведенным примерам, определение профиля генной экспрессии и протеомика помогли выявить избыточное количество растворимых факторов и белков ВКМ, содержание которых повышено в микроокружении опухолей, что указывает на сложную организацию сигнальных каскадов, индуцируемых как в опухолевых, так и в стромальных клетках (Allinen et al., 2004; Wang et al., 2004). Помимо своей локальной роли в перитуморальном пространстве, многие депонированные факторы, диффундируя в кровоток и лимфатическую жидкость, проявляют системные, гормоноподобные эффекты. Хемокин CXCL12/SDF-1 и остеопонтин служат важными примерами подобных растворимых факторов. Секретируемый опухолью хемокин CXCL12/SDF-1 мобилизует стволовые клетки костного мозга, которые рекрутируются в опухоль и способствуют организации опухолевых кровеносных сосудов (Orimo et al., 2005), а остеопонтин активирует клетки костного мозга, которые способны интегрироваться в структуру опухоли и ускорять его рост (McAllister et al., 2008).
Таким образом, многочисленные и частично перекрываемые друг другом механизмы вносят свой вклад в физическую и молекулярную маршрутизацию опухолевых клеток, однако их перекрестные взаимодействия и иерархическая структура еще остаются неизученными.
Пластичность механизмов инвазии и метастазирования
Разные режимы инвазивного роста опухолевых клеток; рецепторы и молекулы-регуляторы перестроек цитоскелета, способствующие межклеточной и клеточно-матриксной адгезии; различная способность к ремоделированию ВКМ; многообразие контролирующих направление инвазии молекулярных и физических тканевых структур — все это обеспечивает многоуровневую взаимосвязь комбинаторных возможностей и состояний, которые позволяют опухолевой инвазии быть пластичным и адаптивным процессом (Friedl, 2004; Friedl and Wolf, 2010). Как следствие, при нарушении тканевой структуры и формировании определенных условий под воздействием высвобождаемых факторов происходят значительные изменения в активности опухолевых клеток и сигнальных каскадах, что приводит к побочным эффектам в ткани, которая подвергается инвазии, и, в свою очередь, в самих опухолевых клетках.
Пластичность тканевых структур
Опухолевая инвазия в ткани проходит в несколько фаз, которые могут быть обозначены как начальная, недеструктивная фаза навигации и фаза ремоделирования тканей. Постепенно в ходе инвазивной миграции происходит формирование канальцев, тоннелей и «лагун» в структуре ВКМ, которые прокладывают маршрут для подвижных опухолевых клеток и могут быть заселены ими (Alexander et al., 2008; Condeelis and Segall, 2003) (S. A., неопубликованные данные) (рис. 5А). При участии либо самих опухолевых клеток, либо фибробластов и при повышенной секреции ММР (особенно МТ1-ММР/ММР14) происходит перицеллюлярный протеолиз матрикса, в результате чего в нем образуются микро-и макротрещины, граничащие с уплотненными упорядоченными пучками коллагена, которые способствуют как одиночной, так и коллективной инвазии (Friedl et al., 1997; Gaggioli et al., 2007; Goetz et al., 2011; Wolf et al., 2007) (рис. 5А). Эти de novo сформированные «ходы» служат маршрутом для направления миграции опухолевых клеток и при механическом давлении, которое оказывается инвазивными клетками, данные канальцы постепенно расширяются до тех пор, пока не наступит регресс ВКM (Gaggioli et al., 2007; Ilina et al., 2011; Wold and Friedl, 2011). Такие расщелины, часто заполняемые опухолевыми клетками, обильно встречаются в большинстве интерстициальных тканей, богатых коллагеном, включая десмопластическую строму (Levental et al., 2009; Paszek et al., 2005). Таким образом, несмотря на повышение абсолютной плотности содержания коллагена в матриксе, сигнальные молекулы, разрывы и канальцы в структуре десмопластической стромы скорее способствуют инвазии и опухолевой прогрессии, чем мешают им.
.
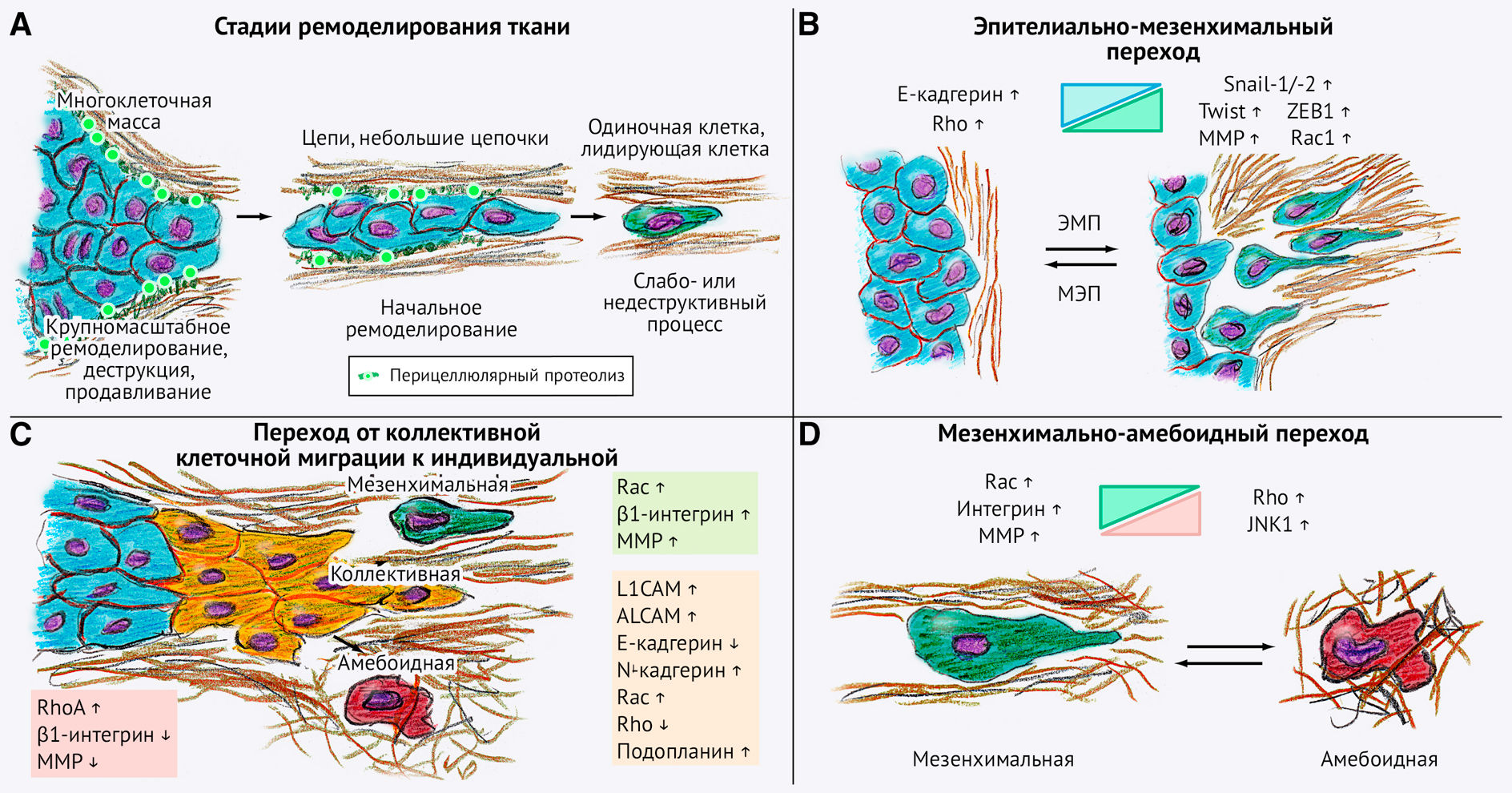
(B) Эпителиально-мезенхимальный переход клеток стабильного эпителия в результате уменьшения количества межклеточных соединений и облегчения «отслойки» отдельных клеток.
(C и D) Механизмы инвазии характеризуются пластичностью (адаптивностью), что подразумевает, например, переход от коллективной миграции клеток к индивидуальной (C) и мезенхимально-амебоидный переход (D). Ключевые регуляторы этих переходов, экспрессия которых при этом изменяется, отражены на рисунке.
Ремоделирование десмопластической ткани путем прямых и косвенных механизмов служит активатором опухолевой прогрессии, инвазии и метастазирования (Egeblad et al., 2010). Будучи ключевыми посредниками при десмопластических преобразованиях, резидентные фибробласты и иммигрировавшие в ткани их клетки-предшественники получают сигналы активации от факторов роста, включая TGFβ, IL-1 и PDGF. В процессе этого они преобразуются в индуцированные опухолью миофибробласты (cancer-associated myofibroblasts, CAF), которые депонируют, ремоделируют и стягивают (contract) фибриллярный коллаген (De Wever et al., 2008; Egeblad et al., 2010). Послеродовая инволюция молочной железы, являясь физиологическим процессом реорганизации соединительной ткани, приводит к отложению фибриллярного коллагена и индуцированному этим высвобождению провоспалительных молекул COX-2 (Lyons et al., 2011). Этой реорганизации порой достаточно для того, чтобы запустить механизмы роста, коллективной инвазии с формированием многоклеточных тонких тяжей и метастазирования в опухолевых очагах молочной железы, которые, на первый взгляд, кажутся доброкачественными или низко агрессивными (Lyons et al., 2011). Аналогичное прогрессирование рака молочной железы вызывают активированные фибробласты, которые реорганизуют и конденсируют строму молочной железы, формируя выровненные, связанные в пучки коллагеновые тяжи, которые обусловливают инвазию и метастазирование рака молочной железы (Goetz et al., 2011).
В костных метастазах резорбция кости осуществляется остеокластами, в которых RANKL (активатор рецептора лиганда NF-κB) активируется при участии TGFβ- и MMP13-зависимых механизмов; это позволяет растущей опухоли расширяться в de novo сформированном пространстве, что в конечном итоге приводит к локальной деструкции кости (Nannuru et al., 2010; Nannuru and Singh, 2010). Во всех случаях ранее существовавшее тканевое пространство сначала заполняется инвазивными клетками, при этом каких-либо признаков деградации матрикса не наблюдается; но затем, с увеличением плотности клеток и повышением концентрации ММР и других протеаз, ткань деградирует и реорганизуется. В результате инвазия рака приводит ко вторичной потере целостности и функции тканей, в том числе к некрозу тканей, изъязвлению и разрыву сосудов. Структуры, видимые при гистологическом исследовании, можно сравнить со статическими снимками, которые в реальности запечатлевают динамичный и пластичный процесс замещения и, в конечном итоге, разрушения растущей и инвазивной опухолью интерстициальной ткани.
Пластичность межклеточных соединений: эпителиально-мезенхимальный переход
Центральным молекулярным процессом, способствующим инвазивному росту опухолевых клеток в ответ на влияние внешних факторов, считается эпителиально-мезенхимальный переход (ЭМП). ЭМП инициирует или повышает инвазивную активность путем усиления Rac-зависимой мезенхимальной миграции. Он также способствует росту клеток, их выживанию в среде и возвращению к фенотипу стволовых клеток (Thiery et al., 2009) (рис. 5В).
В ходе ЭМП восходящие сигнальные каскады при участии факторов роста стромы опухоли, включая Wnt, TGFβ, FGF и EGF, приводят к активации транскрипционных репрессоров, включая ZEB1, Twist и Snail1 и 2, которые прямо или косвенно ингибируют транскрипцию E-кадгерина (Spaderna et al., 2008; Yang et al., 2004). Например, в клетках рака молочной железы, вступающих в ЭМП в ответ на присутствие в среде ММР-3 (которые расщепляют Е-кадгерин на клеточной поверхности и тем самым ослабляют межклеточные соединения), начало миграции зависит от активации Rac и от клеточной продукции активных форм кислорода (АФК), которые, в свою очередь, активируют сигнальный путь Snail (Radisky et al., 2005). При снижении экспрессии E-кадгерина адгезивные соединения и их сигнальные каскады ослабляются или заменяются менее жесткими межклеточными соединениями при участии N-кадгерина или L1CAM (Gavert et al., 2007; Yano et al., 2004). Это приводит к нарушению апикобазальной полярной дифференцировки и заякориванию клеток на базальной мембране, что, в свою очередь, способствуют развитию подвижного мезенхимального фенотипа (Thiery et al., 2009). Механизм ЭМП также благоприятствует появлению стволовых характеристик, что облегчает процессы инвазии и диссеминации, а также вызывает способность к формированию отдаленных метастазов (Mani et al., 2008).
Механизм активации ЭМП с пониженной экспрессией Е-кадгерина, вероятно, может несколько изменяться, что зависит от того, в полной ли мере реализуется сигнальный каскад, приводящий к ЭМП. Например, ЭМП может сопровождаться полной потерей Е-кадгерина и типичным профилем ЭМП-механотрансдукции и экспрессии белка. Однако ЭМП также может быть лишь частичным, с сохранением экспрессии Е-кадгерина в различной степени, и даже может развиться ЭМП-подобная диссеминация без ЭМП-ассоциированных паттернов экспрессии генов (Christiansen and Rajasekaran, 2006; Gavert et al., 2011; Paéz-Ribes et al., 2009; Wicki et al., 2006). В очагах эпителиального рака ЭМП наблюдается лишь в нескольких, зачастую связанных друг с другом клетках, расположенных на лидирующем крае мигрирующей клеточной группы, а также в небольших связанных группах и отдельных клетках, рассеянных по очагу и движущихся независимо друг от друга без какого-либо контакта с основной массой опухоли (Brabletz et al., 2001; Gavert et al., 2007). Таким образом, помимо представлений о полной потере межклеточных соединений в ходе ЭМП, существует понимание того, что данное явление способствует активизации коллективных клеточных взаимодействий, включая коллективную инвазию. Это согласуется с известными примерами коллективной инвазии первичных мезенхимальных опухолей и меланомы (Alexander et al., 2008; Hegerfeldt et al., 2002).
Считается также, что ЭМП представляет собой программу, которая находится под временным контролем микроокружения, вызывающего локальное ослабление эпителиального фенотипа и облегчающего выход некоторых клеток (cell escape) из первичной опухоли. Однако при потере локального восходящего сигнального пути после метастатического диссеминирования в отдаленные органы клетки вступают в обратный процесс — мезенхимально-эпителиальный переход (Spaderna et al., 2006; Thiery et al., 2009). Таким образом, ЭМП-зависимые программы инвазии и метастазирования чутко реагируют на изменения в микроокружении опухоли и носят адаптивный характер в отношении регуляции сигнальных каскадов и связанной с ней динамики инвазивного роста.
Пластичность клеточно-матриксных взаимодействий и динамических перестроек цитоскелета
Исполнительные механизмы механотрансдукции, ассоциированной с миграцией клеток, пластичны и позволяют быстро адаптироваться к изменениям и вызовам окружающей среды; эти адаптации часто приводят к смене различных режимов миграции (Friedl and Wolf, 2010; Sanz-Moreno and Marshall, 2010). Такая пластичность, вероятно, возникает в ответ на изменения в тканевых микрорегионах (tissue microregions) и на терапевтические воздействия. Таким образом, естественная регуляция экспрессии генов и сигнальной трансдукции в опухолевых клетках под контролем микроокружения объясняет зачастую гетерогенный характер инвазии при прогрессирующих опухолевых поражениях. Кроме этого, разнообразие в персистирующей инвазии обусловлено перестройками сигнальных каскадов и выживанием отдельных клеток при повреждении тканей и противоопухолевом лечении (Alexander and Friedl, 2012).
В опухолях, для которых характерна коллективная инвазия, координация и сигнальная трансдукция между клетками опосредуются либо Е-кадгерином, экспрессируемым на не препятствующем миграции уровне, либо альтернативными кадгеринами, в том числе N- или VE-кадгерином (Yano et al., 2004) (рис. 5С). Механизмы коллективной инвазии с экспрессией Е-кадгерина в межклеточных соединениях включают в себя активацию: L1CAM, который значительно способствует миграции (Gavert et al., 2011; Shtutman et al., 2006); фактора обмена гуаниновых нуклеотидов Tiam-1, запускающего сигнальные пути Rac1, но при этом сохраняющего адгезионные и плотные клеточные контакты (Mertens et al., 2005; Walch et al., 2008); и подопланина, повышающего уровень RhoA в условиях Е-кадгерин-опосредованной адгезии (Wicki et al., 2006).
Как и при осуществлении ЭMП, переход от коллективной миграции клеток к индивидуальной (т. н. коллективно-индивидуальный переход) запускается при локальном вовлечении Rac1, что способствует развитию эктопических свойств у клеток лидирующего края мигрирующей опухоли, взаимодействиям с субстратом и, в конечном счете, откреплению клеток от матрикса (что достигается благодаря ослаблению клеточной адгезии, опосредованной кадгерином) (рис. 5С). Стимулы внешней среды могут способствовать отщеплению отдельных клеток от общей опухолевой массы, отчасти посредством ЭМП, отчасти — другими путями (Bertout et al., 2008; Pennacchietti et al., 2003). К таким стимулам относятся TGFb, EGF и другие факторы роста, а также метаболический стресс в виде закисления среды стромы, что вызывает значимый сдвиг в опухолевом метаболизме (эффект Варбурга) и клеточную гипоксию с реактивной активацией сигнального каскада HIF-1a (Bertout et al., 2008; Pennacchietti et al., 2003).
Помимо этого, возможен и другой переход: при потере межклеточных соединений и активации в клетках программы индивидуальной миграции с низкой интегрин-опосредованной адгезией и высокой Rho-индуцируемой кортикальной актомиозиновой сократимостью коллективная инвазия может преобразоваться в амебоидную диссеминацию (Hegerfeldt et al., 2002; Sanz-Moreno et al., 2008). При раке молочной железы EGF, секретируемый преимущественно активированными макрофагами, активирует опухолевые клетки, отделившиеся от основной линии эпителия, и направляет их миграцию в режиме амебоидной диссеминации (Wyckoff et al., 2004). Таким образом, инициация того или иного вида миграции после открепления отдельных клеток от многоклеточной массы зависит от регуляции адгезионных соединений, формирования опосредованных цитоскелетом выступов на переднем крае клеток и сократительной активности, а также от способности ремоделировать ВКМ.
Мезенхимальная инвазия может трансформироваться в амебоидную миграцию под влиянием различных механизмов, таких как снижение активности Rac и сопутствующая активация Rho-опосредованной сократительной способности актомиозина (Sahai and Marshall, 2003). Терапевтическое ингибирование MMP также может способствовать амебоидной миграции, поскольку перицеллюлярный протеолиз при участии MMP вызывает непротеолитическую деформацию амебоидных клеток для обхода узких барьеров ВКМ (Wolf et al., 2003а) (рис. 5D). Кроме этого, амебоидное передвижение фенотипически мезенхимальных клеток может индуцироваться следующими путями: ингибированием хемокин-опосредованной активации Rac (Gérard et al., 2007), активацией Rho посредством подавления экспрессии белков p190RhoGAP (Nimnual et al., 2003), либо вовлечением EphA2 (непрямого активатора Rho) (Parri et al., 2009). Наконец, генные мутации, влияющие на экспрессию интегрина или равновесие сигнальных каскадов Rac/Rho, могут также влиять на изменчивость и пластичность процессов инвазии и метастазирования. Мутация или потеря гена р53 приводит к повышению темпов обновления интегринов и их деградации, что переводит клетки в режим амебоидной диссеминации и значительно ускоряет инвазию/метастазирование (Gadea et al., 2007; Muller et al., 2009).
Соответственно, благодаря приобретению или потере межклеточных соединений и контроля над адаптивной сигнальной трансдукцией с участием Rac и Rho механизмы опухолевой инвазии становятся пластичными и способными быстро реагировать на сигналы от микроокружения и молекулярную интерференцию, что обеспечивает миграцию клеток в неблагоприятных для них условиях (Madsen and Sahai, 2010). Эти основные механизмы переходов между разными режимами миграции были изучены в условиях in vitro с использованием клеточных линий, и их актуальность для опухолевых очагов in vivo еще ожидает подтверждения; в этом могут помочь методы 3D-гистопатологии в сочетании с интравитальной визуализацией (Pittet and Weissleder, 2011). Аналогично тому, что инвазионная пластичность имеет функциональные сходства и различия с механизмами ЭМП, пути осуществления последних необходимо продемонстрировать in vitro и in vivo. Это позволит выявить ЭМП-зависимые и независимые пути и ниши естественной и индуцированной инвазионной пластичности, опосредованной терапией, а также их вклад в метастатическую диссеминацию (Christiansen and Rajasekaran, 2006).
Пластичность и реципрокность: моделирование
Механизмы пространственно-временной пластичности (т. е. изменений фенотипа и функций) и реципрокности (т. е. обработки сигналов, поступающих из окружающей среды) являются фундаментальными для многоступенчатого процесса преобразований как в опухолевых клетках, так и в микроокружении - процесса, который получает свой вектор развития при перемещении клеток из одной среды в другую. Концепция динамической реципрокности для клеток, взаимодействующих с ВКМ и изменяющих его структуру, была первоначально сформулирована Полом Борнштейном для клеточно-матриксных взаимодействий при заживлении ран (Bornstein et al., 1982). Далее она была дополнена Миной Бисселл и ее коллегами при изучении морфогенеза эпителия (Bissell et al., 1982) и рака (Nelson et al., 2008; Xu et al., 2009). Соответственно, пластичность и реципрокность обусловливают морфологические и физиологические особенности межопухолевой и внутриопухолевой гетерогенности, которая основана на дополняющих друг друга механизмах, включая геномную нестабильность и эпигенетическую, сигнальную и функциональную адаптацию к изменяющимся условиям окружающей среды (рис. 6А). Подобные «судьбоносные» события, индуцирующие высокий адаптивный потенциал опухолевых клеток, происходят в ответ на метаболические изменения в микроокружении, включая гипоксию и тяжелый метаболический стресс (Bertout et al., 2008), а также постоянную стимуляцию секреции факторов роста и воспаления (Allinen et al., 2004; Polyak et al., 2009) (рис. 6В).
.
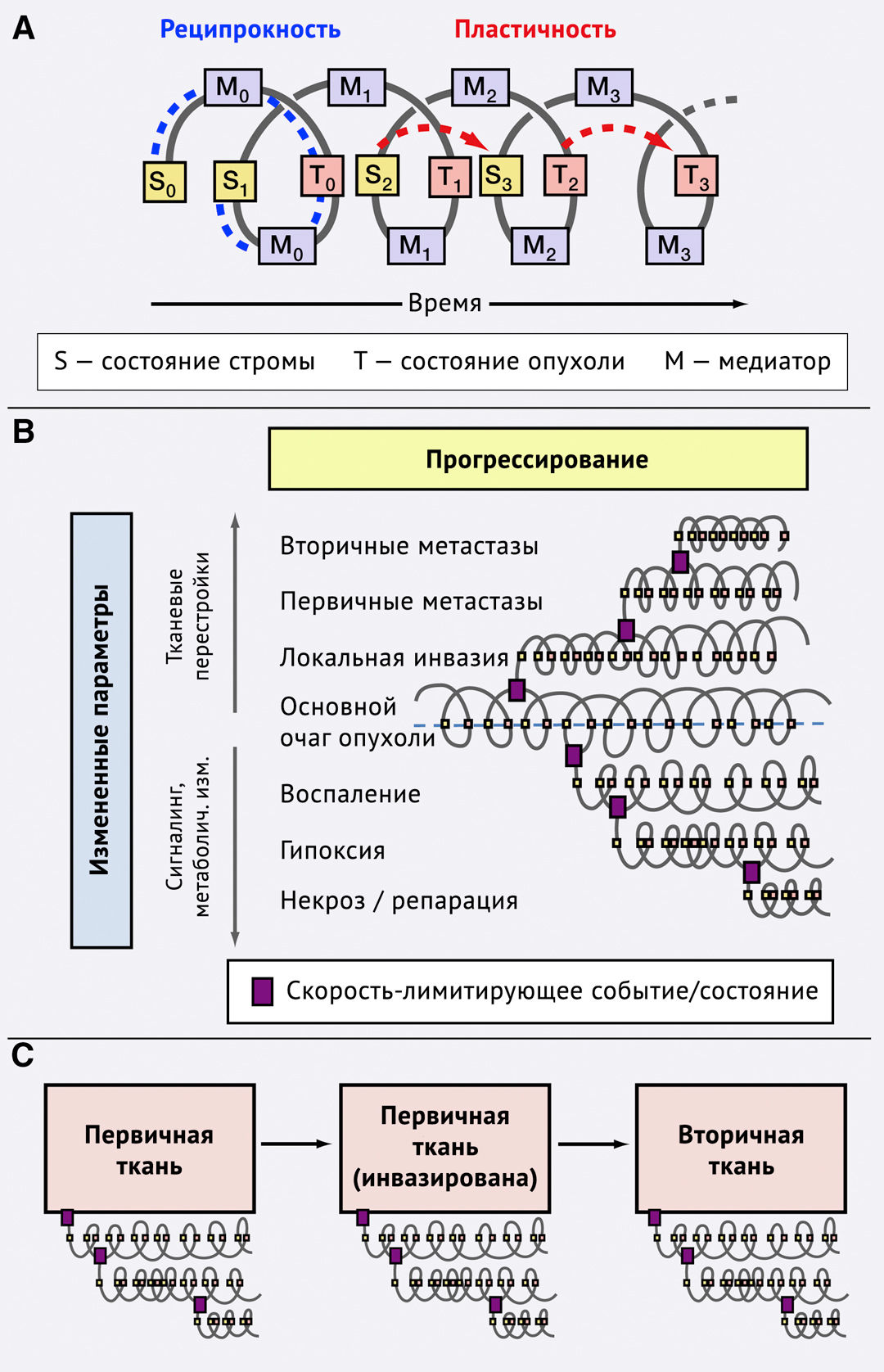
(B) Ветвление и изменение направленности реципрокной пластичности в ходе опухолевой прогрессии. Дихотомическое изменение ее направленности достигается путем смены местоположения опухолевой клетки, что приводит к различиям в устройстве ткани и изменениям воздействий от окружающей среды (верхние спирали); аналогично этому многоэтапная бифуркация при реципрокной эволюции может быть вызвана изменениями местных условий в ткани, включая нарушенный состав инфильтрирующих клеток при воспалительном и метаболическом стрессе, недостаточную перфузию, приводящую к гипоксии, а также программы тканевой репарации, индуцированной спонтанным или опосредованным терапией (опухолевым) некрозом (нижние спирали).
(C) Реципрокность второго и третьего порядков. Реципрокная пластичность может эволюционировать в ходе метастатической прогрессии, что приводит к реципрокности второго и третьего порядков. В ходе метастазирования тканеспецифическая реципрокность и воздействия со стороны микроокружения взаимопотенциируют друг друга, стимулируя локальную пластичность опухолевых клеток и опухолевой стромы, что приводит к эволюции опухолевых субрегионов с развитием различных возможностей для прогрессирования и адаптации. Как следствие, реципрокность и пластичность могут приводить к параллельной или дивергентной эволюции клеточных клонов и популяций.
Заключение
Хорошо изученные экспериментальные модели in vitro помогли в достаточно полной мере определить схемы взаимодействий «рецептор-лиганд» и их фундаментальную роль в инвазивной миграции, однако из-за их сложной организации и взаимопотенциирующей активности in vivo выявление доминирующих и компенсаторных механизмов, которые поддерживают метастатическую диссеминацию либо противодействуют ей, затруднено (Friedl and Wolf, 2003; Madsen and Sahai, 2010; Sanz-Moreno and Marshall, 2010). Хорошо известен внутриклеточный актомиозиновый механизм генерации силы перемещения; вместе с тем существует также широкий спектр режимов молекулярной и физической адгезии и сигнальной трансдукции на клеточном и тканевом уровнях, которые способствуют адаптивным изменениям в ходе клеточной миграции. Эти адаптации сопоставимы и, вероятно, взаимосвязаны с пластичностью и компенсационной активностью фокальной адгезии и других сигнальных каскадов в ходе клеточной инвазии (Zaidel-Bar et al., 2007). Так как большинство сигнальных путей с участием адгезионных молекул, протеаз и хемокинов/факторов роста довольно часто перекрываются и дублируют друг друга, естественная или терапевтически индуцированная потеря одного из путей может привести к смещению эффекторных связей при механо- и сигнальной трансдукции. Вместо первоначально ожидаемого ингибирующего сценария это может привести к запуску альтернативных механизмов инвазии и диссеминации.
В недавних работах исследователи выявили два неожиданных примера альтернативных типов миграции в трехмерном пространстве: независимая от интегринов интерстициальная миграция лейкоцитов (Friedl and Weigelin, 2008; Lammermann et al., 2008; Lammerman and Sixt, 2009) и миграция здоровых и злокачественных клеток посредством попеременных циклов расширений и сокращений клеточных тел (propulsive migration) с возникновением «пузыреподобных» выпячиваний на мембране (Fackler and Grosse, 2008; Lorentzen et al., 2011; Poincloux et al., 2011). Роль данных типов клеточного передвижения при инвазии метастатического рака in vivo еще предстоит изучить. Помимо активной миграции, опосредованной актомиозином, к другим механизмам клеточного перемещения относят пассивный дрейф вдоль тканевых структур и механическое выталкивание клеток из экспансивно растущего опухолевого очага. Оба этих механизма до сих пор формально не включены в классификацию способов передвижения клеток.
Инвазируемая ткань зачастую рассматривается как однородный инертный каркас, который модифицируется опухолевыми клетками в одностороннем порядке; это положение подкреплялось большинством 2D- и 3D- моделей in vitro (Friedl et al., 1997; Wolf et al., 2009). Однако появилась концепция пластичности и реципрокности опухолевой инвазии, которая описывает инвазию как взаимообратный процесс, регулируемый множеством перекрываемых, избыточных и постоянно изменяющихся активных и пассивных механизмов молекулярной механотрансдукции. Такая адаптивность превращает клеточную инвазию и метастазирование в надежный продолжительный процесс; поиск направленной на него таргетной терапии, если это вообще возможно, потребует понимания иерархии важных контрольных точек. В связи с этим необходимы инструменты системной биологии и математического моделирования для систематизации скорость-лимитирующих узловых пунктов и преобразователей молекулярной механотрансдукции для каждого режима миграции в условиях конкретной ткани.
