Физиология эндометрия и регуляция менструаций

Возрождающийся подобно фениксу эндометрий является физиологическим примером поврежденной или «раневой» поверхности, которой каждый месяц требуется быстрое восстановление. Ежемесячно эндометрий человека подвергается воздействию последовательно изменяющихся концентраций циркулирующих половых стероидов, вырабатываемых яичниками: эстрадиол (E2) и прогестерон (P4). Падение уровня прогестерона служит фактором, запускающим менструацию. Вероятно, ключевую роль в процессах репарации эндометрия играет гипоксия. При менструации может наблюдаться нормальный уровень кровопотери (НМК), однако у четверти женщин репродуктивного возраста происходят обильные менструальные кровотечения (ОМК). Аномальное маточное кровотечение (АМК, включая симптом ОМК) — достаточно распространенное и изнуряющее состояние. С АМК могут быть связаны такие структурные особенности матки, как лейомиома/миома (Л) и/или аденомиоз (A). В данном обзоре авторы кратко рассматривают физиологию менструации (эндокринную, воспалительную и гематологическую регуляцию отторжения и восстановления эндометрия), очерчивают причины АМК и определяют актуальные области исследований, позволяющие усовершенствовать лечение нарушений менструального цикла и облегчить тяжесть АМК.
Физиологическими функциями эндометрия (слизистой оболочки) матки являются подготовка к имплантации, поддержание беременности в случае имплантации и менструация при отсутствии беременности. Таким образом, эндометрий играет ключевую роль в размножении и продолжении нашего вида. Менструация — это событие, регулируемое стероидами, и для подготовленного прогестероном эндометрия существуют лишь одна ей альтернатива — беременность. Падение уровня прогестерона служит фактором, запускающим менструацию. Эндометрий при менструации является физиологическим примером поврежденной или «раневой» поверхности, которой каждый месяц требуется быстрое восстановление. Физиологические события менструации и восстановления эндометрия обеспечивают доступную in vivo на человеке модель воспаления и восстановления тканей. Развитию нашего понимания патофизиологии эндометрия способствовали современные инструменты клеточных и молекулярных исследований, а также модели имитируемых менструаций на животных. АМК, включая ОМК, тяжелым бременем ложится на общество, затрагивая каждую четвертую женщину репродуктивного возраста. Понимание структурных и неструктурных причин, лежащих в основе АМК, необходимо для оптимизации и обеспечения точности тактики ведения пациентов. Этому способствует тщательная классификация факторов возникновения кровотечений. Авторы подчеркивают острую необходимость понимания механизмов, лежащих в основе менструации и ее нарушений. Эндометрий является основной тканью-мишенью для селективных модуляторов рецепторов прогестерона (selective progesterone receptor modulators, SPRM). Этот класс соединений обладает терапевтическим потенциалом для решения клинических проблем ОМК. Механизмы, благодаря которым SPRM ослабляют менструальное кровотечение, в настоящее время мало изучены. Менструация у человека остается табуированной темой, и многие вопросы физиологии эндометрия, которые касаются менструальных кровотечений, до сих пор не получили ответа.
Введение
Функции эндометрия матки заключаются в подготовке к имплантации, поддержании беременности, если имплантация произошла, и менструации при отсутствии беременности. Таким образом, эндометрий (слизистая оболочка матки) играет ключевую роль в размножении и поддержании нашего вида. Эти важнейшие процессы регулируются стероидами, и для подготовленного прогестероном эндометрия существуют лишь две альтернативы: беременность или менструация. Эндометрий представляет собой сложную многокомпонентную ткань, мишень стероидных гормонов, которая при отсутствии беременности ежемесячно отторгается (происходит менструация), а затем быстро восстанавливается без остаточных рубцов или потери функции. Восстановление эндометрия после его разрушения и отторжения включает устранение воспаления, ангиогенез, ремоделирование и формирование новой ткани. В состав эндометрия входят такие типы клеток, как стромальные, эпителиальные, сосудистые и иммунные клетки. Динамичный межклеточный диалог с участием эндокринной и иммунной систем необходим для обеспечения эффективного отторжения эндометрия и последующей реэпителизации (восстановления поврежденной поверхности слизистой оболочки) в случае, если беременность не наступила. Эндометрий человека и физиологические события менструации и восстановления эндометрия обеспечивают доступную in vivo на человеке модель воспаления и восстановления тканей. Следовательно, эндометрий при менструации можно считать прекрасным физиологическим примером поврежденной или «раневой» поверхности, которая должна быстро восстанавливаться каждый месяц.
Стадия менструального цикла определяется преобладающим эндокринным окружением, оказывающим значительное влияние на строение и функцию эндометрия
Во время менструального цикла человека эндометрий ежемесячно подвергается воздействию последовательно изменяющихся концентраций циркулирующих половых стероидов, вырабатываемых яичниками, что имеет решающее значение для регуляции его роста и дифференцировки. Главными участниками такой подготовки к беременности являются вырабатываемые яичниками 17-эстрадиол (E2) и прегн-4-ен-3,20-дион (прогестерон; P4). Колебания концентраций этих гормонов на протяжении всего менструального цикла хорошо описаны (рис. 1A).
В эндокринной среде эндометрия изначально преобладает эстрадиол — на ранней, «пролиферативной», фазе менструального цикла происходит интенсивная пролиферация тканей сосудов и собственно эндометрия. Пролиферативная фаза эндометриального цикла соответствует «фолликулярной» фазе яичников; а после овуляции и образования желтого тела происходит секреция прогестерона [49, 181].
Во время «секреторной» фазы эндометриального цикла (соответствующей «лютеиновой» фазе яичников) преобладает прогестерон, выработка которого необходима для обеспечения имплантации эмбриона в подготовленный эстрадиолом эндометрий и для поддержания беременности [49, 62, 181].
События, охватывающие время от регрессии желтого тела в поздней секреторной фазе (время падения уровня прогестерона) и менструации до постменструального восстановления эндометрия в последующей пролиферативной фазе, отражают эндокринный «лютеофолликулярный» переходный период и могут быть названы «перименструальным окном» (рис. 1B).
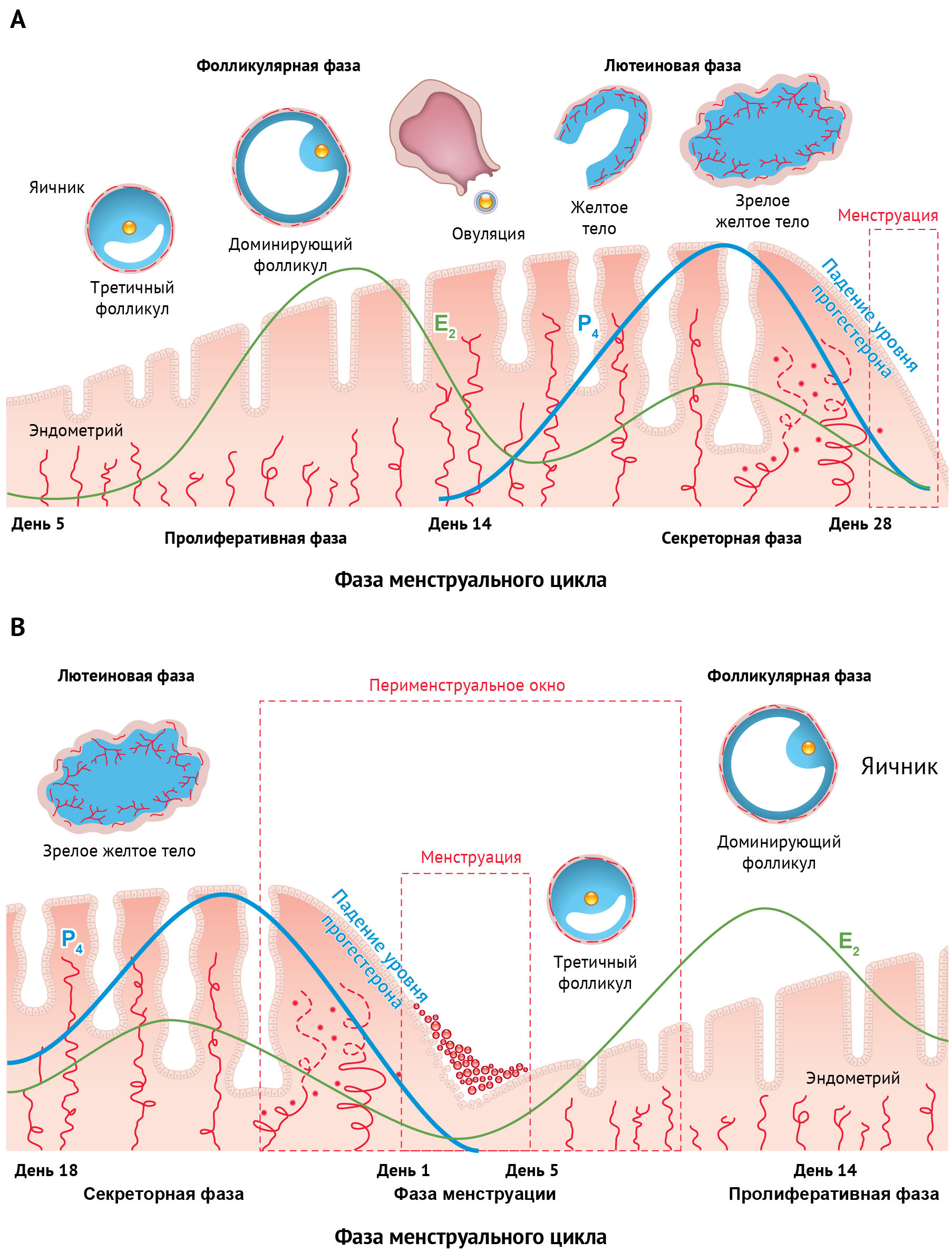
В: перименструальное окно (лютео-фолликулярный переход): смещение традиционной иллюстрации менструального цикла с целью фокусировки на значительных изменениях гормонального фона и эндометрия, которые происходят при его разрушении и восстановлении.
Гистологически эндометрий состоит из простого цилиндрического эпителия и лежащей под ним многоклеточной стромы. Строма содержит клеточные компоненты соединительной ткани с фибробластоподобными стромальными клетками, а также трубчатые железы, открывающиеся в просвет матки, спиральные артерии и варьирующийся поток привлекаемых клеток врожденного иммунитета [181]. Имеются также существенные доказательства наличия популяции стволовых клеток эндометрия [89]. Эти клетки-предшественники способны дифференцироваться в стромальные и эпителиальные клетки и способствовать эффективному обновлению и поддержанию эндометрия, что необходимо для восстановления его целостности при менструации. У человека эти стволовые клетки-предшественники находятся в базальном слое эндометрия [205].
Стромальные клетки эндометрия (СКЭ) являются мишенью для прогестерона. Процесс, называемый децидуализацией эндометрия, указывает на превращение СКЭ в специализированные секреторные децидуальные клетки, которые создают питательное и восприимчивое клеточное микроокружение, необходимое для имплантации эмбриона и дальнейшего развития плаценты [95]. Децидуализация — это процесс, включающий трансформацию СКЭ удлиненной формы в округлые клетки, сопровождающийся индукцией экспрессии в СКЭ прогестерон-зависимых белков, включая пролактин, тканевой фактор, белок IGFBP1 и транскрипционный фактор FOXO1, а также гликоген [31, 32, 72, 138, 139, 207]. Реакция децидуализации эндометрия запускается внутриклеточно путем продукции цАМФ [32], возникающей первоначально в периваскулярных клетках стромы эндометрия, еще до того, как децидуализация охватит всю строму. Также децидуализация распространяется под эпителием, обращенным в просвет матки, и таким образом наблюдается в тех участках эндометрия, куда может имплантироваться эмбрион. У человека децидуализация не зависит от контакта эмбриона с эндометрием (имплантации) и происходит спонтанно под воздействием прогестерона. Также спонтанная децидуализация была описана у недавно обнаруженного менструирующего грызуна — иглистой мыши [16] (описание имитируемых менструаций в модели на мышах см. в разделе V).
Эти функционально разные фазы менструального цикла имеют решающее значение для синхронизации эндометрия с созреванием ооцитов, оплодотворением и имплантацией эмбриона в середине секреторной фазы, когда имплантационная восприимчивость эндометрия, скорее всего, будет оптимальной [229]. Интересно, что эндометрий человека проявляет наиболее обширную реакцию децидуализации среди всех изученных на сегодняшний день менструирующих видов [194]. Эта особенность, в свою очередь, может играть важную роль в обширной инвазии трофобласта, которая происходит у человека во время имплантации [82, 113]. Важно отметить, что недостаточность или нарушение инвазии трофобласта на ранних сроках беременности может привести к выкидышу, а на поздних сроках повлечь за собой такие проблемы, как задержка роста плода и преэклампсия [40, 117, 140].
Все больше фактов свидетельствует о том, что нарушения децидуализации лежат в основе отклонений на ранних, средних и поздних сроках беременности. Изменение функции децидуальных клеток в начале первого триместра может быть связано с последующим развитием преэклампсии. Например, аберрантная экспрессия хемокинов/цитокинов децидуальными клетками может влиять на миграцию, адгезию и выживаемость иммунных клеток эндометрия (NK-клетки матки, моноциты/макрофаги, Т-лимфоциты).
Это может привести к аномальным взаимодействиям с эпителиальными и/или эндотелиальными клетками эндометрия, в результате чего нарушаются их функции (количество, активация) и влияние на инвазию трофобласта с последующим риском развития преэклампсии [113]. Также было высказано предположение, что «менструальная предварительная подготовка» [33] защищает от развития преэклампсии. Существуют хорошие подтверждения того, что и менструация, и беременность являются воспалительными состояниями, связанными с физиологическим повреждением тканей процессами ишемии-реперфузии. Последнее особенно заметно во время беременности. Так, Бросенс с соавт. [33] предположили, что циклическая менструация защищает ткани матки от избыточного воспаления и окислительного стресса, который проявляется при глубокой плацентации, описав это термином «менструальная предварительная подготовка».
Более глубокое рассмотрение этого аспекта функции матки/эндометрия выходит за рамки данного обзора.
Концентрация циркулирующего эстрадиола снижается в течение поздней секреторной фазы, частично вследствие действия прогестерона. Прогестерон способствует превращению эстрадиола в менее биологически активную форму (эстрон; Е1) путем индукции метаболизирующих стероиды ферментов 17-гидроксистероиддегидрогеназ (HSD) [115, 133, 190, 237, 239], тем самым регулируя доступность эстрогенных лигандов. Сообщается, что прогестерон также снижает экспрессию рецепторов эстрогена (ER) [238] и тем самым дополнительно ингибирует действие эстрадиола. Таким образом, 17-HSD позволяют каждой клетке точно контролировать внутриклеточную концентрацию каждого полового стероида в соответствии с локальными потребностями тканей [133]. Децидуализация, по-видимому, является необходимым условием для менструации и происходит спонтанно у женщин и самок приматов Старого Света. У других же видов, напротив, децидуализация наблюдается только при имплантации, а менструации не возникают.
Отсутствие беременности приводит к регрессу желтого тела (формированию в яичнике рубцеподобной структуры, известной как беловатое тело, corpus albicans) и к последующему резкому снижению концентрации циркулирующего прогестерона и эстрадиола [63]. Снижение уровня эстрадиола и особенно прогестерона запускает наступление менструации (рис. 1 и 2), при которой верхний, функциональный слой эндометрия разрушается, отторгается, а затем восстанавливается.
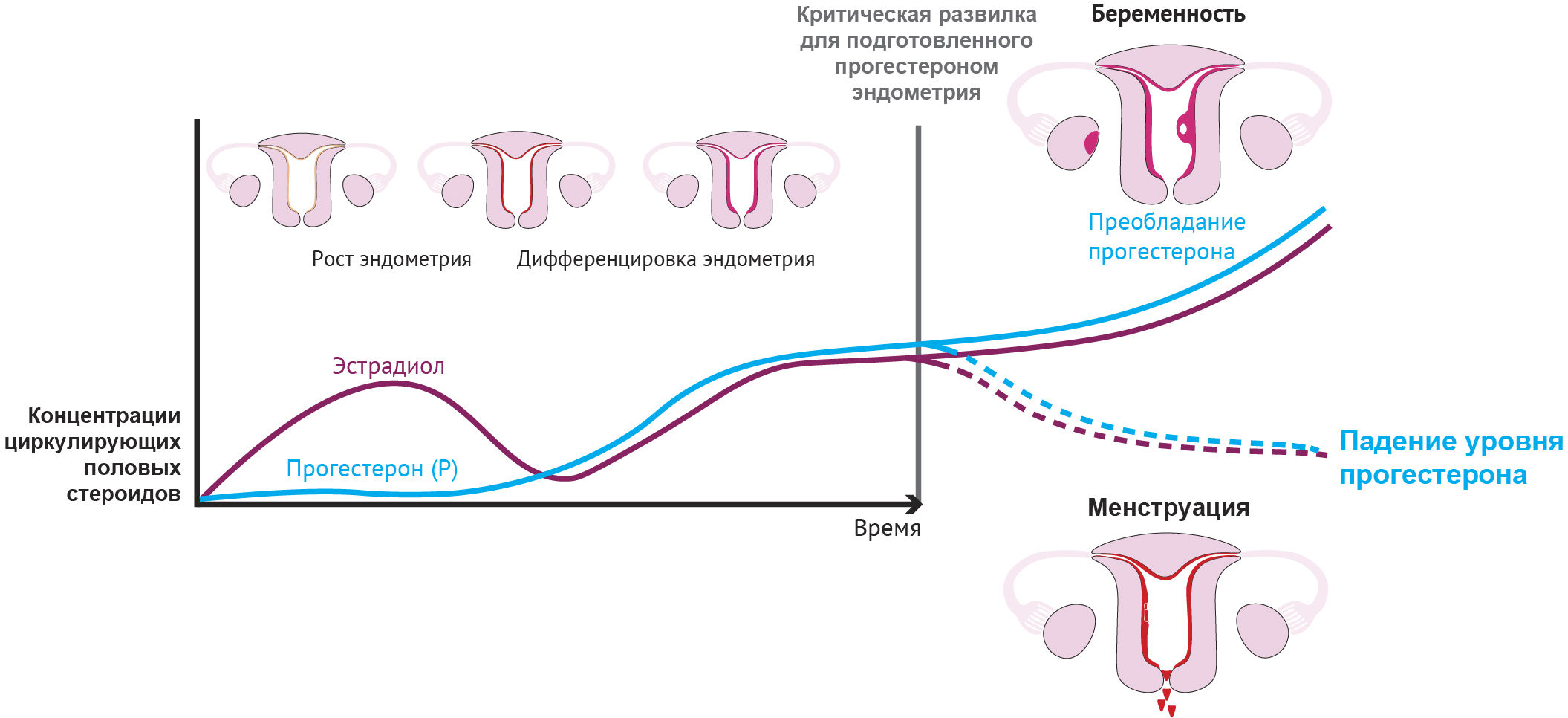
Падение уровня прогестерона вызывает ряд морфологических изменений в эндометрии, в том числе отек тканей, усиление кровотока в эндометрии, повышение проницаемости и ломкости сосудов [81, 92, 181, 198], а также миграцию большого количества лейкоцитов [55, 76, 81, 109, 116, 129, 165]. Более 30 лет назад Финн [81] впервые выдвинул гипотезу о том, что менструация является «воспалительным событием» и процессы в менструальном эндометрии аналогичны признакам классического воспаления, наблюдаемым в других тканях организма.
Морфологические изменения в эндометрии сопровождаются важными молекулярными и клеточными процессами, среди которых — очаговая активация матриксных металлопротеиназ (MMP) в зонах менструального лизиса [87, 144, 241] и усиление в эндометрии локальной экспрессии медиаторов воспаления, например, циклооксигеназы-2 (ЦОГ-2) [57, 119], цитокинов/хемокинов (например, интерлейкина-8 (IL-8), CCL-2) [57], а также повышение уровня локального синтеза простагландина [222, 228]. Сигнальный путь ядерного фактора NF-κB и рецепторов простагландинов типа Е, а также связанные с ними другие сигнальные пути реагируют на снижение концентрации прогестерона и вовлечены в регуляцию менструации (см. раздел VII). Имеются данные о нарушениях некоторых из этих путей у женщин с отклонениями менструального цикла, чаще всего с ОМК [222].
Регуляция эндометрия половыми стероидами и роль местных глюкокортикоидов
Имеются данные о том, что наряду с эстрадиолом и прогестероном, которые синтезируются в яичниках и регулируют состояние и функцию эндометрия, важную роль в функционировании эндометрия играют местные стероиды, в том числе другие эстрогены [96], андрогены [97] и глюкокортикоиды [159, 193].
Клетками-мишенями для андрогенов являются стромальные клетки эндометрия. Клетки функционального слоя экспрессируют рецепторы к андрогенам (androgen receptor, AR) во время пролиферативной фазы, а клетки базального слоя — на протяжении всего менструального цикла [97, 148]. Во время секреторной фазы экспрессия AR на поверхности клеток функционального слоя ослабляется, а в эпителиальных клетках эндометрия — усиливается, поскольку при регрессии желтого тела (т. е. при отсутствии беременности) падает концентрация циркулирующего прогестерона.
Локально синтезируемые глюкокортикоиды ограничивают воспаление в других участках ткани. Эти эффекты опосредованы связыванием кортизола с рецепторами глюкокортикоидов в ядре (glucocorticoid receptor, GR) [42]. В эндометрии GR находятся в стромальных и эндотелиальных клетках, а также NK-клетках матки [107]. Фермент 11β-гидроксистероиддегидрогеназа 1-го типа (11β-HSD1) синтезирует кортизол путем ферментативного восстановления кортизона, а 11β-гидроксистероид-дегидрогеназа 2-го типа (11β-HSD2) катализирует обратную реакцию [73].
Показано, что глюкокортикоиды ингибируют ангиогенез [141, 221]. В исследованиях описана экспрессия 11β-HSD1 в эндометрии, которая усиливается при менструации и совпадает с максимальными концентрациями мРНК GR в гомогенатах тканей эндометрия [159]. Интересно, что в эндометрии женщин с ОМК наблюдается повышенная локальная инактивация кортизола ферментом 11β-HSD2 [193]. В этом исследовании уровень мРНК HSD11B2 у женщин с ОМК был в 2,5 раза выше, чем у женщин с объективно измеренной нормальной менструальной кровопотерей. Это привело к гипотезе о более низкой локальной концентрации кортизола в эндометрии у женщин с более обильными менструальными кровотечениями. Таким образом, инактивация кортизола с помощью 11β-HSD2 может вызвать местный дефицит глюкокортикоидов в эндометрии и, следовательно, усиление ангиогенеза и нарушение сужения сосудов. Впоследствии на основе этого наблюдения было проведено двойное слепое плацебо-контролируемое исследование с адаптивным дизайном на основе ответа параллельных групп [248]. В ходе исследования изучалось влияние краткосрочного перорального приема синтетического глюкокортикоида дексаметазона, относительно устойчивого к инактивации ферментом 11β-HSD2, на «спасение» эндометрия от дефицита глюкокортикоидов в лютеиновой фазе и уменьшение менструальной кровопотери (ClinicalTrials.gov NCT01769820; EudractCT 2012–003405–98).
Рецепторы эстрогена (изоформа ERα) присутствуют в ядрах эпителиальных и стромальных клеток эндометрия на протяжении всей пролиферативной фазы, во время которой доминирует эстроген. В течение секреторной фазы менструального цикла с преобладанием прогестерона уровень ERα в эпителиальных и стромальных клетках эндометрия падает, в то время как уровень рецепторов прогестерона в строме эндометрия сохраняется, но снижается в железистом эпителии [58, 60, 136, 224].
Рецепторы прогестерона (progesterone receptor, PR) находятся в ядрах эпителиальных и стромальных клеток во время пролиферативной фазы. Существует, по крайней мере, две изоформы PR — PRA и PRB, которые действуют как транскрипционные регуляторы прогестерон-чувствительных генов [102, 103]. Хорошо описаны временные и пространственные паттерны экспрессии PR [136, 224]. Во время секреторной фазы PR сохраняются в строме функционального слоя, особенно в периваскулярной области.
Экспрессия PR согласуется с функциональной ролью прогестерона в данной фазе, т. е. с дифференцировкой и децидуализацией стромальных клеток при подготовке к беременности. Иммуногистохимический анализ эндометрия человека показал, что изоформа PRA преобладает в секреторной фазе, в то время как для изоформы PRB показано снижение во второй половине менструального цикла как в клетках стромы, так и в железистом эпителии [32, 167, 246]. Таким образом, стромальные клетки эндометрия остаются чувствительными к прогестерону во время секреторной фазы. Клетки базального слоя эндометрия, напротив, стойко экспрессируют PR на протяжении всего менструального цикла [136, 224].
Проведенные на микрочипах генетические исследования эндометрия человека и мыши рассмотрены в работе Дей с соавт. [67]. Изучение эндометрия в середине секреторной фазы, обработанного in vitro децидуализированными стромальными клетками, эндометрия, обработанного ex vivo прогестероном и антагонистом PR, и тканей матки, полученных от PR-дефицитных мышей, выявило множество прогестерон-чувствительных генов, способных сохранять экспрессию PR и демонстрировать максимальную реакцию на прогестерон. В контексте регрессии желтого тела и подготовки к менструации это заставляет эндометрий реагировать на падение уровня прогестерона. Доступны подробные обзоры, рассматривающие молекулярную биологию ER и PR, их роль в функционировании женской половой системы и репродукции, особенно в контексте имплантации [20, 48, 188].
Гетерогенность клеток эндометрия
Существует тонко скоординированное взаимодействие между циркулирующими стероидными гормонами яичников и соответствующими рецепторами во множестве типов клеток [143, 152], составляющих эндометрий. Следствием этого взаимодействия являются функциональные особенности эндометрия, которые жестко регулируются «во времени и пространстве». Нарушение взаимосвязи гормонов и клеток-мишеней нередко имеет клинические последствия, такие как расстройства менструального цикла или проблемы с имплантацией.
Таким образом, учитывая гетерогенную природу эндометрия с его многочисленными клеточными компонентами, важно понимать, что каждый компонент, т. е. клетки эпителия, стромы, сосудов и иммунные клетки, обладает уникальным профилем экспрессии генов. Поэтому при проведении «-омиксных» исследований (омиксные технологии — комплекс современных технологий, включающий геномику, транскриптомику, протеомику и метаболомику — прим. пер.) с использованием образцов цельных тканей необходимо тщательно учитывать клеточный состав образцов эндометрия. Данные, касающиеся, например, профилей экспрессии генов, ассоциированных с имплантационной восприимчивостью эндометрия, продолжают уточняться, особенно по мере развития технологий и использования диагностических платформ [68]. Показано, что классические гистологические характеристики эндометрия [181] в конкретный момент взятия проб / исследования эндометрия влияют на профили экспрессии генов в тканях [7, 36, 232]. Более поздние данные описывают важные изменения в эпителиальном и стромальном компонентах между пререцептивной и рецептивной фазами эндометрия [229]. Следовательно, анализ экспрессии генов эндометрия в настоящее время является предпочтительным золотым стандартом для прогнозирования окна имплантации [7, 229]. Однако следует отметить, что на данные о профилях экспрессии генов, полученные в результате исследований цельной ткани, могут влиять пропорции клеток различных типов в биоптате эндометрия, что, в свою очередь, будет отражать изменение соотношений клеточных компонентов в течение всего менструального цикла [229]. Новая эра транскриптомики единичных клеток предвещает захватывающие открытия в отношении функции эндометрия во время менструации и имплантации [242].
Моделирование менструации на мышах
Менструация — это явление, в природе встречающееся лишь у нескольких видов млекопитающих: человека, приматов Старого Света, крыланов, иглистой мыши и слоновой землеройки. Изучение образцов эндометрия человека позволяет получить важные данные, касающиеся процесса менструации и его регуляции. Однако вариабельность состояния пациенток и нарушение нормальной архитектуры эндометрия во время взятия образцов могут ограничить результаты исследования. Для точного определения причинно-следственной связи требуется моделирование на животных. Модели на приматах Старого Света внесли значительный вклад в наши знания о функции эндометрия (см. ниже), но они дороги и требуют большого числа животных для уменьшения межиндивидуальной вариабельности [176]. Кроме того, дизайн исследования и условия содержания нечеловекообразных приматов должны соответствовать современным рекомендациям, что приводит к дополнительным издержкам. Моделирование на мышах привлекательно благодаря генетической однородности, доступности реагентов для исследований и относительно низкой стоимости. В настоящее время в распоряжении исследователей имеются три обширные категории моделей менструации на мышах.
Уже упоминавшаяся мышиная модель имитируемой менструации была первоначально разработана Финном и Поупом в 1980-х годах [83], но лишь спустя 20 лет была создана модель с более точной воспроизводимостью. В первоначальной модели [83] мышам с удаленными яичниками путем инъекций последовательно вводили эстрадиол и прогестерон для подготовки эндометрия к искусственной децидуализации. Последний этап включал внутриматочное введение арахисового масла для стимуляции децидуализации эндометрия. Модель Финна и Поупа (1984) оказалась весьма успешной, поскольку обычно в конце протокола только у одной мыши из шести не происходила децидуализация. Тем не менее, из-за вариабельности ответной реакции и плохой воспроизводимости времени децидуализации потребовалось два десятилетия, чтобы широко внедрить эту модель и вызвать к ней интерес. В 2003 г. Брастед с соавт. [24] вместо инъекций прогестерона применили подкожные силиконовые помпы, высвобождающие прогестерон (авторы разработки — Коэн и Миллиган, 1993 [46]). Использование силиконовых имплантатов для контроля выделения прогестерона обеспечило методику быстрого снижения концентрации прогестерона в матке при хирургическом удалении гормональной помпы. Этот шаг улучшил воспроизводимость времени имитированных менструальных событий, которые в этой модели следуют за снижением уровня прогестерона. В результате отмены прогестерона в эндометрии и окружающей его среде происходит множество гистологических и молекулярных изменений, аналогичных тем, которые на морфологическом уровне наблюдаются в эндометрии человека во время месячных. Происходит отторжение децидуализированного эндометрия, рекрутирование лейкоцитов [160] и видимое менструальноподобное кровотечение [54, 201]. Впоследствии вся ткань эндометрия восстанавливается, ремоделируется и регенерирует (рис. 3).
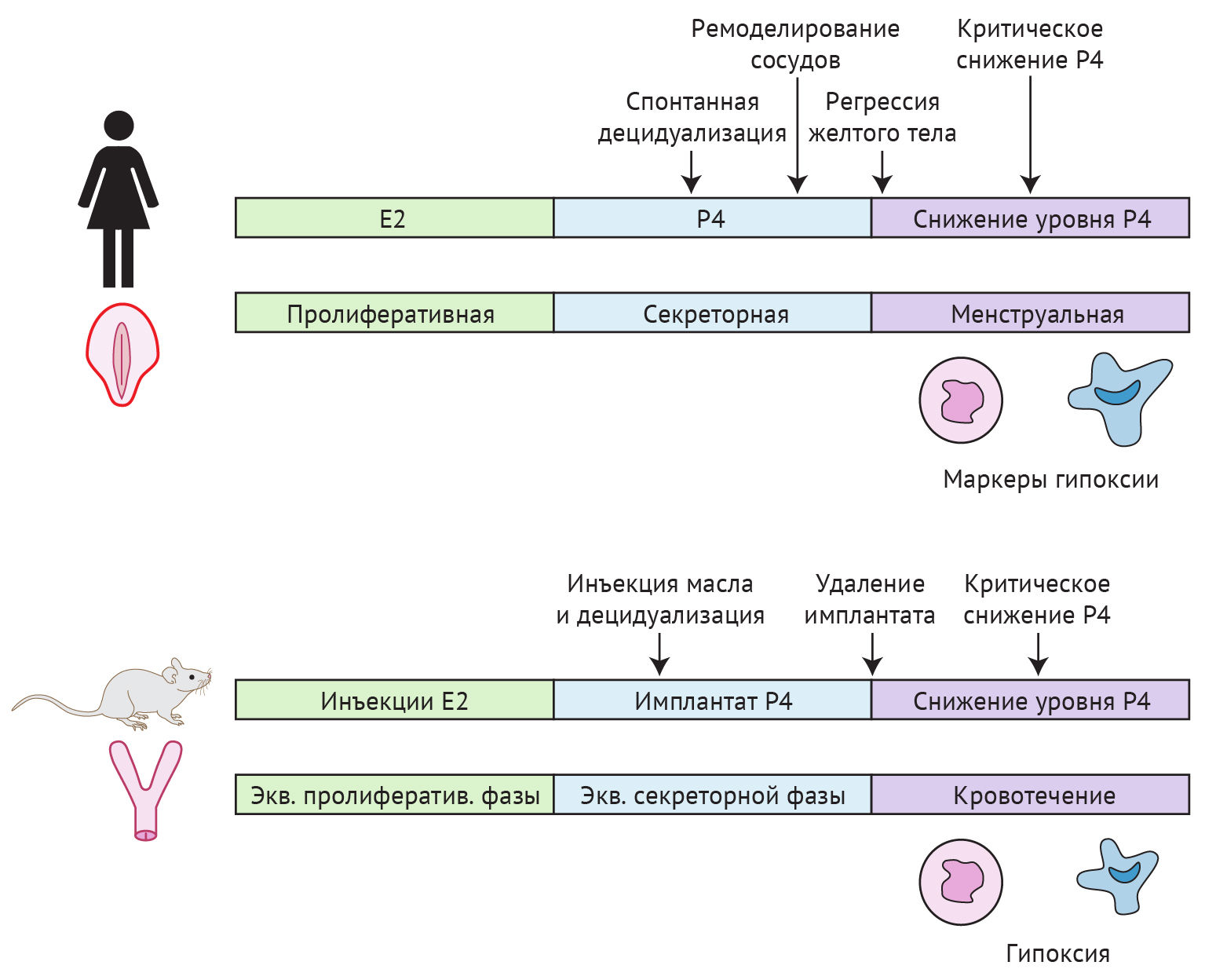
Е2 — эстрадиол; Р4 — прогестерон; Экв. — эквивалент
В ходе разработки модели имитируемой менструации на мышах была установлена необходимость «этапа децидуализации», поскольку было показано, что одного лишь быстрого снижения концентрации прогестерона недостаточно для индукции эндометриального кровотечения [24, 54, 83, 160, 201]. Инъекция арахисового масла в просвет матки обеспечила индуцированное повреждение в условиях эндокринного окружения с высоким уровнем системного прогестерона и привела к преимплантационной децидуализации эндометрия мыши. Это искусственно созданное событие было аналогично естественным явлениям в середине секреторной фазы как у нечеловекообразных приматов (макаки-резусы), так и у людей. Модель имитируемой менструации на мышах подтвердила важность этапа децидуализации, происходящего перед снижением уровня прогестерона, в физиологии менструации.
В дальнейшем Брастед с соавт. (2003) усовершенствовали модель имитируемой менструации на мышах, что дало возможность изучить важные особенности менструации у человека. Эти особенности включают экспрессию медиаторов воспаления, факторы, влияющие на эндометриальное/менструальное кровотечение, а также восстановление эндометрия [45, 54, 122, 123, 125, 160, 201, 254].
Эта модель была использована для управления воспалительным ответом [122] и гормональным контролем [123] при менструации, а также для фармакологического и генетического изменения участвующих в ней ключевых факторов [157]. Данные эксперименты подтвердили и расширили результаты исследований на тканях человека, обеспечив понимание механизмов регуляции менструации и восстановления эндометрия. Параллельные наблюдения процессов в «перименструальном» эндометрии человека и эндометрии мыши при отмене прогестерона в «модели имитируемых менструаций» (рис. 3) подтверждают, что мышиная модель способна воспроизводить события менструации у человека [11].
Ксенотрансплантатная модель менструации также позволяет исследовать процесс менструации in vivo [51, 105]. В этой модели фрагменты функционального слоя эндометрия человека трансплантируются иммунодефицитным мышам с удаленными яичниками. Введение таким мышам эстрадиола и прогестерона с последующим удалением стероидов яичников приводило к разрушению ксенотрансплантированного эндометрия человека, что аналогично процессу при менструации. Явным преимуществом этой модели является возможность стандартизации гормональных изменений, которым подвергается эндометрий человека, а также возможность введения препаратов и проведения манипуляций на эндометрии таким способом, который был бы неэтичен в случае человека. Также модель позволяет исследовать местный лейкоцитарный ответ в сравнении с системным ответом путем анализа распределения лейкоцитов человека и мыши. Однако трансплантация эндометрия человека нарушает нормальную архитектуру мышиного эндометрия и может изменить сосудистые и иммунологические реакции при менструации. Кроме того, для трансплантации необходимы иммунодефицитные мыши, что еще больше изменяет местную среду эндометрия.
Совсем недавно в качестве нового модельного объекта для изучения менструации была предложена обыкновенная, или египетская, иглистая мышь [17]. У иглистой мыши обнаружена спонтанная децидуализация и циклическая менструация продолжительностью в среднем 3 дня каждые 6–10 дней. Перед менструацией наблюдалась эндометриальная трансформация стромы, соответствующая спонтанной децидуализации. Поскольку этот грызун подвержен ожирению и сахарному диабету и ранее использовался при моделировании данных состояний, для исследований на иглистых мышах уже доступны некоторые методики и реагенты. Потенциальное преимущество этой мыши по сравнению с моделями на стандартных лабораторных мышах заключается в том, что иглистая мышь позволит изучать множественные/последовательные менструальные циклы и любые подготавливающие эффекты, которые менструальные циклы будут оказывать на физиологию эндометрия. Кроме того, у иглистой мыши, как и у человека, основным циркулирующим глюкокортикоидом является кортизол, а не кортикостерон, как у обычных лабораторных мышей. Кроме того, у иглистой мыши также наблюдается ремоделирование спиральных артерий в децидуализированном эндометрии [16], и это позволяет предположить, что данный вид можно использовать в качестве модельного объекта для изучения сосудистых нарушений беременности, таких как преэклампсия. К недостаткам модели можно отнести вариабельность естественных циклов, что также затрудняет изучение человека и приматов, и невозможность на данный момент проводить генетические манипуляции над иглистой мышью, что ограничивает доказательные исследования.
Моделирование менструации на нечеловекообразных приматах
Нечеловекообразные приматы относятся к тем видам животных, у которых происходит менструация и спонтанная децидуализация эндометрия. Несколько исследований надежно доказали, что макака-резус является подходящим объектом для моделирования менструации человека. Эндометрий макак-резусов и женщин схожи в молекулярном и гистологическом аспекте в период перименструального окна (лютео-фолликулярный переход) и во время менструации. У обоих видов во время менструации наблюдается строго скоординированное, регулируемое в пространстве и времени повышение уровня экспрессии MMP [27, 200] и VEGF (фактора роста эндотелия сосудов) [175], которым предшествует резкое снижение уровня прогестерона [28–30, 60, 175, 218, 220]
Хотя сходство между человеком и макаками благоприятствует исследованиям на нечеловекообразных приматах с целью изучения механизмов, лежащих в основе менструации, новых терапевтических подходов к лечению нарушений менструального цикла и стратегий контрацепции, существуют этические соображения относительно использования приматов в экспериментах, а финансовые расходы, связанные с содержанием макак, ограничивают их полезность в качестве модели для рассматриваемого аспекта женского здоровья.
Это послужило основанием для рассмотрения альтернативных моделей, и вышеописанные модели менструации на мышах оказались привлекательными вариантами для моделирования менструации и экспериментального манипулирования процессами, лежащими в ее основе.
Резкое снижение уровня прогестерона: триггер для менструации
Эндометрий человека представляет собой ткань с физиологически повторяющимися эпизодами «повреждения и восстановления» (менструации). Падение концентрации циркулирующего прогестерона у женщин, вызванное регрессией желтого тела, является триггером менструации. Важнейшую роль резкого снижения уровня прогестерона в физиологии менструации подтверждают клинические исследования, в которых введение женщинам антагонистов PR в секреторную фазу приводило к менструальноподобному кровотечению. Введение PR-антагониста мифепристона в середине секреторной фазы повышало концентрацию медиаторов воспаления в эндометрии, включая COX-2, NF-κB и IL-8 (CXCL8) [56, 57].
Дальнейшее подтверждение роли резкого снижения уровня прогестерона в индукции менструации предоставили современные исследования на нечеловекообразных приматах (макаках-резусах) [158, 175]. В этих исследованиях менструальный цикл и менструальное кровотечение у приматов были вызваны удалением обоих яичников, 14-дневным введением эстрогена и последующей установкой прогестерон-выделяющего имплантата для имитации секреторной фазы эндометрия. Поддержание уровня эстрадиола в период отмены прогестерона (удаления прогестерон-выделяющего имплантата) показало, что при индукции менструации эффект снижения концентрации прогестерона преобладает над эффектом снижения уровня эстрадиола.
Считается, что локальные процессы в эндометрии, которые следуют за падением уровня прогестерона у женщин, происходят в две фазы [128] (рис. 4). Первая фаза после понижения концентрации прогестерона связана с усиленным локальным воздействием на эндометрий цитокинов и простагландинов (PG) и зависит от эффективной реакции децидуализированных периваскулярных стромальных клеток на падение уровня прогестерона, который является противовоспалительным гормоном [39, 77]. Хемокины — специфические цитокины-хемоаттрактанты — отвечают за передвижение лейкоцитов в эндометрии (рекрутирование, миграцию и активацию). Хемокины делят на четыре подкласса исходя из структуры их N-концевых остатков цистеина: C, CC, CXC и CX3C. Опубликованные данные исследований децидуализированных стромальных клеток эндометрия человека in vitro описывают происходящую после снижения уровня прогестерона индукцию медиаторов воспаления, включая IL-6, хемокины CCL11, CCL2, CXCL10 и CXCL8 и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). Этот клеточный ответ на снижение концентрации прогестерона in vitro и индукцию медиаторов воспаления управляется действием транскрипционного фактора NF-κB [127, 130; рассмотрено в работе Эванс и Саламонсен — 77]
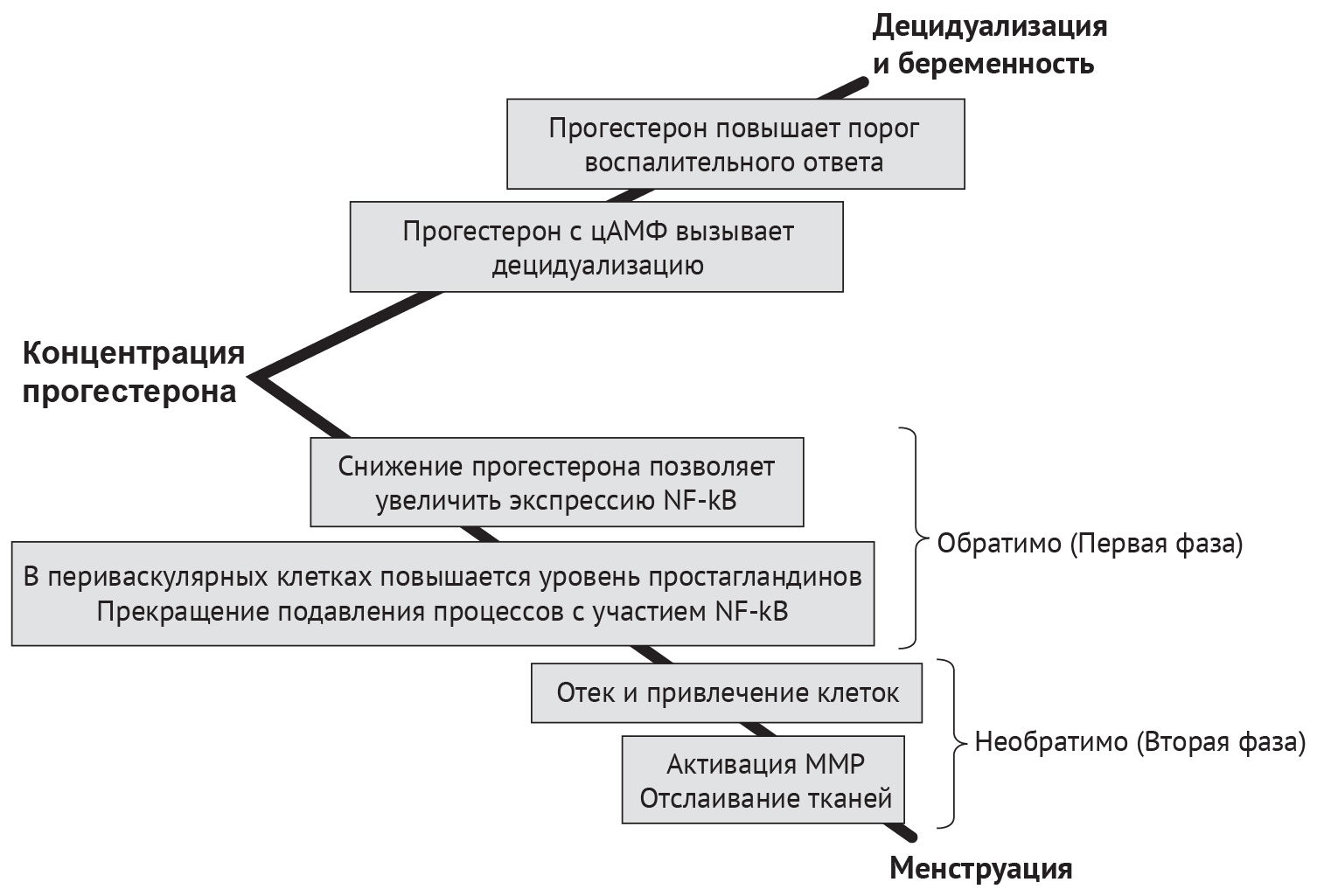
NF-κB является индуцибельным транскрипционным фактором, который регулирует экспрессию генов, участвующих в воспалительном ответе. Семейство NF-κB включает пять членов: NF-κB1 (p50), NF-κB2 (p52), RelA (p65), RelB и c-Rel, которые опосредуют транскрипцию генов-мишеней путем связывания со специфическими элементами ДНК в виде гетеро- или гомодимеров [230]. В цитоплазме клеток белки NF-κB обычно поддерживаются в неактивной форме с помощью ингибирующих белков, в том числе IκB. При активации внеклеточными стимулами, такими как IL-1 и фактор некроза опухоли (TNF) [184], протеасомы осуществляют убиквитин-зависимую деградацию IκB, что приводит к транслокации NF-κB в ядро. В активацию NF-κB вовлечены несколько протеинкиназ, а также последующая деградация эндогенного ингибитора, IκBα.
В контексте менструации и функции эндометрия прогестерон оказывает ингибирующее действие на путь NF-κB [128, 130], увеличивая концентрацию IκB или конкурируя за сайты распознавания NF-κB на генах. Снижение уровня прогестерона после регрессии желтого тела ослабляет ингибирование и приводит к повышению активности NF-κB и, как следствие, к выработке в эндометрии цитокинов и хемокинов. Также показано, что транскрипционный фактор NF-κB важен для контроля продукции ММР-1, ММР-3 и ММР-9 [43], обеспечивая тем самым путь, посредством которого снижение концентрации прогестерона способствует повышению активности ММР эндометрия.
Вторая фаза локальных процессов в эндометрии после резкого снижения уровня прогестерона (рис. 4) является следствием увеличения выработки цитокинов и сопровождается притоком клеток врожденного иммунного ответа в локальную среду эндометрия, а также активацией и высвобождением MMP с разрушением внеклеточного матрикса (ВКМ). Считается, что эта вторая фаза не зависит от воздействия на рецепторы прогестерона (рис. 4); данная гипотеза подтверждена в исследованиях нечеловекообразных приматов (макаки-резусы) с удаленными яичниками и в модели на мышах. У нечеловекообразных приматов прогестероновые имплантаты удаляли в конце моделируемого менструального цикла и затем вводили новые в различных временных точках от 12 до 72 ч после первоначального удаления имплантата [218]. Исследование на макаках показало, что замена прогестеронового имплантата в течение 24 ч предотвращала как менструацию, так и ожидаемое повышение содержания MMP-1, -2 и -3 в эндометрии. В противоположность, замена прогестеронового имплантата спустя 36 ч после удаления не влияла на менструальное кровотечение и лишь частично блокировала выработку MMP, заметно уменьшая концентрацию MMP-2 в эндометрии. Также в мышиной модели имитируемой менструации воспроизводимо продемонстрирована возможность остановки локальных процессов в эндометрии, происходящих при резком снижении уровня прогестерона [247]. В том же исследовании на мышах показан и «временной порог отсутствия прогестерона» [247], при достижении которого менструальное кровотечение становится неизбежным.
Децидуализированные стромальные клетки, характерные для предменструального эндометрия, являются ключевым компонентом чувствительности эндометрия к циркулирующим гормонам. Отсюда можно предложить механизм, посредством которого прогестерон-зависимые децидуализированные стромальные клетки эндометрия (экспрессирующие PR) влияют на рекрутирование клеток врожденного иммунитета перед менструацией. Это подтверждает исследование, в котором Эванс и Саламонсен [77] имитировали лютеиновую фазу путем децидуализации клеток при 12-дневном воздействии эстрадиола и прогестина (медроксипрогестерона ацетат). При последующей отмене гормонов наблюдалось прогнозируемое увеличение уровня NF-κB наряду с ожидаемой выработкой воспалительных цитокинов и хемокинов. Усиленная продукция медиаторов воспаления прекратилась после введения ингибитора NF-κB.
Менструация как воспаление
Под воспалением понимается общий ответ иммунной системы на вредоносные внешние раздражители, направленный на устранение инфекции, регенерацию поврежденных тканей и восстановление физиологических функций. Воспалительные реакции разделяют на «острые» и «хронические». Острая реакция представляет собой кратковременный, первоначальный ответ на повреждающие стимулы, а хроническая реакция — длительный ответ, включающий поддержание уровня определенных иммунных клеток в месте воспаления наряду с опосредованным хозяином разрушением и/или фиброзом тканей, что в конечном итоге может привести к потере функции [34]. Для всего организма крайне важно эффективное разрешение воспаления после успешного удаления вредоносных раздражителей, чтобы ограничить повреждение тканей и восстановить их целостность и функцию. На клеточном уровне процесс острого воспаления включает быстрое рекрутирование нейтрофильных гранулоцитов, за которыми вскоре следуют воспалительные моноциты, дифференцирующиеся в макрофаги, пролиферирующие in situ и управляющие продолжающимся воспалительным ответом и его разрешением [98]. Молекулярные медиаторы острого воспаления, продуцируемые локально в тканях и рекрутируемыми лейкоцитами, включают простаноиды (простагландины и простациклины), липидные медиаторы, комплемент, цитокины и хемокины. Медиаторы воспаления, которые вырабатываются локально в эндометрии во время лютео-фолликулярного перехода, то есть во время индуцированного снижением прогестерона отторжения эндометрия (менструации), могут действовать по отдельности или совместно и обуславливать воспалительный ответ путем индукции вазодилатации, изменения экспрессии молекул клеточной адгезии и, в конечном итоге, привлечения лейкоцитов [50, 57, 88, 120, 162, 212].
Разрешение воспаления в эндометрии координируется не менее жестко, чем воспалительный ответ в других местах организма. Как и в прочих тканях, синтез провоспалительных медиаторов сокращается, а существующие медиаторы воспаления деградируют, ограничивая рекрутирование лейкоцитов и восстанавливая целостность сосудов. Простаноиды эндометрия подвергаются катаболизму посредством ряда реакций окисления и восстановления [8, 75], а устранение хемокинов осуществляется путем их захвата апоптотическими лейкоцитами через рецепторы хемокинов [10]. Местное разрешение воспаления также включает фагоцитоз апоптотических нейтрофилов. Распознавание апоптотических клеток макрофагами во время фагоцитоза модулирует фенотип макрофагов и способствует высвобождению противовоспалительных и способствующих разрешению воспаления цитокинов, таких как IL-10 и TGF-β [114], наряду с липидными медиаторами, например, липоксинами и резольвинами [34].
Полезность и надежность моделирования менструации человека на мышах описана в недавнем исследовании, где процессы апоптоза и воспаления в эндометрии человека в период перименструального окна были изучены как в эндометрии женщин в фазе менструации и при кровотечении, так и в эндометрии мышей после отмены прогестерона в модели имитируемой менструации [11]. Показано, что пространственно-временная регуляция апоптоза в нормальном эндометрии человека воспроизводится в эндометрии в модели имитируемой менструации на мышах, поскольку интенсивный апоптоз эндометрия (оцениваемый по экспрессии расщепленной каспазы 3) до начала разрушения, отторжения и кровотечения наблюдался как у людей, так и у мышей.
Кроме того, усиление транскрипции воспалительных хемокинов менструальной фазы (CXCL8, CCL2, Cxcl1) и транскрипции воспалительных цитокинов (TNF, IL-6, Tnf) наблюдалось как в хорошо изученном нормальном эндометрии человека, так и в эндометрии в модели менструации на мышах [11]. Такое усиление экспрессии хемо- и цитокинов в ответ на снижение уровня прогестерона у человека и мыши сопровождалось существенным увеличением количества нейтрофилов при наступлении менструации / симуляции менструации у мышей. Аналогичный ответ лейкоцитов и мононуклеарных фагоцитов в зонах активной репарации был описан и при моделировании менструации на мышах [53].
Менструация является физиологической моделью самоограничивающегося воспаления. В менструальном эндометрии наблюдается множество классических признаков воспаления, включая отек тканей и приток иммунных клеток. Воспалительный процесс, происходящий в эндометрии во время менструации, жестко регулируется, чтобы предотвратить потерю функции [55, 116].
Предположение о том, что менструация представляет собой воспалительный процесс [81], получило дополнительную поддержку за последние три десятилетия благодаря многим важным открытиям, касающимся молекулярных и клеточных изменений в эндометрии, которые сопровождают воспаление и включают в себя очаговую активацию MMP [87, 144, 241], повышенную экспрессию ЦОГ-2 [57, 119], увеличение концентрации простагландинов [228] и вовлечение локальной гипоксии тканей [52, 59, 93, 154, 157] (см. ниже).
Усиленная экспрессия местных воспалительных хемокинов и цитокинов эндометрия совпадает со снижением уровня прогестерона. Доказано усиление экспрессии CCL2 (MCP-1), CXCL8 (IL-8), IL-6, TNF и COX-2 в поздней секреторной и менструальной фазах менструального цикла [11, 57, 119, 162].
В эндометрии человека мРНК и белок CXCL8 [9, 154] в выявляемых концентрациях присутствуют в течение всего менструального цикла в стромальных [9, 154] и периваскулярных клетках, а экспрессия CXCL8 достигает максимума после снижения уровня прогестерона [162]. Максимальная транскрипция и экспрессия цитокина IL-6 в эндометрии отмечена в поздней секреторной фазе менструального цикла [243], при этом белок локализован в железах эндометрия и их секрете [244]. Вероятно, определенную роль в менструации играет TNF, обнаруженный в стромальных и эпителиальных клетках эндометрия человека [231]. Есть данные о повышенном уровне мРНК TNF в эндометрии во время поздней секреторной фазы [243]. Однако ни в одном из вышеуказанных исследований не были изучены образцы, взятые в менструальной фазе. Недавно Амстронг с соавт. [11] описали усиление транскрипции CCL2, CXCL8, IL6 и TNF в эндометрии во время менструальной фазы у женщин с объективно измеренной нормальной менструальной кровопотерей. Эти результаты были воспроизведены в модели имитируемой менструации на мышах: наблюдалось повышение уровня транскрипции Tnf (TNF) и хемокина нейтрофилов Cxcl1 (KC; GRO-α), который у мышей является гомологом CXCL8 человека (183, 225).
Хемокины, выработка которых максимальна при менструации, выполняют целый ряд функций, не только рекрутируя лейкоциты, но и способствуя местной пролиферации клеток и ангиогенезу. Например, CXCL8 (IL-8), наряду с хорошо описанной способностью вызывать хемотаксис лейкоцитов, активно участвует в местном ангиогенезе [131] и в индукции хемотаксиса и пролиферации гладкомышечных клеток сосудов [255].
Трафик лейкоцитов эндометрия
Лейкоциты эндометрия играют важнейшую роль в его функционировании, включая не только разрушение ткани эндометрия, но и его восстановление [204] и инвазию эмбриона [214]. Лейкоциты, рекрутированные во время перименструального окна, являются неотъемлемыми компонентами процесса восстановления эндометрия. Ключевую роль локальной популяции (популяций) иммунных клеток эндометрия продемонстрировало наблюдение, что истощение пула нейтрофильных гранулоцитов замедляет восстановление эндометрия в модели имитируемой менструации на мышах [122]. Также интересно, что в модели повреждения миокарда на мышах заживление ран нарушалось из-за истощения популяции макрофагов. Можно было бы обоснованно предположить аналогичную ситуацию, если бы во время менструации человека наблюдалось истощение популяции или недостаток макрофагов, но этот феномен еще предстоит продемонстрировать [240].
Возможно, что местная доступность биоактивных глюкокортикоидов также играет роль во взаимодействиях иммунных клеток с клетками сосудов в эндометрии во время восстановления тканей при менструации, и такое действие может быть прямым или косвенным — опосредованным функциями тканевых резидентных макрофагов [235]. Макрофаги эндометрия экспрессируют рецепторы глюкокортикоидов, но не рецепторы прогестерона [235]. Имеются данные, которые обращают внимание на важность местного кортизола в регуляции паракринного действия макрофагов в эндометрии человека. Исследования in vitro показали, что культура с супернатантом из обработанных кортизолом макрофагов, происходящих из моноцитов периферической крови, изменяет в эндотелиальных клетках эндометрия транскрипцию генов ангиогенеза, например, CXCL2, CXCL8, CTGF и VEGFC. Белки CXCL2 и CXCL8 также обнаружены в макрофагах эндометрия in situ [235]. Экспрессия этих факторов в эндометрии была максимальной во время фазы менструации, что согласуется с их ролью в восстановлении эндометрия в данный период.
Размер популяции лейкоцитов эндометрия варьирует в течение менструального цикла [152]. Первоначально популяцию лейкоцитов эндометрия в пролиферативной фазе, когда число лейкоцитов ниже всего, описывали как изменяющуюся между 8,2 % [35] и 10–15 % [126] от числа стромальных клеток эндометрия. Напротив, непосредственно перед началом менструации, когда число лейкоцитов наиболее велико, количество иммунных клеток варьирует от 20–25 % [126] до 40–45 % популяции стромальных клеток эндометрия [23, 203]. Однако количественная оценка популяций клеток иммунной системы эндометрия сопряжена с весьма серьезными проблемами, обусловленными значительным влиянием стадии эндокринного цикла яичников, а также большой неоднородностью распределения клеток в многоклеточном эндометрии. Сообщается о попытках решения проблемы количественной оценки конкретных типов иммунных клеток в эндометрии, например, NK-клеток матки, что имеет важное значение для клинической практики [135]. Такие измерения проводятся у женщин в контексте лечения бесплодия, но, насколько известно, они не имеют отношения к жалобам на нарушения менструального цикла или менструального кровотечения. Любой значимый клинический тест для подсчета NK-клеток матки, независимо от клинического контекста, потребует стандартизированного метода для установления границ нормы числа NK-клеток матки. Это будет непростой задачей из-за неоднородности распределения NK-клеток матки в эндометрии и, как отмечено выше, из-за изменения числа клеток в разные фазы менструального цикла.
Нейтрофильные гранулоциты в значительном количестве рекрутируются в эндометрий непосредственно перед менструацией [191], и такое привлечение лейкоцитов совпадает со снижением уровня прогестерона [11]. Нейтрофилы содержат высокие уровни MMP, а в эндометрии они могут активировать MMP in situ [88], тем самым способствуя разрушению эндометрия во время менструации.
Макрофаги присутствуют в эндометрии на протяжении всего менструального цикла, и с началом менструации их количество незначительно увеличивается [11, 152, 203, 234]. Фагоцитоз апоптотических клеток макрофагами необходим для разрешения воспаления в других тканях [206] и, следовательно, может иметь важное значение для разрешения связанного с менструацией воспаления в эндометрии. После менструации макрофаги вычищают продукты клеточного распада [92] и способствуют ремоделированию и восстановлению функционального слоя эндометрия [156].
Считается, что в популяцию макрофагов в эндометрии вносят вклад два различных источника: это пролиферация резидентных макрофагов in situ [64, 118, 161] и макрофаги, возникшие из привлеченных в ткань моноцитов [70, 209]. Известно, что макрофаги пролиферируют in situ и в других воспалительных условиях, например в присутствии IL-4 в ходе воспалительного ответа Th2-клеток [118]. Доказательства пролиферации in situ в менструальном эндометрии получены в результате экспериментов, в которых эндометрий человека был ксенотрансплантирован мышам с ослабленным иммунитетом [105]. Мышей подвергали воздействию гормональной среды, имитирующей человеческий менструальный цикл, и число макрофагов человека было наибольшим на 28-й день такого имитированного цикла. Резидентные макрофаги эндометрия человека экспрессируют β-изоформу ER [104], и всем макрофагам эндометрия свойственна положительная реакция при иммуноцитохимическом окрашивании на GR [235].
Среди хемотаксических стимулов, с помощью которых моноциты попадают в эндометрий, выделяют CCL2 (MCP-1), который интенсивно экспрессируется в эндометрии поздней секреторной фазы [119]. Сообщается, что популяции макрофагов эндометрия относительно стабильны в течение всего менструального цикла, причем их численность увеличивается только в поздней секреторной / менструальной фазе и в ранней пролиферативной фазе менструального цикла [25]. Следует отметить, что авторы данного исследования объединили образцы тканей поздней секреторной и менструальной фаз в одну группу. В более поздней работе [47] описано значительное увеличение численности макрофагов только во время менструальной фазы.
Амстронг с соавт. [11] охарактеризовали закономерности локализации макрофагов в период перименструального окна (лютео-фолликулярного перехода) и описали миграцию клеток врожденного иммунитета в направлении желез, подвергающихся апоптозу (рис. 5), с последующим передвижением наружу в строму (рис. 6).
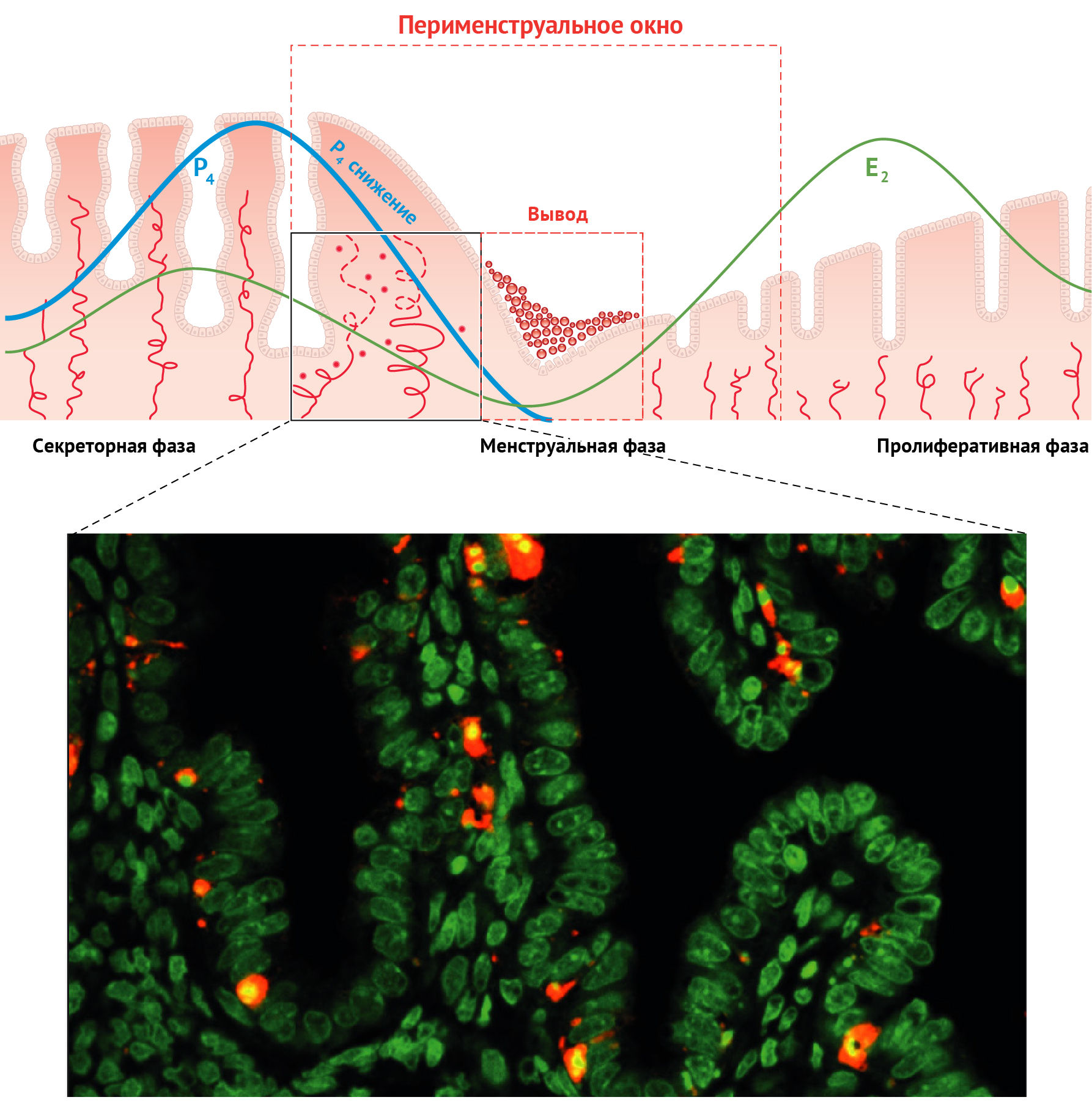
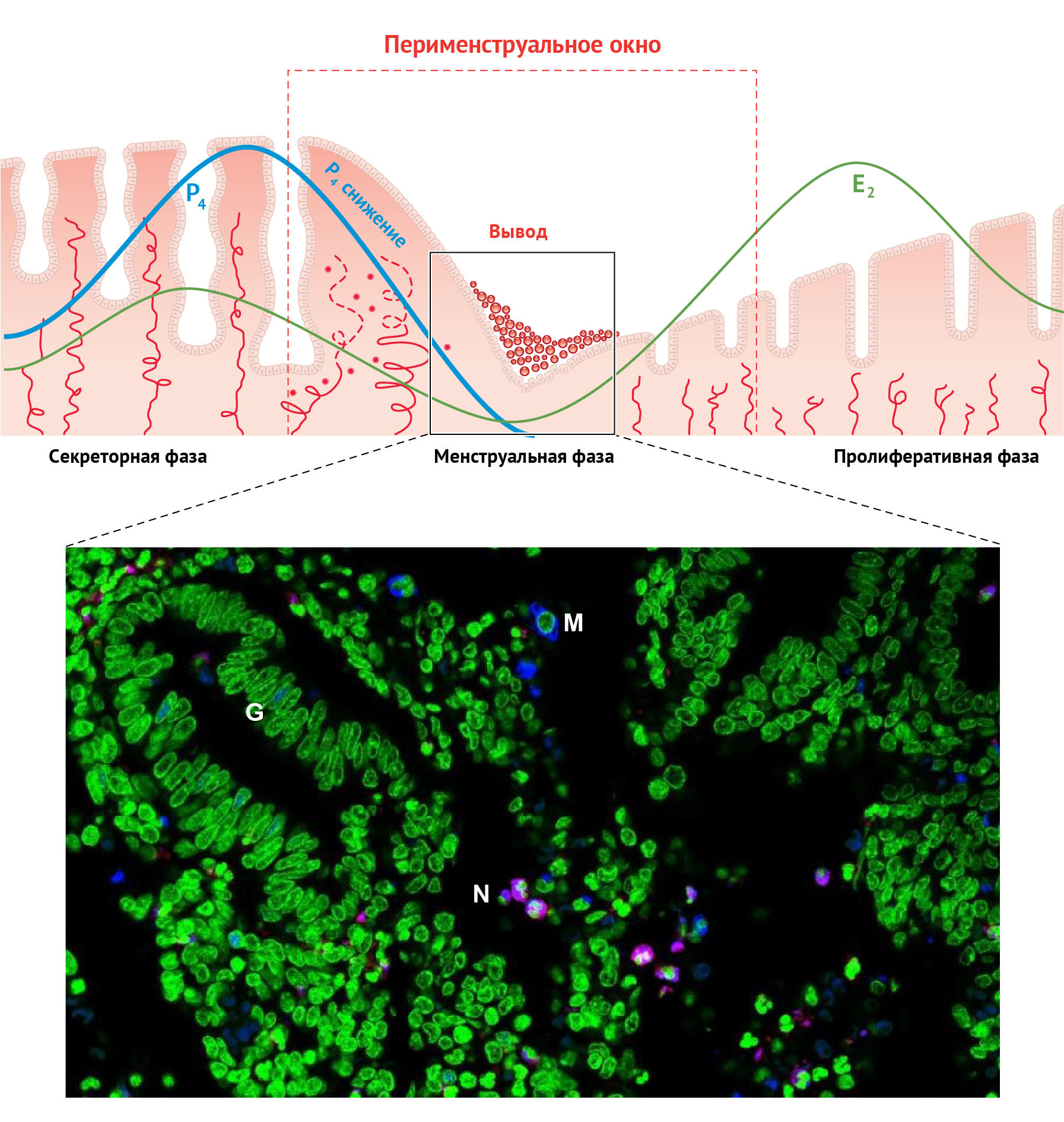
Обозначения: G — железы эндометрия, М — макрофаги, N — нейтрофилы. Контрастирующая окраска ядер: Sytox Green (зеленый; Molecular Probes Inc.)
Таким образом, резидентные и рекрутированные популяции лейкоцитов имеют решающее значение для разрушения эндометрия посредством экспрессии и активации MMP, а также для его восстановления путем модулирования локальной экспрессии ангиогенных факторов и очистки от продуктов клеточного распада. Число этих лейкоцитов, среди которых наиболее многочисленны нейтрофилы и макрофаги, выше всего перед менструацией и во время нее.
Мезенхимально-эпителиальный переход как критический фактор в определении функции эндометрия
Свойства повторного (физиологического) восстановления и ремоделирования эндометрия человека в последнее время были предметом внимания в контексте мезенхимально-эпителиального перехода (МЭП) и эпителиально-мезенхимального перехода (ЭМП). Важнейшее физиологическое событие — менструация — является прекрасным примером того, насколько для успешного функционирования эндометрия необходим переход между мезенхимальным и эпителиальным фенотипом клеток. В недавнем обзоре по этой теме подробно рассмотрена историческая перспектива исследований, связанных с переходом клеточных фенотипов в контексте репродукции [185], а также фундаментальные работы в области заживления ран. В конце концов, менструирующий эндометрий является физиологическим примером поврежденной «раненой» поверхности, которая должна быстро восстанавливаться каждый месяц.
Были охарактеризованы маркеры как мезенхимальных, так и эпителиальных клеток. Фенотипически мезенхимальная клетка имеет веретенообразную, многополярную форму и способна к инвазии и миграции. Эпителиальная клетка, напротив, представляет собой многоугольник с апико-базолатеральной поляризацией и способностью к межклеточной адгезии. Мезенхимальные маркеры включают виментин, фибронектин, Snail 1 и Snail 2, гладкомышечный актин [137, 185] и N-кадгерин; эпителиальные маркеры — цитокератины [8, 9, 18] и Е-кадгерин [137, 185]. В экспериментах in vitro показано, что в контексте регенерации эндометрия N-кадгерин является специфическим поверхностным маркером для клеток-предшественников эпителия в составе эндометрия. Кроме того, в том же исследовании изучение полнослойных (от просвета до соединения эндометрий/миометрий) гистерэктомических срезов показало, что N-кадгерин является маркером клеток-предшественников эпителия в железах в пределах базального слоя эндометрия [178].
При менструации верхний функциональный слой эндометрия отторгается. Как описано ранее, это событие запускается резким снижением уровня прогестерона и согласованной последовательностью провоспалительных событий [55, 152, 202, 204]. Вслед за этим следует регенерация эндометрия. Накапливаются доказательства существования популяций стволовых клеток или клеток-предшественников, расположенных как в верхнем функциональном слое, так и в нижнем базальном слое вблизи соединения эндометрий/миометрий [41, 90, 149, 186], а также в базальном и функциональном слоях в периваскулярных областях. Таким образом, для регенерации эндометрия требуется несколько типов стволовых клеток или клеток-предшественников, включая циркулирующие клетки костномозгового происхождения [5, 71, 233]. Также охарактеризована популяция стволовых клеток, полученная из менструальных выделений, и, как сообщается, эти клетки обладают ангиогенными и провоспалительными свойствами [6, 187]. В менструальных выделениях присутствуют и клетки функционального слоя эндометрия. Описан транскриптом единичных клеток, полученных с помощью лазера из функционального и базального слоя эндометрия [87]. В данном транскриптомном исследовании наряду с генными продуктами апоптоза были выявлены продукты генов, связанных с деградацией тканей (например, системы матриксных металлопротеиназ и плазмина). Клетки функционального слоя были обогащены продуктами генов, связанных с биосинтезом ВКМ (коллагенами и ферментами их созревания). Эти данные согласуются с гипотезой о том, что клеточные фрагменты функционального слоя способствуют регенерации эндометрия на позднем этапе менструации. Дальнейшее обсуждение стволовых клеток и клеток-предшественников эндометрия выходит за рамки данного обзора [65, 90].
Роль МЭП в процессе регенерации эндометрия изучалась в мышиной модели имитируемой менструации [54]. В этой модели процесс децидуализации индуцируется искусственно, а снижение концентрации прогестерона обеспечивается путем удаления имплантата. Обнаружено, что стромальные клетки эндометрия мыши, расположенные рядом с областями восстановления эпителия просвета, экспрессируют маркеры как эпителиальных, так и стромальных клеток. Кроме того, отмечено снижение числа мезенхимальных маркеров и увеличение количества маркеров эпителиальных клеток, что подтверждает идею об основополагающей роли МЭП в регенерации эндометрия [54].
Местные механизмы, которые ограничивают нормальное менструальное кровотечение: сужение сосудов, роль гипоксии, восстановление сосудов и эпителия и гемостаз
Как уже подчеркивалось, резкое снижение уровня прогестерона является причиной многих классических признаков воспаления в эндометрии. Приток клеток врожденного иммунитета и высвобождение MMP приводит к отторжению функционального слоя при менструации. Такое повреждение эндометрия должно быть строго отрегулировано и быстро остановлено, чтобы ограничить менструальную кровопотерю. Таким образом, для сокращения эндометриального кровотечения (менструации) требуется своевременное разрешение воспаления, сужение специализированных спиральных артериол эндометрия, эффективный гемостатический ответ, включающий восстановление поврежденной сосудистой сети, реэпителизацию остатков оголенного базального эндометрия (поврежденной поверхности слизистой оболочки), обращенного в просвет матки, и увеличение объема стромы [151, 152, 202]. Уникальный, не оставляющий шрамов процесс восстановления после менструации имеет важное значение для поддержания потенциала фертильности и ограничения менструального кровотечения. Однако механизмы и регуляция восстановления эндометрия по-прежнему плохо изучены [157].
Около 80 лет назад физиологическая роль гипоксии и снижения уровня половых стероидов изучалась в классических экспериментах — на моделях на нечеловекообразных приматах [145]. Аутологичные трансплантаты эндометрия макаки-резуса в переднюю камеру глаза позволили визуализировать процесс менструации непосредственно с помощью офтальмоскопа с щелевой лампой. За 4-24 ч до менструации, после отмены стероидов (прогестерона), наблюдалась интенсивная транзиторная вазоконстрикция спиральных артериол и очаговое кровотечение. Позже, более 30 лет назад, эти наблюдения пересмотрели Baird с соавт. [4], которые трансплантировали эндометрий в щечный мешок хомяка — иммуно-привилегированный участок, позволяющий непосредственно наблюдать влияние введения и отмены стероидов на сужение и расширение кровеносных сосудов.
После выхода этих публикаций решающая роль гипоксии в эндометрии продолжала оставаться предметом дискуссий. Литературные данные в этой области противоречивы и получены на различных моделях in vitro, ex vivo и in vivo. Поскольку радиус кровеносного сосуда является основным фактором, определяющим сопротивление потоку, даже небольшое увеличение радиуса сосуда будет оказывать существенное влияние на поток, например, двукратное увеличение радиуса сосуда приведет к 16-кратному уменьшению сопротивления потоку [153] (рис. 7А). Эффективное сужение артериол эндометрия необходимо для ограничения менструальной кровопотери.
А. Медиаторы вазоконстрикции эндометрия
Ослабление сужения сосудов при менструации может быть связано с нарушением продукции сосудосуживающих факторов после резкого снижения уровня прогестерона. PGF2α и эндотелин-1 (ET-1) являются двумя эндометриальными факторами с известными сосудосуживающими свойствами [15, 147]. Показано, что у женщин с обильной менструальной кровопотерей значительно снижается соотношение PGF2α / PGE2 [223], а также уменьшается экспрессия рецептора простагландина F [222]. Чрезмерная продукция PGE2 за счет PGF2α может привести к ослаблению сужения спиральных артериол перед менструацией. Также показано, что в эндометрии женщин с ОМК уменьшена экспрессия мощного вазоконстриктора ET-1 и усилена экспрессия его метаболизирующего фермента, нейральной эндопептидазы [147] (рис. 7В).
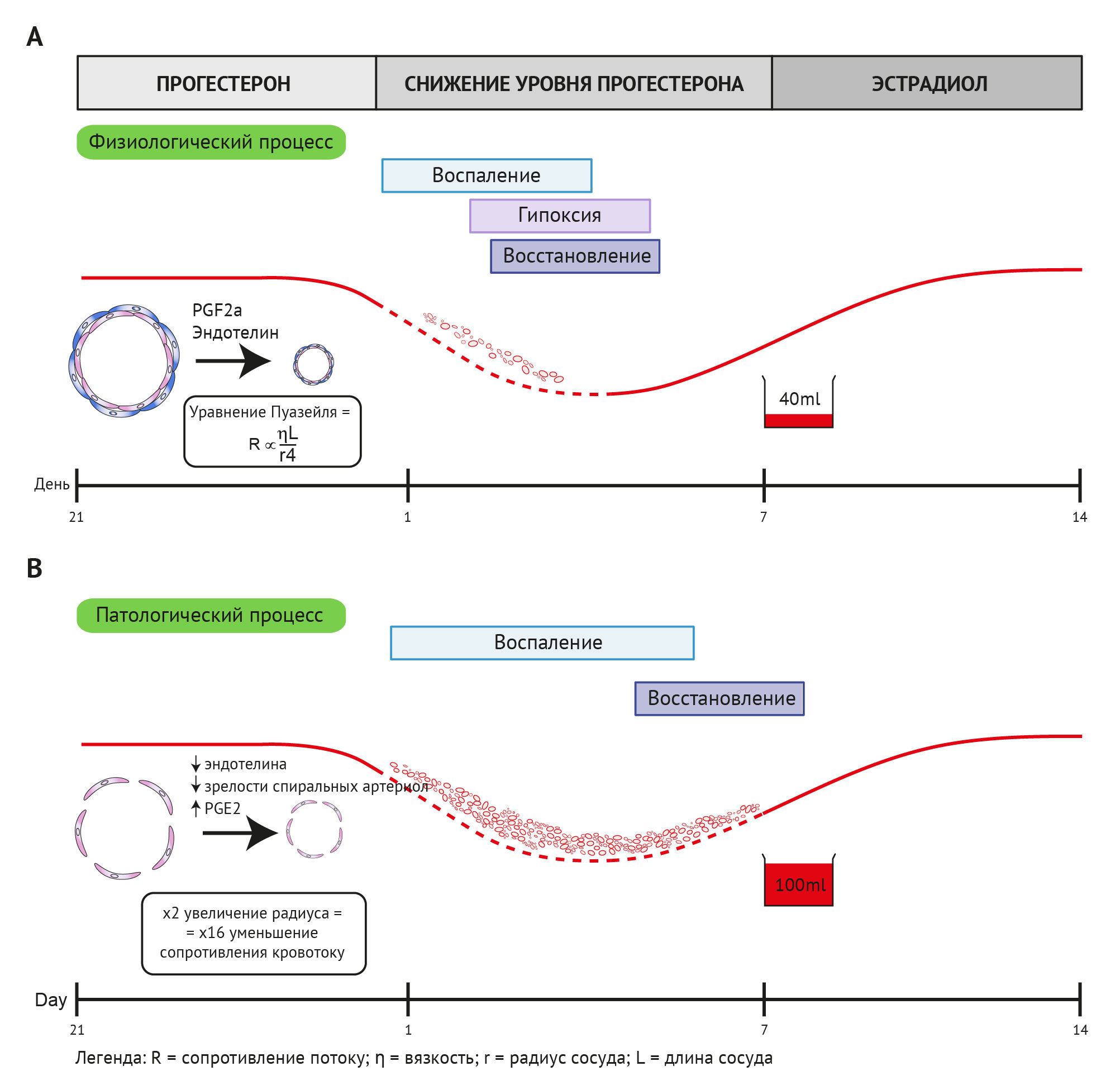
B: происходят патологические процессы, вызывающие аномальную кровопотерю. Незрелость сосудов эндометрия и снижение уровня сосудосуживающих факторов приводят к увеличению радиуса сосуда во время менструации, что значительно усиливает менструальную кровопотерю. Кроме того, это может препятствовать физиологическому ответу — гипоксии, необходимой для нормального восстановления эндометрия после менструации.
Кроме того, ослабление вазоконстрикции при менструации может быть связано с аберрантным созреванием спиральных артериол в ходе всего предшествующего менструального цикла. Было отмечено, что окружность сосудов и участки нарушения целостности сосудов эндометрия у женщин с ОМК больше, чем в норме [163]. У женщин с тяжелым кровотечением наблюдалось значительное снижение пролиферации гладкомышечных клеток сосудов в спиральных артериолах в середине и конце секреторной фазы по сравнению с контрольной группой с нормальной менструальной кровопотерей [2]. Кроме того, показано, что уровень тяжелой цепи миозина гладких мышц (сократительного белка) — маркера созревания гладкомышечных клеток сосудов — также значительно снижается в спиральных артериолах женщин с ОМК [1]. Дополнительные данные в этом контексте получены из исследования количества и стадии дифференцировки гладкомышечных клеток сосудов (ГМКС) в кровеносных сосудах эндометрия у женщин с нормальным и подтвержденным обильным менструальным кровотечением [21]. При этом у женщин с ОМК в сосудах эндометрия наблюдалось нарушение регуляции экспрессии маркеров дифференцировки ГМКС, смутелина (smoothelin) и кальпонина. Смутелин и кальпонин являются регуляторами тонуса и сократимости сосудов [21]. Артериогенез эндометрия требует скоординированного созревания ГМКС, нижележащих клеток эндотелия (КЭ) и окружающего ВКМ. Также у женщин с ОМК отмечались пространственные и временные различия в уровнях белков-маркеров КЭ и компонентов ВКМ в сосудах эндометрия и поверхностном миометрии [22]. Такие сосудистые нарушения могут привести к неоптимальному сужению сосудов при менструации и значительно увеличить менструальную кровопотерю (рис. 7B).
Таким образом, ослабление вазоконстрикции специализированных спиральных артериол эндометрия не только влияет на объем менструальной кровопотери, но и может увеличить продолжительность кровотечения из-за задержки восстановления эндометрия. Действительно, показано, что у женщин с ОМК кровотечение длится на 2 дня дольше [157]. Ниже рассматриваются процессы, связанные с восстановлением сосудов и эпителия.
B. Гипоксия эндометрия
Помимо воздействия на кровоток, сужение сосудов при менструации может способствовать индукции гипоксии в менструальном эндометрии. Исследования Markee, в которых эндометрий трансплантировали в переднюю камеру глаза макак-резусов, показали, что наблюдаемое сужение сосудов согласуется с гипоксией в менструальном эндометрии [145]. Это привело к гипотезе, что гипоксия необходима для начала менструации. Однако последующие исследования in vitro и ex vivo показали, что менструальное отторжение эндометрия может происходить и при отсутствии гипоксии [86, 256].
Фактор, индуцируемый гипоксией (Hypoxia inducible factor, HIF), является основным регулятором клеточного ответа на гипоксию; хорошо описана его роль в митогенезе, ангиогенезе, апоптозе, воспалении и метаболизме в других тканях организма [210, 211]. Он состоит из двух субъединиц: α-субъединицы, быстро распадающейся при избытке кислорода, и конститутивно экспрессируемой β-субъединицы [210]. При гипоксии происходит αβ-димеризация, и HIF транслоцируется в ядро, где индуцирует транскрипцию генов, которые содержат элемент, определяющий реакцию на гипоксию (hypoxia responsive element, HRE), включая гены, участвующие в ангиогенезе, энергетическом метаболизме и ремоделировании тканей. Все эти процессы лежат в основе менструации.
В присутствии избытка кислорода α-субъединица HIF, она же HIF-1α, гидроксилируется ферментами пролил-гидроксилазами (prolyl hydroxylase, PHD). Эти ферменты инициируют быстрое разрушение HIF-1α протеасомой. В условиях гипоксии кислород-зависимые ферменты PHD неактивны, а белок HIF-1α остается стабильным. Следовательно, HIF-1α способен связываться с β-субъединицей HIF, HIF-1β. Происходит транскрипция генов-мишеней HIF, которая обеспечивает адаптацию к гипоксической среде. Альтернативным партнером для связывания с HIF-1β является субъединица HIF-2α, и в этом случае гены-мишени будут частично различаться, хотя некоторые из них останутся прежними [195].
HIF-1α был обнаружен в эндометрии человека, но его присутствие ограничено перименструальной фазой [59, 217]. У женщин с объективно измеренным ОМК в эндометрии во время менструации наблюдалось значительное уменьшение белка HIF-1α и его мишеней по сравнению с женщинами с нормальной кровопотерей, что согласуется с недостаточной реакцией на гипоксию. Это состояние было смоделировано на мышах [157] путем фармакологического и генетического снижения уровня HIF-1 при менструации и привело к значительному замедлению восстановления эндометрия (суррогатный маркер менструации в этой модели на мышах).
Существовала значительная неопределенность относительно наличия и роли гипоксии при менструации. Модель менструации на мышах (подробно описанная в разделе V) позволила пролить свет на эту проблему. Модель имитируемых менструаций на мышах позволила использовать пимонидазол — маркер парциального давления кислорода <10 мм рт. ст. Интенсивное окрашивание пимонидазолом было обнаружено в самом верхнем слое эндометрия после отмены прогестерона [52, 79, 157]. Во время разрушения ткани возникала транзиторная гипоксия, которая не выявлялась после восстановления оголенной поверхности эндометрия. Это убедительно свидетельствовало о наличии физиологической гипоксии в менструальном эндометрии в модели имитируемых менструаций на мышах. Для определения ее роли гипоксию при менструации предотвращали путем содержания мышей в гипероксической камере в период отмены прогестерона. Такие меры замедляли восстановление эндометрия после отторжения, указывая на то, что гипоксия необходима для нормального восстановления при менструации [157].
Это исследование особо подчеркивает ключевую роль гипоксии/ HIF в процессе менструации. Фармакологическая стабилизация HIF-1α с помощью диметилоксалилглицина (dimethyloxalylglycine, DMOG) нормализовала замедленное восстановление эндометрия, наблюдаемое у мышей, перенесших негипоксическую менструацию. DMOG является ингибитором пролилгидроксилазы и стабилизирует HIF-1α даже при нормоксии [110]. Это исследование подтверждает роль HIF-1 в эндометрии [157]. Кроме того, было предложено потенциальное применение ингибиторов PHD (стабилизаторов HIF-1α) в качестве кратковременного негормонального лечения для женщин с ОМК.
C. Восстановление сосудов и эпителия эндометрия
В ткани эндометрия человека во время менструации повышается уровень матричной РНК и белка ангиогенного фактора VEGF. В данном контексте следует отметить, что HIF-1α необходим для индуцированного гипоксией увеличения VEGF в эпителиальных клетках эндометрия человека [155]. Дополнительное исследование, в котором ангиогенный фактор VEGF был на молекулярном уровне заблокирован у нечеловекообразных приматов (макаки-резусы), и в альтернативной модели имитируемой менструации на мышах (псевдобеременность с последующей индукцией децидуализации и удалением яичников для запуска менструации) выявило подавление развития новых кровеносных сосудов и замедление восстановления (реэпителизации) оголенной поверхности эндометрия во время менструации [79]. Дополнительные доказательства, подтверждающие роль HIF в физиологическом процессе восстановления эндометрия во время менструации, получены в модели на мышах, где HIF-1α напрямую связывался с промотором VEGF во время менструации [44]. Эти экспериментальные наблюдения дают хорошие доказательства того, что гипоксия регулирует HIF-1α in vivo, координируя своевременное восстановление поврежденной поверхности слизистой оболочки эндометрия во время менструации.
D. Гемостаз в эндометрии
В других тканях повреждение кровеносных сосудов при травме приводит к прилипанию тромбоцитов к коллагену на поврежденной базальной мембране. Агрегация тромбоцитов стимулирует каскад коагуляции и образование фибринового сгустка. Однакоучастие тромбоцитов в восстановлении сосудов эндометрия относительно невелико. Сужение сосудов и активация каскада свертывания крови более важны для гемостаза в постменструальном периоде [94]. Каскад коагуляции активируется двумя путями: внешним и внутренним. Каждый из них завершается превращением фактора X в Ха (активированный фактор Х, — прим. пер.), который катализирует превращение протромбина в тромбин, что в конечном итоге приводит к образованию фибринового сгустка. Заболевания, нарушающие системный гемостаз, существенно влияют на уровень менструальной кровопотери (см. обзор 66). Среди таких расстройств чаще всего встречается болезнь фон Виллебранда, которая выявляется у 13 % женщин с жалобами на ОМК [213].
Деградация фибринового сгустка опосредована работой фибринолитической системы. Фибринолиз включает превращение плазминогена в активный плазмин, способствующий расщеплению отложений фибрина. Тканевой активатор плазминогена (tissue plasminogen activator, t-PA) и урокиназный активатор плазминогена (urokinase plasminogen activator, u-PA) стимулируют выработку плазмина. Ингибитор активатора плазминогена (plasminogen activator inhibitor, PAI), напротив, ингибирует фибринолитическую активность. Эндометрий человека содержит t-PA и u-PA, а также PAI и рецепторы u-PA [100, 180]. У женщин, страдающих от ОМК, уровень активности t-PA на второй день кровотечения повышен по сравнению с женщинами с нормальной менструальной кровопотерей [100], что согласуется с гиперактивностью фибринолитической системы. Еще одним доказательством такой чрезмерной активации фибринолитической системы является эффективность транексамовой кислоты как негормонального препарата для лечения ОМК при назначении в первые дни обильных менструаций. Это антифибринолитическое средство снижает уровень t-PA и PAI у женщин с ОМК и приводит к снижению кровопотери на 58 % [101].
Формирование и ремоделирование тканей — ключевые процессы заживления раны. Восстановление эндометрия после менструации обычно не оставляет рубцов и происходит быстро, в течение 3-5 дней [78, 157]. Было проведено интересное исследование менструальной жидкости (МЖ), при котором на 2-й день цикла у женщин с нормальной продолжительностью кровотечения 3-5 дней с помощью менструальной чаши были собраны менструальные выделения. Показано, что МЖ усиливает заживление ран как in vivo, в моделях на свиньях, так и in vitro, а также определено влияние МЖ на миграцию клеток — важный процесс в авторских моделях заживления ран [78].
Исследование менструального эндометрия с помощью сканирующей электронной микроскопии показало, что в первую очередь происходит восстановление эпителия, за которым следует увеличение объема стромы [142]. В этом исследовании было высказано предположение, что эпителиальные клетки растут из шейки желез эндометрия и распространяются навстречу клеткам, мигрирующим из других желез, образуя новую поверхность просвета матки. Исследование с окраской на бромдезоксиуридин и ядерный антиген пролиферирующих клеток, проведенное в модели имитируемой менструации на мышах, показало, что источником реэпителизации поверхности матки выступают клетки-предшественники, находящиеся среди эпителиальных клеток желез эндометрия [124]. Исследование эндометрия человека с использованием методов динамической гистероскопии и микроскопии показало, что отторжение и восстановление эндометрия происходят фрагментарно и одновременно в различных областях матки [91]. Это исследование выявило, что источником реэпителизации выступают оголенные клетки стромы, а не клетки желез. Все это доказывает, что наше понимание процесса восстановления эндометрия все еще находится в зачаточном состоянии. Учитывая способность эндометрия многократно восстанавливаться без образования рубцов или потери функции, стратегически важно определить эти процессы и их регуляцию.
Влияние и классификация аномальных маточных кровотечений
Аномальные маточные кровотечения (АМК) [169, 170], включая ОМК, связаны с изнуряющими симптомами и железодефицитной анемией (ЖДА). АМК тяжелым бременем ложатся на клинику. Двадцать процентов из 1,2 миллиона обращений к гинекологам в Великобритании приходятся на женщин с ОМК [179, 197]. В исследовании, проведенном в Соединенных Штатах Америки, подсчитано, что ОМК приводят к финансовым потерям в размере более 2000 долларов на пациента в год из-за отсутствия больной женщины на работе и расходов на ведение домашнего хозяйства [85]. Благодаря доступной контрацепции у женщин в странах с высоким уровнем дохода теперь ожидается не менее 400 менструаций в течение жизни. Ранее у женщин происходило около 40 менструальных кровотечений в течение жизни из-за многократных беременностей и длительной лактационной аменореи [216]. Таким образом, из-за большего числа менструаций повышается как вероятность развития менструальных нарушений у женщины, так и общее число жалоб, связанных с нарушениями менструального цикла, в том числе с аномальными менструальными кровотечениями.
Для АМК доступно медикаментозное лечение, но оно часто прекращается из-за побочных эффектов или отсутствия эффективности, что указывает на необходимость персонализированного негормонального лечения ОМК. Все методы, основанные только на прогестинах, связаны с нерегулярными и часто непредсказуемыми мажущими выделениями или кровотечениями [3]. Незапланированное маточное кровотечение является одной из наиболее распространенных причин прекращения применения методов лечения, основанных только на прогестинах. Такие методы включают внутриматочную систему, высвобождающую левоноргестрел [199]. По данным национального 4-летнего мониторинга ОМК, 43 % женщин потребовалось хирургическое вмешательство в течение года после первого обращения к врачу [196, 197]. В Англии и Уэльсе наибольший процентный рост коэффициента фертильности в последнее время был отмечен среди женщин в возрасте 40 лет и старше, и с 1981 года этот показатель увеличился более чем в три раза. В 2015 году коэффициент фертильности для женщин в возрасте 40 лет и старше превысил показатель для женщин в возрасте до 20 лет [182, 196, 197], и это означает, что операции, ведущие к потере репродуктивной функции, не всегда являются приемлемым вариантом для женщин, испытывающих проблемы с менструацией. Кроме того, операция создает риск повреждения кишечника / мочевого пузыря / мочеточника, кровоизлияния и инфекции. Проблемы, связанные с менструацией, представляют собой клиническую область, требующую серьезных решений и персонализированных, эффективных методов лечения, которые позволят женщинам сохранить свою фертильность / матку. Определение фундаментальной физиологии инициации и прекращения менструального цикла, а также аномалий эндометрия, присутствующих у женщин с АМК, поможет выявить новые стратегии диагностики и лечения таких расстройств.
Тактика ведения пациента при жалобах на это распространенное состояние, ухудшающее качество жизни, не улучшится без соответствующей диагностики основного заболевания. Обилие потенциальных причин АМК и отсутствие их общепринятой номенклатуры ранее препятствовали прогрессу в этой клинически важной области. Однако в 2011 году для АМК была опубликована система классификации FIGO (The International Federation of Gynecology and Obstetrics, Международная федерация гинекологии и акушерства), разработанная в несколько этапов при участии международной группы врачей-исследователей из более чем 17 стран на 6 континентах [168]. Эта группа рекомендовала исключить непоследовательные, сбивающие с толку термины, такие как «дисфункциональное маточное кровотечение» и «меноррагия», заменив их более упрощенными терминами, такими как «обильное менструальное кровотечение» или «нерегулярное обильное менструальное кровотечение». Кроме того, была введена система классификации PALM-COEIN [169, 170] (в данной классификации AUB (abnormal uterine bleeding) = АМК — прим. пер.) (рис. 8). PALM обозначает структурные нарушения: полипы (AUB-P), аденомиоз (AUB-A), лейомиомы (AUB-L) и злокачественные / предраковые состояния (AUB-M). COEIN обозначает неструктурные причины, такие как коагулопатия (AUB-C), дисфункция овуляции (AUB-O), дисфункция эндометрия (AUB-E), ятрогенные причины, например, связанные с терапией прогестином и другими гормонами (AUB-I), и причины, не классифицированные иначе (AUB-N). Эндометриоз включен в категорию AUB-N, так как он может иногда вызывать АМК. Фенотип эндометрия при эндометриозе является областью активных исследований и предметом недавних обзоров [89, 146], поэтому далее обсуждаться не будет.
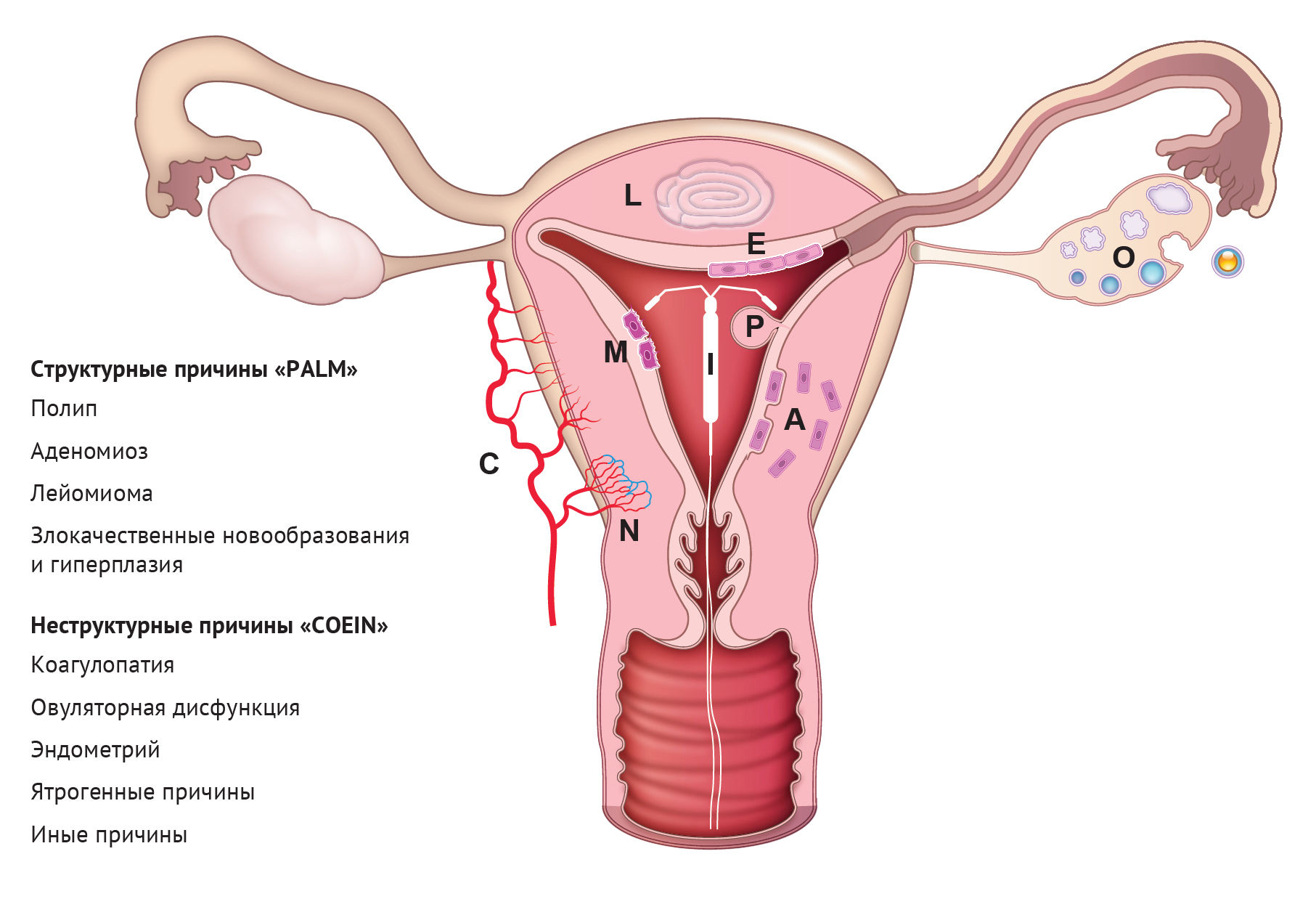
A. Структурные причины АМК («PALM») (см. рис. 8)
Полипы эндометрия или шейки матки, как правило, возникают в результате доброкачественной пролиферации эпителия и стромы и содержат различные сосудистые, железистые, фиброзно-мышечные и соединительнотканные компоненты. Обычно полипы проявляются нерегулярными маточными кровотечениями, однако плохо изучены причины их возникновения и то, как полипы вызывают АМК. Они могут представлять собой локализованные очаги неотслаивающегося эндометрия, которые разрастаются в течение нескольких циклов. Полипы поддаются хирургическому удалению, а появление устройств для изъятия тканей позволило эффективно проводить гистероскопическое удаление полипов в амбулаторных условиях.
Аденомиоз (AUB-A по классификации FIGO) [170] определяется наличием эктопических эндометриальных желез и стромы в пределах миометрия. Его распространенность колеблется от 7 до 27 %, при этом значительные различия частоты встречаемости обусловлены сложностями постановки диагноза [150, 174]. У женщин с аденомиозом эктопические участки эндометрия, как и нормально расположенный эндометрий, претерпевают циклическое отторжение, что приводит к выраженным болям. Влияние аденомиоза на эндометрий и механизмы, вызывающие АМК, изучены недостаточно. Аденомиоз является особенно сложной задачей, поскольку он часто устойчив к медикаментозному лечению, а варианты хирургического вмешательства (абляция или гистерэктомия) неприемлемы для тех, кто хочет сохранить репродуктивную функцию. Определение механизмов, путем которых эндометрий вовлечен в развитие аденомиоза, может выявить новые терапевтические стратегии для больных женщин. Имеются некоторые данные, свидетельствующие о снижении уровня рецепторов прогестерона в эндометрии у женщин с аденомиозом [18, 19], что может привести к снижению чувствительности эндометрия к прогестерону. Также в эндометрии у женщин с аденомиозом была выявлена повышенная экспрессия такого подтипа ER, как ER-B, при сниженной экспрессии PR [108]. Прогестерон подавляет пролиферацию и противодействует воздействию эстрогена во время пролиферативной фазы менструального цикла, следовательно, такие нарушения могут частично способствовать развитию ОМК у женщин с аденомиозом.
Лейомиомы (миомы, фибромы матки; AUB-L) являются наиболее распространенными доброкачественными опухолями у женщин репродуктивного возраста, а совокупный риск их возникновения в течение жизни достигает 80 % [12]. Симптомы этого состояния, которые наблюдаются в ~50 % случаев [12], могут включать нарушения свертываемости крови (ОМК или нерегулярные кровотечения), симптомы давления (на мочевой пузырь и кишечник), боли в области таза и нарушения репродуктивной функции. Лейомиомы образуются вследствие пролиферации гладкомышечных клеток матки и связанного с ними коллагенового матрикса, они чрезвычайно неоднородны по размеру и расположению. Новые данные, полученные в результате полногеномных исследований ассоциаций, позволили выявить подгруппы генов, приводящие к образованию миомы (см. обзор 226). Их воздействие на функцию эндометрия привлекло внимание благодаря связи с нарушениями репродуктивной функции и АМК. Подслизистая миома связана с ослабленным ответом на децидуализацию и повреждением генов, регулируемых прогестероном, таких как HOXA10 [69, 192]. Помимо негативного влияния на имплантацию, нарушение «менструальной предварительной подготовки» секреторного эндометрия может существенно повлиять на функцию эндометрия во время менструации и увеличить кровопотерю. Также у женщин с миомой может быть нарушено сокращение сосудов во время менструации, при этом экспрессия рецепторов эндотелина и PGF2α в фиброзной ткани отличается от нормы [164, 189]. Как уже говорилось выше, даже небольшое ослабление вазоконстрикции значительно усиливает ток крови при менструации [153]. Дальнейшее изучение влияния миомы на эндометрий позволит разработать стратегии терапии с сохранением репродуктивной функции при лейомиомах.
B. Неструктурные причины АМК («COEIN») (см. рис. 8)
Эти расстройства не всегда легко выявляются с помощью визуализации органов малого таза и требуют квалифицированного сбора анамнеза и осмотра пациента для проведения соответствующего обследования и постановки диагноза. К классификационной категории AUB-C относят наследственные коагулопатии и нарушения гемостаза. Местная регуляция гемостаза эндометрия была рассмотрена выше, это состояние требует участия гематолога для надлежащего лечения [100, 121, 132]. Кровотечение из-за овуляторной дисфункции (AUB-O) может быть следствием крайних значений репродуктивного возраста или индекса массы тела, а также из-за фоновых заболеваний, таких как синдром поликистозных яичников. Поскольку нарушение происходит на уровне яичников, часто эффективна гормональная терапия. Категория AUB-E включает нарушения локальной коагуляции, сосудистой функции и/или воспаления в эндометрии, которые рассмотрены выше (см. Разделы VIII и XI). Детальное понимание регуляторных факторов, участвующих в ключевом репродуктивном событии — менструации — и нарушений, возникших у пациентов с АМК, будет способствовать специфической коррекции и более точному, персонализированному лечению. Только понимание физиологии и патологии менструации позволит повысить эффективность и приемлемость медицинских стратегий лечения АМК и ослабить зависимость от неспецифических хирургических вмешательств, приводящих к утрате репродуктивной функции.
Терапия путем направленного взаимодействия с PR: эффекты класса препаратов, клиническое применение, механизмы действия лигандов PR (SPRM)
В настоящее время существует большой клинический интерес к селективным модуляторам рецепторов прогестерона (selective progesterone receptor modulator, SPRM), группе соединений, воздействующих на PR. Эти соединения обладают терапевтическим потенциалом в отношении ряда нерешенных проблем доброкачественных новообразований в гинекологии [245]. Одним из наиболее значимых клинических эффектов SPRM является способность быстро вызывать аменорею (отсутствие кровотечения) с помощью механизмов, которые в основном остаются неизвестными (рис. 9А). Эндометрий является основной тканью-мишенью для SPRM. Существует целый ряд потенциальных действий этих препаратов: от чистого агонистического эффекта прогестерона и синтетических прогестинов до чистого антагонизма с синтетическими фармацевтическими препаратами, такими как онапристон. Некоторые соединения, включая азоприснил и мифепристон, демонстрируют смешанный частичный агонистический и антагонистический эффект (рис. 9B).
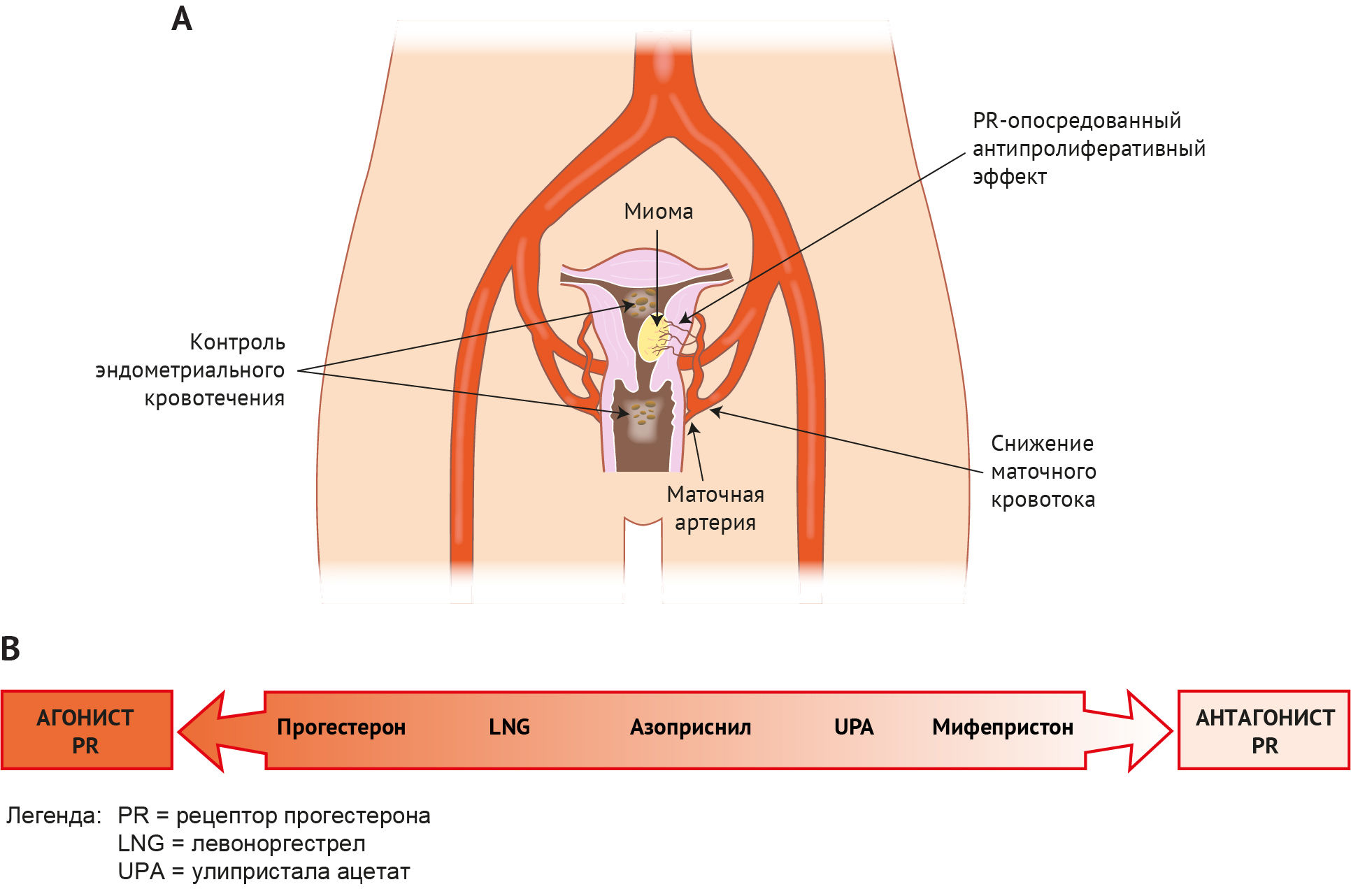
В: спектр модуляторов рецепторов прогестерона от агонистов до антагонистов. SPRM — это класс синтетических лигандов рецепторов прогестерона, оказывающих агонистическое, антагонистическое или смешанное воздействие на ткани-мишени прогестерона, например, на эндометрий.
Первым клинически разработанным SPRM стал мифепристон, применение которого, помимо медицинского прерывания беременности [236], возможно для экстренной контрацепции [99]; в качестве ежедневной пероральной контрацепции, не содержащей эстрогены [134]; в противозачаточных средствах длительного высвобождения [106]; а также при лечении миомы матки [215], эндометриоза и аденомиоза. Клиническая разработка зависела не только от демонстрации эффективности, но и от профиля безопасности: высказывалась озабоченность по поводу долгосрочных эффектов воздействия мифепристона на эндометрий, что, по сути, в настоящее время относится ко всем SPRM.
Влияние мифепристона на эндометрий зависит от дозы и продолжительности приема. При дозировке 10 мг/сут и более развитие фолликулов тормозится путем подавления гонадотропинов, а секреция эстрадиола в яичниках минимальна. В низких дозах (2 мг/сут или менее) мифепристон подавляет или задерживает овуляцию, не препятствуя развитию фолликулов, а уровень циркулирующих эстрогенов, как правило, находится в диапазоне, соответствующем середине фолликулярной фазы [14]. Таким образом, эндометрий подвергается воздействию свободного эстрогена, и в ранних исследованиях было высказано предположение, что это может привести к гиперплазии или карциноме эндометрия. Действительно, в ряде заключений у женщин были описаны эффекты [приема препарата], соответствующие гиперплазии эндометрия, с широко распространенным кистозным расширением желез и общим утолщением эндометрия [74, 171]. При очень высоких дозах (400 мг в сутки в течение 6 мес.) отмечалась массивная простая гиперплазия эндометрия, которая регрессировала при прекращении приема препарата [177].
Однако стало очевидно, что на самом деле ситуация была более сложной и что мифепристон и другие SPRM оказывают парадоксальное антипролиферативное действие именно на эндометрий. Первоначально это было изучено в экспериментах на приматах, и антипролиферативный эффект оказался специфичным для эндометрия [111, 253]. Клинические исследования показали, что в эндометрии женщин, принимавших SPRM, железистый эпителий выглядел как покоящийся или неактивный со сниженной митотической активностью, а кистозные железы больше походили на состояние постменопаузальной кистозной атрофии, чем гиперплазии [38, 61]. В клеточных линиях эндометрия также был описан антипролиферативный эффект [172, 208].
Митотическая активность в эндометрии запускается эстрогеном, а прогестерон оказывает ингибирующее действие, поэтому несколько парадоксально, что антипрогестины оказывают антипролиферативное действие на эндометрий. Даже при высоких концентрациях эстрогена SPRM способны подавлять пролиферацию эндометрия у самок приматов [219, 253] и у женщин [38]. Механизм этого действия неизвестен, и предлагаются такие объяснения, как подавление ER или ингибирование эстроген-индуцируемых протоонкогенов. Данные экспериментов на приматах позволяют предположить, что важную роль в этих эффектах могут играть рецепторы андрогенов (AR) в эндометрии. Эндометрий у самок приматов и женщин реагирует на терапию SPRM активацией экспрессии AR, и важно отметить, что у приматов антипролиферативное воздействие на эндометрий можно предотвратить путем введения антиандрогена флутамида [26].
Стало ясно, что на лечение различными SPRM эндометрий реагирует примерно одинаковым образом, с незначительными особенностями для каждого препарата, которые, как полагают, зависят от степени агонистического / антагонистического воздействия на PR (рис. 9B). Морфологические изменения варьируют в зависимости от продолжительности лечения, однако удивительно схожи при лечении различными препаратами, назначаемыми на срок до 3 месяцев. Основным эффектом для желез эндометрия является их кистозное расширение, связанное с нарушением архитектуры желез. Для желез наблюдается нефизиологический секреторный эффект, который включает развитие выпячиваний апокринного типа в просвет матки и незавершенную вакуолизацию цитоплазмы. Характерно, что железистый эпителий выглядит спокойным, снижено число клеток с ядрами на разном уровне, клетки в митозе немногочисленны, что отражает антипролиферативный эффект. Строма эндометрия компактна, без изменений, предшествующих стадии децидуализации (рис. 10, A–C). Эти изменения в настоящее время признаны эффектом всего класса SPRM — спектром морфологических изменений, из которых ни одно не является специфическим, но сочетание которых не наблюдается ни в какой другой ситуации или при действии любого другого препарата. Эти изменения получили название названы «изменения эндометрия, связанные с модуляторами рецепторов прогестерона» (progesterone receptor modulator associated endometrial changes или PAEC) [112, 173]. Характерные гистологические изменения были описаны при применении мифепристона [84], азоприснила [252], онапристона [37], лонапризана [106], телапристона ацетата [173] и улипристала ацетата [251].
Естественная динамика развития и последствия PAEC в эндометрии имеют большое клиническое значение, так как многие потенциальные клинические показания в идеале требуют постоянного длительного применения препарата. Непрерывное применение SPRM в течение 6 месяцев и более приводит к утолщению эндометрия, степень которого коррелирует со степенью кистозного расширения желез эндометрия [13, 227]. Несмотря на то что с увеличением продолжительности непрерывного лечения железистый эпителий морфологически принимает все более спокойный или атрофический вид, увеличение толщины эндометрия часто приводит к клиническим проблемам, которые требуют инвазивных методов исследования и лечения. Поэтому современные схемы лечения используют прерывистый график приема SPRM, при котором препарат применяют в течение 12 недель, а затем отменяют, чтобы произошло отторжение эндометрия. Данные клинических испытаний улипристала ацетата показывают, что у подавляющего большинства женщин эндометрий возвращается к нормальной физиологической картине даже после восьми прерванных курсов [80]. Некоторые проблемы безопасности по-прежнему связаны с последствиями долгосрочного воздействия SPRM на эндометрий, однако основной проблемой безопасности, находящейся сейчас в центре внимания, является потенциальная гепатотоксичность, поскольку применение некоторых препаратов, в том числе, как недавно показано, улипристала ацетата, было связано с тяжелым повреждением печени у очень малого числа женщин [166].
Еще многое предстоит узнать о механизмах воздействия SPRM на эндометрий, в частности о механизмах антипролиферативного действия и аменореи. Вполне вероятно, что в опосредовании этих эффектов важную роль играет измененная экспрессия рецепторов половых стероидов (рис. 10, D–F) и прогестерон-регулируемых генов. Имеются доказательства не только изменения общего уровня экспрессии рецепторов половых стероидов в эндометрии, но и значительных изменений в характере экспрессии между железами эндометрия и стромой. Например, было показано увеличение общей концентрации мРНК AR, PR, PRB и ESRI (ERa) в эндометрии под воздействием улипристала ацетата по сравнению с секреторной фазой до начала терапии [249]. Иммуногистохимическое исследование распределения PR и PRB выявило их интенсивную экспрессию в ядрах клеток желез, с минимальной экспрессией в стромальных клетках, в отличие от пролиферативной фазы эндометрия до начала терапии, где наблюдалось интенсивное окрашивание ядер как в железах, так и в строме. При окрашивании на AR в секреторной фазе до начала терапии наблюдалось интенсивное окрашивание ядер в железах, но не в строме; иммуноэкспрессия ERα показала менее значительные различия, хотя были описаны изменения интенсивности.
Интересные наблюдения за эндометрием человека после терапии SPRM (азоприснилом) подтверждают роль пути IL-15 в сложном взаимодействии между стромальными клетками эндометрия, клетками врожденного иммунитета (NK-клетками матки) и спиральными артериями эндометрия, влияющими как на морфологию артериол, так и на менструальные кровотечения [250]. Наблюдаются ли такие нарушения нормальной функции эндометрия, как только что описано, при терапии другими препаратами класса SPRM, еще предстоит определить. Тем не менее SPRM являются бесценным инструментом для управления взаимодействием между прогестероном и рецепторами прогестерона и тем самым улучшают наше понимание физиологии эндометрия и, в частности, загадочной области регуляции менструального кровотечения.
Заключительные комментарии и будущие направления работы
Первые исследования физиологии эндометрия и его регуляции с помощью стероидов, результаты которых до сих пор лежат в основе многих наших знаний о процессе менструации, были проведены почти 80 лет назад. Значительный прогресс в нашем понимании патофизиологии эндометрия был достигнут благодаря современным инструментам исследования клеток и молекул, а также моделям имитируемых менструаций на животных. Однако и сегодня, спустя почти четыре десятилетия, остается актуальной цитата 1982 года: «несмотря на интерес, возобновившийся в течение последних нескольких лет, механизм менструального кровотечения все еще остается загадкой» [4]. Наше понимание биологии эндометрия продвинулось вперед, но многие вопросы, связанные с этой замечательной физиологической моделью повторного повреждения и восстановления, столь важной для продолжения существования нашего вида, остаются нерешенными.
Тема менструации у человека до сих пор остается табуированной, и многие вопросы, касающиеся физиологии менструации, по сей день остаются без ответа. К сожалению, сохраняется негативное отношение к менструации, особенно там, где женщины имеют более низкий социальный статус и где отсутствует просвещение в области репродуктивного здоровья. Это, наряду с ранее запутанной классификацией и терминологией, связанной с менструацией, препятствовало прогрессу в этой области. По мере внедрения системы классификации FIGO для АМК несоответствия будут уменьшаться, а полезность исследований в этой области будет возрастать. Это неизбежно положительно скажется на женщинах, страдающих от изнурительных аномальных маточных кровотечений.
Эндометрий представляет собой физиологическую ткань с повторяющимися эпизодами «травмы и восстановления» (менструации), которые регулируются преобладающей эндокринной средой и последовательным воздействием стероидов. Следовательно, он может также служить моделью повреждения / восстановления поверхности слизистой оболочки без образования рубцов, что может дать информацию о биологии других тканей организма [152]. После менструации «поврежденный» эндометрий быстро восстанавливает строение и функционирование тканей в процессе подготовки к следующему менструальному циклу. Для восстановления функционального эндометрия, готового к имплантации, необходимо устранить воспаление эндометрия и обеспечить клеточную пролиферацию и ангиогенез. Поэтому решение оставшихся без ответа вопросов в этой области может не только улучшить жизнь многих женщин, но и оказать значительное влияние на процессы в других тканях.
Остается интересным и все еще необъясненным, почему менструация происходит только у тех биологических видов, у которых эндометрий спонтанно децидуализируется перед [возможной] имплантацией. Напротив, у тех видов, у которых эндометрий не децидуализируется до установления контакта эмбриона с эндометрием, резкое снижение уровня прогестерона не влияет на разрушение эндометрия или кровотечение. Также неизвестно, влияет ли на менструацию «предварительная подготовка» эндометрия в предшествующем цикле. Существенно ли влияют на кровотечение во время менструации нарушения процессов децидуализации, ремоделирования сосудов и/или иммунного ответа? Механизмы прекращения менструации остаются неопределенными. Что влияет сильнее: факторы гемостаза или сужение сосудов? Или же для прекращения кровотечения требуется заново сформировать эпителий просвета матки? Влияет ли способность клеток менструальной жидкости к миграции на реэпителизацию просвета матки? Что регулирует эти локальные механизмы? Почему в физиологических условиях в эндометрии не образуются рубцы и почему происходит его рубцевание при таких состояниях, как синдром Ашермана [приобретенное состояние, когда в полости матки образуется рубцовая ткань (спайки)]?
Помимо множества вопросов, связанных с физиологией эндометрия, многое не изучено в отношении патологии эндометрия. Мы пока не знаем, каково влияние лейомиом (миом) или аденомиоза на эндометрий, а также каковы механизмы, с помощью которых они приводят к АМК. Кроме того, мы еще не до конца понимаем механизмы действия многих из наших современных методов лечения, например, SPRM.
Без этих знаний мы не сможем предоставить эффективное лечение многим женщинам, страдающим в настоящее время от АМК. Разгадка физиологии и патологии нарушений эндометрия приведет к созданию персонализированных терапевтических стратегий, которые будут способствовать сохранению фертильности и ограничат побочные эффекты, улучшая жизнь миллионов женщин во всем мире.
