Гипопаратиреоз

Аннотация
Гипопаратиреоз — это заболевание, характеризующееся низкими циркулирующими концентрациями паратиреоидного гормона (ПТГ), недостаток которого приводит к снижению концентрации кальция и повышению концентрации фосфора в крови. Вызванное гипокальциемией повышение нервно-мышечной проводимости обуславливает симптомы гипопаратиреоза, включающие ощущение покалывания, мышечные спазмы и судороги. Самая распространенная причина этого заболевания — случайное повреждение или удаление паращитовидных желез в ходе операций на шее, реже оно вызывается генетическими, идиопатическими или аутоиммунными причинами. Традиционная схема лечения включает активные метаболиты витамина D и/или препараты кальция, но при подобной терапии не происходит полного замещения всех функций ПТГ, что может вызывать осложнения как в ранние сроки (например, гипокальциемия, гиперкальциемия, повышение почечной экскреции кальция), так и в долгосрочной перспективе (например, нефрокальциноз, мочекаменная болезнь и формирование кальцификатов в головном мозге). Новым вариантом лечения стала заместительная терапия ПТГ. В ходе клинических испытаний с максимальной продолжительностью исследований до 6 лет было показано, что лечение препаратами человеческого ПТГ(1–34) и ПТГ(1–84) безопасно и эффективно. Рекомбинантный человеческий ПТГ(1–84) был одобрен для лечения гипопаратиреоза в США и Европе, однако его влияние на развитие осложнений в долгосрочной перспективе все еще оценивается. В опубликованных клинических руководствах специалистами единогласно признается необходимость продолжения исследований для оптимизации лечения. В этой статье обобщаются имеющиеся знания о распространенности, патофизиологии, клинической картине гипопаратиреоза и ведении пациентов с данным заболеванием.
Гипопаратиреоз — это заболевание, которое характеризуется полным отсутствием или неадекватным снижением концентрации циркулирующего паратиреоидного гормона (ПТГ), что приводит к гипокальциемии, гиперфосфатемии и повышению выделения кальция с мочой [1, 2]. Наиболее частой причиной заболевания является удаление или повреждение паращитовидных желез в ходе операций на области шеи, например, при тотальной тиреоидэктомии или радикальной диссекции шеи при злокачественных новообразованиях головы и шеи. Другими этиологическими факторами являются аутоиммунные, генетические и очень редко — инфильтративные заболевания (такие как гемохроматоз, болезнь Вильсона — Коновалова и метастазирование) [3, 4]. Открытие множества генетических дефектов, ответственных за развитие гипопаратиреоза, позволило понять физиологию паращитовидных желез. К этим дефектам относятся мутации приобретения функций, которые влияют на внеклеточный кальций-чувствительный рецептор (CaSR) или на гуанин-нуклеотид-связывающий белок 11α (G11α), и мутации потери функций, воздействующие на основные факторы транскрипции или непосредственно на ПТГ [2].
Клинические проявления варьируют от легкой формы заболевания с парестезией (чувство жжения или покалывания) и мышечными судорогами до тяжелых симптомов, таких как ларингоспазм (спазм голосовых связок) и судорожные приступы [2]. Несмотря на то, что на сегодняшний день стандартом лечения является традиционная схема терапии активными метаболитами витамина D и пероральными препаратами кальция, они замещают функции ПТГ не полностью и их прием приводит к отдаленным осложнениям, таким как внескелетная кальцификация. Особое беспокойство вызывает происходящая при отсутствии ПТГ потеря кальция с мочой, которая в перспективе провоцирует развитие нефрокальциноза (кальцификации почечной паренхимы) и нарушения функции почек. Кроме того, результаты ряда клинических исследований показали снижение качества жизни пациентов с гипопаратиреозом. Все это указывает на необходимость появления новых методов лечения. До недавнего времени гипопаратиреоз оставался одним из немногих классических эндокринных дефицитных состояний, для которых не существовало заместительной терапии соответствующим гормоном. Однако клинические испытания продемонстрировали эффективность ПТГ при лечении гипопаратиреоза, что позволило зарегистрировать рекомбинантный человеческий паратиреоидный гормон (рчПТГ(1–84)) как препарат для терапии гипопаратиреоза в США и Евросоюзе и способствовало исследованию новых методов лечения и ранее неизвестных аналогов ПТГ [5, 6]. По мере все более широкого применения современной терапии, решающее значение будут иметь оценка эффективности контроля над заболеванием, появление отдаленных осложнений и качество жизни пациентов.
Эпидемиология
По имеющимся оценкам, распространенность гипопаратиреоза в США, Дании и Италии относительно схожа и составляет 23–37 случаев на 100 000 населения [3], однако в некоторых других странах отмечается более низкая распространенность [7]. Различия между странами могут объясняться различиями в хирургических подходах, поскольку в большинстве случаев заболевание развивается после операции. Необходимы дальнейшие исследования, которые позволили бы оценить распространенность и заболеваемость гипопаратиреозом не только в США и Европе, поскольку данных о проведении таких исследований из Южной Америки, Азии, Африки и Австралии не поступало. Хотя распространенность наследственных форм гипопаратиреоза у женщин и мужчин примерно одинакова [8], послеоперационный гипопаратиреоз чаще встречается у женщин [9], поскольку женщины более склонны к заболеваниям щитовидной железы и, как следствие, чаще подвергаются тиреоидэктомии [10].
Северная Америка
Наилучшая оценка распространенности гипопаратиреоза в Северной Америке основывается на анализе большой базы данных медицинского страхования США за период 12 месяцев 2007–2008 годов [11]. Распространенность гипопаратиреоза в популяции оценивается в 59 000 взрослых, имеющих медицинскую страховку, и всего в 77 000 взрослых в США. Альтернативный подход, основанный на частоте оперативных вмешательств на области шеи и распространенности хронического гипопаратиреоза как хирургического осложнения с использованием той же базы данных, позволил сформулировать аналогичные выводы [11]. Еще одна оценка распространенности гипопаратиреоза, представлена в кратком изложении и основана на результатах лонгитюдного популяционного Ротчестерского эпидемиологического проекта. Средства медицинской статистики использовались для идентификации всех лиц, проживающих в округе Олмстед, Миннесота, США в 2009 году (средний возраст и стандартное отклонение = 58 ± 20 лет; 71 % женщин), у которых был диагностирован гипопаратиреоз любой этиологии в период с 1945 года по настоящее время [12]. Было выявлено 54 случая гипопаратиреоза, что позволило подсчитать распространенность, составившую 37 на 100 000 населения. Подобная распространенность прогнозирует наличие в США примерно 115 000 лиц больных гипопаратиреозом любой этиологии. В изученной базе данных гипопаратиреоз, развившийся после операций на области шеи составлял 78 % случаев, по другим вторичным причинам — 9 %, как наследственное заболевание был выявлен в 7 % случаев и в 6 % был идиопатическим.
Европа
Для оценки распространенности гипопаратиреоза в Дании использовался Датский национальный реестр пациентов [8, 9, 13]. В этих исследованиях также оценивали смертность и коморбидность, сопоставляя схожих по возрасту и полу пациентов с гипопаратиреозом и контрольную группу. Было выявлено 1849 лиц с послеоперационным гипопаратиреозом и 180 с гипопаратиреозом нехирургической этиологии. Предполагаемая распространенность послеоперационного гипопаратиреоза составила 22 на 100 000 населения, а нехирургического — 2,3 на 100 000 населения. Заболеваемость послеоперационным гипопаратиреозом составила 0,8 на 100 000 человеко-лет [13]. В послеоперационных случаях операции были выполнены по следующим показаниям: злокачественное новообразование (чаще всего рак щитовидной железы) в 30 %, нетоксический зоб (нормальная активность, неонкогенная гипертрофия щитовидной железы) в 37 %; токсический зоб (гиперфункция щитовидной железы) в 25 % и первичный гиперпаратиреоз в 8 % [13]. Распространенность гипопаратиреоза в Норвегии приблизительно в два раза ниже, чем в Дании, и составляет 10,2 на 100 000 населения [5]. Средняя частота госпитализаций по поводу гипопаратиреоза в Италии составила 5,9 на 100 000 человек за год [14].
Механизмы/патофизиология
Для гипопаратиреоза характерно отсутствие или крайне низкие уровни ПТГ, ключевого гормона минерального гомеостаза, в крови. Наиболее распространенной причиной является удаление или повреждение паращитовидных желез в ходе операции. Другими причинами являются аутоиммунные заболевания или генетические нарушения, влияющие на формирование железы или биосинтез и высвобождение ПТГ.
ПТГ и минеральный гомеостаз
Паращитовидные железы контролируют гомеостаз внеклеточного кальция путем секреции ПТГ (рис. 1). В клетках паращитовидных желез ПТГ синтезируется как 115-аминокислотный пептид-предшественник (препроПТГ(1–115)), который позднее модифицируется в полноценный ПТГ, состоящий из 84 аминокислот (ПТГ(1–84)). ПТГ запасается в секреторных гранулах и выбрасывается из паращитовидных желез при уменьшении концентрации ионизированного кальция в циркулирующей крови. Эти изменения улавливаются CaSR — рецептором, связанным с G-белком, который в больших количествах экспрессируется на поверхности клеток паращитовидных желез [15]. Снижение уровней внеклеточного кальция уменьшает передачу сигнала от CaSR посредством G11α и Gqα, что индуцирует заметное повышение высвобождения ПТГ из паращитовидных желез. Секретируемый ПТГ в циркулирующей крови воздействует на связанный с G-белком рецептор ПТГ1 (PTH1R, ПТГ1Р) [16] в костях и почках, повышая плазменные уровни кальция, что приводит к ингибированию секреции ПТГ паращитовидными железами по типу обратной связи [15].
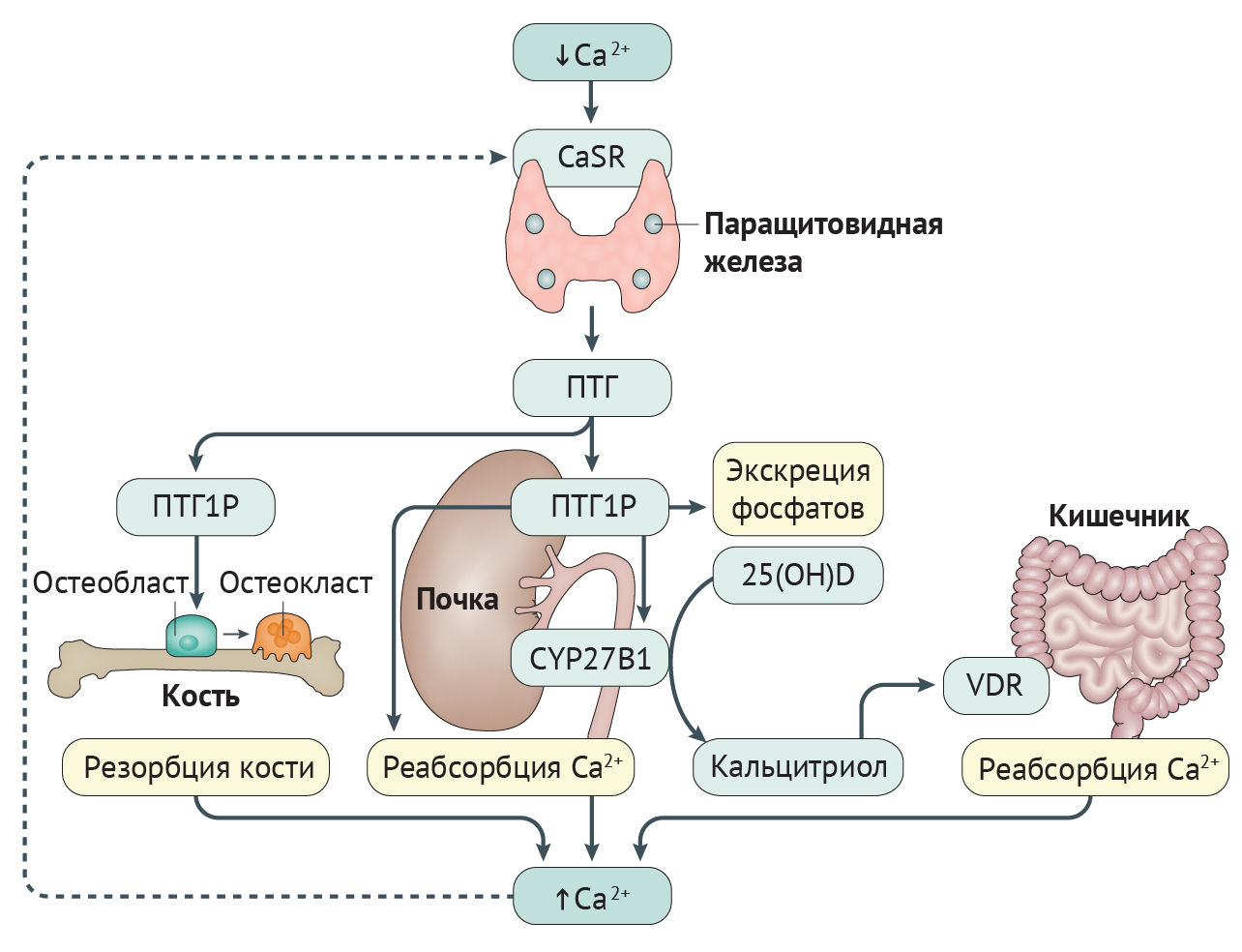
Также ПТГ регулирует уровни фосфата в циркулирующей крови. Действительно, повышение уровней фосфата в циркулирующей крови стимулирует секрецию ПТГ, который воздействует на почки препятствуя реабсорбции фосфатов канальцевым аппаратом [17]. Гомеостаз фосфатов регулируется фактором роста фибробластов 23 (FGF23) — производимым остеоцитами гормоном, который ингибирует реабсорбцию фосфатов канальцевым аппаратом и синтез кальцитриола в почках (также известен как 1,25-дигидроксивитамин D (1,25(ОН)2D)) [18].
При развитии гипопаратиреоза отсутствие или низкий уровень ПТГ приводят к гипокальциемии, поскольку нарушается активность остеокластов, что уменьшает высвобождение кальция из кости, усиливается экскреция кальция с мочой и происходит ингибирование синтеза кальцитриола в почках, из-за чего ухудшается абсорбция кальция в кишечнике [19]. В результате дефицита ПТГ увеличивается реабсорбции фосфатов канальцевым аппаратом почек, ведущая к гиперфосфатемии. У пациентов с гиперпаратиреозом была выявлена связь между повышением уровня FGF23 в сыворотке крови и хронической гиперфосфатемией [20].
ПТГ также принимает участие в гомеостазе магния. ПТГ усиливает реабсорбцию магния в почках [21], в то время как тяжелая и продолжительная гипомагнезиемия приводит к развитию гипокальциемии вследствии ингибирования секреции ПТГ и развития резистентности к ПТГ в органах-мишенях [22, 23]. Гипермагнезиемия также может приводить к ингибированию высвобождения ПТГ через активацию CaSR, что способствует развитию гипокальциемии [24, 25].
Послеоперационный гипопаратиреоз
Операции в области шеи — наиболее распространенная причина приобретенного гипопаратиреоза, которая составляет около 75 % от всех случаев гипопаратиреоза [3]. К хирургическим вмешательствам, ассоциированным с развитием гипопаратиреоза, относятся тотальная тиреоидэктомия или радикальная диссекция шеи при злокачественных опухолях головы и шеи. Также причинами гипопаратиреоза могут быть случайное удаление железы, интраоперационная травматизация паращитовидных желез или деваскуляризация железы. К гипопаратиреозу может приводить и паратиреоидэктомия, направленная на удаление, например, одной или нескольких опухолей паращитовидных желез [1, 3, 26].
Транзиторным послеоперационным гипопаратиреозом называют состояние, сопровождающееся полным отсутствием или снижением уровня ПТГ продолжительностью менее шести месяцев, которое развивается у 25–30 % пациентов, перенесших тотальную тиреоидэктомию, тогда как постоянный послеоперационный гипопаратиреоз (длительностью более шести месяцев) развивается лишь у 3 % пациентов [27]. К независимым прогностическим факторам транзиторного гипопаратиреоза после тиреоидэктомии относятся: низкие предоперационные уровни ПТГ, сывороточного кальция и 25-гидроксивитамина D (25(OH)D), аутотрансплантация (реимплантация паращитовидной железы в ткани шеи или предплечья после операций на области шеи) одной или нескольких паращитовидных желез и длительная операция [28]. К факторам риска постоянного гипопаратиреоза после операции на щитовидной железе относятся: степень хирургического вмешательства; диагностированная перед операцией болезнь Грейвса (аутоиммунное заболевание, которое сопровождается гиперфункцией щитовидной железы); невозможность идентифицировать ≥ 2 паращитовидных желез в ходе операции; уровень сывороточного кальция ≥ 1,88 ммоль/л (7,5 мг/дл [норма: 2,12–2,62 ммоль/л или 8,5–10,5 мг/дл]) в течение 24 часов после операции; повторное вмешательство по поводу кровотечения [28]. В редких случаях послеоперационный гипопаратиреоз может дать о себе знать спустя годы после операции в области шеи [29]. Механизм, лежащий в основе этого явления, до конца не выяснен, но причиной могут быть опосредованные возрастом эффекты измененной васкуляризации небольшого количества оставшейся после операции ткани паращитовидных желез [1].
Генетические причины гипопаратиреоза
Гипопаратиреоз имеет генетическую этиологию менее чем в 10 % случаев [3]. Однако хромосомные микроделеции и моногенные аномалии являются наиболее частыми причинами гипопаратиреоза у детей [30]. Генетические формы гипопаратиреоза встречаются в виде компонентов синдромальных расстройств, одиночной эндокринопатии (изолированный гипопаратиреоз) или в виде аутосомно-доминантной гипокальциемии, которая может считаться отдельным типом гипопаратиреоза (табл. 1). Генетические формы резистентности к ПТГ (модуль 1) — отдельной группы состояний, называемых псевдогипопаратиреозом — не рассматриваются в этой статье.
Модуль 1 | Псевдогипопаратиреоз
Псевдогипопаратиреоз — это нарушение, связанное с резистентностью к паратиреоидному гормону (ПТГ). Хотя оно также приводит к гиперкальциемии и гиперфосфатемии, концентрации ПТГ в циркулирующей крови повышаются, что отличает это состояние от гипопаратиреоза. Основными причинами псевдогипопаратиреоза являются генетические или эпигенетические мутации в GNAS — импритинговом гене, кодирующем α‑субъединицу (Gsα) гуанин-нуклеотид-связывающего стимулирующего белка (Gs), и варианты его сплайсинга (рис. 2) [167]. Gsα кодируется 1–13 экзонами GNAS и биаллельно экспрессируется в большинстве тканей, но в некоторых тканях, к которым относятся проксимальные почечные канальцы и щитовидная железа, экспрессия материнской аллели снижается или совсем отсутствует. Гетерозиготные инактивирующие мутации на материнской аллели GNAS приводят к развитию псевдогипопаратиреоза Iа типа. В дополнение к резистентности к ПТГ, у пациентов с гипопаратиреозом Iа типа отмечаются признаки наследственной остеодистрофии Олбрайта (НОО), в том числе низкий рост, ожирение, округлое лицо, подкожные кальцификаты и брахидактилия (укорочение пальцев рук или ног) [167]. Может развиться резистентность к другим гормонам, воздействующим через Gs, например к тиреотропному гормону (ТТГ) и соматотропному-рилизинг гормону. Напротив, мутации GNAS, унаследованные от отца, вызывают псевдопсевдогипопаратиреоз, который характеризуется фенотипом НОО, но без ожирения, нейрокогнитивных аномалий и резистентности к гормонам. Для псевдогипопаратиреоза Ib типа характерны дефекты метилирования GNAS, которые приводят к резистентности к ПТГ, а иногда и к ТТГ [167–169]. Аутосомно-доминантный псевдогипопаратиреоз Ib типа может быть вызван материнскими делециями экзонов AS3–4 GNAS и/или NESP (который кодирует нейроэндокринный секреторный протеин 55 [NESP55; часть общего локуса GNAS]) или близлежащего гена синтаксина 16 (STX16), но молекулярный дефект наиболее распространенной спорадической формы заболевания до сих пор неизвестен. Аномалии кодирующей области GNAS также приводят к развитию псевдогипопаратиреоза Iс типа, который клинически схож с Iа типом, хотя активность Gs и не изменяется in vitro [170]. В отличие от пациентов с псевдогипопаратиреозом Iа и IIb типов, у которых ответ цАМФ на ПТГ притупляется, у пациентов с псевдогипопаратиреозом II типа отмечается обычный ответ. Псевдогипопаратиреоз II типа в некоторых случаях может развиваться при дефиците витамина D [171]. Поскольку в дистальном почечном канальце Gs экспрессируется обоими аллелями, реабсорбция кальция в дистальных трубочках нормальная, и у пациентов с псевдогипопаратиреозом отсутствует риск нефрокальциноза. Лечение резистентности к ПТГ при псевдогипопаратиреозе состоит из активных форм витамина D и препаратов кальция, но цели отличаются от таковых при гипопаратиреозе. В данном случае это нормализация уровня кальция в крови и поддержание уровня ПТГ в нормальном или в незначительно превышающем норму диапазоне. Необходим регулярный контроль показателей крови и периодическое исследование экскреции кальция с мочой.
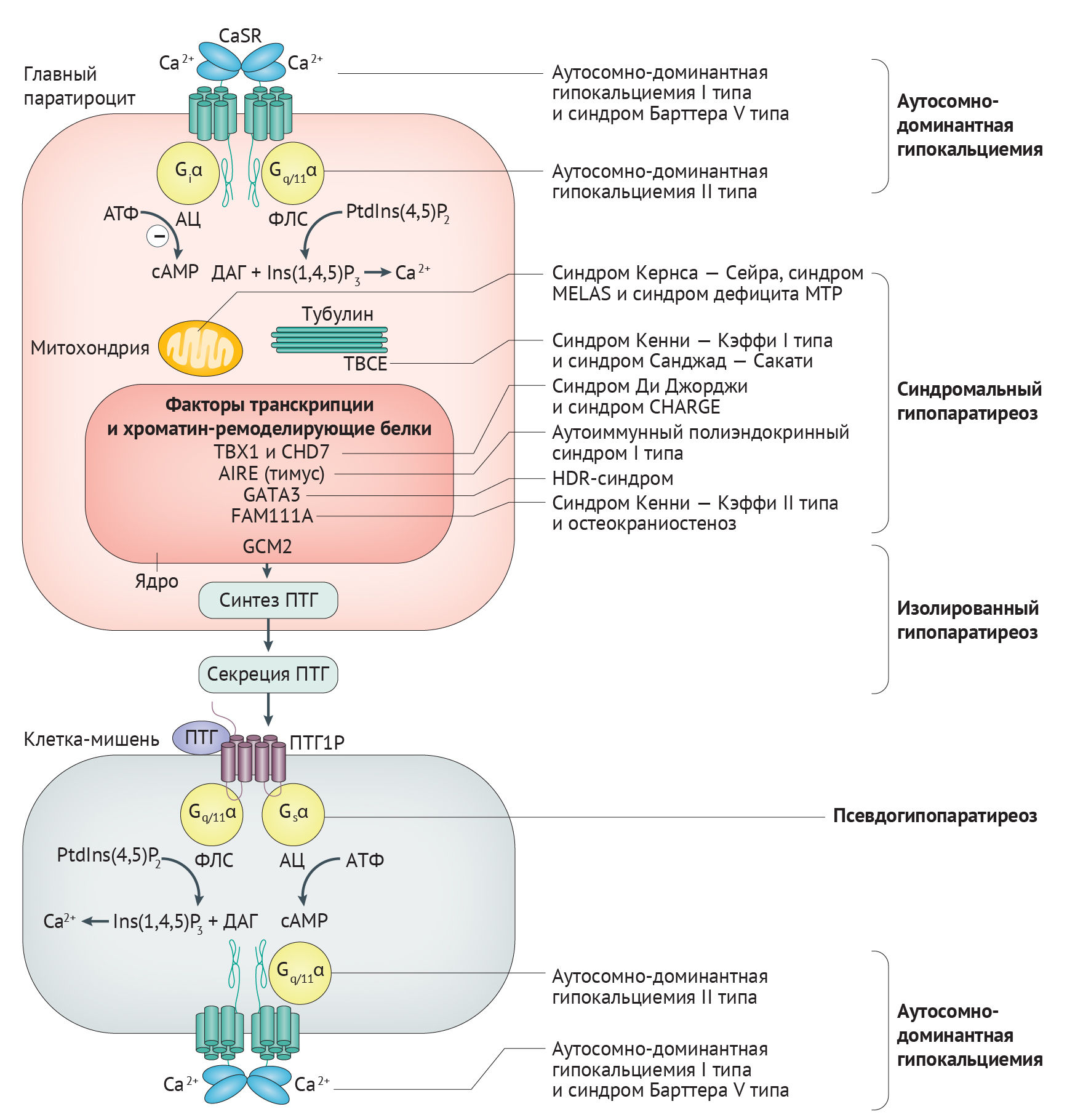
AIRE — аутоиммунный регулятор; CHD7 — хромодомен ДНК-связывающей геликазы 7; DAG — диацилглицерол; GATA3 — GATA-связывающий фактор 3; GCM2 — гомолог отсутствия глиальных клеток 2; HDR — гипопаратиреоз, нейросенсорная глухота и аномалии почек; MELAS — митохондриальная энцефаломиопатия с лактатацидозом и инсультоподобными эпизодами; MTP — митохондриальный трифункциональный белок; TBCE — тубулин-специфический шаперон E; TBX1 — фактор транскрипции T-box, brain 1
Синдром Ди Джорджи. Синдром Ди Джорджи встречается примерно у 60 % детей с проявлениями гипопаратиреоза [30]. Синдром включает гипопаратиреоз, пороки развития выходных отделов сердца, дисморфизм лица, психические заболевания, дисфункцию неба и гипоплазию тимуса [31]. Синдром Ди Джорджи чаще всего развивается в результате гетерозиготной микроделеции 3 миллионов пар оснований в хромосоме 22q11.2 [31], обозначается как I тип синдрома Ди Джорди (также известен как синдром делеции 22q11.2) (табл. 1). Область делеции захватывает ген TBX1, кодирующий фактор транскрипции T-box, brain 1 (белок TBR1), участвующий в развитии паращитовидных желез и тимуса из эмбриональной глоточной области (рис. 2, 3) [32]. Аномалии в функционировании ТВХ1 объясняют все основные фенотипические черты синдрома Ди Джорджи I типа [33].
Таблица 1 | Наследственные формы гипопаратиреоза
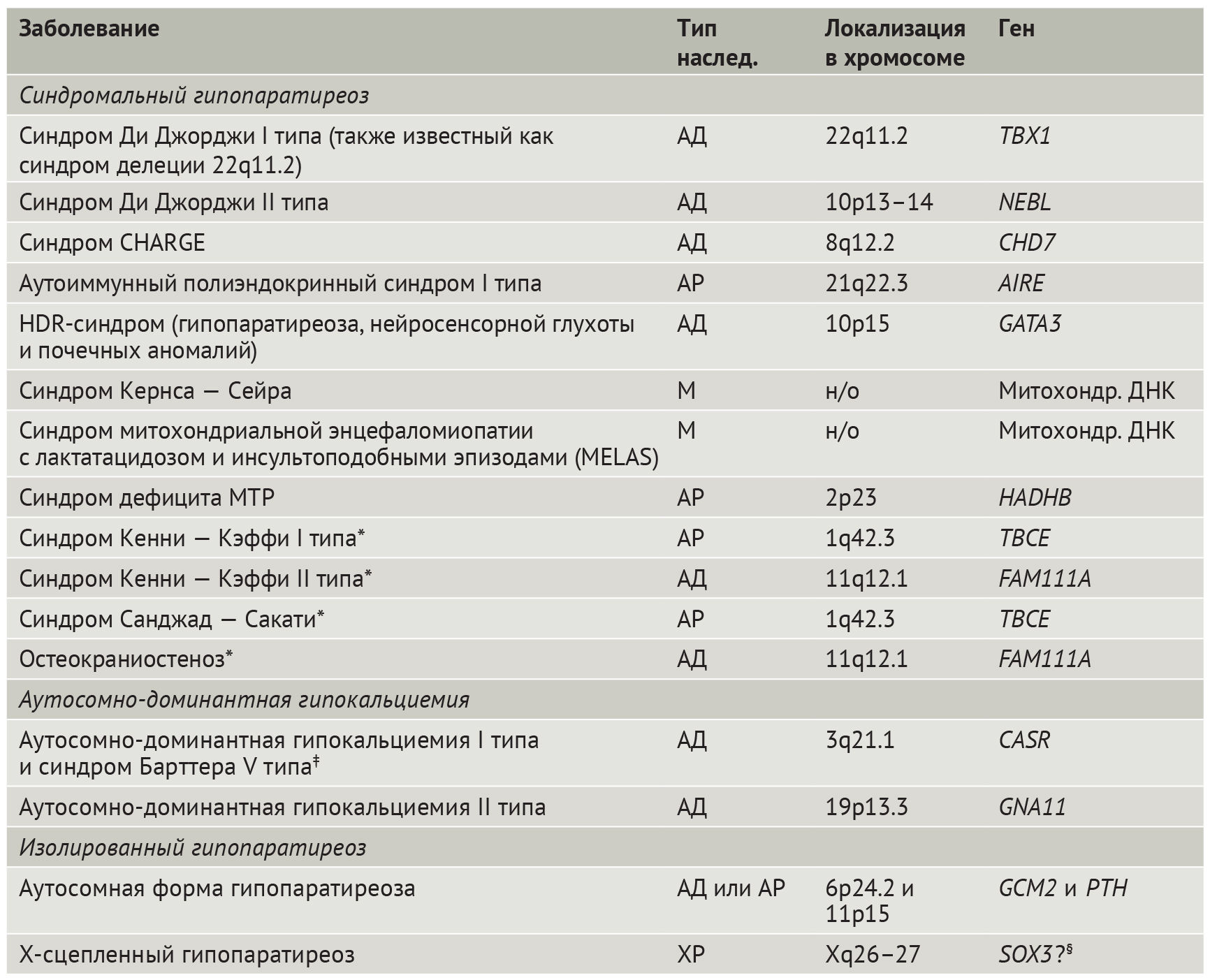
АД — аутосомно-доминантный; АР — аутосомно-рецессивный; М — по материнской линии; н/о — не определено; ПТГ — паратиреоидный гормон; ХР — Х-сцепленный рецессивный.
*Дисплазия костей и низкий рост.
‡ Синдром Барттера V типа — это разновидность аутосомно-доминантной гипокальциемии I типа.
§ Роль гена SOX3 в развитии Х-сцепленного гипопаратиреоза неизвестна.
У некоторых пациентов встречается делеция короткого плеча хромосомы 10, обозначенная как синдром Ди Джорджи II типа [19]. Вероятно, за это расстройство ответственна делеция гена, кодирующего актин-связывающий белок небулин (NEBL) (табл. 1) [34], но как дефицит NEBL сказывается на развитии гипопаратиреоза, пока неясно.
Также у некоторых пациентов с синдромом Ди Джорджи встречаются признаки, характерные для синдрома CHARGE: колобома (расщепление одной или нескольких структур глаза), аномалии развития сердца, атрезия хоан (врожденная аномалия носового дыхания), замедление роста и аномалии мочеполовой системы и/или слуха [35]. CHARGE-синдром развивается в результате гетерозиготных мутаций в хромодомене ДНК-связывающей хеликазы 7 (CHD7) (табл. 1) [35], которая экспрессируется клетками глоточной эктодермы [36] и, возможно, играет роль в развитии глоточной области.
Аутоиммунный полиэндокринный синдром I типа. Аутоиммунный полиэндокринный синдром I типа, который также называют синдромом аутоиммунной полиэндокринопатии, кандидоза и эктодермальной дистрофии, представляет собой аутосомно-рецессивное заболевание, которое характеризуется иммунодефицитом и аутоиммунной деструкцией таких эндокринных органов, как паращитовидные железы, кора надпочечников и яичников (рис. 2, табл. 1) [37]. Аутоиммунный полиэндокринный синдром I типа вызывают мутации в аутоиммунном регуляторе (AIRE). Белок AIRE экспрессируется эпителиальными клетками мозгового вещества тимуса [38] и способствует развитию иммунологической толерантности к собственным антигенам путем удаления клонов аутореактивных Т-клеток в тимусе [39]. Клинически аутоиммунный полиэндокринный синдром I типа определяется наличием как минимум двух компонентов триады, которая включает кандидоз кожи и слизистых (инфицирование Candida spp. кожи, слизистых оболочек или ногтей), гипопаратиреоз и недостаточность коры надпочечников [40]. Однако заболевание также может быть ассоциировано с разнообразными аутоиммунными нарушениями, такими как гонадная недостаточность, алопеция, пернициозная анемия, витилиго и сахарный диабет I типа, а может проявляться лишь изолированным гипопаратиреозом [41]. У пациентов могут быть такие признаки эктодермальной дистрофии, как гипоплазия зубной эмали [42], а также повышенный риск развития рака полости рта [43].
Синдром гипопаратиреоза, нейросенсорной глухоты и почечных аномалий. Синдром гипопаратиреоза, нейросенсорной глухоты и почечных аномалий (HDR-синдром) — это аутосомно-доминантное заболевание, при котором у пациентов часто развивается гипокальциемия при неопределяемой, низкой или необъяснимо нормальной концентрации ПТГ в сыворотке крови [44, 45]. Кроме этого, HDR-синдром ассоциирован с билатеральной симметричной нейросенсорной глухотой и почечными аномалиями, которые в основном представлены кистами, сдавливающими клубочки и канальцы, что приводит к развитию почечной недостаточности [45]. Причиной развития HDR-синдрома являются гетерозиготные мутации в GATA-связывающем факторе 3 (GATA3) [46] у зародыша (табл. 1). Этот транскрипционный фактор, имеющий два домена типа «цинковые пальцы», опосредует экспрессию ПТГ (рис. 2) и участвует в эмбриональном развитии общих зачатков паращитовидных желез и тимуса (рис. 3) [47–50].
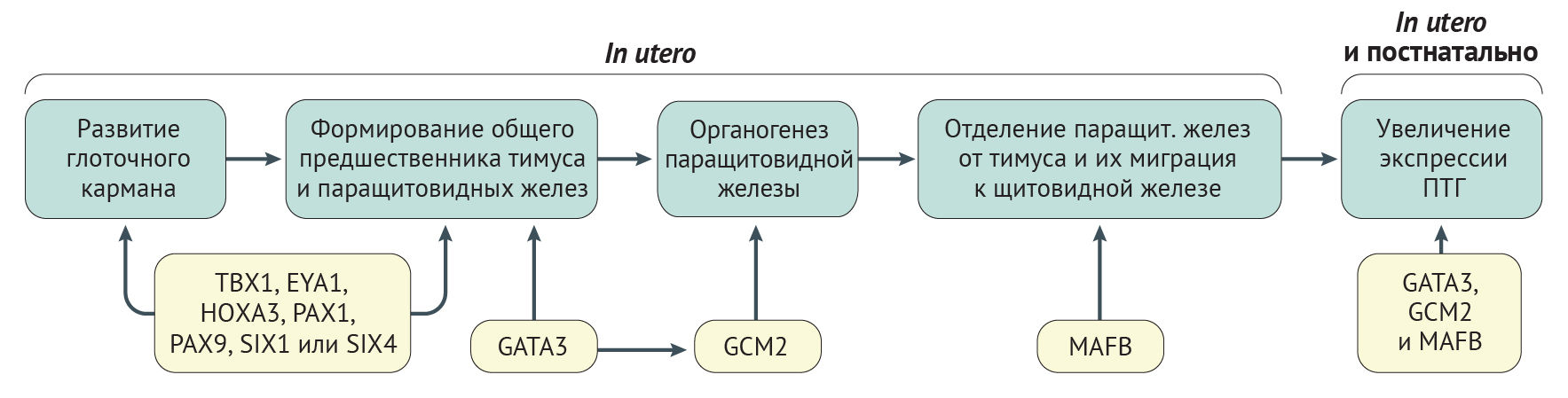
EYA1 — гомолог отсутствия глаз 1; HOXA3 — гомеобокс A3; PAX — белок, содержащий парный домен; SIX (Sine oculis homeobox homologue) — гомолог Sine oculis (so) Drosophila melanogaster c гомеобоксом.
Митохондриальные заболевания, ассоциированные с гипопаратиреозом. Поступали сообщения о развитии гипопаратиреоза при трех заболеваниях, ассоциированных с митохондриальной дисфункцией: синдроме Кернса — Сейра, синдроме митохондриальной энцефаломиопатии с лактатацидозом и инсультоподобными эпизодами (MELAS), а также при синдроме дефицита митохондриального трифункционального белка (mitochondrial trifunctional protein, МТР) (рис. 2, табл. 1) [51–53]. Синдром Кернса — Сейра характеризуется прогрессирующей периферической офтальмоплегией (паралич глазных мышц) и пигментной ретинопатией, которые развиваются в возрасте менее 20 лет [52]. Делеции, дупликации и миссенс-мутации в митохондриальной ДНК приводят к развитию синдрома Кернса — Сейра и MELAS-синдрома [19, 30, 51], тогда как синдром дефицита МТР развивается в результате нарушения окисления жирных кислот в митохондриях. Синдром дефицита MTP ассоциирован с кардиомиопатией, периферической нейропатией, пигментной ретинопатией и дисфункцией печени и вызван мутациями в гене НADHB, который кодирует β-субъединицу трифункционального фермента [53]. Остается непонятным механизм (или механизмы), который приводит к гипопаратиреозу при этих митохондриальных заболеваниях.
Наследственные костные дисплазии, ассоциированные с гипопаратиреозом. Гипопаратиреоз встречается более чем у 50 % пациентов с синдромом Кенни — Кэффи [19], который также характеризуется низким ростом и остеосклеротической дисплазией костей. Синдром Кенни — Кэффи может наследоваться как аутосомно-рецессивное (тип I) или доминантное (тип II) заболевание [19]. Синдром Санджад — Сакати, который также известен как синдром гипопаратиреоза, задержки развития и дисморфизма, распространен в популяциях на Ближнем Востоке и имеет фенотип, схожий с синдромом Кенни — Кэффи [54]. Синдром Санджад — Сакати и синдром Кенни — Кэффи I типа вызваны мутациями в гене тубулин-специфичного шаперона Е (ТВСЕ) [55], который кодирует белок шаперона, необходимый для правильного фолдинга субъединиц α-тубулина [55] и играет главную роль в миграции паращитовидной железы [56]. Синдром Кенни — Кэффи II типа развивается в результате гетерозиготной миссенс-мутации в гене А семейства со сходством последовательностей, равным 111 (FAM111A), который кодирует белок, участвующий в репликации ДНК и созревании хроматина, а также может принимать участие в эмбриональном развитии [57, 58]. Было продемонстрировано, что мутация гена FAM111A Ser342del вызывает ассоциированную с гипопаратиреозом скелетную дисплазию, характеризующуюся хрупкостью костей (остеокраниостеноз) и приводящую к гибели в перинатальном периоде (рис. 2, табл. 1) [58].
Аутосомно-доминантная гипокальциемия. Аутосомно-доминантные гипокальциемии I и II типов представляют собой генетически отличающиеся заболевания, которые, как оказалось, связаны с герминативными мутациями белков CaSR и G11α соответственно (рис. 2, табл. 1) [15, 59, 60]. Для I типа, который является наиболее распространенным типом аутосомно-доминантной гипокальциемии, характерна гипокальциемия, изменения уровней ПТГ от неопределяемого до нормального и повышение экскреции кальция, которое может привести к выраженной гиперкальциурии даже при низких сывороточных концентрациях кальция [15, 60–62]. Эктопические кальцификаты в почках или базальных ганглиях образуются примерно у 35 % пациентов с аутосомно-доминантной гипокальциемией I типа [15, 60, 63]. У некоторых пациентов с гипокальциемией I типа, которая связана с мутациями CaSR, может также развиваться Барттер-подобный синдром (синдром Барттера V типа), который характеризуется гипокальциемическим алкалозом, ренальной потерей солей и гиперренинемическим гиперальдостеронизмом вместе с гипокальциемией и гипопаратиреозом [15, 64]. Аутосомно-доминантная гипокальциемия II типа имеет сходный с I типом биохимический фенотип сыворотки крови [59, 65, 66], но, как правило, менее выраженные клинические проявления со стороны почек — значительно меньшую экскрецию кальция с мочой [67]. Кроме того, у некоторых пациентов отмечается низкорослость, которая вызвана задержкой роста в постнатальном периоде [67, 68].
Аутосомные формы гипопаратиреоза. Гомолог отсутствия глиальных клеток 2 (GCM2) — паратиреоид-специфический фактор транскрипции (рис. 2), который играет решающую роль во внеклеточном гомеостазе кальция, способствуя развитию паращитовидных желез [47, 48, 69] и взаимодействуя с факторами транскрипции GATA3 и MAFB, которые повышают экспрессию ПТГ (рис. 3) [49, 50] . Герминативные мутации GCM2 (табл. 1) часто ассоциированы с тяжелой гипокальциемией и сывороточными концентрациями ПТГ от низких до неопределяемых [70]. Гомозиготные мутации GCM2 вызывают аутосомно-рецессивную форму изолированного гипопаратиреоза, нарушая локализацию в ядре, связывание с ДНК и/или трансактивационные свойства фактора транскрипции GCM2 [70], тогда как гетерозиготные мутации GCM2 приводят к развитию аутосомно-доминантного гипопаратиреоза, оказывая доминантно-негативный эффект на трансактивационные свойства GCM2 [71, 72].
Герминативные аномалии гена PTH — редкая причина аутосомно-доминантных и рецессивных форм изолированного гипопаратиреоза (табл. 1). Эти аномалии, к которым относятся нонсенс- и миссенс-мутации или мутации в сайтах сплайсинга, в основном воздействуют на экзон 2 (кодирует область сигнального пептида — препроПТГ(1–115) пептида) и предположительно нарушают биосинтез и секрецию ПТГ (рис. 2) [19, 73–75]. Недавно в семье со случаями аутосомно-рецессивной формой гипокальциемии была идентифицирована мутация, воздействующая на зрелый пептид ПТГ(1–84), и было показано, что в результате нарушалась связь ПТГ с рецептором PTH1R75 [75]. В зависимости от типа используемого анализа ПТГ, у больных членов семьи были определены высокие или низкие уровни ПТГ в плазме крови. Затем была обнаружена мутация (Arg25Cys), которая препятствовала проведению некоторых иммунохимических анализов, где использовались антитела к ПТГ(1–34) и к фрагментам ПТГ(13–34). Это объясняет, почему некоторые тест-системы не могли обнаружить мутантный пептид ПТГ [75].
Х-сцепленный рецессивный гипопаратиреоз. Х-сцепленный рецессивный гипопаратиреоз развивается только у мужчин и ассоциирован с развитием гипокальциемических судорог у младенцев [76]. Были определены молекулярные делеции и инсерции, затрагивающие хромосомы 2p25 и Xq27, также эти структурные изменения могут изменить экспрессию близлежащего гена SOX3 (табл. 1) [77, 78]. SOX3 кодирует высокомобильный групповой фактор транскрипции, который экспрессируется паращитовидными железами во время эмбриогенеза и может играть некоторую роль в развитии паращитовидных желез из глоточных карманов (рис. 3) [77].
Другие причины гипопаратиреоза
В некоторых случаях изолированного гипопаратиреоза, когда другие причины не удается установить, также предполагается аутоиммунная этиология разрушения паращитовидных желез. Не существует формальных диагностических критериев и утвержденных лабораторных тестов, которые могли бы быть использованы для постановки этого диагноза. К функциональному гипопаратиреозу также может привести тяжелая и длительная гипомагниемия [79, 80]. Редко причиной гипопаратиреоза могут стать такие инфильтративные заболевания как гемохроматоз, болезнь Вильсона и опухолевые метастазы [2]. Считается, что в этом случае механизм связан с ингибированием функции клеток паращитовидных желез железом (первичный избыток железа при гемохроматозе и вторичный при переливаниях крови больным талассемией [группа наследственных болезней крови в основе которых лежит продукция аномального гемоглобина]), медью (болезнь Вильсона — Коновалова) и замещением функциональной ткани паращитовидных желез опухолевыми клетками. Несмотря на то, что были описаны случаи гипопаратиреоза, индуцированного облучением, эта этиология очень редка [2].
Диагностика, скрининг и профилактика
Клинические проявления
Клинические проявления гипопаратиреоза крайне разнообразны и могут возникать со стороны различных органов и систем (рис. 4). Классические симптомы гипопаратиреоза — это повышение нервно-мышечной проводимости вследствие гипокальциемии. Другие проявления могут быть вызваны эпизодами гиперкальциемии и гиперфосфатемии (например, внескелетные кальцификаты), но происхождение некоторых симптомов (например, психических) пока недостаточно понятно [2].
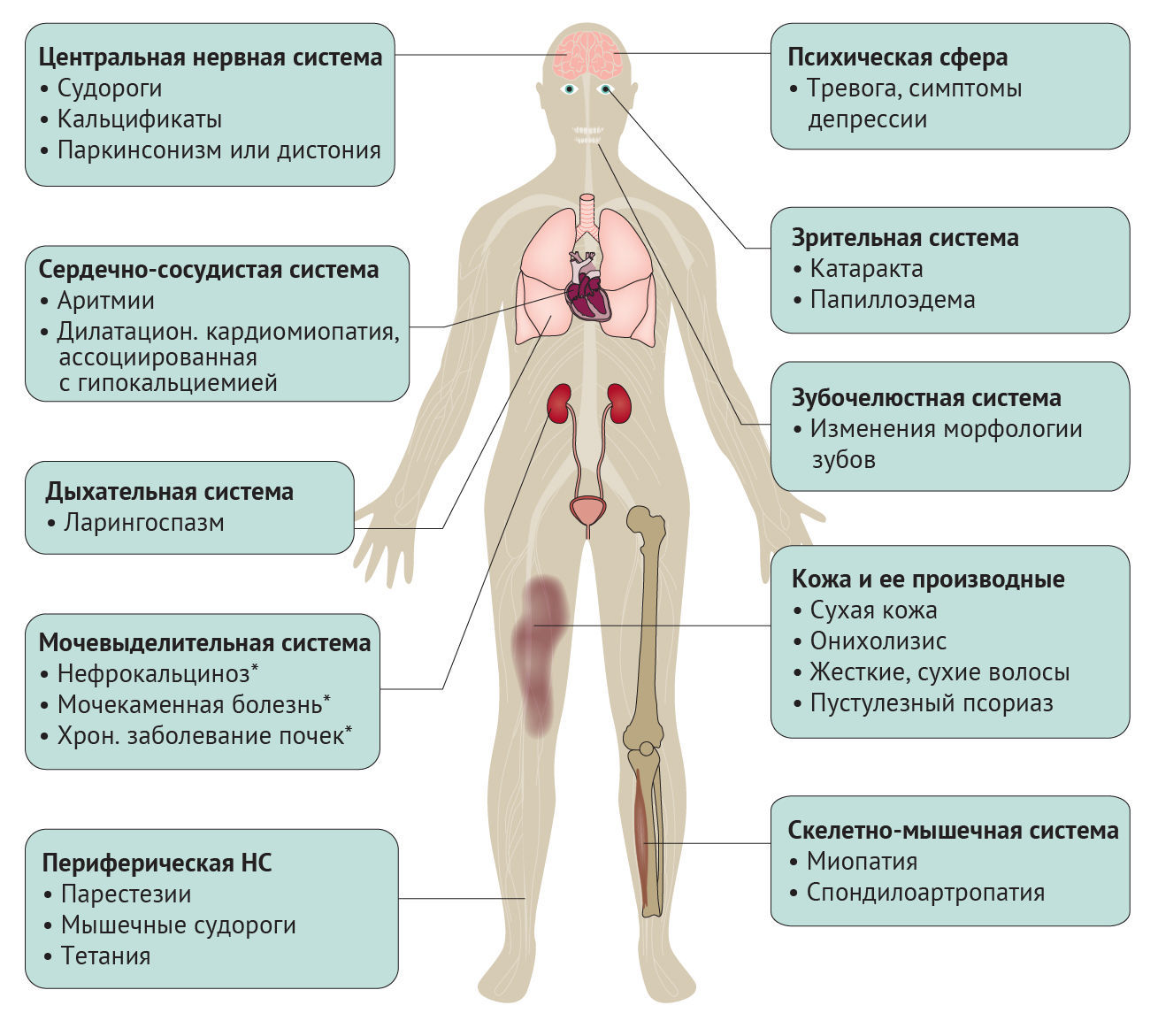
Периферическая нервная система. Гипокальциемия индуцирует частичную деполяризацию покоящейся мембраны нейрона, тем самым повышая вероятность запуска потенциала действия [81]. Это приводит к повышению нервно-мышечной проводимости — ключевого симптома гипокальциемии любой этиологии. Повышение чувствительности сенсорного нейрона проявляется как парестезия в конечностях и периоральной и оральной областях. Повышение проводимости в двигательных нейронах может проявляться развитием мышечных спазмов или тетании, варьируя от классического карпопедального спазма (спазм мышц предплечья, кисти, нижней конечности и/или стопы) до жизнеугрожающего ларингоспазма [82, 83]. Повышение нервно-мышечной проводимости можно распознать с помощью симптомов Хвостека (ипсилатеральное подергивание мышц лица при нажатии в области точек выхода лицевого нерва) и Труссо (сокращение мышц руки при раздувании манжеты тонометра до значений, превышающих систолическое давление на 3 минуты и более) [84].
Центральная нервная система. При тяжелой гипокальциемии возможно развитие фокальных или генерализованных (тонико-клонического типа) судорожных приступов. Хотя ранее у пациентов с гипопаратиреозом часто развивались судороги, в двух недавних исследованиях они отмечаются лишь у 4–8 % пациентов [13, 85]. Возможными объяснениями могут быть как систематическая ошибка отбора в ранних исследованиях, так и лучших контроль уровней сывороточного кальция в последующих исследованиях.
Кальцификаты в центральной нервной системе (рис. 5a, b) — обычная находка у пациентов с гипопаратиреозом, распространенность которой в двух когортах средней величины в США и Индии составила 52–74 % [85, 86]. Кальцификаты чаще всего встречаются в базальных ганглиях, но могут возникать и в сером, и в белом веществе, в паренхиме мозжечка, в таламусе и зубчатых ядрах. Хотя точная причина возникновения кальцификатов не ясна, их прогрессия была независимо ассоциирована с уменьшением соотношения кальция и фосфата в сыворотке крови, что позволяет предположить, что изменения метаболизма фосфата могут играть ключевую роль в образовании эктопических кальцификатов [86]. Примечательно, что два гена (натрий-зависимый фосфатного транспортера 2 [PIT2, также известный как SLC20А2] и ксенотропного и политропного ретровирусного рецептора 1 [XPR1]) оказались ассоциированы с семейной идиопатической кальцификацией базальных ганглиев (также известной как синдром Фара), кодируя белки, участвующие в транспорте фосфатов, что поддерживает гипотезу о роли аномального гомеостаза фосфатов в развитии эктопической кальцификации при хроническом гипопаратиреозе [87, 88]. Клиническая значимость кальцификатов центральной нервной системы, наблюдаемых у пациентов с длительным течением гипопаратиреоза, остается не ясной. К симптомам относятся паркинсонизм (неврологическое двигательное расстройство, которое характеризуется тремором, брадикинезией, ригидностью и постуральной нестабильностью) и дистония (неврологическое двигательное расстройство, ассоциированное с выгибаниями или аномальными фиксированными позами), отмечаемые при гипопаратиреозе, но встречающиеся гораздо реже, чем кальцификация базальных ганглиев [85, 86, 89]. Кроме того, противоречива связь между масштабом и локализацией кальцификатов и неврологической симптоматикой [90, 91].
Сердечно-сосудистая система. При гипопаратиреозе редко развиваются аритмии. У некоторых пациентов с хронической гипокальциемией, ассоциированной с гипопаратиреозом, отмечалось удлинение скорректированного интервала QT на ЭКГ наряду с заметными аномалиями зубцов U и Т [92]. Однако большинство из этих симптомов быстро исчезает после устранения гипокальциемии. Дилатационная кардиомиопатия, ассоциированная с хронической тяжелой гипокальциемией, обычно также исчезает после лечения [93]. Тем не менее, в недавнем обзоре клинического случая тяжелой гипокальциемии у младенца, предполагался необратимый компонент дилатационной кардиомиопатии, ассоциированной с гипокальциемий [94]. Несмотря на многочисленные сообщения о случаях, распространенность кардиомиопатии в когортах пациентов с гипотиреозом очень низка, что свидетельствует о наличии подгруппы уязвимых пациентов, факторы риска для которых пока не определены [13, 85].
Почки. Как правило, гипопаратиреоз обычно не ассоциирован с почечной недостаточностью даже среди пациентов с функциональными мутациями CASR, для которых при отсутствии лечения характерно развитие гиперкальциурии [63, 95]. Однако традиционная терапия гипопаратиреоза препаратами кальция и активными метаболитами витамина D обычно приводит к повышению экскреции кальция с мочой, поскольку угнетает его ПТГ-опосредованную реабсорбцию в дистальных канальцах нефрона. Развивающаяся в результате гиперкальциурия может стать причиной нефрокальциноза и камней в почках (рис. 5с). По имеющимся данным, частота нефрокальциноза у пациентов с гипопаратиреозом, находящихся на лечении препаратами кальция или витамином D, составляет 12–57 % [63, 96, 97]. В крупном датском исследовании типа «случай-контроль» соотношение рисков образования камней в почках составило 4,82 (95 %; ДИ 2,00–11,64) для пациентов с послеоперационным гипопаратиреозом [13]. При традиционном лечении гипопаратиреоза у пациентов повышается риск хронической болезни почек. В когорте из США [85] у 41 % пациентов скорость клубочковой фильтрации (СКФ) составила < 60 мл/мин/1,73 м² (при норме СКФ ≥ 90 мл/мин/1,73 м²), что в 2–17 раз превышало нормальные значения. В двух датских исследованиях типа «случай-контроль» [8, 13] соотношение рисков для диагностированной почечной недостаточности составляло 3,1 (95 % ДИ: 1,73–5,55) и 6,01 (95 % ДИ: 2,45–14,75) для пациентов с послеоперационным и нехирургическим гипопаратиреозом соответственно, в сравнении с контрольной группой того же возраста.
Скелетно-мышечная и зубочелюстная системы. Гипопаратиреоз ассоциирован с ослаблением ремоделирования кости (активный процесс, объединяющий образование кости и ее резорбцию), которое сочетается с нормальной или повышенной минеральной плотностью кости и деформацией микроархитектуры кости [98, 99]. Уменьшение процессов формирования кости подтверждается выраженным снижением числа тетрациклиновых меток в костных биоптатах в сравнении с контролем [100–102]. Частота активации (показывает, сколько раз в год на определенном участке кости происходит остеогенез) снижается на 50–80 % у пациентов с гипопаратиреозом в сравнении с контрольной группой. В дополнение к общему ослаблению ремоделирования кости, снижается глубина и количество резорбционных углублений, что говорит об ослаблении резорбции кости. Скорость остеогенеза, поверхность и ширина остеоида (неминерализованного костного матрикса) постепенно и значительно уменьшаются. Снижение скорости костеобразования отражается в снижении уровней минерализации поверхности и аппозиции минералов. При гипопаратиреозе ослабление ремоделирования костной ткани приводит к ситуации, когда после завершения каждого цикла ремоделирования костная ткань в большей степени осаждается, а не удаляется [99]. Это наблюдение объясняет увеличение минеральной плотности кости и толщины коркового слоя, о которых сообщалось в некоторых исследованиях. Данные скелетные аномалии обнаруживаются в трабекулярной и кортикальной костной ткани, а изменения подтверждаются в ходе микроКТ костных биоптатов [103, 104]. У пациентов с гипопаратиреозом нехирургической этиологии может поражаться зубочелюстная система, что сопровождается укорочением корней, гипоплазией эмали и гипоплазией или полным отсутствием зубов [105, 106].
Остается неясной связь ассоциированных с гипопаратиреозом скелетных аномалий и остеопороза. В датском исследовании типа «случай-контроль» [8, 13] в сравнении с общей популяцией не было обнаружено различий в частоте переломов. Анализ конкретных типов переломов показал, что у пациентов с нехирургическим гипопаратиреозом повышен риск переломов верхних конечностей в сравнении с контрольной группой (1,94; 95 % ДИ 1,31–2,85), а также что у пациентов с послеоперационным гипопаратиреозом риск подобных переломов ниже (0,69; ДИ 0,49–0,97) [9]. В некоторых сообщениях о случаях заболевания гипопаратиреоз также ассоциировался со спондилоартропатией, для которой характерна оссификация связок и образование синдесмофитов [107]. В одной небольшой серии случаев сообщалось о наличии клинически очевидной спондилоартропатии у 3 из 40 пациентов с гипопаратиреозом, причем радиологические изменения были идентифицированы у 14 из 40 [108].
Для миопатии скелетных мышц характерны высокие уровни креатинфосфокиназы и гистологические аномалии в биоптатах мышц; миопатия также наблюдается при гипопаратиреозе и, видимо, опосредована тяжелой гипокальциемией [109, 110]. У пациентов с гипопаратиреозом в сравнении с контрольной группой, схожей с ними по возрасту и полу, значительно снижается мышечная сила и максимальное мышечное усилие, а также им требуется больше времени для выполнения тестов на физические функции [111].
Зрительная система. Гипопаратиреоз ассоциирован с высоким риском катаракты, распространенность которой составляет 27–55 % [112–114]. В датском исследовании типа «случай-контроль» нехирургический гипопаратиреоз был ассоциирован с повышенным риском (95 % ДИ 2,13–8,34) в сравнении с контрольной группой, но риск катаракты у пациентов с послеоперационным гипопаратиреозом не отличался существенным образом от риска в общей популяции. Это свидетельствует о том, что возраст начала заболевания и/или длительность течения гипопаратиреоза являются важными факторами [8, 13]. В недавнем исследовании типа «случай-контроль» пациентов с катарактой, лица с гипопаратиреозом были значительно младше обычных пациентов с этим заболеванием, а также имели признаки более тяжелого поражения задней капсулы хрусталика (мембраны, которая окружает хрусталик) и большую скорость поражения передней капсулы [114]. Кроме того, преимущественно гипопаратиреоз ассоциирован с кортикальной катарактой (постепенное помутнение, начинающееся с периферии хрусталика), тогда как «возрастные» катаракты преимущественно являются ядерными (постепенное помутнение центральной части хрусталика) [113]. Этиология катаракты неизвестна, но доклинические исследования показывают, что она может быть следствием хронической гипокальциемии [115]. Папиллоэдема (отек соска диска зрительного нерва из-за повышенного внутричерепного давления) также может наблюдаться у пациентов с гипопаратиреозом и обычно улучшается после коррекции гипокальциемии [116].
Кожа и ее производные. Гипопаратиреоз воздействует на кожу и ее производные. Обычно отмечается сухость, шелушение кожи, а ногти зачастую становятся ломкими, происходит онихолизис (отделение ногтя от ногтевого ложа) [117]. Волосы на волосистой части головы, в подмышечной области и на лобке могут быть волнистыми и тонкими [117]. В многочисленных клинических случаях описан редкий и тяжелый тип псориаза (генерализованный пустулезный псориаз, ассоциированный с пузырьковыми высыпаниями). Во всех случаях пустулезный псориаз был ассоциирован с тяжелой гипокальциемией, а его симптомы уменьшались после лечения гипокальциемии [118, 119].
Психическая сфера. Гипопаратиреоз ассоциирован с высоким риском психических заболеваний [120]. В датской когорте риск госпитализации по поводу психических расстройств, таких как депрессия или биполярное аффективное расстройство, был значительно выше у пациентов с послеоперационным (коэффициент рисков: 2,01; 95 % ДИ 1,16–3,50) и нехирургическим гипопаратиреозом (коэффициент рисков: 2,45; 95 % ДИ: 1,78–3,35) в сравнении с контрольной группой, сходной по возрасту и полу [9].
Диагностика
Для подтверждения клинического диагноза гипопаратиреоза необходимы биохимические исследования. Комбинация сывороточных уровней альбумина или ионизированного кальция ниже нормального уровня (< 8,5 мг/дл или 2,12 ммоль/л) и отсутствие, низкие или недостаточно адекватные уровни ПТГ во время гипокальциемии являются ключевыми признаками гипопаратиреоза и позволяют отличить гипопаратиреоз от других заболеваний, ассоциированных с гипокальциемией, как например псевдогипопаратиреоз (модуль 1). Следовательно, решающим для диагностического процесса является надежный анализ уровня ПТГ в сыворотке крови (модуль 2).
Биохимическая диагностика гипопаратиреоза в правильных клинических условиях обычно проста. Например, когда у пациента, имеющего в анамнезе операции на области шеи, отмечаются симптомы гипокальциемии и низкие уровни ПТГ, предполагается гипопаратиреоз. Однако уровни ПТГ у таких пациентов могут быть в пределах нормы. Аналогично диагностике гиперпаратиреоза, у пациентов с гипопаратиреозом уровень ПТГ следует учитывать относительно уровня кальция в той же пробе сыворотки. У пациентов с гипокальциемией уровни ПТГ, находящиеся в пределах нормального лабораторного диапазона, неинформативны, поскольку они повышались бы, если бы функция паращитовидных желез оставалась нормальной. У пациентов с семейным анамнезом гипопаратиреоза и у детей с нехирургическим гипопаратиреозом следует рассматривать возможность поиска генетического дефекта после соответствующего дотестового консультирования и информированного согласия.
Модуль 2 | Измерение уровней ПТГ в сыворотке крови
К циркулирующим формам паратиреоидного гормона относятся полноразмерные активные пептиды ПТГ (1–84) и несколько усеченных форм, преимущественно карбоксильных терминальных фрагментов, большинство из которых представлено ПТГ(34–84) и ПТГ(37–84) [172, 173]. Усеченные фрагменты не могут связываться с классическим рецептором ПТГ1 (ПТГ1Р) и активировать его. Хотя период полураспада интактного плазменного ПТГ (1–84) составляет всего несколько минут, почечный клиренс фрагментов ПТГ гораздо медленнее. Таким образом, в условиях нормокальциемии лишь 20 % пептидов ПТГ являются интактным, биологически активным ПТГ [174]. Для повышения клинической эффективности первого поколения исследований ПТГ [175], которые определяли не только интактный ПТГ, но и его усеченные фрагменты, в 1987 году был предложен метод иммунорадиометрического анализа с двойными антителами (IRMA) [164]. В этом анализе типа «сэндвич» используется иммобилизованное антитело к С-концевой аминокислоте, связанное с твердой фазой, и идентифицирующее антитело к N-концевой аминокислоте, что делает измерение ПТГ (1–84) более точным. Этот анализ второго поколения, который не определяет большинство С-концевых фрагментов, на сегодняшний день является наиболее распространенным исследованием интактного ПТГ. В 1999 году было внедрено исследование ПТГ третьего поколения, названное анализом «цельного ПТГ» или «интактного ПТГ». В этом анализе используется иммобилизованное антитело к С-концевой аминокислоте, сходное с таковым в тестовых системах второго поколения, но детекторное антитело обнаруживает только крайний N-концевой участок ПТГ (то есть ПТГ (1–6)). Примечательно, несмотря на то, что теоретически этот тест лучше, это не доказано в клинической практике, поскольку число исследований ограничено [177, 178].
Мониторинг
Пациенты должны регулярно обследоваться на предмет потенциальных осложнений гипопаратиреоза (табл. 2, 3) [5, 6]. В дополнение к измерению уровней общего кальция и альбумина, или ионизированного кальция, биохимические тесты должны включать измерения уровней сывороточных фосфатов (для определения гиперфосфатемии), креатинина в крови, расчет СКФ для определения функции почек и концентрации магния в сыворотке крови, в особенности у пациентов с аутосомно-доминантной гипокальциемией. Уровень производных фосфата кальция должен быть не ниже 55 мг/дл, что позволит предотвратить кальцификацию почек [1, 5]. Эти целевые показатели производных фосфата кальция используются нефрологами у пациентов с хронической болезнью почек для снижения риска кальцификации артерий. Однако использование уровней производных фосфата кальция для прогнозирования риска кальцификации, которая может привести к почечной недостаточности, остается спорным и нуждается в дальнейшей оценке [121, 122]. Тем не менее, большинство экспертов учитывают уровни производных фосфата кальция при гипопаратиреозе и стремятся их снизить, если значения превышают установленный порог, каким бы неопределенным ни был этот порог.
Таблица 2 | Цели ведения больных с гипопаратиреозом согласно рекомендациям Европейского общества эндокринологов
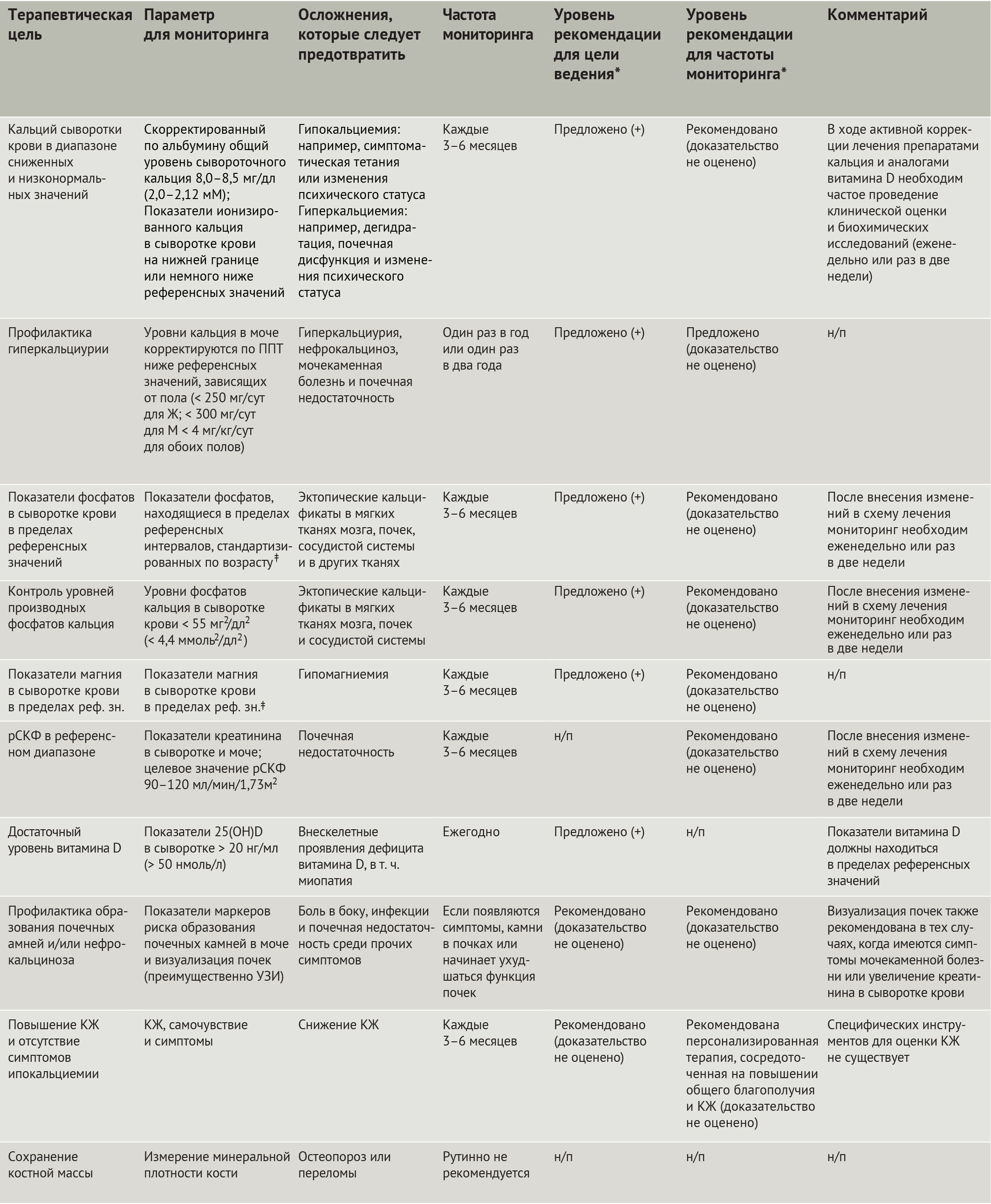
25(OH)D — 25-дигидроксивитамин D; ППТ — площадь поверхности тела; рСКФ — расчетная скорость клубочковой фильтрации; н/п — не предусмотрены; КЖ — качество жизни. *Классификация рекомендаций: рекомендовано (настоятельная рекомендация) и предложено (условная рекомендация), с градацией качества доказательств: высокое (++++), среднее (+++), низкое (++) и очень низкое (+) в соответствии с принципами Системы классификации, оценки, разработки и экспертизы рекомендаций (GRADE) [5]. ‡ Референсные значения могут незначительно отличаться в разных лабораториях.
Таблица 3 | Цели ведения больных с гипопаратиреозом согласно рекомендациям Первой Международной конференции по лечению гипопаратиреоза
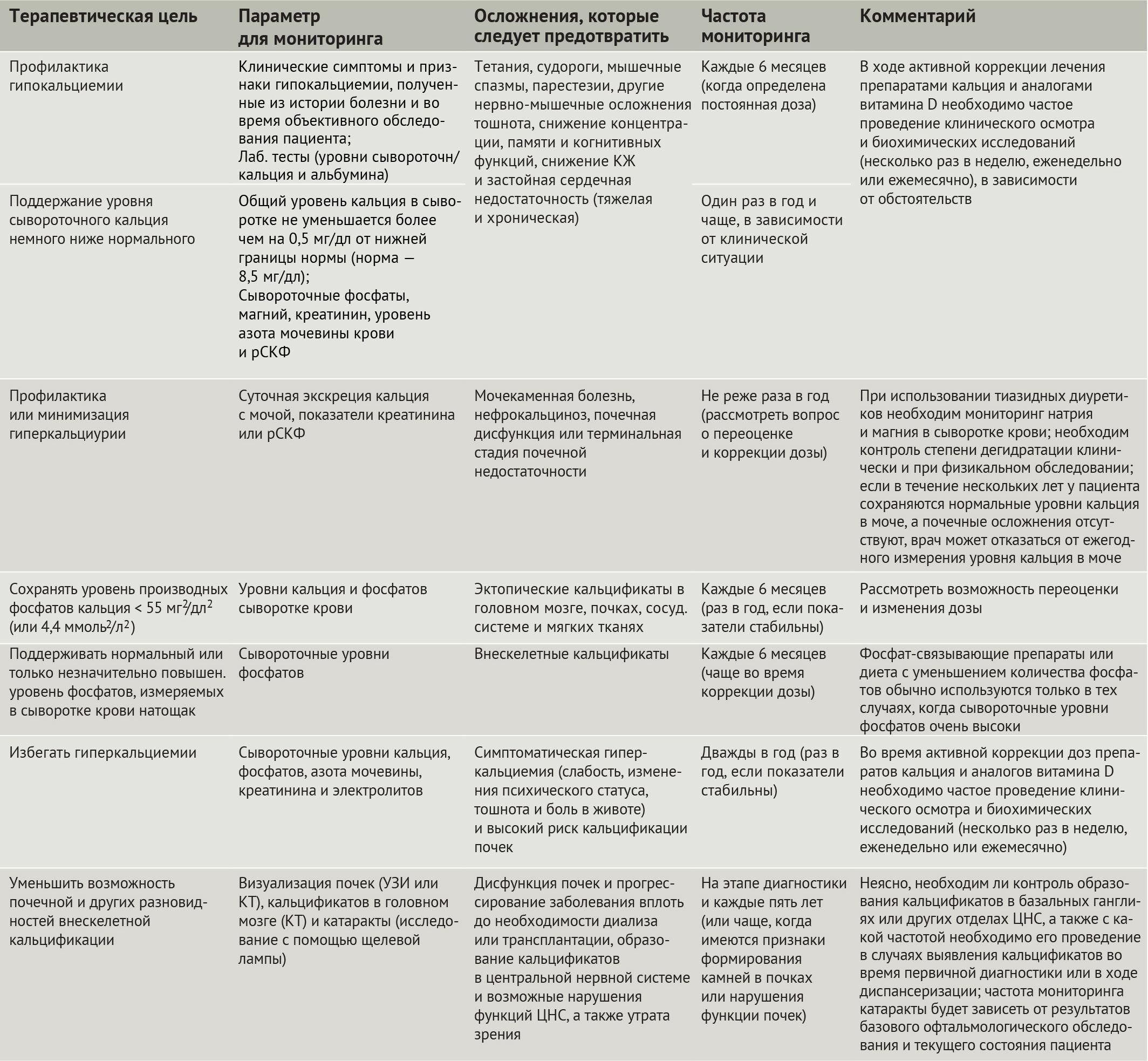
Гайдлайны Первой Международной конференции по лечению гипопаратиреоза [6]; рСКФ — расчетная скорость клубочковой фильтрации
У пациентов необходимо выяснить, имеются ли у них такие симптомы, как боль в боку или гематурия (для диагностики мочекаменной болезни), помутнение зрения (для определения катаракты) и психопатологические симптомы (например, для определения депрессии и тревожных расстройств), а также любые другие симптомы. Если симптомы имеются, они должны быть правильно оценены. Для контроля гиперкальциурии необходимо один раз в год проводить измерение кальция в суточной моче. Пациентам с большей склонностью к гиперкальциурии может потребоваться более частый мониторинг. У детей значения кальция в суточной моче должны быть скорректированы по массе или площади поверхности тела. Периодически необходимо проводить визуализацию почек [123], также если у пациента имеются симптомы мочекаменной болезни или если уровни креатинина в сыворотке крови начинают повышаться [5]. Ультразвуковое исследование почек является безопасным методом выявления ранних стадий нефрокальциноза и в одном из исследований показало себя лучше, чем КТ [124]. Поскольку традиционная терапия гипопаратиреоза ассоциирована со снижением ремоделирования кости, пациенты не слишком склонны к развитию остеопороза. Двухэнергетическое рентгеновское абсорбциометрическое сканирование (ДЭРА) для определения минеральной плотности кости не требуется у пациентов с гипопаратиреозом, но может выполняться в соответствии с клиническими рекомендациями по диагностике и мониторингу остеопороза (например, скрининг в группах риска). Из-за неопределенной клинической значимости кальцификатов в центральной нервной системе визуализация мозга с использованием КТ должна выполняться только в случае необъяснимых неврологических проявлений [5, 123].
Скрининг
Поскольку большинство случаев гипопаратиреоза являются послеоперационными, пациенты после операций на шее должны обследоваться по поводу гипокальциемии, но никаких рекомендаций относительно диагностических тестов и сроков не существует. Для семейных форм гипопаратиреоза может быть предложен биохимический скрининг родственников первой линии. У некоторых пациентов с судорожным синдромом, в том числе у детей с предположительно фебрильными судорогами, отсутствие измерений кальция в сыворотке крови может стать причиной затруднений в диагностике гипопаратиреоза [125].
Профилактика
Решающим в профилактике послеоперационного гипопаратиреоза является опыт хирурга в операциях на области шеи. В случаях нехирургического гипопаратиреоза с известной генетической этиологией следует предлагать генетическую консультацию. Чтобы избежать длительных эпизодов гипокальциемии или гиперкальциемии, пациентов с гипопаратиреозом необходимо информировать о симптомах снижения или повышения циркулирующего кальция, что позволит обеспечить раннюю диагностику и корректировку лечения. Следует отметить, что у пациентов, получающих лечение по поводу хронического гипопаратиреоза, показатели кальция могут колебаться без видимых на то причин. Аналогичным образом, для раннего выявления осложнений пациенты должны быть ознакомлены с их проявлениями.
Ведение пациентов
Традиционная терапия
Традиционная терапия у взрослых с гипопаратиреозом включает пищевые добавки кальция или активных форм витамина D [используется кальцитриол или альфакальцидол (1α(OH)D3; модуль 3)], а также их комбинации. Лечение нацелено на увеличение абсорбции кальция в кишечнике, что позволяет повысить концентрацию кальция в сыворотке крови (рис. 1). Целью ведения хронических пациентов является профилактика признаков и симптомов гипокальциемии, а также снижение риска долгосрочных осложнений (табл. 2,3) [5, 6]. Лечение направлено на достижение нормальных уровней сывороточного кальция (~8.0–8.5 мг/дл [2,0–2,12 миллимоль]) и кальция в моче.
Пациентам часто требуется не менее 1 г элементарного кальция в сутки, разделенного на несколько приемов. Наименее дорогостоящим препаратом является карбонат кальция (40 % кальция по массе). Поскольку эффективность абсорбции зависит от рН в желудке, его следует принимать во время еды. Альтернативами карбонату кальция являются цитрат кальция, глюконат кальция и лактат кальция, но они предполагают употребление большего количества таблеток, поскольку содержание элементарного кальция в них относительно мало. Цитрат кальция рекомендован пациентам с ахлогидрией (нарушение секреции желудочной кислоты) или пациентам, получающим ингибиторы протонной помпы. Острая тяжелая гипокальциемия лечится внутривенным введением глюконата кальция [5, 6].
В лечении гипопаратиреоза используются различные метаболиты и аналоги витамина D (модуль 3). Хотя возможно использование высоких доз предшественников витамина D — эргокальциферола (витамин D2) и холекальциферола (витамин D3), такое лечение не является общепринятым и может привести к продолжительной гиперкальциемии из-за длительного периода полувыведения. Использование активных форм витамина D — кальцитриола (1,25(OH)2D) или альфакальцидола (1α(OH)D3) — является предпочтительным, поскольку они напрямую воздействуют на желудочно-кишечный тракт, увеличивая абсорбцию кальция в кишечнике, а также быстрее действуют и имеют более короткий период полувыведения [127]. Альфакальцидол, как и кальцитриол, титруют до достижения целевых сывороточных концентраций кальция, находящихся в пределах низконормальных значений или немного не достигающих нижней границы нормы.
Новорожденные и дети раннего возраста должны получать кальцитриол (дозируется в зависимости от веса, 0,01–0,04 мкг/кг/сут); некоторые центры также дают препараты карбоната кальция (20–40 мг/кг/сут), разделяя их на два или три приема. Дети старшего возраста обычно получают взрослые дозы активных форм витамина D [128].
Модуль 3 | Метаболизм витамина D
Предшественники витамина D образуются в результате превращения холестерина в холекальциферол (витамин D3) путем химической реакции, которая протекает в коже под действием средневолнового УФ-излучения. Холекальциферол и эргокальциферол (витамин D2) могут поступать с пищей, но лишь немногие продукты (такие как жирная рыба) содержат их в достаточном количестве. Биологически неактивные холекальциферол и эргокальциферол активируются двумя этапами гидроксилирования. В ходе гидроксилирования в печени до кальциферола (25(ОН)холекальциферол) или до 25(ОН)эргокальциферола (вместе известны как 25(ОН)D) образуется стабильный предшественник активного гормона, который в клинической практике обычно измеряется для получения информации об уровне витамина D. Дальнейшее гидроксилирование 25(ОН)D в почках до кальцитриола (также известного как 1,25-дигидроксивитамин D (1,25(OH)2D) — активной формы витамина D — является этапом с ограниченной скоростью, которая повышается паратиреоидным гормоном и снижается фактором роста фибробластов 23 (FGF-23). Лечение гипопаратиреоза часто включает кальцитриол или альфакальцидол (1α(OH)D3), последнему из которых требуется биоактивация в печени путем 25-гидроксилирования.
Аналоги ПТГ
Хотя традиционная терапия активными формами витамина D и кальциевыми добавками может восстановить уровень сывороточного кальция, она не восполняет другие функции ПТГ, такие как ремоделирование кости или реабсорбция кальция почками. Кроме того, традиционное лечение ассоциировано с гиперкальциурией, которая повышает риск развития нефрокальциноза и камней в почках. Для создания более физиологичной альтернативы традиционной терапии в исследованиях, основанных на замещении ПТГ, был впервые предложен синтетический человеческий ПТГ (1–34) (чПТГ(1–34)) — биологически активный амино-концевой фрагмент полноразмерного пептида ПТГ. Активный N-концевой фрагмент, как и полноразмерный 84-аминокислотный пептид, связываются с рецептором ПТГ I типа (PTH1R, ПТГ1Р) и активируют его.
чПТГ(1–34). Синтетический чПТГ использовался в первых клинических испытаниях гормональной заместительной терапии гипопаратиреоза. В этих исследованиях биологически активный фрагмент чПТГ(1–34) создавался в лабораторных условиях, поскольку на момент начала исследований в 1992 году еще не существовало коммерчески доступного гормона. Синтетический чПТГ(1–34) назначался без кальцитриола, тиазидных диуретиков или фосфат-связывающих препаратов и титровался до низконормальных значений сывороточного кальция или значений чуть ниже нормы, а также до нормального уровня экскреции кальция с мочой. Различные схемы назначения чПТГ(1–34) оценивались в долгосрочных и краткосрочных исследованиях [61, 62, 129–133]. В первых исследованиях подтвердилось преимущество однократной ежедневной подкожной инъекции чПТГ(1–34) над традиционной терапией [132]. Фосфатурическое и кальцийсберегающее воздействие чПТГ(1–34) на почки уменьшало уровни фосфатов в сыворотке крови и экскрецию кальция с мочой в сравнении с традиционной терапией в течение 10-недельного периода [132]. Заместительная терапия чПТГ(1–34) в сравнении с традиционной терапией также изучалась в трехлетнем рандомизированном контролируемом исследовании у взрослых и детей [129, 131].
Сравнение однократного и двукратного введения чПТГ(1–34) у взрослых и детей показало, что повышение частоты инъекций значительно снижает необходимую суточную дозу [62,130]. При двукратном введении чПТГ происходило снижение маркеров ремоделирования кости, и устанавливались более физиологичные уровни сывороточного кальция и магния с меньшими колебаниями к концу дня по сравнению с однократным введением препарата. В трехлетнем рандомизированном контролируемом исследовании у детей сравнивалась традиционная терапия и лечение двукратными подкожными инъекциями чПТГ(1–34), дозы которых титровались до достижения целевых уровней кальция и фосфора в сыворотке и моче [131]. В обеих группах испытуемых средние уровни сывороточного кальция были немного ниже нормального диапазона; средний уровень экскреции кальция с мочой, минеральная плотность костей поясничного отдела и всего тела, а также показатели роста и массы находились в пределах нормальных значений и не различались между группами [129,131]. Уровни кальцитриола у детей, получавших инъекции чПТГ(1–34) дважды в день, были выше, чем у находившихся на традиционной терапии [131]. Это исследование показывает, что лечение чПТГ(1–34) является безопасным и эффективным в поддержании стабильного метаболизма кальция у детей с гипопаратиреозом и обеспечивает нормальный линейный рост в течение трех лет.
У 27 взрослых с гипопаратиреозом в трехлетнем рандомизированном открытом исследовании традиционную терапию сравнивали с двукратным суточным введением чПТГ(1–34) [129]. Уровни сывороточного кальция в обеих группах поддерживались в значениях чуть ниже нормальных. Хотя средний уровень экскреции кальция с мочой неизменно находился в норме в группе, получавшей чПТГ(1–34), и превышал норму группе, получавшей традиционное лечение, значения между группами существенно не различались. Содержание минералов в кости и минеральная плотности кости, измеряемые дважды в год, не различались между группами [129]. Лечение препаратами чПТГ(1–34) у взрослых с гипопаратиреозом в течение трех лет безопасно и эффективно поддерживало уровни сывороточного кальция в диапазоне значений чуть ниже нормы и низконормальных и не сопровождалось гиперкальциурией.
С целью дальнейшего улучшения метаболического контроля у взрослых и детей, имеющих гипопаратиреоз различной этиологии, было изучено помповое введение чПТГ(1–34) в сравнении с двукратными суточными инъекциями [61, 133]. Микроболюсно (0,1 мкг) чПТГ(1–34) подавался с интервалами от 2 до 8 доз в час, что соответствовало диапазону 4,8–19,2 мкг в день — одной трети суточной дозы, поступающей при двукратной инъекционной терапии. Помповое введение чПТГ(1–34) в отличие от двукратного ежедневного введения снижало колебания уровня сывороточного кальция, а также более чем на > 50 % уровень кальция в моче у взрослых с послеоперационным гипопаратиреозом [133]. В группе с помпой сывороточные концентрации магния были повышены, а маркеры резорбции кости понижены [133]. Хотя у помповой подачи имелись клинические преимущества, она требовала помощи опытного специалиста с квалификацией в области ведения пациентов с гипопаратиреозом и работы с помповыми устройствами. У детей с врожденным гипопаратиреозом (аутоиммунный полиэндокринный синдром I типа или мутация в гене CASR), помповая подача чПТГ(1–34) в сравнении с двукратными ежедневными инъекциями приводила к почти полной нормализации средних уровней сывороточного кальция (2,02 ± 0,05 ммоль/л против 1,88 ± 0,03 ммоль/л; P < 0.05), незначительному снижению уровней экскретируемого кальция в моче (5,17 ± 1,10 ммоль/сут в сравнении с 6,67 ± 0,76 ммоль/сут; Р = 0,3) и значительному снижению уровней маркеров ремоделирования кости [61]. Во время помповой терапии повышались уровни магния в сыворотке крови, снижалась экскреция магния с мочой, в связи с чем разрешалось сокращение приема пищевых добавок с магнием [61,133].
Трое детей с гипопаратиреозом (два брата с аутоиммунным полиэндокринным синдромом I типа и один ребенок с идиопатическим гипопаратиреозом), нечувствительные к традиционной терапии, успешно реагировали на постоянное подкожное введение чПТГ(1–34) в течение трех лет. Двоим пациентам с аутоиммунным полиэндокринным синдромом I типа требовались значительно большие дозы, чем ребенку с идиопатическим гипопаратиреозом [134].
Внезапное прекращение терапии чПТГ(1–34) может привести к гипокальциемии, а пациентам могут потребоваться дозы кальция и кальцитриола, значительно превышающие базальные [135]. Постепенное прекращение приема чПТГ(1–34) — более безопасный выход для пациентов, переходящих на традиционную терапию.
В 2002 году чПТГ(1–34) был одобрен Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (US FDA) для лечения остеопороза у взрослых. Ограничения на продолжительность лечения до 2 лет и на его использование у детей дают возможность применения его в длительной заместительной терапии гипопаратиреоза только в качестве препарата «off-label» («вне инструкции»).
Рекомбинантный чПТГ(1–84). Полноразмерный рекомбинантный чПТГ(1–84) (рчПТГ(1–84)) ассоциирован с более длительным кальциемическим эффектом при инъекции в бедро, чем при инъекциях в живот [136]. Препараты чПТГ(1–34) при лечении остеопороза вводятся подкожно в области бедра или живота. В одном одноцентровом исследовании тестировались результаты подкожного введения рчПТГ(1–84) в область бедра у 33 пациентов в течение шестилетнего периода в сравнении с исходными данными [137]. Стартовая доза составляла 100 мкг подкожно через день, но большинство пациентов позже переходило к ежедневным однократным инъекциям с диапазоном доз от 25 мкг/сут до 100 мкг/сут. По сравнению с исходным уровнем, показатели сывороточного кальция были стабильны в течение шести лет, а уровни кальция в моче и фосфатов в сыворотке были значительно снижены при промежуточных измерениях. Минеральная плотность костей позвоночника незначительно увеличилась, тогда как в бедренной кости и дистальном отделе лучевой кости она уменьшилась. Необходимая доза кальция снизилась на 53 %, а кальцитриола на 67 %. Нежелательные эффекты включали гиперкальциемию (12 эпизодов у девяти пациентов), гипокальциемию (пять эпизодов), симптомы со стороны скелетно-мышечной системы, инфекции, переломы (восемь переломов у шести пациентов), а также камни в почках (у трех пациентов). Из этого исследования был сделан вывод, что лечение рчПТГ(1–84) безопасно и эффективно в течение как минимум шести лет и позволяет снизить дозы препаратов, получаемых в рамках традиционного лечения.
В другом одноцентровом исследовании 62 пациента были рандомизированы в соотношении 1:1 для получения либо плацебо, либо рчПТГ(1–84) (100 мкг/сут) в течение 24 недель в качестве дополнения к традиционной терапии [138]. Пищевые добавки титровались до достижения нормальных уровней кальция в сыворотке крови и суточной моче. Суточные дозы кальция и активных форм витамина D снизились на 75 и 73 % соответственно у пациентов из группы рчПТГ(1–84) в сравнении с плацебо. При терапии рчПТГ(1–84) в сравнении с плацебо повышались маркеры ремоделирования кости и снижалась минеральная плотность бедренных костей и позвоночника.
В двойном слепом международном рандомизированном контролируемом испытании (REPLACE) 134 пациента с гипопаратиреозом (2:1) в течение 24 недель получали рчПТГ(1–84) или плацебо [139, 140]. Когда суточная доза рчПТГ(1–84) составляла 50 мкг ежедневно, дозы активных форм витамина D (кальцитриола или альфакальцидола) и препаратов кальция снижались примерно на 50 %. В течение последующих двухнедельных интервалов дозы рчПТГ(1–84) были увеличены, а добавок снижены. Основная конечная точка была определена как снижение суточных доз активных форм витамина D и препаратов кальция более чем на 50 % при сохранении сывороточной концентрации кальция в пределах целевого диапазона (равных референсным значениям). Она была достигнута у 53 % пациентов, получавших рчПТГ(1–84), в сравнении с 2 % пациентов, получавших плацебо (P < 0,001). Уровень кальция в моче при лечении рчПТГ(1–84) не изменялся [140], но уровни фосфата в сыворотке значительно снижались в сравнении с плацебо [139]. Нежелательные эффекты были схожи в обеих группах и включали гипокальциемию, мышечные спазмы, парестезии, головную боль и тошноту. После окончания лечения гипокальциемия отмечалась у большей доли пациентов в группе рчПТГ(1–84), чем в группе плацебо [140].
Традиционное лечение мало препятствует выраженным статическим и динамическим повреждениям кости при гипопаратиреозе [123]. В противоположность этому, при использовании рчПТГ(1–84) отмечалось обратное развитие и восстановление многих из этих нарушений. При биопсии гребня подвздошной кости было продемонстрировано быстрое и заметное увеличение меченых тетрациклином поверхностей, что являлось показателем повышенного остеогенеза уже через три месяца после начала применения рчПТГ(1–84) [101]. В течение года лечения отмечались положительные изменения в плоских и трубчатых костях, например, уменьшение ширины трабекулы и увеличение числа трабекул [101]. Интратрабекулярное туннелирование (резорбция кости в группах трабекул) было отмечено более чем в половине биоптатов [104]. Эти микроструктурные изменения показывают, что одной из функций ПТГ в кости является обеспечение костного ремоделирования и репарации.
В 2015 году FDA одобрило рчПТГ(1–84) в качестве дополнения к препаратам кальция и витамина D при лечении гипопаратиреоза у взрослых, у которых невозможен контроль гипопаратиреоза традиционной терапией. В 2017 году Европейская комиссия предоставила условную регистрацию препарата рчПТГ(1–84) в Европе.
Тиазидные диуретики
Тиазидные диуретики могут уменьшать экскрецию кальция с мочой [141–144] и назначаются в качестве вспомогательной терапии. В исследовании на собаках с гипопаратиреозом, получавших хлортиазид, демонстрировалось постепенное снижение фракционного клиренса кальция в сочетании с повышенным клиренсом натрия [145]. Таким образом, диета с высоким содержанием соли в любом случае будет препятствовать снижению кальциурии, ассоциированной с тиазидами, поэтому рекомендуется ограничение потребления натрия. Действительно, в исследовании на семи пациентах со среднетяжелым послеоперационным гипопаратиреозом отмечалось, что хлорталидон в сочетании с бессолевой диетой эффективно снижал уровень кальция в моче [146]. Тиазиды приводят к потере магния с мочой. Таким образом, пациенты с аутосомно-доминантной гипокальциемией I типа, у которых отмечаются аномально высокие показатели экскреции магния и гипомагниемия должны избегать тиазидных диуретиков [147]. Аналогичным образом пациенты с аутоиммунным полиэндокринным синдромом I типа и недостаточностью коры надпочечников не должны принимать тиазидные диуретики во избежание чрезмерной потери натрия с мочой [148].
Диета
Лечение гипопаратиреоза дополняется диетой, богатой кальцием. Для контроля гиперфосфатемии при гипопаратиреозе иногда рекомендуют ограничение поступления фосфатов с пищей и фосфат-связывающие препараты. Простое ограничение продуктов с добавлением фосфатов и коммерчески приготовленных продуктов, зачастую содержащих большие количества натрия и фосфатов, эффективно ограничивает поступление фосфатов с пищей, однако допускается прием молочных продуктов, в которых содержатся важные питательные вещества, особенно для детей. Всем пациентам, особенно при наличии факторов риска образования почечных камней, необходимо рекомендовать придерживаться адекватного водного режима, что снижает риск кальцификации почек.
Осложнения
Традиционная терапия часто ассоциирована с гиперкальциурией даже в тех случаях, когда показатели сывороточного кальция достигают нормальных или значений чуть ниже нормы. Хотя терапия препаратами ПТГ в сравнении с традиционной потенциально снижает экскрецию кальция с мочой, это продемонстрировано лишь в немногих исследованиях, возможно, из-за недостаточной продолжительности воздействия однократных инъекций ПТГ на почки [132, 137, 138]. Чтобы избежать повреждения почек при рецидивируюшей транзиторной гиперкальциемии в сочетании с гиперкальциурией, необходимо внимательно отслеживать уровни кальция в сыворотке крови после каждой корректировки доз препарата (табл. 2,3) [5, 6].
Эффекты от инъекций чПТГ на кости зависят от величины дозы и частоты введения. Однократные или двукратные инъекции чПТГ(1–34) [62], а также введение рчПТГ(1–84) ежедневно или через день приводили к устойчивому повышению уровней маркеров ремоделирования кости с различными долгосрочными изменениями минеральной плотности кости, измеряемой с помощью ДЭРА [129, 137]. При помповой подаче чПТГ(1–34) в ходе 12-недельного исследования происходила нормализация уровней маркеров ремоделирования кости [61], но для определения долгосрочного воздействия на костную ткань необходимы дальнейшие исследования лечения на основе помпового введения препаратов.
FDA выносит особое предостержение относительно потенциальных канцерогенных эффектов чПТГ(1–34) и рчПТГ(1–84). В 1998 году фармацевтической компанией Eli Lilly были опубликованы данные двухлетнего исследования канцерогенности нового препарата чПТГ(1–34) у крыс для FDA США [149–151]. У этих крыс за период 18–24 месяцев (сравнимо с 75 годами жизни человека) при использовании доз, эквивалентных человеческим, остеосаркомы развивались в 3–58 раз чаще. Развитие остеосарком зависело от дозы препарата и продолжительности введения — наиболее часто они развивались у животных, получавших высокие дозы (75 мкг/кг). В аналогичных исследованиях канцерогенности у грызунов был продемонстрирован повышенный риск остеосаркомы, ассоциированный с фармакологическими дозами подкожно вводимого препарата рчПТГ(1–84) [152]. Последующие данные исследований у нечеловекообразных приматов, получавших высокие дозы чПТГ(1–34) (5 мкг/кг) в течение 18 месяцев, сообщают об увеличении костной массы, но остеосаркомы или пролиферативные изменения в кости не встречались после прекращения терапии и в последующем за трехлетний период наблюдения [153]. В отличие от данных о токсичности у крыс, важным наблюдением является то, что длительное течение гиперпаратиреоза у людей не связано с развитием остеосаркомы, несмотря на хронически повышенный уровень ПТГ [154]. Кроме того, повышения риска возникновения остеосарком несмотря на длительное использование чПТГ(1–34) не наблюдалось у пациентов с гипопаратиреозом или остеопорозом в течение более 20 лет, хотя большинство из них получало лечение лишь два года [155, 156].
Не так давно в помощь практикующим врачам, занимающимся лечением хронического гипопаратиреоза у взрослых, были разработаны два гайдлайна (табл. 2, 3). Данные, на которых основываются эти гайдлайны, получены из небольших испытаний, преимущественно биохимических, противоположных клиническим ожидаемым результатам (таким как прогрессирование заболевания и выживаемость). Руководство, спонсируемое Европейским обществом эндокринологов [5], основывалось на систематическом обзоре литературы, а руководство Первой Международной конференции по вопросам лечения гипопаратиреоза основывалось на обзорах литературы и мнениях экспертов [6]. Оба гайдлайна рекомендуют периодический мониторинг возможных осложнений заболевания, таких как почечная недостаточность, кальцификация мягких тканей и гиперкальциурия, как указано в таблицах 2, 3.
Качество жизни
Пациенты с гипопаратиреозом, получающие традиционную терапию препаратами кальция и активными формами витамина D, часто жалуются на снижение качества жизни (КЖ) [1, 2, 4]. К этим жалобам относятся физические симптомы, такие как усталость; нервно-мышечные жалобы, такие как слабость, колики, парестезии и судороги; неспособность сконцентрироваться или сфокусироваться, часто описываемая как «спутанность сознания», а также нарушения в эмоциональной сфере — тревожность, депрессия и расстройства личности, которые зачастую являются преходящими и могут быть не замечены за другими симптомами. В недавних исследованиях предпринималась попытка оценить характер и распространенность нарушений КЖ при гипопаратиреозе [7, 11, 113, 120, 157]. В сравнении со здоровой контрольной группой или с пациентами, перенесшими операцию на щитовидной железе, но имеющими сохранную функцию паращитовидных желез, у пациентов с послеоперационным гипопаратиреозом отмечались значительно более высокие оценки общих жалоб [113], низкие баллы общих физических показателей по краткому опроснику оценки КЖ пациента из 36 пунктов (SF36) и снижение мышечной функции [111]. Сниженные показатели КЖ также наблюдались в реестрах и опросах у пациентов из Норвегии [7], Дании [8, 9] и США [120]. Наконец, у пациентов с развившимся послеоперационным гипопаратиреозом отмечались более низкие показатели КЖ, чем ожидались здоровыми людьми, изучившими описание заболевания, и опытными хирургами (специалистами по эндокринной хирургии) [157].
Когда чПТГ(1–34) и рчПТГ(1–84) стали доступны, появилась надежда, что замещение отсутствующего гормона восстановит КЖ у пациентов с гипопаратиреозом. Действительно, многие пациенты получавшие синтетический чПТГ отмечали улучшение самочувствия в сравнении с исходным (традиционная терапия). Однако несмотря на такие отдельные благоприятные сообщения, результаты исследований влияния синтетического чПТГ на КЖ были непоследовательными. В открытом неконтролируемом исследовании Колумбийского университета, Нью-Йорк, США, КЖ оценивалось по опроснику SF-36 и было низким, независимо от исходного состояния, несмотря на приемлемые уровни сывороточного кальция в ответ на традиционную терапию [158, 159]. Во всех случаях через один и два года произошло значительное улучшение в ответ на терапию рчПТГ(1–84) [158]. У лиц, получавших лечение в течение пяти лет, КЖ становилось лучше в течение всего периода исследования [159]. Аналогичные изменения были отмечены в итальянском исследовании, где применялись двукратные суточные инъекции рчПТГ(1–84) [160]. Однако изначально у многих пациентов была гипокальциемия, скорректированная во время исследования [160]. Таким образом, улучшение самочувствия в некоторой степени может быть связано с адекватным контролем кальциемии.
В отличие от удивительно положительных результатов открытых исследований, описанных выше, в датском двойном слепом плацебо-контролируемом исследовании пациентов с относительно хорошо контролируемым гипопаратиреозом было обнаружено, что у лиц, получавших рчПТГ(1–84), отмечался меньший прирост показателей SF-36, чем у получавших плацебо, и худшие показатели некоторых функциональных мышечных тестов [161]. Однако у многих пациентов, получавших рчПТГ(1–84), в этом исследовании развилась гиперкальциемия, которая могла негативно сказаться на их самочувствии. Предварительный анализ исследования REPLACE показал улучшение показателей качества жизни при лечении рчПТГ(1–84). Однако различия между группами не были значимыми [162].
Для лучшего понимания природы и степени нарушений КЖ, индивидуальных различий, связи с отклонениями биохимических показателей (если таковые имеются) и методами лечения необходимы дальнейшие исследования. Для достижения этой цели важно разработать более эффективные, специфические для гипопаратиреоза инструменты оценки качества жизни.
Перспективы
За 25 лет, прошедших с момента первых исследований терапии синтетическим чПТГ, наши знания о гипопаратиреозе значительно расширились. Несмотря на редкость заболевания, стимулом для проведения дальнейших исследований послужил тот факт, что гипопаратиреоз был одним из последних классических дефицитных заболеваний, не имевших заместительной гормональной терапии. Это ироничный исторический факт, ведь впервые последовательность аминокислот в ПТГ была описана в конце 1960-х годов [163], и это был второй пептидный гормон после инсулина, для которого был разработан иммуноферментный анализ типа «сэндвич» [164]. Спустя почти 50 лет наконец появилась одобренная заместительная терапия гипопаратиреоза.
Результатом недавно появившегося интереса к этому расстройству стало увеличение информации о заболеваемости, распространенности и естественном течении гипопаратиреоза. Значительно улучшилось наше понимание генетических основ многих редких вариантов заболевания. Такой подход не только прибавил нам знаний о редких генетических мутациях, являющихся причиной гипопаратиреоза, но также дал нам представление о действиях ПТГ на молекулярном уровне и его клеточных функциях в нормальных условиях.
Опыт применения рчПТГ(1–84) в терапии гипопаратиреоза свидетельствует о возможности поддержания уровня сывороточного кальция дозами препаратов кальция и активных форм витамина D, которые значительно снижаются относительно показателей до начала лечения. Наблюдалось лишь умеренное влияние на экскрецию кальция с мочой, восстановление аномальных скелетных гистоморфометрических параметров и КЖ. Эксперты «оживили» новые знания о гипопаратиреозе, предложив руководства по диагностике и лечению этого заболевания [5, 6].
Если смотреть в будущее, есть некоторые вопросы, требующие углубленного понимания и знаний, в том числе вопросы, связанные с тем, какие пациенты подходят для лечения недавно одобренным рчПТГ(1–84). Хотя пациентам с легкой формой заболевания часто подходит лечение пероральными препаратами кальция и/или активными формами витамина D, пациентам с более выраженным проявлениями требуются большие дозы этих препаратов, что вызывает опасения относительно долгосрочных осложнений, таких как образование кальцификатов в почках, головном мозге и суставах. Более того, традиционная терапия не восполняет существующий гормональный дефицит. Некоторые эксперты также обращают внимание на снижение качества жизни, отмечаемое во многих исследованиях, использующих общие показатели, такие как шкала КЖ SF-36, что частично обусловлено отсутствием ПТГ.
Показанием к применению одобренных FDA препаратов рчПТГ(1–84) целевыми пациентами является невозможность хорошего контроля на традиционной терапии. Хотя формулировка «хороший контроль» — объект споров, на Первой Международной конференции по вопросам ведения гипопаратиреоза было рассмотрено шесть конкретных ситуаций, любая из которых требует терапии рчПТГ(1–84) (модуль 4) [123]. С течением времени эти руководства будут дополняться, они не должны быть правилами, но могут помочь практикующему врачу определить наилучший курс действий в отношении конкретного пациента. Данные об эффективности терапии рчПТГ(1–84) в предупреждении долгосрочных осложнений гипопаратиреоза являются недостаточными, а данные о безопасности в крупных когортах пациентов, особенно у детей, отсутствуют. Текущие траты на лечение рчПТГ(1–84) и комплаенс в отношении инъекционных форм являются потенциальными препятствиями к его использованию. Для определения лучшей терапевтической схемы лечения пациентов с гипопаратиреозом необходимы долгосрочные многоцентровые контролируемые испытания.
Модуль 4 | Показания к терапии рчПТГ(1–84)
Экспертное заключение Первой Международной конференции по вопросам лечения гипопаратиреоза относительно руководства по использованию полноразмерного рекомбинантного паратиреоидного гормона человека (рчПТГ(1–84)) [6]:
• неадекватный контроль сывороточного кальция с развитием гипокальциемии или неустойчивые колебания от гипокальциемии к гиперкальциемии у пациентов находящихся на традиционной терапии;
• ежедневная потребность в дозах препаратов кальция > 2,5 г или активных форм витамина D > 1,5 мкг для кальцитриола и > 3,0 мкг для альфакальцидола;
• доказательства поражения почек при гиперкальциурии, нефрокальциноз, нефролитиаз или снижение клиренса креатинина у пациентов, находящихся на традиционной терапии;
• гиперфосфатемия или количество производных фосфатов кальция > 55 мг2/дл2 (или > 4,4 ммоль2/л2) у пациентов, находящихся на традиционной терапии;
• гастроинтестинальные заболевания или состояния после бариатрических хирургических вмешательств, ассоциированные с мальабсорбцией;
• снижение качества жизни у пациентов, находящихся на традиционной терапии.
Кроме того, более детальный анализ состояния скелета при помощи новых технологий, таких как высокочувствительная периферическая количественная КТ, оценка трабекулярного костного индекса и референсной точки твердости (reference point indentation, RPI) могут обеспечить понимание изменений качества кости при гипопаратиреозе. Для понимания долгосрочного влияния рчПТГ(1–84), необходимо глубокое понимание естественного течения гипопаратиреоза, скелетной динамики, качества кости, функции почек, КЖ и известных осложнений этого заболевания. В отношении долгосрочных исследований заслуживает изучения идея о том, что рчПТГ(1–84) может повлиять на обратное развитие или сокращение эктопических кальцификатов в мягких тканях. Другим, вероятно, важным направлением является выполнимость и применимость новых систем введения (в том числе трансдермального пластыря, помпы для длительных инфузий и пероральных форм чПТГ), а также аналогов и агонистов ПТГ [165, 166].
Вооружившись достижениями последнего десятилетия и заметным интересом к этой орфанной болезни, мы, вероятно, узнаем больше не только о заболевании, но и о многих важных и разнообразных функциях ПТГ.
