Какие существуют эффекты статинов помимо снижения холестерина?

Статины (ингибиторы редуктазы β-гидрокси-β-метилглутарил-коэнзима A [ГМГ-КoA-редуктазы]) относятся к наиболее часто назначаемым классам лекарств во всем мире: частота назначения составляет 33 % от общего количества лиц в возрасте старше 60 лет в Дании [1], и до 80 % пациентов в возрасте от 45 до 75 лет с установленным сердечно-сосудистым заболеванием в США [2]. Статины — конкурентные ингибиторы ГМГ-КoA-редуктазы, фермента, ограничивающего скорость биосинтеза холестерина и других изопреноидов (рис. 1). Уменьшая внутриклеточные концентрации холестерина в тканях печени, гепатоциты усиливают экспрессию рецепторов липопротеинов низкой плотности (ЛПНП) на своей поверхности, что приводит к снижению концентрации холестерина ЛПНП в плазме. Убедительные доказательства свидетельствуют о снижении статинами уровня холестерина ЛПНП, что способствует их применению в качестве препаратов для уменьшения риска неблагоприятных сердечно-сосудистых исходов и смерти.
В течение нескольких лет появлялись сведения о дополнительных (плейотропных) эффектах статинов. В 1996 году Vaughan с соавт. предположили, что эффекты статинов куда шире, чем просто понижение уровня холестерина [3]. Гипотеза ученых основывалась на результатах таких исследований, как 4S (Скандинавское исследование выживаемости после приема симвастатина) и WOSCOPS (Исследование профилактики сердечно-сосудистых заболеваний на западе Шотландии), заключавшихся в том, что клиническая польза от употребления статинов проявилась раньше, чем любое ожидаемое влияние на морфологию атеросклеротических бляшек. Возможное объяснение было предоставлено с помощью экспериментов на клеточных культурах, свидетельствующих об ингибирующем влиянии статинов на воспалительную активность макрофагов, функцию эндотелиоцитов и пролиферацию гладкомышечных клеток сосудов. Эффекты, полученные в культуре клеток, оказались обратимы при добавлении мевалоната, но не сквалена (предшественника холестерина). Это говрорит о специфичности эффектов статинов по отношению к ГМГ-КoA-редуктазе и их независимости от холестерина [4]. Более того, в других работах отмечалось улучшение NO-зависимых эндотелиальных функций у пациентов, принимавших статины [5]. С тех пор многочисленные экспериментальные исследования [на людях] и эксперименты на животных четко установили не зависящие от холестерина ЛПНП противовоспалительные, антиатеросклеротические, антитромботические и стимулирующие выработку оксида азота эффекты статинов (обзор Oesterle с соавт. [6]).
ПНФ — Предсердный натрийуретический фактор;
BMP-2 — Костный морфогенетический белок 2;
CASR — Ca2+-чувствительный рецептор;
eNOS — Эндотелиальная синтаза оксида азота;
MLC-2 — Легкая цепь 2 миозина;
НАД(Ф)Н-ox - никотинамидадениндинуклеотидфосфатоксидаза;
PAI — ингибитор активатора плазминогена;
ROCK — Rho-ассоциированная протеинкиназа, содержащая coiled coil;
tPA — тканевый активатор плазминогена.
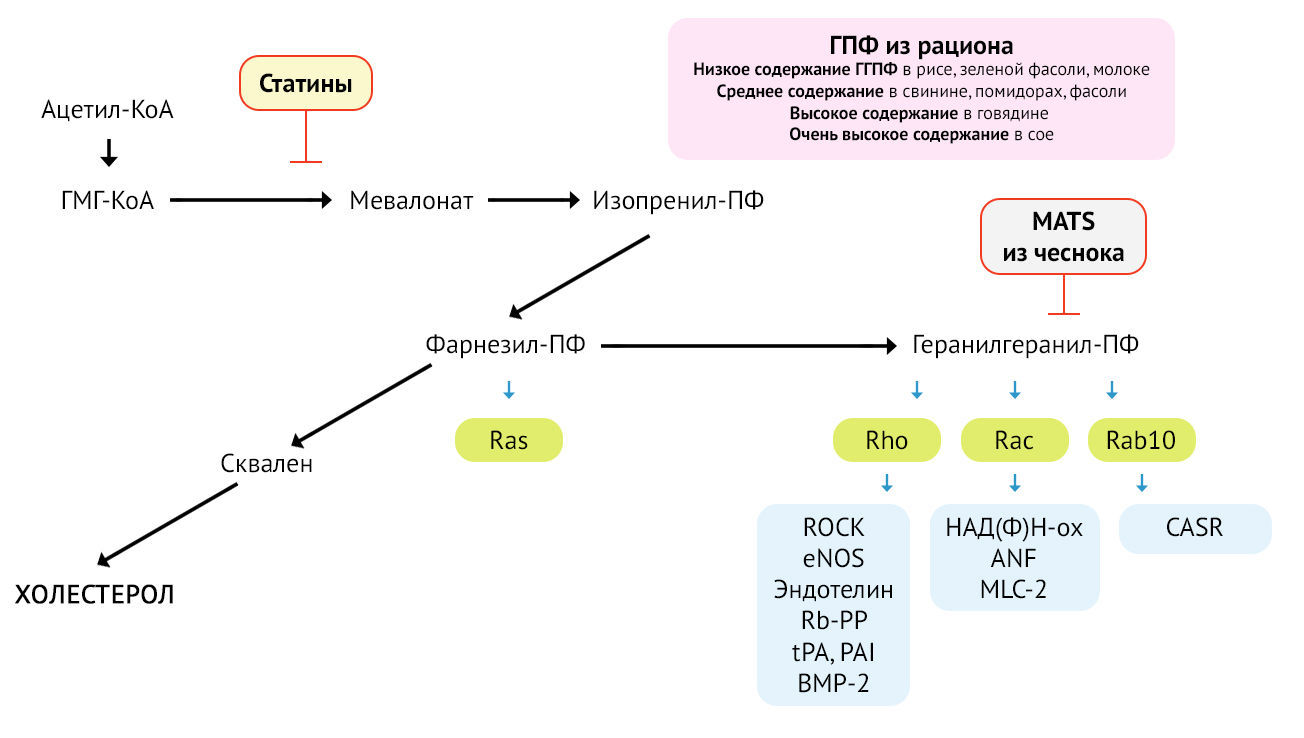
Существование иных, помимо влияния на обмен холестерина, эффектов статинов, объясняется тем фактом, что ГМГ-КoA-редуктаза не только регулирует синтез холестерина в печени, но также обеспечивает все клетки организма изопреноидами, участвующими в реакциях (изо)пренилирования важных сигнальных белков. Изопреноиды, такие как фарнезилпирофосфат и геранилгеранилпирофосфат (ГГПФ), представляют собой короткоцепочечные жирные кислоты, которые в ходе посттрансляционной модификации связываются с широко распространенными внутриклеточными сигнальными молекулами, такими как Ras (фарнезилпирофосфат) и белки RhoA, Rac и Cdc42 (cell division control protein 42 homolog) (ГГПФ). Считается, что они необходимы для заякоривания различных молекул в структуре мембраны и их полноценного функционирования. Стимулирующее воздействие этих сигнальных молекул на процессы клеточной пролиферации, миграции, оксидативного стресса и полимеризации актина, а также их ингибирующее действие на эндотелиальную синтазу оксида азота объясняют благотворные эффекты ингибирования их изопренилирования, опосредованного статинами [6, 7].
Этот распространенный механизм стал причиной экспериментального применения статинов при широком спектре клинических показаний. И действительно, накоплены доказательства клинической пользы статиновой терапии у пациентов с сосудистыми заболеваниями (например, заболеваниями почек, венозным тромбозом, эректильной дисфункцией), аутоиммунными заболеваниями (такими как рассеянный склероз, ревматоидный артрит) и заболеваниями соединительной ткани (например, остеопорозом, заболеваниями периодонта; по обзору Oesterle с соавт. [6]). Однако доказательства значимого, помимо влияния на холестериновый обмен, воздействия на заболевания человека в целом противоречивы и не привели к составлению руководств или рекомендаций по применению статинов при показаниях, отличных от сердечно-сосудистых заболеваний. Более того, в более крупных исследованиях не удалось подтвердить преимущества иных эффектов статинов помимо влияния на холестериновый обмен (например, при послеоперационной фибрилляции предсердий [8] или сердечной недостаточности [9]), а количественное сравнение гиполипидемических и противовоспалительных эффектов (по суррогатному маркеру «С-реактивный белок») в крупных исследованиях, таких как JUPITER (Обоснование использования статинов с профилактической целью: исследование оценки розувастатина), HOPE-3 (Оценка профилактики сердечно-сосудистых исходов) и А–Z (Сравнение ранней интенсивной терапии с отложенной консервативной стратегией симвастатином у пациентов с острым коронарным синдромом в фазе Z клинического испытания А–Z) не выявили убедительных доказательств того, что другие эффекты статинов на сердечно-сосудистую систему превышают эффективность снижения уровня холестерина.
Клиническую значимость иных эффектов статинов трудно определить по двум основным причинам. В силу своего механизма действия статины всегда подавляют синтез как холестерина, так и изопреноидов. Более того, в клинических исследованиях сердечно-сосудистой системы всегда тестируются новые липидоснижающие терапевтические препараты, такие как эзетимиб, ингибиторы PCSK9 и бемпедоевая кислота, — на фоне терапии статинами. Таким образом, наилучших доказательств иных преимуществ приема статинов можно было бы ожидать от прямых их сравнений с лекарствами, которые, как предполагают, могут эффективно снижать только холестерин ЛПНП. Несмотря на отсутствие крупных исследований, небольшое клиническое испытание с участием пациентов с сердечной недостаточностью свидетельствует о том, что симвастатин улучшал радиальный кровоток, а эзетимиб — нет [10]. Прочие авторы сообщали о более сильных эффектах высоких доз статинов по сравнению с комбинацией статинов с эзетимибом [11], однако в других испытаниях с аналогичным дизайном исследования, целью которых было повторение такого же результата, подтверждения эффективности статинов обнаружено не было [12]. Таким образом, роль плейотропных эффектов статинов у людей остается спорной.
В этом выпуске Circulation Zhu с соавт. [13] представили новый взгляд на ситуацию с плейотропными эффектами статинов. Ученые вначале выдвигают гипотезу о том, что ГГПФ возникает из мевалоната почти во всех живых организмах, однако у растений существует свой альтернативный метаболический путь. Это повысило вероятность появления разницы концентраций ГГПФ при использовании различных диет. Действительно, оценка концентрации ГГПФ хроматографическим методом свидетельствует об отсутствии данного соединения в муке, салате, брокколи и картофеле, а в рисе, молоке и зеленой фасоли его концентрация оказалась крайне низкой (от 6 до 16 нг/г); в свинине, помидорах и фасоли концентрация была на уровне средней; в говядине — высокой (≈ 70 нг/г); а в сое — очень высокой (≈ 130 нг/г). Эти различия хорошо соотносились с точки зрения разного влияния на концентрацию ГГПФ в плазме (от исходного уровня 50 нг/мл до ≈ 200 нг/мл) у крыс, которых кормили соответствующими пищевыми добавками из расчета 2 г/100 г массы тела.
Учитывая потенциальную терапевтическую эффективность статинов при легочной артериальной гипертензии (ЛАГ), авторы сосредоточили внимание на влиянии диеты на кровообращение в легочной ткани. В то время как диеты с различным содержанием ГГПФ в продуктах не воздействовали на базовую гемодинамику или реакцию легочных сосудов при хронической гипоксии (4 недели при содержании кислорода 10 %), диета с высоким содержанием ГГПФ (а также прямое применение добавки ГГПФ) нивелировало положительные эффекты лечения симвастатином (10 мг/кг массы тела) как в модели ЛАГ при гипоксии, так и в модели ЛАГ с монокроталином. Дальнейшее исследование как на крысах in vivo, так и в культуре клеток привело к тому, что симвастатин ингибировал RhoA и его молекулярную мишень ROCK (Rho associated coiled-coil containing protein kinase), Ras-связанный белок Rab10, участвующий в переносе соединений через мембрану, и рецептор, чувствительный к Ca2+, который, как было выявлено ранее, вовлечен в патогенез ЛАГ (см. рисунок) [14]. Все эффекты симвастатина предотвращались добавлением к пище ГГПФ (в дозе 2 мкг/кг массы тела). И наоборот, эффекты ГГПФ (из рациона) обращались вспять одновременным пероральным введением экстрактов чеснока, содержащих высокие концентрации метилаллилтиосульфината, или непосредственно высоких доз метилаллилтиосульфината (0,5 мг/кг веса тела) — конкурентного ингибитора ГГПФ — для использования этого вещества геранилгеранилтрансферазами. Кроме того, авторы создали генетически модифицированных крыс с мутацией Ca2+-чувствительного рецептора в двух сайтах связывания с Rab10. Ученым удалось показать, что крысы оказались защищены от ЛАГ в условиях гипоксии, что подтверждает важную роль Ca2+-чувствительного рецептора. Возможное применение этих результатов к человеку было изучено в небольшом проспективном слепом клиническом исследовании на добровольцах. Результат свидетельствует о том, что рацион с высоким содержанием ГГПФ (говядина, соевые бобы; ≈ 1,2 мкг на прием пищи) повышал концентрацию ГГПФ в плазме по сравнению со стандартной китайской диетой (содержание ГГПФ 0,3 мкг на прием пищи) в 1,5–2 раза. Также симвастатин снижал концентрацию ГГПФ в плазме и активность RhoA в моноцитах крови (при гипоксии). Как было продемонстрировано ранее в случае с крысами, все эффекты статинов устранялись диетой на основе говядины или сои и восстанавливались при одновременном приеме экстракта чеснока с высоким содержанием метилаллилтиосульфината.
Это элегантное, насыщенное интересными сведениями исследование предлагает ряд важных новых идей. Удивительно, что в прошлом никто никогда не изучал содержание ГГПФ в рационе в свете статиновой терапии. В одном исследовании сообщалось о сходных (с полученными в данной работе) или более высоких значениях ГГПФ в шлифованном рисе (от 0 до ≈ 1000 нг/г) [15], но данный факт связывали с возможным противоопухолевым эффектом ГГПФ. Предлагаемый механизм действия статинов на животной модели ЛАГ и их антагонизм с ГГПФ хорошо согласуется с предыдущими работами и значительно расширяет их — например, в плане роли Rab10 и Ca2+-чувствительного рецептора. Сильные стороны данного исследования — тщательное аналитическое определение ГГПФ, изучение механизмов, в том числе с использованием мутантов с потерей функции in vitro и in vivo, а также фармакологическая сопоставимость аналогичных концентраций в плазме у крыс и людей, объективные эффекты статинов и диеты/ГГПФ соответственно.
Конечно, остаются нерешенные вопросы. Полученные терапевтические эффекты у крыс с ЛАГ нельзя напрямую применить к человеку. Как однозначно заявили авторы, схожая терапевтическая эффективность у пациентов с ЛАГ достигнута не была. Фактически несоответствие клинических данных и было одной из причин исследования. Доза симвастатина у крыс была намного выше максимальной терапевтической дозы у пациентов (10 мг/кг против максимально 1 мг/кг у пациентов). Однако даже низкая доза симвастатина величиной 20 мг повлияла на активность ГГПФ и RhoA в исследовании на людях, что указывает на способность стандартных доз статинов изменять концентрацию ГГПФ в плазме. В связи с крайне низкой системной биодоступностью статинов (≈ 5 % для симвастатина) предполагается, что ингибирование печеночной ГМГ-КoA-редуктазы снизит сывороточные концентрации изопреноидов, однако это требует дальнейшего изучения. Исследование не дает ответа на вопрос, оказывает ли влияние ГГПФ из рациона на эффективность статинов в профилактике сердечно-сосудистых и других заболеваний.
Исследование Zhu с соавт. [13] предоставляет убедительные доказательства того, что различные продукты содержат сильно различающиеся уровни ГГПФ, и это соединение оказывает влияние на концентрацию его в плазме и изменяет плейотропные эффекты статинов в животных моделях ЛАГ и у людей-добровольцев (например, активность RhoA). Эти результаты поднимают провокационный вопрос о меньшей пользе статинов для тех групп населения, у которых основу рациона составляют соевые бобы или говядина. Отталкиваясь от данной работы, можно выдвинуть много гипотез, а также спроектировать ретроспективный анализ клинических баз данных и существующих крупных клинических испытаний. Независимо от результата, исследование является подходящим примером тщательного научного обоснования широко распространенного принципа, согласно которому мы — то, что мы едим.
