Наблюдательное исследование ROCCA: первые результаты изучения безопасности вакцины Sputnik V (Гам-КОВИД-Вак) в Республике Сан-Марино с помощью активного наблюдения

Аннотация
Справочная информация: в августе 2020 года вакцина Sputnik V была зарегистрирована Министерством здравоохранения Российской Федерации под названием Гам-КОВИД-Вак, а с декабря 2020 года стала доступна в 61 стране мира. 25 февраля 2021 года в Республике Сан-Марино началась кампания вакцинации с использованием Sputnik V. Цель данного исследования — описать побочные проявления после иммунизации (ПППИ) данной вакциной посредством активного наблюдения за участниками исследования в стране.
Методы: с 4 марта по 8 апреля 2021 г. было проведено общенациональное исследование среди населения Сан-Марино в возрасте 18–89 лет, получившего одну или две дозы Sputnik V. Распространение опросника происходило по электронной почте, с помощью QR-кодов или при очном интервью / по телефону спустя около семи дней после введения первой и второй дозы вакцины. Описательный анализ был проведен для количественной оценки ПППИ в обоих случаях со стратификацией результатов по типу и тяжести симптомов.
Результаты. Средний возраст 2558 реципиентов вакцины составил 66 ± 14 лет. Частота ПППИ после первой дозы составила 53,3 % (системные реакции составили 42,2 %), тогда как частота ПППИ после второй дозы составила 66,8 % (системные реакции 50,4 %) (n = 1288). В целом 76,0 % реципиентов, получивших два компонента, сообщали о некоторых ПППИ после введения того или иного компонента вакцины, а у 2,1% наблюдались тяжелые реакции. У лиц в возрасте от 60 до 89 лет (n = 1021) частота ПППИ составила 70,0 %, при этом 53,0 % участников исследования сообщили о системных реакциях, а 0,8 % сообщили о тяжелых симптомах. Наиболее частыми симптомами были местные болевые ощущения, астения, головная боль и боль в суставах.
Интерпретация: наши результаты, хотя и предварительные, предполагают, что Sputnik V имеет высокий профиль переносимости среди населения в возрасте 60 лет с точки зрения краткосрочных ПППИ.
© 2021 Автор(ы). Опубликовано Elsevier Ltd. Это статья в открытом доступе под лицензией CC BY-NC-ND.
1. Введение
Через год после начала пандемии COVID-19 количество смертей во всем мире приближается к 3 миллионам [1]. Республика Сан-Марино была одной из первых стран, пострадавшей от все еще продолжающейся пандемии COVID-19, а также одной из стран с самым высоким уровнем смертности пропорционально ее населению [2]. Столкнувшись с катастрофическими последствиями пандемии, власти Сан-Марино стали использовать все доступные ресурсы для охвата населения, необходимого для достижения коллективного иммунитета. Вакцина Sputnik V была включена в государственную кампанию вакцинации [3].
Вакцина Sputnik V, одна из первых зарегистрированных вакцин против COVID-19, представляет собой гетерологичную рекомбинантную аденовирусную вакцину с двумя разными типами аденовирусных векторов, rAd26 и rAd5, для первой и второй доз соответственно, разработанную Национальным центром эпидемиологии и микробиологии им. Н. Ф. Гамалеи в Москве [4]. Sputnik V был зарегистрирован в августе 2020 года Минздравом России как Гам-КОВИД-Вак [5], а с декабря 2020 года началось массовое распространение вакцины в нескольких странах, включая Аргентину, Беларусь, Венгрию, Сербию и Объединенные Арабские Эмираты. Список стран, в которых был зарегистрирован Sputnik V, с тех пор расширился, достигнув 61 страны, включая Российскую Федерацию [6].
23 февраля 2021 года Республика Сан-Марино получила первую поставку Sputnik V, и 25 числа того же месяца была запущена национальная кампания вакцинации [7], начавшаяся с медицинских работников и наиболее уязвимых категорий граждан. Через 55 дней от начала кампании 46,1 % (n = 15 621) населения были привиты первой дозой [8] с целью быстрой вакцинации всего населения.
В процессе планирования национальной кампании вакцинации получение убедительных доказательств эффективности и безопасности вакцины имеет первостепенное значение. Единственное доступное исследование III фазы по Sputnik V показало эффективность 91,6 % (95 % ДИ 85,6–95,2) без существенных различий в возрастных группах и 100 % (95 % ДИ 94,4–100,0) эффективность против умеренного или тяжелого COVID-19. В качестве наиболее частых нежелательных явлений после иммунизации (ПППИ) были зарегистрированы гриппоподобные заболевания, локальные реакции в месте инъекции, головная боль и астения: большинство из них (94 %) относились к 1 степени, 5,7 % — к 2 степени и 0,4 % — к 3 степени. Ни один из серьезных ПППИ не считался связанным с вакцинацией [9].
Доказательства, полученные в результате клинических испытаний, предшествовавших утверждению вакцин, необходимы, но недостаточны. Фактически, они должны быть дополнены немедленным и непрерывным потоком информации в режиме реального времени, собираемой по мере продвижения кампании. Фармаконадзор за вакцинами (постмаркетинговый мониторинг безопасности вакцин) занимается проблемами, которые относятся к выявлению, оценке, пониманию и передаче ПППИ и другим вопросам, связанным с вакцинами или иммунизацией, а также к профилактике нежелательных эффектов [10].
Целью исследования ROCCA является проведение активной программы фармаконадзора за вакцинами и представление предварительных данных о распространенности и характеристиках ПППИ для вакцины Sputnik V среди населения Республики Сан-Марино. Мы намерены сравнить наши результаты с уже существующими данными для III фазы испытаний и других используемых в настоящее время вакцин против COVID. Кроме того, мы намерены рассмотреть и проанализировать, в частности, различия в переносимости между первым и вторым компонентом вакцины.
Контекст исследования
Полученные до исследования данные
В декабре 2020 года началось массовое распространение недавно разработанной вакцины Гам-КОВИД-Вак, которая в настоящее время зарегистрирована в 61 стране. Испытания I, II, III фазы показали высокий профиль эффективности и безопасности, однако эти данные нуждаются в постмаркетинговом подтверждении с помощью специальных исследований.
Дополнительные преимущества данного исследования
Большинство ПППИ, о которых сообщалось в исследовании, были легкой и средней степени тяжести. С точки зрения безопасности, результаты исследования согласуются с выводами III фазы исследования Гам-КОВИД-Вак. Предварительный анализ безопасности вакцины Гам-КОВИД-Вак предполагает более высокий или равный профиль переносимости, особенно в возрастной группе старше 60 лет по сравнению с другими широко распространенными вакцинами против COVID-19.
Результат всех доступных доказательств
Полученные результаты могут способствовать полному принятию вакцин против COVID-19 в Республике Сан-Марино, помогая быстрее достичь коллективного иммунитета; кроме того, они предоставляют данные, которые могут быть использованы другими странами для рассмотрения российской вакцины среди других вариантов местных кампаний иммунизации.
2. Методы
2.1. Дизайн исследования и участники
Это общенациональное исследование по активному фармаконадзору для оценки безопасности вакцины Sputnik V COVID-19 в Республике Сан-Марино. Процесс вакцинации включает одну дозу rAd26-S (0,5 мл), вводимую внутримышечно в день 0, и одну дозу rAd5-S (0,5 мл), вводимую внутримышечно в день 21. Оба центра вакцинации основаны Республиканским Институтом социального обеспечения (SSI). Все исследуемые, вакцинированные Sputnik V, отбираются врачами сразу после введения вакцины. Критерии отбора были определены следующим образом: возраст от 18 лет, наличие хотя бы одной дозы вакцины против COVID-19, наличие медицинской страховки SSI. Критерии исключения были определены как: неспособность правильно понять анкеты или ответить на содержащиеся в них вопросы. Никакой рандомизации или специального отбора не проводилось. Все участники дали информированное согласие на включение в базу данных для участия в исследовании.
Протокол исследования был рассмотрен и одобрен Комитетом по этике исследований и экспериментов Республики Сан-Марино с номером утверждения 30/CERS/2021 от 17 марта 2021 года.
2.2. Цели исследования
Первичной конечной точкой исследования была выбрана безопасность вакцины против COVID-19 Sputnik V (Гам-КОВИД-Вак), определяемая количеством участников, сообщивших о ПППИ, в первую неделю после первой дозы, в первую неделю после второй дозы, а в долгосрочной перспективе — в течение трех месяцев после первой дозы. Такой подход позволяет собирать данные о безопасности, сообщаемые пациентами, в режиме, близком к реальному времени, и в долгосрочной перспективе, и позволяет предсказать частоту возникновения ПППИ. Кроме того, исследователи стремились оценить любые количественные или качественные различия в возникновении ПППИ между первой и второй дозами.
2.3. Процедура и анкетирование
Стандартизированные электронные опросники активно рассылались участникам для сбора информации о потенциальных ПППИ после введения вакцины. Анкеты были созданы с помощью Google Forms и могли быть заполнены как самостоятельно, так и с помощью членов исследовательской группы.
Вакцинированных просили заполнять анкеты через фиксированные промежутки времени, а именно: 1 неделя (Q1), 1 месяц (Q2), 3 месяца после первой дозы вакцины (Q3) (доп. рис. 1). Анкета Q1 исследует демографическую информацию (индивидуальный код пациента, возраст, вес, рост, пол, профессия), анамнестические данные (беременность, заболевания, получаемое лечение, недавние прививки, аллергии, перенесенный COVID-19), дату первой инъекции, название вакцины, потенциальные ПППИ, возникающие через неделю после первой дозы, и тяжесть симптомов (включая необходимость в медицинской помощи и госпитализации). Q1 включает 7 разделов, всего 25 вопросов с закрытыми обязательными ответами, а Q2 и Q3 содержат 2 раздела, всего 6 вопросов. Чтобы связать анкеты друг с другом, код пациента также задается в Q2 и Q3. Q2 исследует потенциальные ПППИ, возникающие через неделю после второй дозы. В третьей анкете (Q3) изучаются дальнейшие потенциальные ПППИ в долгосрочном периоде после вакцинации, которая будет проводиться с июня 2021 года. Ответы на вопросы, касающиеся соответствующих переменных, были сделаны обязательными для заполнения анкеты, чтобы свести к минимуму потерю данных.
Список ПППИ и большинство вопросов были адаптированы из исследований по надзору за вакцинами, проведенных Европейским агентством по лекарственным средствам. Указанные события соответствуют типичным ПППИ вакцин, которые уже идентифицированы соответствующими регулирующими органами, в том числе по задержкам возможного возникновения. Клинические особенности любых ПППИ, их частота и интенсивность указывались в анкетах с использованием шкалы CTCAE (Common Terminology Criteria for Adverse Events) версии 5.0. В частности, 1 степень включает бессимптомные или легкие симптомы и без показаний к вмешательству; 2 степень охватывает умеренные симптомы; степень 3 указывает на тяжелые или значимые с медицинской точки зрения симптомы, а степень 4 включает симптомы с необходимостью срочного вмешательства. 5 степень (подразумевает летальный исход) в анкете не исследовалась. Также была проведена перекрестная проверка с записями доступа в государственной больнице.
К электронной анкете была приложена форма информированного согласия, и каждый участник дал согласие на участие в опросе после прочтения информационного листа. Таким образом, собранная персональная информация хранится анонимно, чтобы гарантировать конфиденциальность участников.
2.4. Сбор информации
Сроки сбора данных — с 4 марта 2021 года до окончания национальной кампании вакцинации. Срок сбора данных, включенных в этот анализ, составлял с 4 марта по 8 апреля 2021 года. Сбор данных осуществляется с помощью анкетирования с использованием трех различных подходов: персональное очное интервью на участках вакцинации, телефонные опросы и заполнение электронной анкеты, доступ к которой можно получить, отсканировав QR-код или перейдя по ссылке, отправленной по электронной почте.
2.5. Оценка анамнестических данных
Небольшая численность населения Республики Сан-Марино позволяет всем участникам исследования подключаться к своим медицинским картам с помощью персонального кода SSI, что позволяет получать анамнестические данные и информацию об использовании тех или иных препаратов, а также проверять доступ к национальной службе здравоохранения после вакцинации.
2.6. Статистический анализ
Числовые переменные были суммированы как среднее стандартное отклонение и/или как медиана [межквартильный размах (IQR)], категориальные переменные были суммированы как частоты и проценты. Распределение частот отображалось с помощью гистограмм и полигонов частот.
В этот предварительный анализ включено в общей сложности 1946 человек в возрасте 60–89 лет из популяции численностью 8799 человек (источник: https://www.statistica.sm), размер выборки был достаточным для оценки доли нежелательных явлений, равной от 1 % ± 0,4 % до 50 % ± 2 % с доверительной вероятностью 95 %. Несмотря на то, что данный анализ точности и размера выборки был основан на методе Вальда для биномиального распределения, на практике доверительные интервалы (ДИ) были оценены методом Уилсона, который оказался более точным и надежным в большинстве ситуаций [11].
Во вторичном разведочном анализе данных использовался тест Мак-Немара для оценки различий в возникновении побочных реакций после введения первой и второй дозы вакцины: этот анализ был ограничен теми, кто заполнил как анкету Q1, так и Q2. Кроме того, было рассчитано условное распределение ПППИ после введения второй дозы в соответствии с наличием/отсутствием ПППИ после первой дозы; различия между группами оценивались с помощью двухвыборочного теста для больших выборок (т. е. асимптотически нормальных). Все анализы проводились с использованием программного обеспечения Stata, версия 15 (StataCorp, 2017, Stata Statistical Software: Release 15, College Station, Texas, USA: StataCorp LP). Уровень значимости был установлен как 5 %.
2.7. Роль источников финансирования
Авторы не получали никакой внешней финансовой поддержки или финансирования при проведении этого исследования.
3. Результаты
3.1. Характеристики популяции
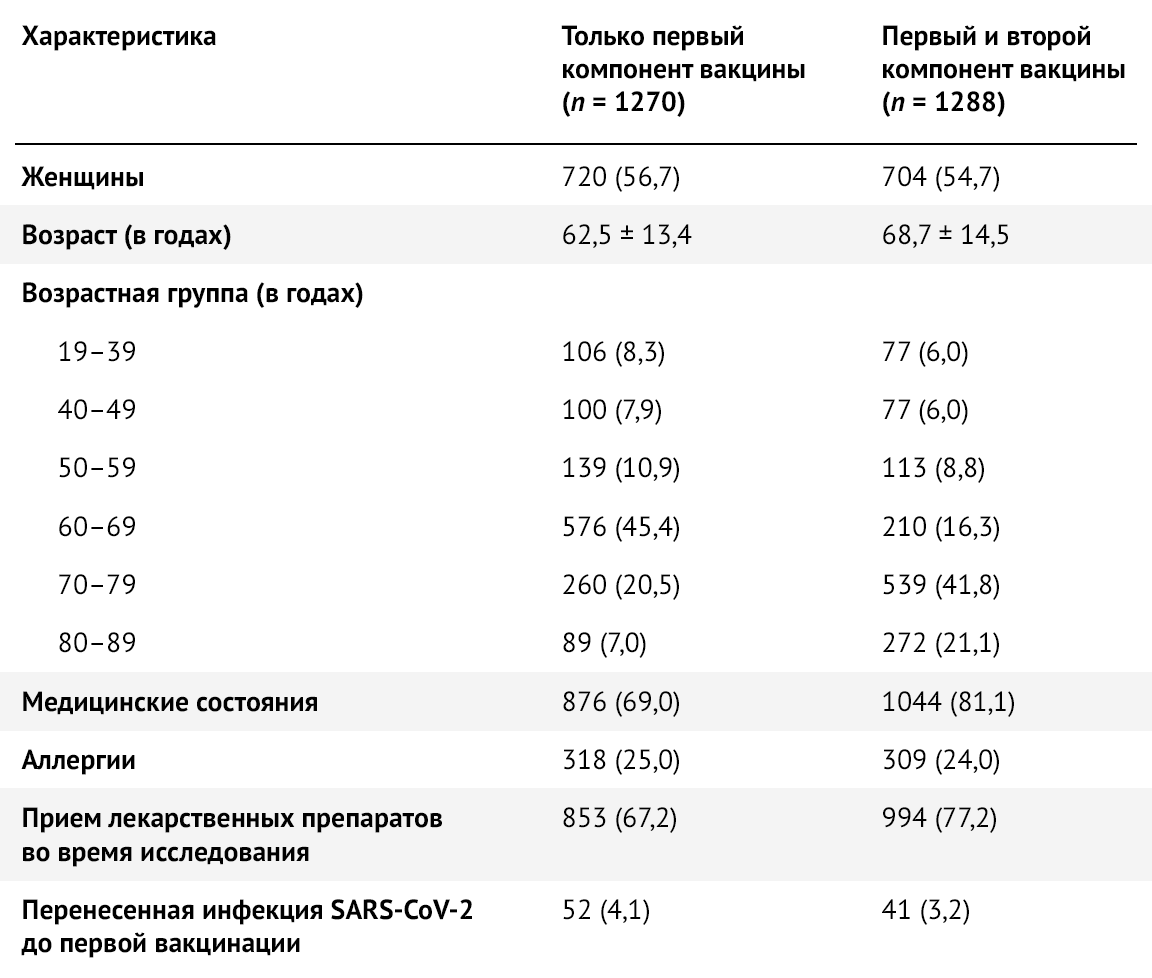
Для исследования было отобрано 2558 участников, которые получили Sputnik V (Гам-КОВИД-Вак) в период с 25 февраля по 8 апреля 2021 года: 55,7 % (n = 1424) составляли женщины. За тот же период времени около половины участников исследования (50,4 %, n = 1288) получили обе дозы вакцины. Средний возраст составлял 66 ± 14 лет, медианный возраст составлял 68 лет [IQR: 6076], а наиболее представленная возрастная группа — 60–69 лет (45,4 %, n = 576) (табл. 1, рис. 1).
Таблица 1 | Социально-демографические характеристики исследуемой выборки в целом и по возрастным группам — Республика Сан-Марино, 2021 г. Значения представляют собой количество (в процентах) или среднее +/- стандартное отклонение.
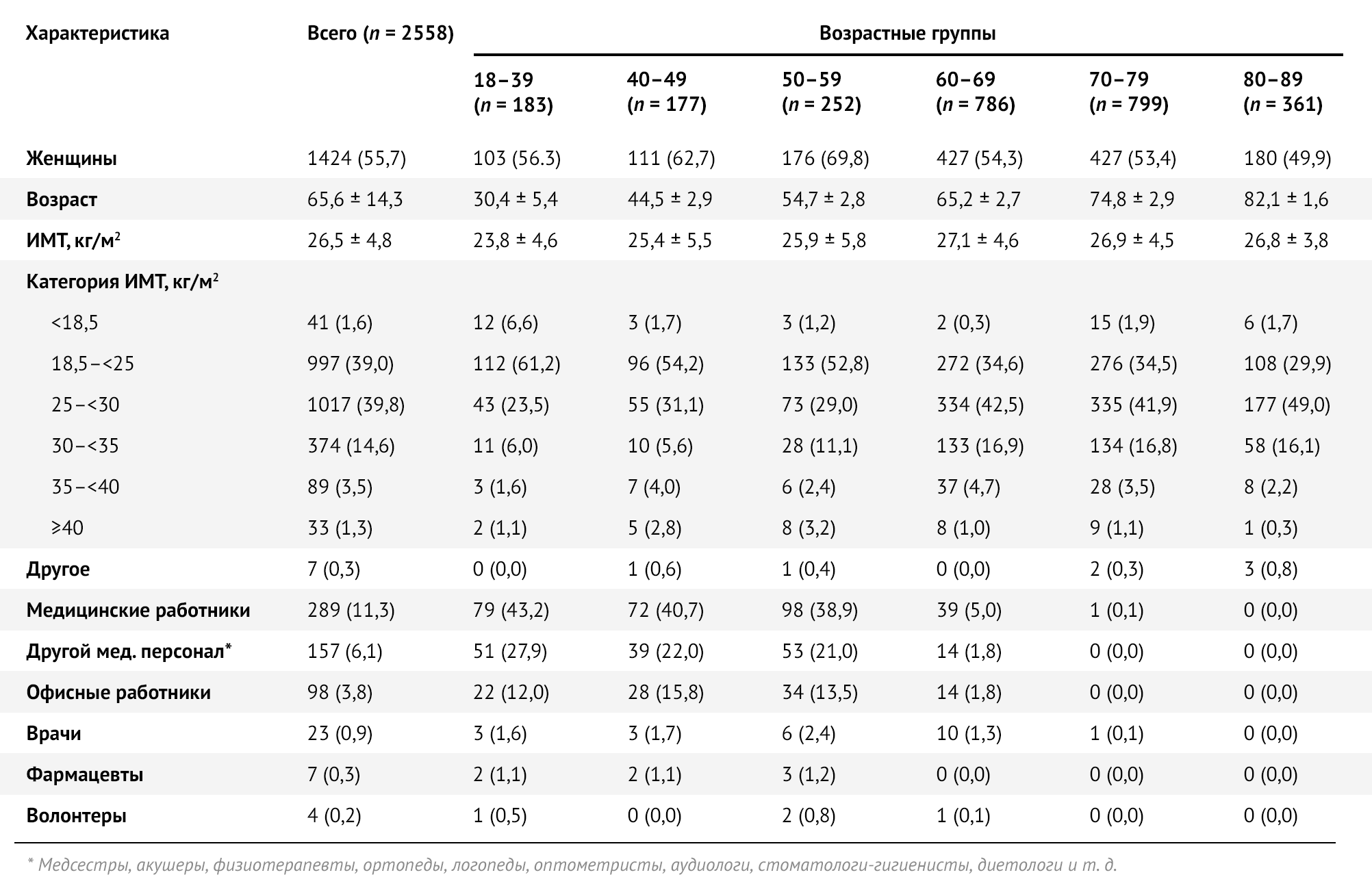
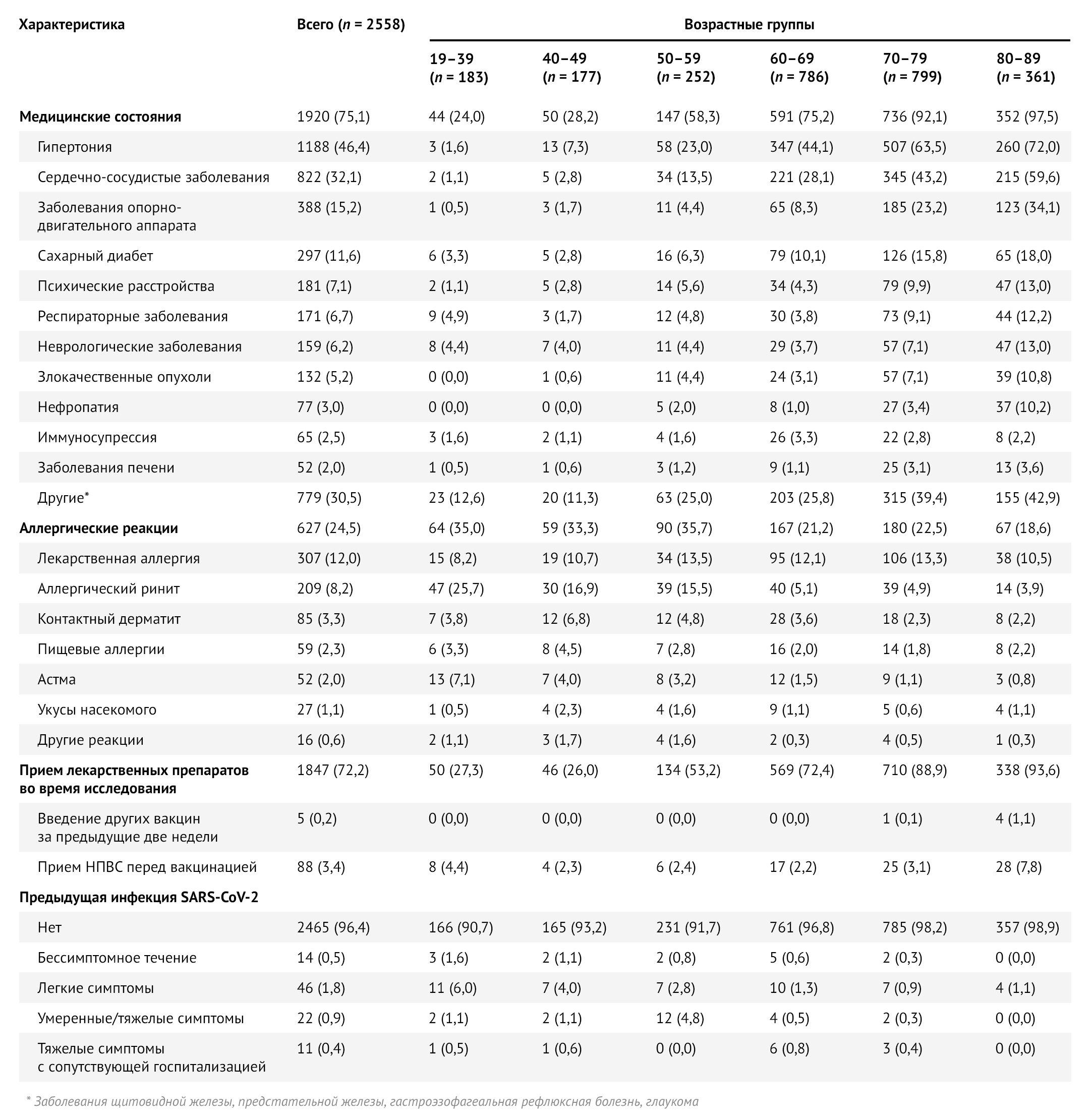
Из 2558 участников 75,1 % (n = 1920) имели хотя бы одно хроническое заболевание. Гипертоническая болезнь была наиболее частым сопутствующим состоянием (46,4 %, n = 1188), за ней следовали другие сердечно-сосудистые заболевания (32,1 %, n = 822) и ожирение (индекс массы тела 30) (19,4 %, n = 496). Перенесенная инфекция SARS-CoV-2 была зарегистрирована у 3,6 % (n = 93) участников. Лица, страдающие как минимум одним типом аллергии, составляли 24,5 % (n = 627), чаще всего аллергическая реакция была на лекарственные препараты (12,0 %, n = 307) (табл. 2).
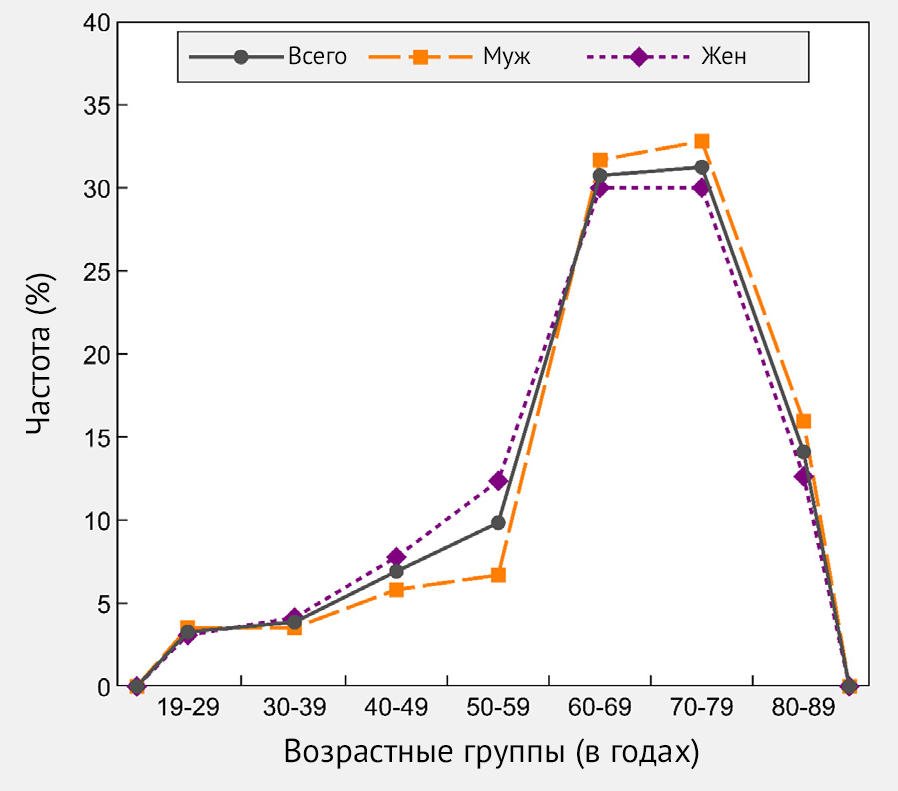
Рисунок 1 | Процентное распределение исследуемой выборки (n = 2558) по возрасту, в целом и по полу — Республика Сан-Марино, 2021 г.
3.2. ПППИ после первой дозы
В целом частота ПППИ после первой дозы составила 53,3 %. Реципиенты вакцины описали как местные, так и системные реакции в 16,4 % случаев; кроме того, 25,8 % сообщили о системных реакциях и 10,2 % сообщили только о местных симптомах. Наиболее частыми местными реакциями были боль (24,8 %), припухлость (3,7 %), повышение температуры (2,2 %) и отечность в месте инъекции (1,9 %). Наиболее частыми системными симптомами были астения (23,8 %), головная боль (18,5 %), боль в суставах (16,5 %), озноб (16,5 %), боль в мышцах (16 %), лихорадка (11,9 %) и недомогание (11,8 %) (рис. 2 и 3). См. доп. табл. 1 для других ПППИ, которые не входили в предоставленный список, но были спонтанно сообщены реципиентами вакцины.
Таблица 2 | Исходные клинические характеристики исследуемой выборки в целом и по возрастным группам — Республика Сан-Марино, 2021 г. Значения — это числа (проценты).
Большинство симптомов появилось в течение 24–48 часов после инъекции (85,7 %) и реже через несколько минут (4,5 %), 3–5 дней (4,2 %) и 6–7 дней (1,4 %); 4,3 % пациентов, сообщивших о ПППИ, не предоставили информацию о времени появления симптомов.
Частота ПППИ в возрастной группе 60–89 составила 43,7 % (95 % ДИ 41,5–45,9); 10,1 % пациентов сообщили о местных симптомах (95 % ДИ 8,9–11,5), 24,7 % сообщили о системных симптомах (95 % ДИ 22,8–26,6) и 8,0% сообщили как о местных, так и о системных симптомах (95 % ДИ 6,9–9,3). В целом обнаружено, что частота участников, не сообщивших об отсутствии ПППИ, постепенно увеличивалась с 10,4 % в возрастной группе 18–39 лет до 63,2 % в возрастной группе 80–89 лет (рис. 2).
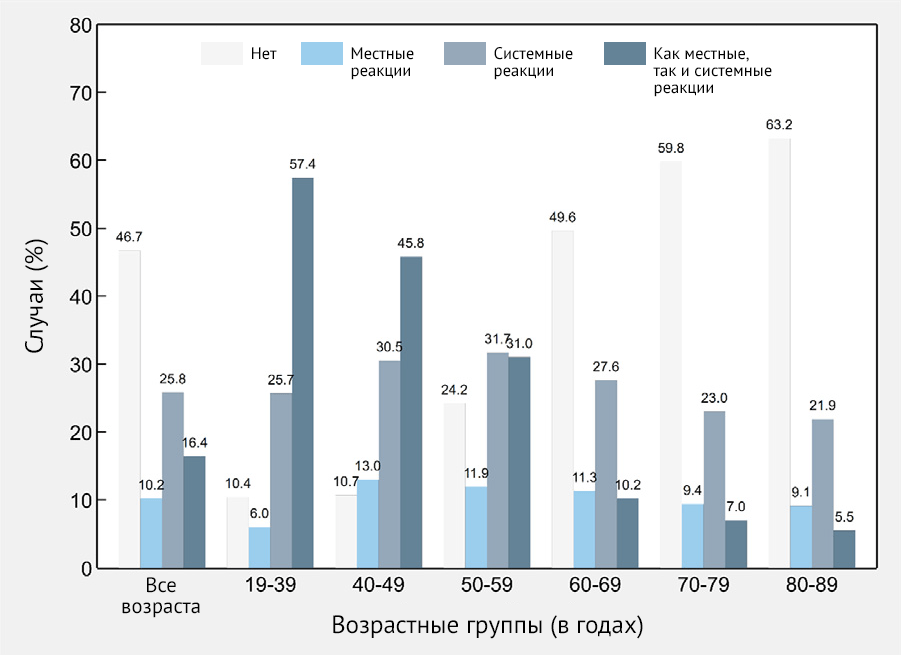
Рисунок 2 | Частота местных и системных нежелательных явлений после иммунизации первым компонентом вакцины Sputnik V (n = 2558) в целом и по возрастным группам — Республика Сан-Марино, 2021 г.
ПППИ медикаментозно лечили 29,2 % пациентов (4,1 % пропущенных значений). 88 участников исследования (3,4 %) сообщили, что они принимали болеутоляющие и/или противовоспалительные препараты в день вакцинации до ее непосредственного проведения (табл. 2).
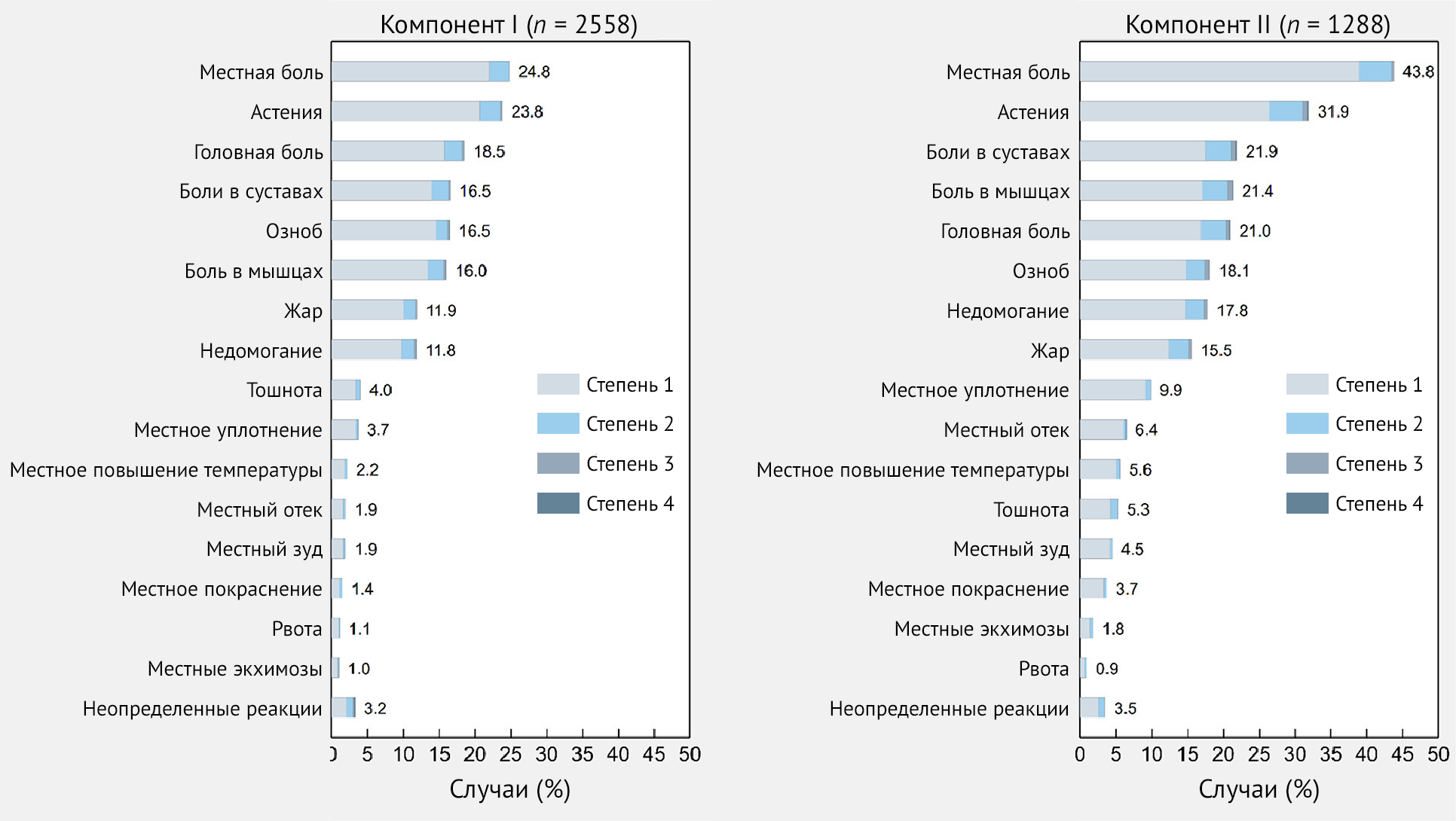
Рисунок 3 | Частота специфических побочных эффектов — как местных, так и системных — после иммунизации первым и вторым компонентом вакцины Sputnik V — Республика Сан-Марино, 2021 г.
3.3. ПППИ после второй дозы
Около половины (50,4 %, n = 1288) участников исследования, ответивших на анкету Q1, заполнили Q2 после второй дозы вакцины (табл. 3). В целом частота ПППИ составила 66,8 %; как местные, так и системные реакции были зарегистрированы в 31,9 % случаев; кроме того, 18,5 % сообщили о системных реакциях, а 16,1 % сообщили только о местных симптомах. Среди местных реакций наиболее часто упоминались боль (43,8 %), припухлость (9,9 %), отек (6,4 %) и повышение температуры (5,6 %) в месте инъекции. Часто сообщаемыми системными симптомами были астения (31,9 %), боль в суставах (21,9 %), мышечная боль (21,4 %), головная боль (21,0 %), озноб (18,1 %), недомогание (17,8 %) и лихорадка (15,5 %) (рис. 3 и 4). См. доп. табл. 2, где указаны другие ПППИ и те, которые не входили в предоставленный список, но были спонтанно сообщены реципиентами вакцины.
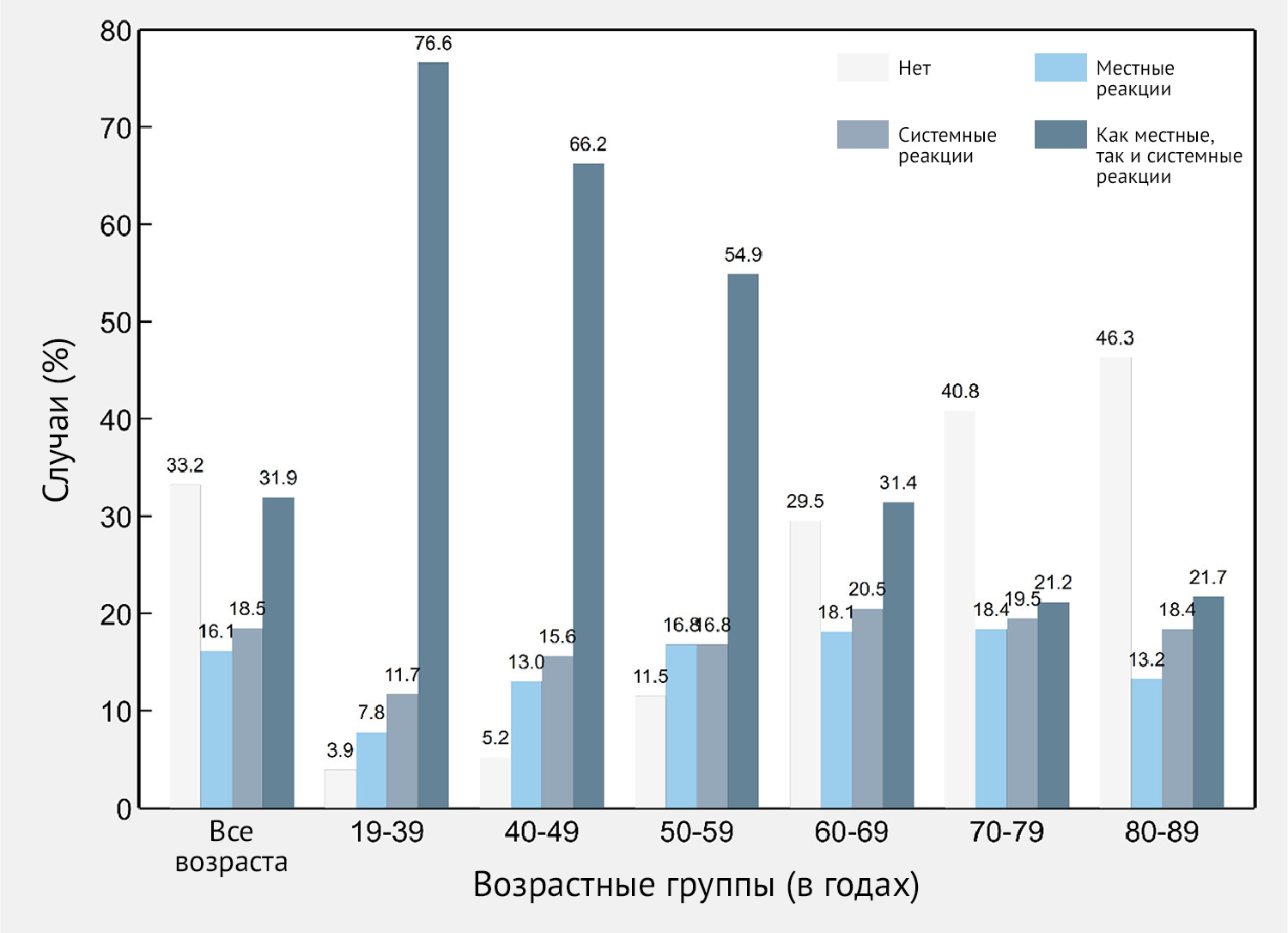
Рисунок 4 | Частота местных и системных нежелательных явлений после иммунизации вторым компонентом вакцины Sputnik V (n = 1288) в целом и по возрастным группам — Республика Сан-Марино, 2021 г.
Большинство симптомов появилось в течение 24–48 часов после инъекции (87,2 %) и реже — через несколько минут (4,3 %), 3–5 дней (3,4 %) и 6–7 дней (0,6 %); 4,5 % пациентов, отмечавших ПППИ, не предоставили информацию о сроках появления симптомов. Частота ПППИ в возрастной группе 60–89 составила 60,0 % (95 % ДИ 57,0–63,0); 16,9 % пациентов сообщили о местных симптомах (95 % ДИ 14,8–19,4), 19,4 % сообщили о системных симптомах (95 % ДИ 17,1–21,9) и 23,4 % сообщили как о местных, так и о системных симптомах (95 % ДИ 20,9–26,1).
Частота участников, сообщивших об отсутствии ПППИ, постепенно увеличивалась с 3,9 % в возрастной группе 18–39 лет до 46,3 % в возрастной группе 80–89 лет (рис. 4).
ПППИ медикаментозно лечили 27,3 % пациентов. 44 участника исследования (3,4 %) сообщили, что они принимали обезболивающие и/или противовоспалительные препараты до получения второй дозы вакцины.
Таблица 3 | Социально-демографические и клинические характеристики лиц, получивших один компонент против двух компонентов вакцины Sputnik V — Республика Сан-Марино, 2021 г. Значения — это числа (в процентах) или среднее стандартное отклонение.
На рис. 5 показаны различия между двумя дозами Sputnik V в частоте возникновения ПППИ после инъекции. В частности, данные для субъектов в возрасте 60 лет были статистически значимыми (p < 0,001). Наибольшая частота (81,8 %) ПППИ после второй дозы с сообщением о ПППИ после первой дозы наблюдалась в возрастной группе 60–69 лет, в то время как для тех, кто не сообщил о каких-либо ПППИ после первой дозы, была обнаружена частота 58,0 % после второй дозы у той же возрастной группы.
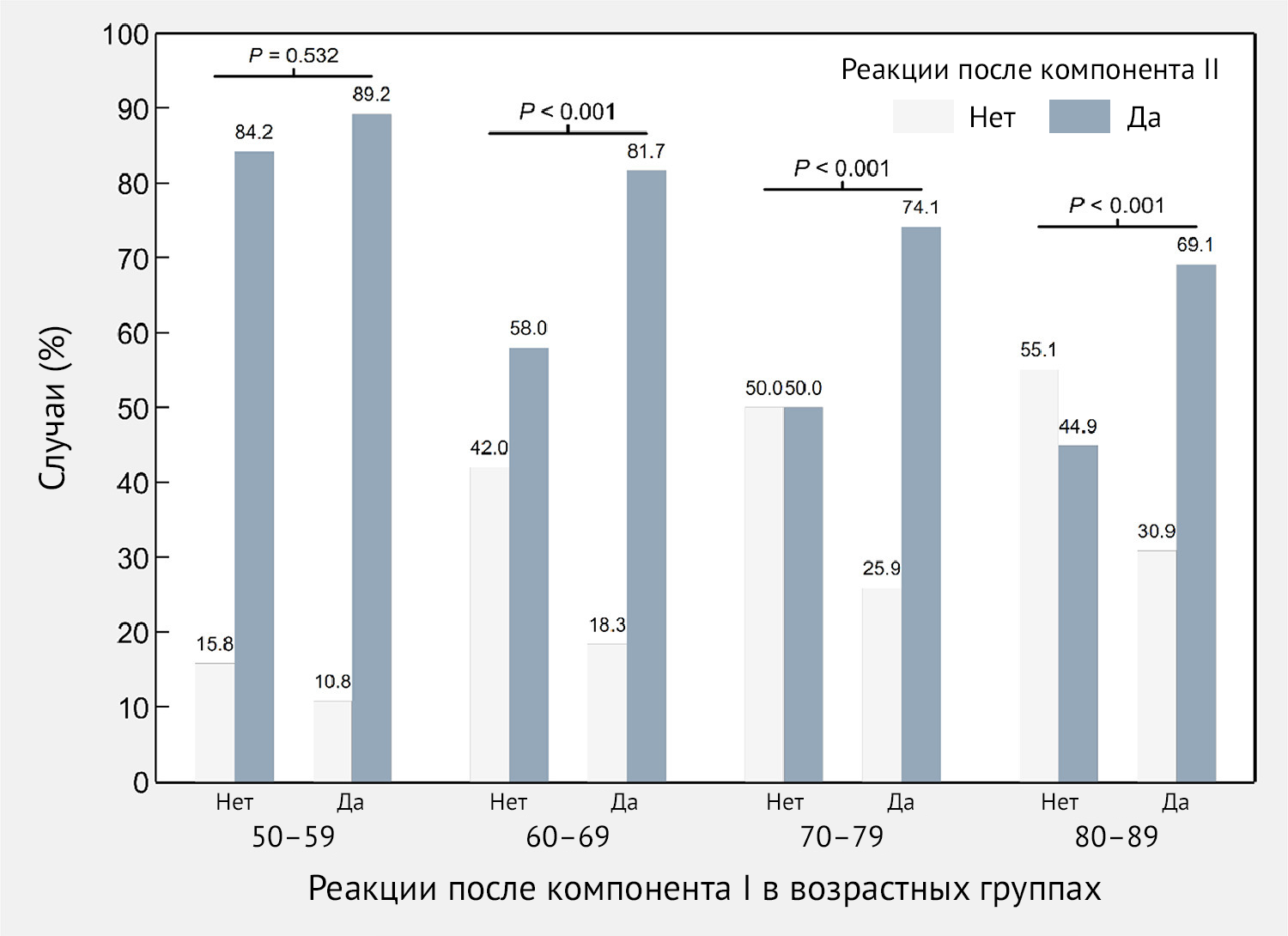
Рисунок 5 | Частота специфических нежелательных явлений — как местных, так и системных — после иммунизации (ПППИ) вторым компонентом вакцины Sputnik V в зависимости от наличия или отсутствия ПППИ после введения первого компонента по возрастным группам — Республика Сан-Марино, 2021 г.
3.4. Оценка ПППИ
После первой дозы вакцины участники, сообщавшие о симптомах не более 1 степени, составили 43,5 % (n = 1112), не более 2 степени — 8,7 % (n = 223), не более 3 степени — 0,8 % (n = 20), и не более 4 степени – 0,3 % (n = 8). Оценка симптомов 4 степени была самостоятельной у 0,1 % реципиентов соответственно и касалась озноба, головной боли и местных симптомов. После второй дозы вакцины участники, сообщившие о симптомах не более 1 степени, составили 53,8 % (n = 693), не более 2 степени —11,3 % (n = 146), не более 3 степени — 1,3 % (n = 17), и не более 4 степени — 0,3 % (n = 4). Симптомами, о которых участники самостоятельно сообщали как о симптомах 4 степени, были астения (0,2 %), головная боль (0,2 %), боль в суставах (0,2 %), озноб (0,1 %), мышечная боль (0,1 %) и местные симптомы (0,1 %) (доп. табл. 3, 4).
После сверки с записями государственной больницы сообщений о 5 степени ПППИ (летальный исход) зарегистрировано не было. Среди реципиентов вакцины, которые сами сообщили о симптомах 4 степени, десять человек действительно были госпитализированы в отделение неотложной помощи. Один из них, в анамнезе которого были множественные аллергии, перенес ларингоспазм, сыпь на коже грудной клетки, сильную головную боль и сильную боль в суставах, что потребовало срочного медикаментозного лечения и медицинского наблюдения. Еще один пациент потерял сознание, однако подобные эпизоды неоднократно отмечались у него в прошлом. Наконец, 8 пациентов были госпитализированы в отделение неотложной помощи с жалобами на различные симптомы (например, парестезию верхних конечностей, сухость во рту, боли в межреберьях), но сохраняли стабильные жизненно важные показатели. Данные пациенты получали анксиолитики и вскоре были выписаны из больницы. Больных не госпитализировали.
Среди 60-летних реципиентов после первой дозы 1,3 % (n = 17) сообщили о ПППИ не более 3 степени и 0,3 % (n = 4) — не более 4 степени. Что касается второй дозы, то степень тяжести ПППИ составила 0,4 % (n = 4) и 0,3 % (n = 3) не более чем для 3 и 4 степени соответственно (доп. табл. 3, 4).
3.5. ПППИ после первой и второй доз
В целом 979 из 1288 участников (76,0 %) сообщили о некоторых ПППИ после введения того или иного компонента вакцины; 14,7 % сообщили только о местных симптомах, 19,8 % — только о системных симптомах и 40,8 % — о местных и системных симптомах (оставшиеся 0,7 % не указали, являются ли их симптомы системными или местными). 27 из 1288 исследуемых (2,1 %) заявили, что перенесли симптомы 3–4 степени.
В возрастной группе 60–89 (n = 1021) общая частота ПППИ составила 70,0 % (95 % ДИ 67,1–72,8); 16,3 % (95 % ДИ 14,1–18,6) сообщили только о местных симптомах, 21,6 % (95 % ДИ 19,2–24,3) — только о системных симптомах и 31,4 % (95 % ДИ 28,7–34,4) — как о местных, так и о системных симптомах (неуточненные симптомы были в 0,7 % случаев). 8 из 1021 испытуемых (0,8 %, 95 % ДИ 0,4–1,5) заявили, что страдали симптомами 3–4 степени.
4. Обсуждение
Данное исследование ROCCA по Sputnik V (Гам-КОВИД-Вак) является первым обсервационным исследованием, проведенным с целью оценки безопасности этой вакцины, и дает возможность выявить потенциальные ПППИ, отражая, таким образом, фактическую подверженность побочным эффектам.
Этот предварительный анализ предполагает более высокий или равный профиль переносимости вакцины Sputnik V в возрастной группе старше 60 лет после приема обеих доз по сравнению с другими широко распространенными вакцинами COVID-19 [12–14]. Наши результаты также согласуются с выводами I–II фаз ранее проведенных исследований [15], а затем подтверждены III фазой испытания вакцины [9] с точки зрения общей безопасности и переносимости. О госпитализации или смерти в течение исследования не сообщалось. Почти все зарегистрированные ПППИ были легкой или средней степени тяжести и/или длились менее двух дней, и более чем в двух третях случаев не сообщалось о необходимости приема в этой связи каких-либо препаратов. Частота участников, которые сообщали об отсутствии ПППИ, постоянно росла наряду с увеличением возрастных групп после приема обеих доз. Подавляющее большинство ПППИ появилось в течение 2 дней после прививки. Это касается как первой, так и второй дозы вакцины. Местная болевая реакция была наиболее частым ПППИ как после первой, так и после второй дозы, за ней следовали астения и головная боль при первой дозе по сравнению с болью в суставах при второй дозе. В частности, частота местных симптомов значительно ниже, чем при других испытаниях вакцины против COVID-19 в возрастных группах, аналогичных данной выборке (60 лет) [16,17]. Большинство ПППИ были описаны как легкие и умеренные (степень 1 и 2), тогда как только несколько участников сообщили о тяжелых (степень 3 и 4) ПППИ. Для участников в возрасте 60 лет и старше мы можем с уверенностью утверждать, что Sputnik V (Гам-КОВИД-Вак) не вызывал никаких вопросов к безопасности, продемонстрировав очень ограниченное количество ПППИ 3 и 4 степени как после первой, так и второй дозы; среди тяжелых симптомов, о которых сообщалось самими реципиентами (степень 4), большинство соответствовало перекрестной проверке в государственной больнице, но лишь немногие были госпитализированы в отделение неотложной помощи для наблюдения.
В целом системные симптомы имели сходную частоту по сравнению с имеющимися данными о других вакцинах, используемых во всем мире [16–19]. Среди них астения регистрировалась реже, чем для доступных мРНК-вакцин, как для первой, так и для второй дозы, тогда как лихорадка и озноб были более частыми, особенно после первой дозы [16, 17].
Количество участников, сообщающих как о местных, так и о системных ПППИ, увеличились после введения второй дозы по сравнению с первой. Что касается тех, кто сообщает только о местных ПППИ, такое же увеличение особенно заметно в старших возрастных группах.
Полученные в ходе исследования результаты позволили выяснить, как у людей старше 60 лет сообщение о ПППИ после первой дозы может быть предиктором рецидива ПППИ после второй дозы. Среди тех, у кого были ПППИ после первой дозы, вероятность ПППИ после второй дозы снижалась с увеличением возраста. Около половины участников отмечали ПППИ после второй дозы, а не после первой.
Исследование ROCCA имеет несколько ограничений. Поскольку исследователи представляют нефинансируемый предварительный анализ и учитывая, что кампания вакцинации все еще продолжается, выборка исследования ограничена. В частности, это ставит под угрозу возможность полного выявления редких ПППИ, таких как тромбоз, в контексте осложнений аденовирусных векторных вакцин [20], что было описано в одном случае в дополнительных материалах исследования III фазы [9]. Сбор дополнительных данных необходим, особенно для различных демографических групп и подгрупп, имеющих определенные сопутствующие заболевания (например, диабет, неврологические заболевания), которые в данном исследовании ограничены наиболее старшими возрастными группами. Действительно, самые молодые возрастные группы не совсем адекватно представлены в данной выборке, поскольку кампания вакцинации все еще находится на начальных этапах, в которых приоритет отдается, в частности, пожилым людям. Таким образом, результаты еще могут измениться, когда будет представлен окончательный анализ. Поскольку сбор данных планируется завершить к концу августа 2021 года, окончательные результаты ожидаются к концу 2021 года. Эти проблемы будут решаться по мере продвижения кампании в отношении более молодого населения в соответствии с графиком, а исследователи обещают предоставить дальнейший анализ в конце трехмесячного наблюдения, в том числе для подгрупп с сопутствующими заболеваниями. Наконец, дальнейшее медицинское наблюдение по-прежнему охватывает короткий период времени и может быть недостаточно отдалено от введения вакцины для выявления любых отсроченных ПППИ.
Исследование ROCCA по вакцинации представляет собой первую попытку изучить ПППИ вакцины Sputnik V в реальных условиях с популяцией с сопутствующими заболеваниями, в отличие от испытаний I, II, III фазы. Как указывалось ранее, последующее наблюдение в течение не менее трех месяцев после введения первой дозы и включение в кампанию вакцинации других возрастных групп позволит получить репрезентативную выборку всего населения Сан-Марино и описать любые другие нетипичные или редкие ПППИ. Совершенно очевидно, что необходимы дальнейшие исследования эффективности, чтобы составить общую картину по данной вакцине.
Кампания вакцинации в Республике Сан-Марино началась позже, чем в других странах, но массовое внедрение вакцины Sputnik V помогает быстро наверстать упущенное. Демонстрация ее безопасности — еще один шаг на долгом пути к окончательному преодолению пандемии, и исследование ROCCA будет отслеживать этот параметр до конца кампании. Исследователи надеются, что полученные результаты будут способствовать широкому использованию вакцин против COVID-19, чтобы достичь уровней охвата вакцинацией (коллективного иммунитета), необходимых для сдерживания распространения инфекции.
