Парацетамол — старое лекарство с новым механизмом действия

Аннотация
Парацетамол (ацетаминофен) — это наиболее часто используемое безрецептурное лекарственное средство во всем мире. Однако, несмотря на популярность и применение в течение многих лет, его безопасность и механизм действия до сих пор неясны. На сегодняшний день считается, что парацетамол — лекарство со множественным действием, и в его обезболивающий и жаропонижающий эффекты вовлечено, как минимум, несколько метаболических путей.
Механизм действия парацетамола состоит в ингибировании циклооксигеназ (ЦОГ-1, ЦОГ-2 и ЦОГ-3), воздействии на эндоканнабиноидную систему и серотонинергический путь. Кроме того, он влияет на каналы транзиторного рецепторного потенциала (TRP-каналы), потенциал-зависимые калиевые каналы Kv7 и ингибирует быстрые кальциевые каналы Cav3.2. В пути синтеза монооксида азота парацетамол затрагивает L-аргинин.
Таким образом, цель данного обзора заключается в обобщении текущих знаний о механизмах действия парацетамола с пристальным вниманием к безопасности его применения.
▶ Читайте также: Dark side: побочные эффекты лекарств
Введение
Парацетамол (рекомендованное непатентованное международное название ацетаминофена (N-ацетил-пара-аминофенол, АПАФ)) был синтезирован Хармоном Морзе в 1878 году и впервые применен в медицинской практике в 1893 году Йозефом фон Мерингом как жаропонижающее и обезболивающее средство [1–3].
Вначале его использовали редко, отдавая предпочтение фенацетину. Однако после того как стало понятно, что парацетамол является основным метаболитом фенацетина и при этом обладает лучшей по сравнению с ним переносимостью, в 1950-х годах парацетамол вытеснил нефротоксичный фенацетин [4–6] и стал с тех пор широко распространенным препаратом.
Простагландины — основные медиаторы боли при воспалении [7–8]. Ферменты, ответственные за их синтез, получили название циклооксигеназ [9]. В 1971 году Джон Вейн обнаружил первую циклооксигеназу (ЦОГ-1) [10]. Это открытие помогло объяснить механизм действия аспирина, который активно использовали с 1899 года как обезболивающее и противовоспалительное средство [10]. Затем в 1991 году Кси с соавт. в лаборатории Дэниеля Симмона университета Бригама Янга открыли вторую циклооксигеназу (ЦОГ-2) [11, 12]. Интересно, что структура фермента ЦОГ-2 значительно не отличается от структуры ранее обнаруженной ЦОГ-1 [13]. Но, несмотря на это, их клиническое значение различно [14, 15]. Наконец, в 2002 году Чандрасекхаран с соавт. обнаружили у собак третью циклооксигеназу (ЦОГ-3) и предположили, что ее экспрессия может играть роль в жаропонижающем эффекте парацетамола [16]. Однако воздействие парацетамола на ЦОГ-3 недостаточно для объяснения всех наблюдаемых эффектов. Соответственно, цель данного обзора — суммировать текущие знания о механизмах действия парацетамола.
Циклооксигеназы
Простагландин-эндопероксид H-синтаза (PGHS) — бифункциональный фермент, состоящий из двух белковых субъединиц, обладающих циклооксигеназной и пероксидазной (POX) активностью, и превращающий арахидоновую кислоту (АК) в простагландин H2 (PGH2) [17]. ЦОГ начинает биосинтез простагландинов (PG) с высокоспецифичного окисления арахидоновой кислоты в положении 11R и заканчивает в 15S, образуя PGG2. Далее POX превращает PGG2 в PGH2 [17]. Затем различные тканевые ферменты превращают простагландин Н в D (PGD2), E (PGE2), и F (PGF2) типы, простациклины (PGI2), и тромбоксаны А2 и B2 (TXA2 и TXB2 соответственно) [18] (Рисунок 1). Перечисленные производные липидов имеют широкий спектр влияния на организм человека (описано в Таблице 1).
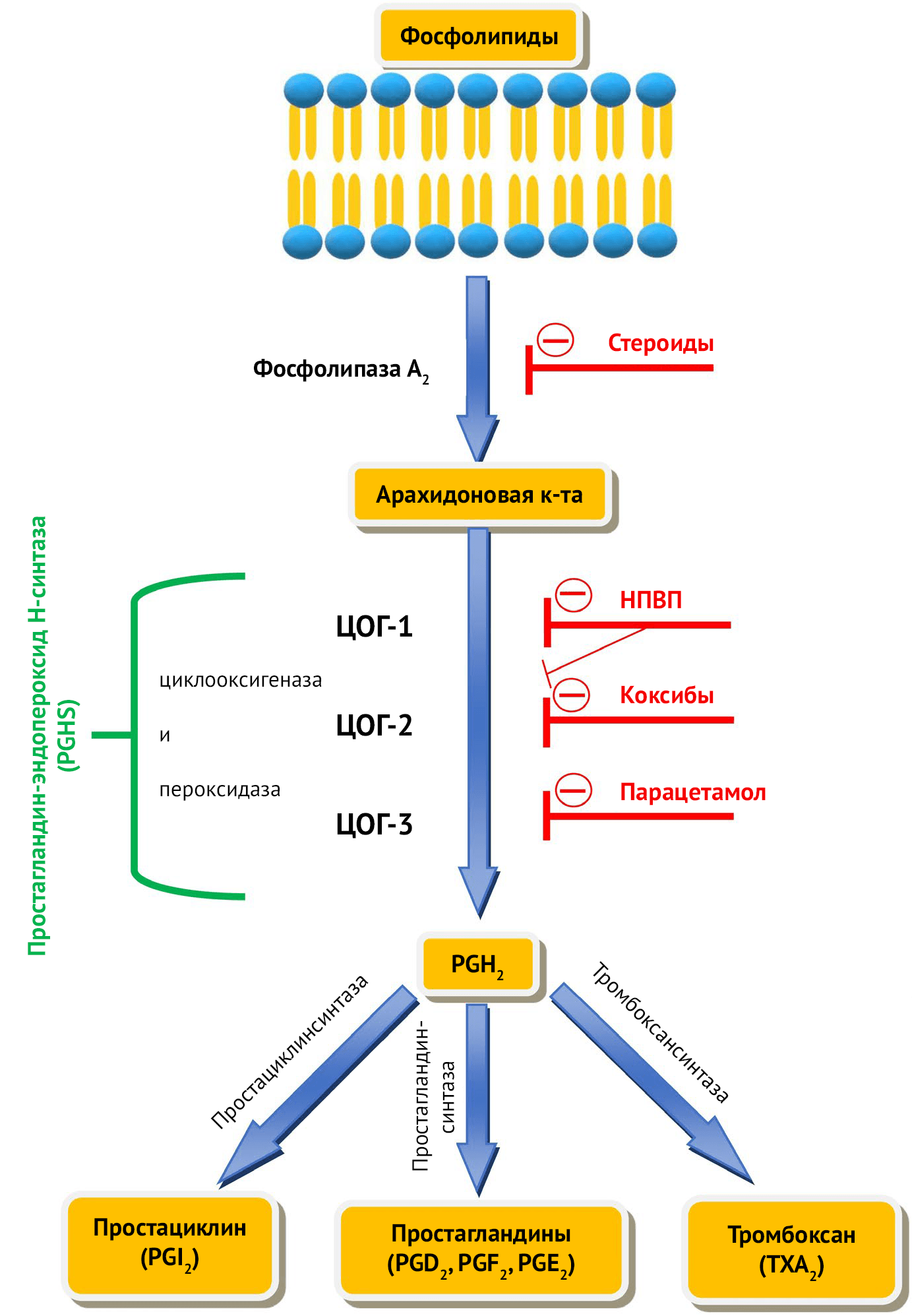
Распространенное лечение нестероидными противовоспалительными препаратами (НПВП) основано на их ингибировании ЦОГ-1 и ЦОГ-2 в различных соотношениях [19, 20]. ЦОГ-1 — это конститутивный фермент, который постоянно экспрессируется во многих тканях, главным образом в слизистой оболочке желудка и почек [21, 22]. Следовательно, частый прием высоких доз НПВП уменьшает выработку защитных простагландинов Е2 (PGE2) и I2 (PGI2) в слизистой оболочке желудка, что может привести к побочным эффектам со стороны желудочно-кишечного тракта — таким как язва желудка [23]. С другой стороны, ЦОГ-2 проявляет активность только при текущем воспалении [24]. Поэтому препараты, селективные по отношению к ЦОГ-2 (коксибы), уменьшают побочные эффекты, вызванные при терапии ЦОГ-1-зависимыми препаратами [25]. К сожалению, в кровеносных сосудах именно ЦОГ-2 преимущественно обеспечивает синтез PGI2, который необходим для защиты от ишемии сосудов [26]. А это значит, что селективные ингибиторы ЦОГ-2 снижают образование PGI2, повышая риск сосудистой ишемии и сердечных заболеваний [27]. Обнаружение селективных ингибиторов ЦОГ способствовало развитию индивидуализированной терапии пациентов, так как позволило выбирать наиболее подходящий селективный ингибитор в зависимости от желаемого клинического действия и возможного побочного эффекта со стороны желудочно-кишечного тракта или сердечно-сосудистой системы [28–30]. Распространенные НПВП оказывают жаропонижающий эффект в результате ингибирования липополисахарид (ЛПС)-индуцируемого фермента ЦОГ-2, экспрессируемого в эндотелиальных клетках гипоталамуса, в которых он вызывает опосредованное PGE2 повышение температуры [31]. Однако при действии парацетамола и других лекарств, имеющих анальгезирующий и жаропонижающий эффект, такой взаимосвязи не наблюдается. Из-за отсутствия противовоспалительного действия было предположено, что эти препараты взаимодействуют с ЦОГ-3 [16].
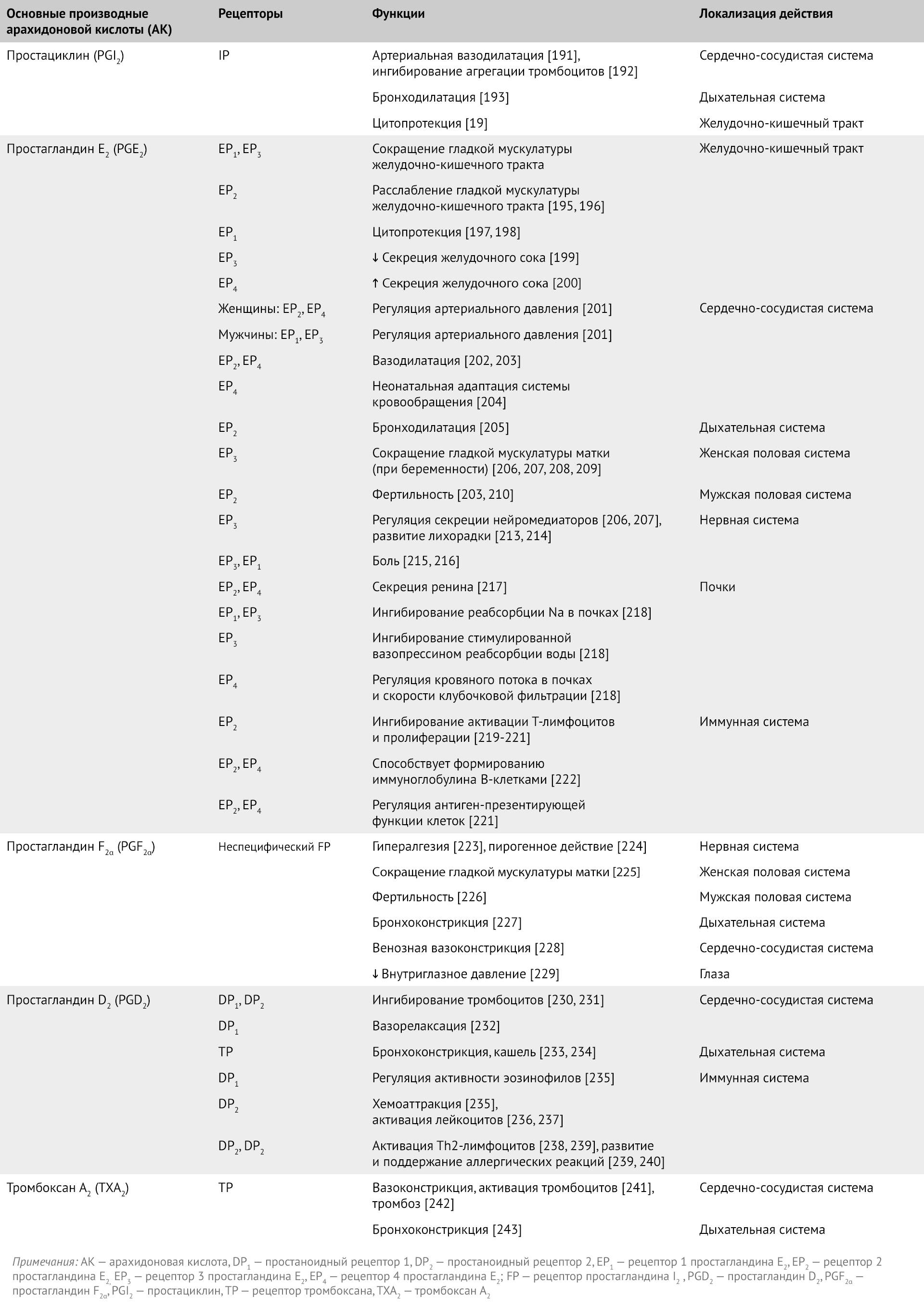
Таблица 1 | Рецепторы простагландинов, простациклинов и тромбоксанов и их предполагаемое физиологическое действие; по материалам статей [19, 90]
Уникальные свойства ЦОГ-3
Открытие ЦОГ-3 дало большую надежду на понимание механизмов действия некоторых часто используемых жаропонижающих и болеутоляющих лекарств — в частности, парацетамола [16, 32]. Хотя, как предполагает Чандрасекхаран с соавт., по механизму действия ЦОГ-3 может напоминать уже ранее открытые изоформы, но, по-видимому, она имеет и характерные отличительные особенности [16]. Открытие ЦОГ-3 у собак методами молекулярного клонирования вызвало множество вопросов [20]. В первую очередь, интересным оказалось то, что мРНК ЦОГ-3 и мРНК ЦОГ-1 — это продукты одного и того же гена, но в отличие от мРНК ЦОГ-1, у мРНК ЦОГ-3 при сплайсинге сохраняется интрон 1 [16]. Модификация привела к вставке двух аминокислотных остатков ниже инициаторного метионила, что обеспечило добавление 30 аминокислотных остатков к сигнальному пептиду. В результате образуется функционально отличный полипептид, обладающий высокой чувствительностью к обезболивающим/жаропонижающим препаратам; но при этом такая чувствительность сопровождается низким противовоспалительным эффектом [16]. Тем не менее, непосредственный механизм превращения мРНК ЦОГ-3 в активный фермент не ясен [16, 20, 33].
Чандрасекхаран с соавт. провели исследование по сравнению чувствительности трех изоферментов циклооксигеназ, экспрессируемых в клеточной культуре, к ингибированию селективными НПВП [16]. ЦОГ-3 обладала большей чувствительностью к ингибированию парацетамолом, индометацином, диклофенаком, ибупрофеном и аспирином, чем ЦОГ-1 и ЦОГ-2 [16]. Это говорит о том, циклооксигеназная активность ЦОГ-3 фармакологически отличается от ЦОГ-1 и ЦОГ-2, но более сходна с таковой у ЦОГ-1 [16, 34]. В некоторых исследованиях сообщалось, что индуцибельная ЦОГ-3 синтезирует меньше PGE2 по сравнению с ЦОГ-1 или ЦОГ-2 [35]. Однако это оказалось не так. Вследствие своей высокой полярности тестируемые препараты, по-видимому, не способны достичь эффективных концентраций в мозге, необходимых для воздействия на ЦОГ-3 [20]. Другой особенностью является локализация экспрессии ЦОГ-3 [36]. Изначально Чандрасекхаран с соавт. (2002) предполагали, что фермент вырабатывается в коре головного мозга и сердце. Однако, скорее всего, мРНК ЦОГ-3 экспрессируется в гипофизе и гипоталамусе, что хорошо согласуется с обнаружением сайтов, связанных с лихорадкой [16, 36–38]. Подобно НПВП, парацетамол способен проникать в центральную нервную систему через гематоэнцефалический барьер в концентрациях, эффективно ингибирующих ЦОГ-3, что также может объяснять, почему парацетамол чаще более эффективен против головной боли и лихорадки, чем некоторые НПВП [39]. Примечательно, что в ряде исследований упоминается, что ЦОГ-3 способна вызывать ремиссию при хронических воспалительных процессах и может способствовать росту опухолевых клеток шейки матки, яичников, крови, толстой кишки [35]. Более того, есть многообещающие данные о том, что у пациентов с болезнью Альцгеймера уровень ЦОГ-3 повышен; и сообщается, что длительное применение НПВП может ослаблять симптомы этого заболевания [39].
Механизм ингибирования ЦОГ-3
Выдвигаемые гипотезы участия ЦОГ-3 в развитии лихорадки и боли неоднозначны. Первые расхождения начинаются после принятия во внимание исследования фермента, синтезирующего простаноиды — соединения, которые лежат в основе развития лихорадки [20, 40]. После делеции у мыши гена ЦОГ-2 лихорадка подавляется; делеция ЦОГ-1 не вызывает подобного эффекта [40]. Такой результат свидетельствует о том, что фермент, синтезирующий простаноиды, не ассоциирован ни с белком ЦОГ-1, ни с геном ЦОГ-1, который также кодирует ЦОГ-3. Развитие лихорадки тесно связано с быстрой индукцией экспрессии ЦОГ-2 и повышением уровня PGE2 без вовлечения ЦОГ-1 или продуктов гена ЦОГ-1 — например, ЦОГ-3 [41]. Следовательно, селективные ингибиторы ЦОГ-2, оказывающие слабое влияние на ЦОГ-1 и ЦОГ-3, так же хороши для подавления лихорадки, как и традиционные НПВП [42–45].
Гипотеза о ЦОГ-3 стала терять популярность после того, как оказалось, что это фермент, столь чувствительный к парацетамолу у собак, в человеческом организме ведет себя иначе [46]. Тем не менее, аналог ЦОГ-3 собак присутствует у человека и грызунов, главным образом в центральной нервной системе (ЦНС) [47]. Длина интрона 1 человеческого ЦОГ-3 отличается на один нуклеотид от собачьего, что приводит к сдвигу рамки считывания белка [34]. Для подтверждения этого были клонированы 24 кДНК ЦОГ-1 коры головного мозга человека. Во всех клонах интрон 1 человеческого ЦОГ-1 имел длину в 94 нуклеотида, что сдвигало рамку считывания оставшейся последовательности ЦОГ-3 по сравнению с открытой рамкой ЦОГ-1 [46, 48]. Таким образом, у грызунов и людей полноценный белок содержит последовательность аминокислот, полностью отличную от ЦОГ-1 и ЦОГ-2 и не обладает каталитической активностью, позволяющей превращать арахидоновую кислоту в простагландин Н, как у собак; таким образом, участие ЦОГ-3 в опосредованном простагландинами повышении температуры у этих видов маловероятно [49, 50]. Более того, многие исследователи подтвердили, что участие ЦОГ-3 в механизме действия парацетамола у человека не находит доказательств [38, 51].
Предположение, что ЦОГ-3 отвечает за развитие боли, также не выдержало испытания временем. Боль — это гораздо более сложный процесс, чем жар, поскольку в ее развитие вовлечено значительно большее количество факторов [52]. Одни из них — это ранее упоминавшиеся простаноиды, которые предположительно синтезируется у человека в том числе при помощи ЦОГ [53]. Однако после того, как стало понятно, что ЦОГ-3 не обладает циклооксигеназной активностью, участие ЦОГ-3 в формировании боли тоже стало представляться маловероятным [49].
Наконец, все вышеописанное оспаривает гипотезу, предложенную Чандрасекхараном с соавт., согласно которой ЦОГ-3 является мишенью для жаропонижающих НПВП и лекарственных препаратов, селективных по отношению к ЦОГ-2 [16, 49], даже несмотря на то, что их исследования позволили открыть два ранее неизвестных варианта ЦОГ-1, сохраняющих интрон-1. Они также способствовали проведению детальных исследований механизма действия парацетамола, демонстрирующих его отличия от НПВП [50]. Однако в настоящее время существует лишь несколько научных статей о данном варианте сплайсинга циклооксигеназы. Таким образом, некоторые ученые до сих пор не теряют надежды на то, что обнаруженные ими три изофермента ЦОГ могут играть потенциальную роль в механизме действия парацетамола; таким образом, обсуждения все еще продолжаются [39, 54–56]. Для определения точной роли белка ЦОГ-3 и других вариантов продуктов этого гена может быть полезно проанализировать транскрипцию генов ЦОГ — в частности, гена ЦОГ-1. Все это будет способствовать лучшему пониманию механизма действия парацетамола или даже эффективному лечению злокачественных опухолей и терапии болезни Альцгеймера [39].
Парацетамол: другие механизмы действия
ЦОГ-зависимый центральный механизм
Когда концепция ЦОГ-3-зависимого действия парацетамола оказалась неприменимой, оставались гипотезы, затрагивающие ранее открытые изоферменты ЦОГ-1 и ЦОГ-2, на которые парацетамол мог воздействовать в ЦНС.
Во-первых, парацетамол не обладает выраженным противовоспалительным действием и имеет низкую частоту побочных эффектов, связанных с классическими ингибиторами ЦОГ-1, такими как аспирин [1, 57]. Следовательно, парацетамол может быть специфическим ингибитором простагландинов в ЦНС. Было показано, что парацетамол снижает синтез простагландинов в мозге в десять раз сильнее, чем в селезенке [16, 58–60] или же действует по другому механизму обезболивания, не зависящему от ингибирования синтеза простагландинов [61, 62].
Во-вторых, исследования, проведенные Грехемом и Скоттом, показали, что парацетамол действительно подавляет синтез простагландинов, но только в хорошо функционирующих клетках с достаточно высокой концентрацией арахидоновой кислоты [60]. В дальнейшем исследования, проведенные Хинзом и Брюном (и опубликованные в 2006–2012 годах), а также ряд других показали, что парацетамол преимущественно ингибирует ЦОГ-2 в условиях низкой концентрации пероксида в окружающей среде [51, 63–65]. Такое пероксид-зависимое ингибирование ЦОГ может объяснять, почему парацетамол не снижает активность тромбоцитов и не влияет на воспаление [59, 63, 64]. Кроме того, Кальгуткарет с соавт. показали, что метаболит парацетамола — N-арахидоноилфеноламин (AM404) — блокирует ЦОГ-1 и ЦОГ-2 в макрофагах, стимулированных ЛПС. В этом контексте АМ404 был почти так же эффективен, как и селективный ингибитор ЦОГ-2 — N-(2-фенокси-4-нитрофенил)-метансульфонамид (NS-398), и неселективный ингибитор ЦОГ — индометацин [66]. Другое утверждение о противовоспалительном компоненте АМ404 было выдвинуто Салиба с соавт.: они продемонстрировали, что в активированной микроглии АМ404 предотвращает синтез простагландинов (PGE2, PGD2), ингибируя активность ЦОГ-1 и ЦОГ-2 [67].
Убедительный аргумент в пользу ЦОГ-зависимого механизма действия парацетамола был представлен в исследованиях, проведенных Аюб с соавт. в 2004 и 2019 годах. У мышей с нокаутом ЦОГ-1 по сравнению с мышами дикого типа при применении парацетамола происходило снижение гипотермического эффекта параллельно с ингибированием синтеза простагландина Е2 в мозге. Однако такая зависимость отсутствовала у мышей с нокаутом ЦОГ-2, что говорит о зависимости гипотермического механизма действия парацетамола от фермента, экспрессируемого с гена ЦОГ-1 [68]. Недавние исследования также подтвердили это наблюдение [69]. Аюб и Флауэр показали, что в ЦОГ-2-зависимой и PGE2-опосредованной модели лихорадки, индуцированной эндотоксином или ЛПС, парацетамол оказывал жаропонижающее и гипотермическое действие у мышей дикого типа; у мышей с нокаутом по ЦОГ-1 такой эффект не наблюдался. Более того, терапевтическое введение парацетамола у мышей дикого типа с лихорадкой снижает биосинтез PGE2 в гипоталамусе и неэффективно у мышей с лихорадкой и нокаутом гена ЦОГ-1 [69].
Следовательно, понижение температуры тела, вызванное парацетамолом, коррелирует во времени со снижением синтеза PGE2 в головном мозге [70]. Таким образом, становится понятно, что жаропонижающий эффект парацетамола связан с ингибированием фермента, кодируемого геном ЦОГ-1 [54]. После исключения ЦОГ-3 появились две возможные мишени индуцированной парацетамолом гипотермии: ЦОГ-1 или вариант ЦОГ-1 как продукт альтернативного сплайсинга [69]. Для того, чтобы проверить, является ли ЦОГ-1 мишенью, было проведено исследование с использованием селективного ингибитора ЦОГ-1 — 5-(4-хлорфенил)-1-(4-метоксифенил) -3-(трифторметил)-1H-пиразола (SC560) и двойного ингибитора — индометацина — у нормотермных мышей. В обоих случаях, несмотря на жаропонижающий эффект парацетамола, применение фармакологически активных доз не индуцировало гипотермию [69] — в отличие от ситуаций, когда парацетамол даже в терапевтических дозах вызывал гипотермию у мышей с лихорадкой [71]. Наблюдаемый гипотермический эффект мог быть опосредован АМ404 [72, 73], что, однако, сомнительно, так как гипотермическое действие парацетамола проявлялось даже при ингибировании амидогидролазы жирных кислот (ГАЖК), опосредующей превращение парацетамола в АМ404 (Таблица 2) [74]. Таким образом, можно сделать вывод, что мишенью жаропонижающего действия парацетамола в гипоталамусе может быть вариант альтернативного сплайсинга продукта гена ЦОГ-1, а не сама ЦОГ-1 [69].
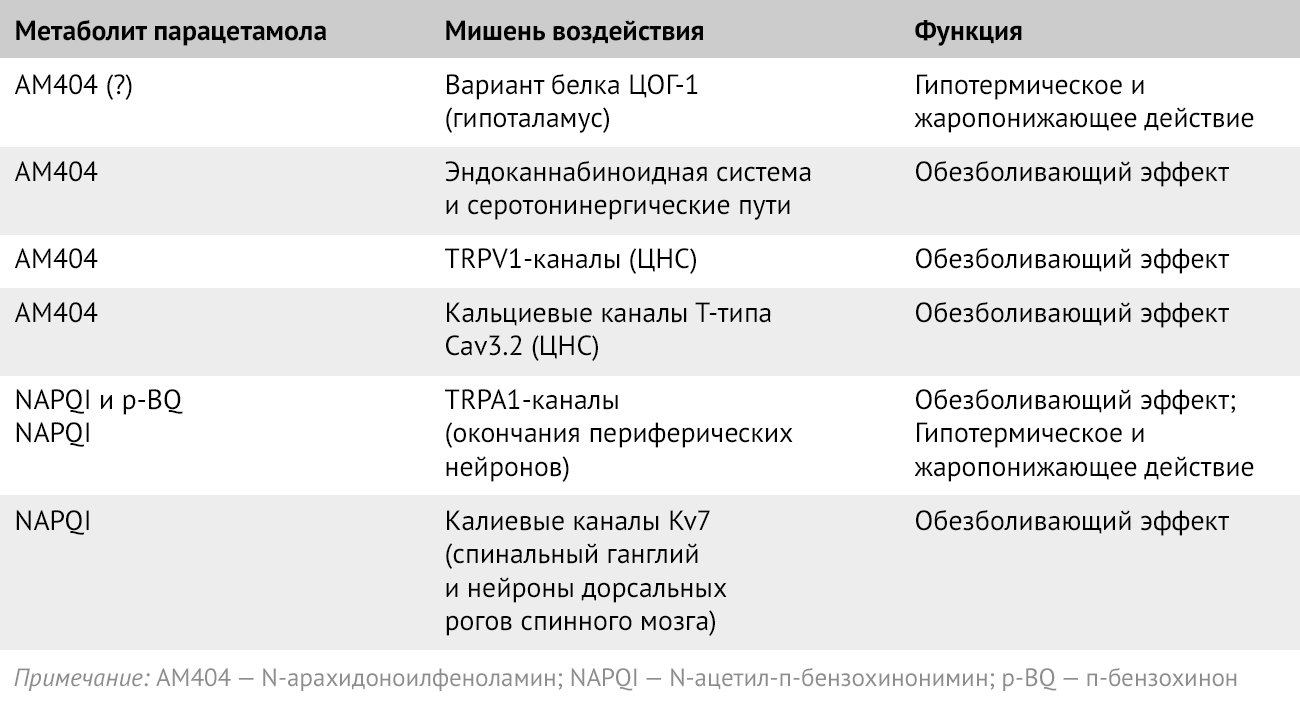
Таблица 2 | Упрощенное резюме основных и наиболее вероятных механизмов действия парацетамола
Некоторые исследования, напротив, не подтверждают ЦОГ-зависимый центральный механизм действия парацетамола. К примеру, комбинация парацетамола с ингибитором ЦОГ — ибупрофеном — улучшает болеутоляющий эффект и оказывает жаропонижающее действие, в отличие от эффекта обоих этих соединений, применяемых по отдельности. Вероятнее всего, это означает, что они имеют разные механизмы действия [75, 76]. Дальнейшие исследования показали, что парацетамол в центральной нервной системе фактически снижает воспалительную гипералгезию, связанную с образованием простагландинов под действием ЦОГ [16, 58-60]. У мышей повышенную болевую чувствительность вызывали интратекальной инъекцией PGE2 и сравнивали с введением парацетамола [77–79]. Оказалось, что парацетамол облегчал воспалительную гипералгезию не зависимо от образования простагландинов [62].
Следовательно, как было продемонстрировано в ранних и поздних исследованиях, ЦОГ-1- и ЦОГ-2-зависимый центральный механизм действия парацетамола не может быть полностью исключен, но и не является преобладающим способом действия [61]. Тем не менее, как показали недавние исследования, гипотермический и жаропонижающий эффекты парацетамола, весьма вероятно, опосредованы белковым вариантом ЦОГ-1, экспрессируемым в ЦНС.
Механизм действия через эндоканнабиодную систему
В рассматриваемом контексте стоит отметить, что ЦОГ-2 участвует в метаболизме эндоканнабиноидов за счет их окисления [80, 81]. Максимальная скорость окисления анандамида (этаноламид арахидоновой кислоты; АЕА) для ЦОГ-2 составляет 27 % от скорости окисления АК. Для ЦОГ-1 этот показатель равен 11 %, из чего следует, что эндоканнабиноид АЕА более предпочтителен как субстрат для ЦОГ-2, нежели для ЦОГ-1 [82]. Также было показано, что ЦОГ-2 участвует в деградации другого важного агониста эндоканнабиноидной системы — 2-арахидонилглицерола (2-АГ) [82, 83]. Кроме того, доказано, что конкурентные ингибиторы окисления АК циклооксигеназой-2 — такие как ибупрофен и мефенамовая кислота, — являются потенциальными ингибиторами 2-АГ с эффектом, зависящим от времени воздействия. С другой стороны, в случае индометацина — потенциального ингибитора ЦОГ с зависимым от времени действия эффектом, — ингибирования не наблюдалось [84, 85]. Следовательно, ингибирование парацетамолом ЦОГ-зависимой деградации эндоканнабиноидов или блокирование их транспортеров может оказывать обезболивающий эффект, который, однако, еще предстоит доказать [1, 86, 87].
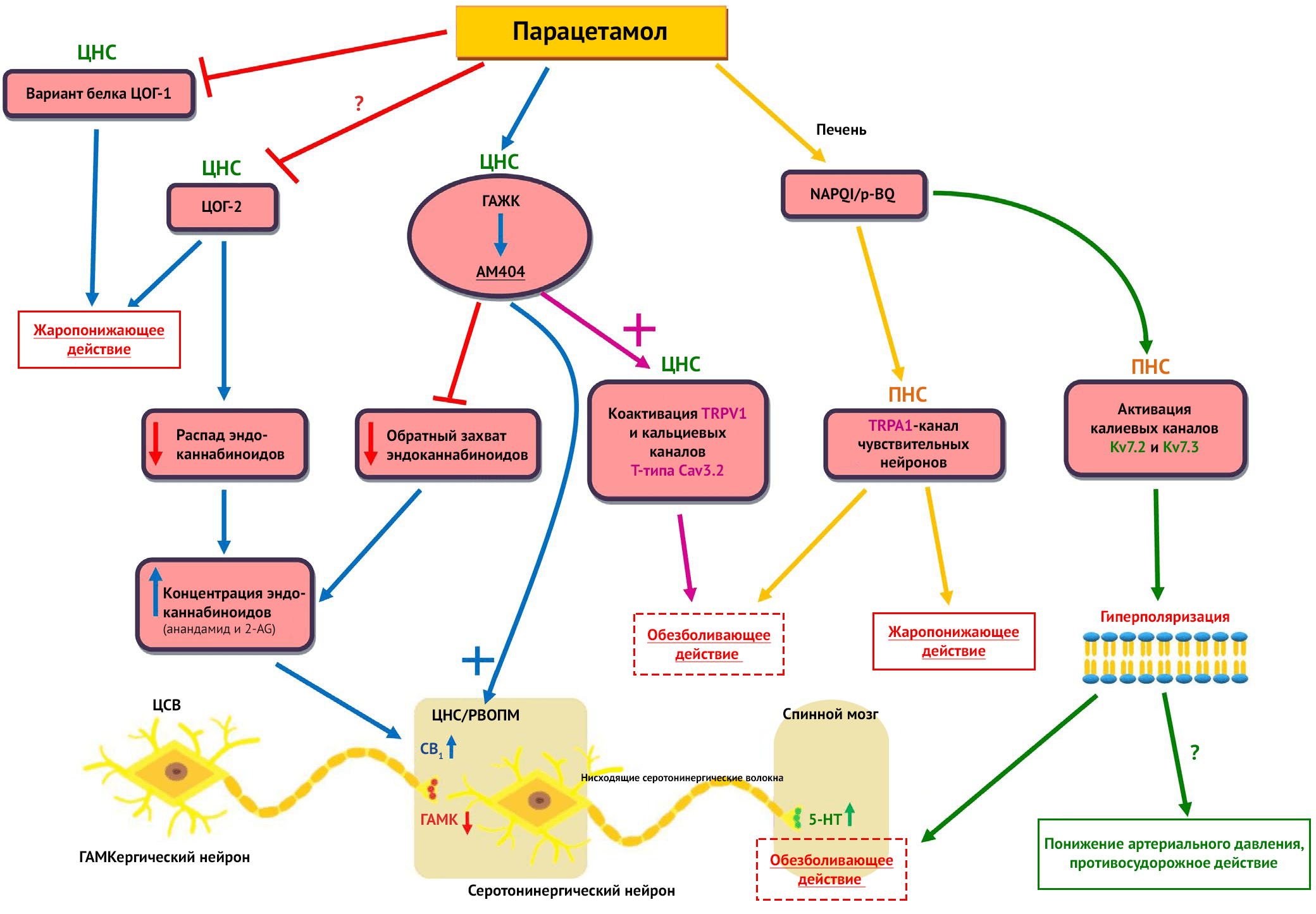
В результате деацетилирования парацетамола и присоединения к нему АК ферментом ГАЖК в ЦНС образуется метаболит — AM404, впервые обнаруженный у людей в 2017 году [88, 89]. Было показано, что АМ404 ингибирует обратный захват анандамида нейронами и астроцитами, что повышает концентрацию АЕА и 2-АГ в тканях. Это сфокусировало внимание ученых на возможности участия эндоканнабиноидной системы в механизме действия парацетамола [90, 91]. Кроме того, в ранее упомянутых исследованиях Ю с соавт. и Козака с соавт. было отмечено, что ингибирование ЦОГ-2 парацетамолом замедляло деградацию эндоканнабиноидов [80, 81]. Так, после спинального или системного введения АМ404 проявлял болеутоляющий эффект по отношению к воспалительной, невропатической боли и острой боли, вызванной химическими раздражителями [92, 93]. В то же время у мышей с недостатком каннабиноидных рецепторов и дефицитом ГАЖК парацетамол не оказывал анальгетического действия [87, 94]. Присутствие ГАЖК важно для проявления обезболивающего эффекта парацетамола [95]. В ранее упомянутых исследованиях описана взаимосвязь анальгетического действия парацетамола и эндоканнабиноидной системы. Клингер-Гратц с соавт. изучали парацетамол сходным образом, но провоцировали у мышей легкую воспалительную гипералгезию, которая входит в показания для применения парацетамола [62]. Клингер-Гратц с соавт. показали, что каннабиноидные рецепторы типа 1 (CB1), связанные с воспалительной антигипералгезией, расположены на терминалях аксонов рострального вентромедиального отдела продолговатого мозга (РВОПМ), который известен как участок контроля эндогенной боли [96]. К тому же, центральное серое вещество (ЦСВ) контролирует активность РВОПМ через нисходящие ГАМКергические аксоны [97]. В таком случае система ингибирования боли формируется совместно с сетью кортикальных участков и ядер ствола головного мозга, участка ЦСВ и проекции РВОПМ к дорсальным рогам спинного мозга [98, 99]. Это облегчает управление восходящим ноцицептивным сигналом от спинного мозга с помощью обратной связи [100] с последующей серотонинергической активацией [101]. Следовательно, возможно, что CB1-рецепторы, имеющие отношение к анальгетическому эффекту парацетамола, расположены на концах волокон, отходящих от ЦСВ и достигающих РВОПМ [62]. В этом случае вполне вероятно, что AM404 увеличивает концентрацию эндоканнабиноидов (AEA и/или 2-AG) в РВОПМ и способствует активации рецепторов CB1 на концах ГАМКергических аксонов. Это уменьшает высвобождение ГАМК из вышележащих областей мозга, таких как ЦСВ, к РВОМП, что, в свою очередь, растормаживает нисходящие от РВОМП к спинному мозгу серотонинергические волокна с последующей активацией серотониновых рецепторов в спинном мозге для усиления контроля эндогенной боли (Рисунок 2) [62]. Также стоит отметить, что парацетамол не проявляет психотропных эффектов, которые сопровождают применение классических агонистов СВ1 — например, тетрагидроканнабинола (ТГК). Эти отличия можно объяснить местными особенностями образования фармакологически активного AM404 вследствие различий в работе ГАЖК разных участков ЦНС или даже отличиями в локальной активности эндоканнабиноидной системы [62].
Парацетамол и TRP-каналы
Каналы переменного рецепторного потенциала (TRP) относятся к суперсемейству из 28 белков, которые можно разделить на семь подсемейств [102]. TRP- каналы представляют собой катион-проницаемую пору, сформированную тетрамером полипептидных субъединиц [102]. Они регулируют концентрацию ионов кальция в клетке [103] и играют важную роль при переносе молекул в ответ на различные физические и химические стимулы (изменение напряжения сдвига, осмолярности, рН, температуры, концентраций реакционноспособных молекул и других агентов) во внутриклеточной и внеклеточной среде [104]. В ряде генетических заболеваний, затрагивающих опорно-двигательный аппарат, кожу, органы чувств, сердце и нервную систему, отмечают нарушения работы этих каналов [103]. TRP-каналы хорошо известны по их действию в периферической нервной системе [103]. Результат их активности проявляется ощущением жжения от красного острого перца или васаби или же в охлаждающем действии ментола [103, 105]. В связи с этим не удивительно, что возник интерес к изучению TRP-каналов и их связи с формированием боли, болезнями легких, наследственными заболеваниями и нарушениями функции ЦНС [103, 106].
Метаболит парацетамола АМ404 не только ингибирует обратный захват эндоканнабиноидов и активирует СВ1-рецепторы, но и является агонистом TRPV1 — супраспинального термочувствительного канала переменного рецепторного потенциала подсемейства ванилоид-1 [94, 103, 107, 108]. Повышение температуры, концентрации протонов и активность фосфолипазы С вызывают активацию канала и связывают TRPV1 со множеством болевых путей [109, 110]. Агонисты TRPV1 также обладают болеутоляющими свойствами: например, разбавленный (0,1 %) крем с капсаицином можно применять в качестве безрецептурного обезболивающего [103, 111]. Более того, интратекальное введение резинифератоксина (RTX) — сильнодействующего агониста TRPV1 — вызывает постоянный обезболивающий эффект, так как разрушает сигнальный потенциал чувствительных нейронов [112]. Например, интратекальное введение RTX страдающим от боли при остеосаркоме собакам резко снижает их болевое поведение [113]. Следовательно, возможно, что анальгезирующее действие парацетамола также связано с TRPV1 и каннабиноидными СВ1-рецепторами, так как они оба задействованы в терморегуляторных и болевых путях [88, 114–116]. В исследовании 2008 года Фиораванти с соавт. подтвердили совместное участие CB1 и TRPV1 в обезболивающем эффекте парацетамола [117]. Было показано, что анальгезия, вызванная AM404, не наблюдается как у мышей TRPV1–/–, так и при введении антагониста TRPV1 — капсаицина — в желудочки мозга [117]. Стоит отметить, что в ядре среднемозгового пути тройничного нерва и первичных сенсорных нейронах в присутствии каналов CB1 и TRPV1 экспрессия ГАЖК (которая образует метаболит АМ404) повышена [118–120]. Помимо головного мозга ГАЖК также синтезируется в спинном мозге и дорсальных корешковых ганглиях. Однако при одинаковых экспериментальных условиях скорость образования АМ404 в последних двух областях значительно ниже, чем в головном мозге [88]. Это, по-видимому, подтверждает предложенную Маллетом с соавт. гипотезу о том, что парацетамол действует через TRPV1 на супраспинальном уровне [94].
Однако недавние исследования усложнили вопрос важности TRP-каналов в механизме действия парацетамола. Андерссон с соавт. описали, что коэкспрессия различных TRP-каналов имеет место в ноцицептивных сенсорных нейронах, а обезболивающий эффект парацетамола дополнительно проявляется за счет активации TRP-каналов другого подсемейства, а именно подсемейства A (анкирин 1), то есть TRPA1-каналов [121]. TRPA1 экспрессируются в соме и периферических окончаниях чувствительных нейронов, они ответственны за восприятие повреждающих стимулов [122–124]. Как и TRPV1, TRPA1 отвечает на различные химические стимулы [103] — например, горчичное масло [125], каннабиноиды [125], чеснок [123] и коричный альдегид [126]. Химическая активация TRPA1 приводит к потенциал-зависимому снижению кальциевых и натриевых токов в первичных чувствительных нейронах [121], что вызывает боль, раздражение, гиперчувствительность кожи и висцеральных органов [127–129]. Важно, что TRPA1-рецепторы также активируются другими метаболитами парацетамола, например, электрофильным N-ацетил-п-бензохинонимином (NAPQI) и пара-бензохиноном (p-BQ). Это подтвердили с помощью интратекального теста, в котором NAPQI, p-BQ и коричный альдегид — электрофильный активатор TRPA1 — вызвали антиноцицепцию, которая не проявлялась у мышей TRPA−/ − в тестах на горячей пластине. Упомянутые метаболиты парацетамола формируются в печени при помощи монооксигеназы, пероксидазы и ЦОГ цитохрома Р450 (CYP450) [121, 130–132]. Примечательно, что многие из этих ферментов присутствуют и в ЦНС [133, 134]. Исследователи предполагают, что NAPQI может вызывать хорошо известные гепато- и нефротоксичный побочные эффекты парацетамола. Метаболиты NAPQI можно найти в крови, моче или даже спинном мозге у людей и мышей после использования терапевтических и нетоксичных доз препарата [121, 130, 135–137].
Результаты этих исследований отражают сложность метаболизма парацетамола [137]. Для проявления обезболивающего эффекта ему нужно превратиться во множество различных метаболитов — агонистов TRP-каналов двух разных подсемейств, которые являются потенциальными мишенями лекарственной терапии [88, 94, 121].
Парацетамолу также приписывают сильное гипотермическое и жаропонижающее действие. Эти эффекты были объяснены в недавнем исследовании Гентри с соавт., которые также ранее описали роль TRPA1 в развитии гипотермии, вызванной парацетамолом, и участие NAPQI в жаропонижающем действии [61]. В их эксперименте при применении парацетамола и систематическом введении антагониста TRPA1 гипотермии не было как у мышей TRPA1–/–, так и у мышей дикого типа [61]. При этом внутрибрюшинное введение агониста TRPA1 (коричный альдегид) у мышей дикого типа вызывало значительную гипотермию. Этот эксперимент еще раз продемонстрировал, что стимуляция TRPA1 влияет на изменение температуры тела [61]. Периферические чувствительные нейроны являются местом гипотермического действия TRPA1, что опосредует обезболивающий эффект [61]. Периферические сенсорные нейроны, контролируемые ЦНС и центральными механизмами терморегуляции, определяют температуру тела. Интересно, что парацетамол не оказывает гипотермический эффект при интратекальном введении: это значит, что для его спинального антиноцицептивного действия гипотермия не требуется [61, 138, 139]. В свою очередь, Миррасехян с соавт. показали, что жаропонижающий эффект парацетамола связан с ингибированием синтеза PGE2 в головном мозге и не зависит от TRPA1 [70].
Давно известно, что каналы TRPV1 регулируют температуру тела in vivo; например, его агонисты капсаицин и RTX вызывают гипотермический эффект у грызунов [138, 140, 141]. Таким образом, в основе гипотермического действия парацетамола может быть активация TRPV1, но исследования показали, что у мышей дикого типа и Trpv1–/– гипотермия развивалась одинаково и не уменьшалась при введении максимально эффективной дозы антагониста TRPV1. Напротив, при введении антагониста TRPA1 у мышей Trpa1–/– парацетамол уже не влиял на температуру тела [61].
Что касается ингибирующей активности парацетамола в отношении ЦОГ-1 и ЦОГ-2, механизмы гипотермии, по-видимому, не зависят от каннабиноидной системы; однако жаропонижающий эффект может быть также результатом ингибирования ЦОГ в гипоталамусе AM404 [62]. На это указывают исследования, в которых парацетамол устранял вызванную дрожжами гипертермию у мышей, дефицитных по TRPA1 и TRPV1 [61]; хотя он может ингибировать ферменты ЦОГ-1 и ЦОГ-2, это возможно только при высоких концентрациях. Однако парацетамол не оказывает сильного противовоспалительного действия, что обычно характерно для ингибирования ЦОГ. Комбинация ибупрофена и парацетамола улучшает жаропонижающий и анальгезирующий эффекты, что указывает на их разные механизмы действия [75, 76]. Таким образом, ингибирование ЦОГ парацетамолом не считается основным механизмом его действия [61].
Другой член подсемейства TRP — канал TRPV4. Он проницаем для ионов Са2+ и чувствителен к осмотическому давлению [142, 143]. Как и другие каналы, он широко распространен в организме и активируется различными стимулами: понижением осмотического давления, механически, низкими температурами, кислотами, метаболитами АК и эндогенными каннабиноидами [102, 144]. До настоящего времени TRPV4 не был описан как молекула-мишень для парацетамола. Однако недавно обнаружено, что парацетамол, воздействуя на TRPV4, способствует миграции клеток [145]. Дальнейшие эксперименты на клеточных линиях с эндогенной экспрессией TRPV4 и линиях со стабильной экзогенной экспрессией TRPV4 показали, что парацетамол ингибирует активность TRPV4 как Ca2+-канала [146]. Эффекты парацетамола по отношению к TRPV4 отличаются от действия на TRPV1 и TRPA1, рассмотренного ранее. Во-первых, в этом случае вряд ли задействованы метаболиты парацетамола, так как ответ каналов, как показали Накагава с соавт., происходит довольно быстро. Во-вторых, воздействие на TRPV4 ингибиторное, в то время как и TRPV1, и TRPA1 in vivo активируются парацетамолом [146]. Однако молекулярный механизм действия парацетамола на активность Ca2+-канала TRPV4 сложен, поскольку неизвестно, действует ли он снаружи или внутри клеточной мембраны. Наконец, ингибирование поступления Ca2+ в клетки через TRPV4 может способствовать клиническим эффектам, вызываемым парацетамолом, которые ранее не связывали с его действием. [146]. Это можно предположить на основании исследований, в которых мыши с генетическим дефицитом TRPV4 были менее восприимчивы к повреждающим стимулам — таким, как кислота и давление. Также стоит отметить, что экспрессия TRPV4 происходит в том числе в периферических нервных окончаниях чувствительных ганглиев [146]. Кроме того, было предположено, что сенсибилизация TRPV4 под действием PGE2 вовлечена в повышение болевой чувствительности в ответ на тепло, стимуляцию давлением в месте воспаления и гипотоническое давление [147]. Кроме того, имеются данные, что TRPV4 может быть также связан с развитием отека легких из-за сердечной недостаточности и участвовать в поддержании сердечно-сосудистого гомеостаза в целом [148]. В связи с новыми появляющимися данными о TRPV4, было бы интересно не только объяснить участие TRPV4 в обезболивающем/жаропонижающем эффекте парацетамола, но также изучить применимость парацетамола для других целей, например, для воздействия на сердечно-сосудистую систему [146, 149].
Действие парацетамола на кальциевые каналы Cav3.2
Кальциевые каналы Cav3.2 активируются при слабой деполяризации мембраны и участвуют таким образом в регуляции клеточной возбудимости [150]. В ЦНС эти каналы участвуют в восприятии боли [151, 152], в эпилепсии [153] и в фазе медленного сна [154].
Существует три Т-типа кальциевых каналов: Cav3.1, Cav3.2 и Cav3.3. Они локализованы в нейронах малого и среднего диаметра в спинальном ганглии, в поверхностных слоях дорсальных рогов спинного мозга и некоторых структурах головного мозга [155]. Основными факторами модуляции боли при обезболивающем действии парацетамола являются соединения, связанные с АК, такие как ASA и 2-AG. Они воздействуют на вышеупомянутые TRPV1 и каннабиноидные рецепторы. Благодаря их липоаминокислотной структуре они взаимодействуют с Т-типом кальциевых каналов, — в частности, с подтипом Cav3.2, — ослабляя боль [156]. Поскольку АМ404 является липоаминовой кислотой, была исследована роль Cav3.2 каналов при действии парацетамола [157]. У мышей с Cav3.2–/– не было обезболивающего эффекта как при введении парацетамола, так и при введении АМ404 в желудочки мозга [157]. Введение блокатора Cav3.2 каналов — (R)-2-(4-циклопропилфенил)-N-(1-(5-(2,2,2-трифтороксид)пиридин-2-ил)этил)ацетамида (TTA-A2) в желудочки мозга мышей перед применением парацетамола также предотвратило его действие. Таким образом, антиноцицептивныйй эффект парацетамола зависит от каналов Cav3.2, расположенных в головном мозге, и не связан с такими каналами в спинном мозге [157]. Стоит отметить, что ингибирование каналов Cav3.2 с помощью AM404 не было столь сильным (IC50 = 13,7 мкмоль/л) по сравнению со специфическим ингибитором TTA-A2 с IC50 = 9,0 нмоль/л. Исходя из полученных результатов было предположено, что при анальгетическом действии парацетамола в активации Cav3.2 участвуют каналы TRPV1. Для проверки этого предположения оценивали анальгетический эффект при введении агониста TRPV1 канала (капсаицина) или антагониста Cav3.2 (TTA-A2) в желудочки мозга мышей с Cav3.2–/– и с TRPV1–/– соответственно. TTA-A2 сохранил свою активность у мышей TRPV1–/–, и обезболивающего эффекта не было, а вот анальгетическое действие капсаицина у мышей Cav3.2–/– подавлялось. Эти результаты демонстрируют, что для реализации обезболивающего эффекта при активации TRPV1 в головном мозге необходимо присутствие каналов Cav3.2; кроме того, вероятно, что основной мишенью AM404 служит TRPV1 [157].
Действие парацетамола на синтез оксида азота
После воздействия повреждающих стимулов происходит активация рецепторов N-метил-D-аспартата (NMDAR) в спинном мозге и выход вещества Р, связанного с передачей информации о возникшей боли [158]. В свою очередь, исследование на мышах показало, что активация NMDA-рецепторов способствует синтезу оксида азота (NO), который является нейромедиатором, передающим ноцицептивную информацию на уровне спинного мозга [159]. Предложенный альтернативный механизм обезболивающего эффекта парацетамола включает в себя влияние на активацию NMDA-рецепторов в спинном мозге и ингибирование пути NO [160]. Введение L-аргинина подавляет обезболивающее действие парацетамола (D-аргинин таким эффектом не обладает), что указывает на связь между этим эффектом и ингибированием синтеза NO [161]. Более того, интратекальное введение ингибитора нейрональной синтазы оксида азота (nNOS) усиливает обезболивающий эффект малых доз парацетамола [162]. Рю с соавт. предположили, что парацетамол подавляет экспрессию индуцибельной синтазы оксида азота (iNOS) на транскрипционном уровне, ингибируя ядерный фактор каппа В (NF-kB) [163]. В конечном счете, роль NO в ноцицепции остается неясной, поскольку, как было обнаружено, доноры NO (S-нитрозо-N-ацетилпеницилламин (SNAP) или динитрат изосорбида) оказывают двойственный эффект в модели нейропатической боли. Низкие дозы доноров NO уменьшают болевые ощущения, в то время как высокие дозы усиливают или не влияют на тактильную аллодинию у крыс [164]. Однако есть интересные исследования, которые подтверждают, что NO, увеличивая или уменьшая активность изоформ ЦОГ-1 и ЦОГ-2, может влиять на естественную концентрацию сигнальных молекул — производных пути синтеза эйкозаноидов [165]. Однако до сих пор неясно, как связаны пути NO и биосинтеза эйкозаноидов [165–167]. Более того, недавние исследования показали, что АМ404 оказывает нейропротекторный эффект против развивающейся в гиппокампе эксайтотоксичности, вызванной гиперактивацией NMDA-рецепторов, поэтому, вероятно, его можно будет применять как нейропротекторное средство при болезнях Хантингтона и Паркинсона, а также при ишемии [67, 168].
Действие парацетамола на калиевые каналы Kv7
Недавно было описано, что NAPQI усиливает активность нейронных потенциал-зависимых калиевых каналов Kv7 — Kv7.2 и Kv7.3 — в спинальном ганглии и нейронах дорсальных рогов спинного мозга [169]. В культуре клеток из окружения дорсального рога спинного мозга крыс линии Спрег — Доули NAPQI путем увеличения активности каналов Kv7 вызывал гиперполяризацию мембраны клеток и повышал порог возбуждения, что также может лежать в основе обезболивающего и противосудорожного действия парацетамола [169]. Более того, прямая и опосредованная активация каналов Kv7 под действием NAPQI снижает тонус артериальных сосудов, что может повлечь понижение артериального давления. В таком случае это объясняет, почему при внутривенном введении парацетамола развивается преходящая гипотензия [170]. Это новая перспективная область исследования, которую еще предстоит изучить.
Безопасность применения парацетамола
Использование парацетамола вызывает серьезные споры, поскольку было показано, что он может проходить через плаценту и гематоэнцефалический барьер, достигая головного мозга плода/новорожденного [171]. Недавние исследования продолжают ставить под сомнение безопасность применения парацетамола беременными женщинами и детьми [173]. В связи с распространенным приемом парацетамола в этот период жизни, существовали опасения, что он может повлиять на интенсивное развитие мозга у детей [174]. Применение парацетамола в раннем возрасте ассоциировано с гиперкинетическим расстройством поведения, гиперактивностью (синдромом дефицита внимания и гиперактивности, СДВГ) и другими неблагоприятными формами поведения в уже более позднем возрасте [175–177]. Кроме того, утверждается, что применение парацетамола матерью во время беременности связано с повышенным риском развития детской астмы [178].
У грызунов воздействие парацетамола в период развития было связано с нарушением пространственного обучения, ухудшением привыкания к новой клетке, изменением спонтанного поведения, снижением анксиолитической и анальгетической реакции на парацетамол и воздействием на различные нейромедиаторы [179–182]. Было показано, что нейротоксичность у маленьких детей вызвана метаболитом AM404, который, как описано выше, стимулирует эндоканнабиноидную систему [174]. Эндоканнабиноидная система, влияя на пролиферацию клеток-предшественников [183] и миграцию нейронов [184], играет важную роль в регуляции раннего развития головного мозга. После применения агонистов СВ1 — WIN 55, 212-1 (WIN) и парацетамола — на стадиях формирования головного мозга в теменной коре у взрослых мышей выявлялось значительное снижение белковых маркеров нейронов — таких как GluR1, белка постсинаптического уплотнения 95 (PSD95) и синаптофизина. Мыши продемонстрировали значительные отклонения в тесте спонтанной локомоторной активности по сравнению с контрольной группой и мышами, подвергшимися воздействию одного агента [174]. Некоторые отклонения, появившиеся у взрослых в результате применения WIN и парацетамола, можно объяснить снижением количества киназы В тропомиозиновых рецепторов (Trkb), уменьшением уровня транскрипции синаптофизина (Syp) в гиппокампе и уровня ГАЖК в коре головного мозга, которая также важна во время развития головного мозга.
Допуская, что полученные результаты применимы к человеку, можно сказать, что есть сомнения относительно безопасности парацетамола при его широком применении среди беременных женщин и детей [174]. Однако в отношении приема парацетамола взрослыми ряд недавних исследований характеризует лекарство положительно. Двойное слепое рандомизированное контролируемое исследование с участием здоровых взрослых мужчин показало, что парацетамол улучшает навыки принятия решений и стратегии планирования [188]. Вероятно, это результат анальгетического, а не термического каскада — возможно, при центральной роли серотонинергической и каннабиноидной систем. [188]. В свою очередь, результаты других исследований ставят под сомнение безопасность постоянного использования парацетамола при остеоартрите и болях в пояснице [189]. Согласно им, постоянное использование парацетамола дозозависимо повышает риск желудочно-кишечного кровотечения и немного (примерно на 4 мм рт. ст.) увеличивает систолическое давление, что может быть существенным для некоторых пациентов [189]. Негативные и токсические эффекты парацетамола суммированы в таблице 3.
Таблица 3 | Сравнение основных побочных эффектов парацетамола в зависимости от дозы

Выводы и перспективы
Несмотря на многие годы его изучения, точный механизм действия парацетамола до сих пор остается неизвестным. Безусловно, он многонаправлен, однако для его более точного понимания требуется провести еще множество исследований. Текущие результаты изучения механизма действия парацетамола очень многообещающие. Кроме того, они открыли пути для создания новых анальгетиков и антипиретиков, которые смогут специфически действовать через серотонинергическую и эндоканнабиноидную системы, каналы TRP, калиевые каналы Kv7, кальциевые каналы Cav3.2 или даже еще неизвестный белковый вариант альтернативного сплайсинга продукта гена ЦОГ-1.
