Ахиллесова пята антибиотикорезистентности
Инфекции, причиной которых служит антибиотикорезистентность бактерий, приобретают все большую распространенность и трудно поддаются лечению. В новом исследовании выявлены уникальные признаки уязвимости группы устойчивых к антибиотикам бактерий-мутантов в геномном масштабе, что дает новое представление о лекарственных средствах, которые можно использовать в сочетании с антибиотиками для подавления устойчивости микробов.
Антибиотикорезистентность сегодня — одна из самых серьезных угроз общественному здравоохранению [1]. Обеспокоенность по поводу увеличения числа патогенных бактерий, устойчивых к существующим ныне антибиотикам, усугубляется тем фактом, что в стадии разработки находится крайне мало новых антибиотиков. Данное обстоятельство приводит к поиску альтернативных стратегий лечения. Для более эффективного использования существующих антибиотиков в борьбе с резистентными бактериями было предложено множество способов — как, например, сочетание антибиотиков с другими веществами — либо прочими антибиотиками, либо препаратами-синергистами антибиотиков. Особый интерес представляют молекулы, которые ингибируют развитие устойчивости к антибиотику или специфически уничтожают антибиотикорезистентные бактерии-мутанты, используя адаптационные дефекты микробов вследствие их мутаций, придающих устойчивость [2]. Однако молекулярные пути, на которые можно воздействовать у таких антибиотикорезистентных бактерий-мутантов, недостаточно изучены. В этой работе в журнале Nature Microbiology Rasouly с соавт. описывают метод цельногеномного транспозонного мутагенеза для идентификации клеточных факторов, которые по-разному влияют на адаптацию антибиотикорезистентных мутантов по сравнению с исходным, чувствительным к антибиотикам штаммом [3]. Авторы используют свой метод для определения нескольких белков, при ингибировании которых значительно снижается рост одного штамма мутантов Escherichia coli, устойчивых к рифампицину (Rif-R) и имеющих крайне важное значение в клинической деятельности. Авторы также показывают, что добавление к рифампицину препаратов, которые ингибируют эти белки, приводит к более низким показателям антибиотикорезистентности, что подчеркивает важность таких средств для терапевтических целей.
Рифампицин обычно применяется для лечения бактериальных инфекций, таких как туберкулез, лепра и легионеллез; принцип действия его состоит в ингибировании транскрипции за счет непосредственного взаимодействия с РНК-полимеразой [4]. Устойчивость к рифампицину регулярно выявляется в клинических условиях, при этом большинство устойчивых штаммов несут мутации в бета-субъединице РНК-полимеразы, особенно в виде замены H526Y или S531F/L. Своим исследованием Rasouly с соавт. начинают систематический анализ взаимодействий между мутантным геном H526Y и всеми генами в геноме E. coli для поиска тех молекулярных путей, которые не являются жизненно необходимыми для выживания исходного штамма дикого типа (WТ), чувствительного к антибиотикам, однако важны для роста резистентного штамма (рис. 1). Вероятно, эти пути послужат новыми мишенями для лечения, поскольку их ингибирование не действует на большинство чувствительных к антибиотикам штаммов, и, следовательно, на них вряд ли повлияют ныне существующие противомикробные препараты. Лекарственные молекулы, ингибирующие эти пути, впоследствии могут специфически действовать и против вновь возникающих резистентных мутантов. Это позволяет продолжать использовать исходный антибиотик (рифампицин) для уничтожения чувствительных клеток и сокращать использование других антибиотиков для комбинированной терапии.
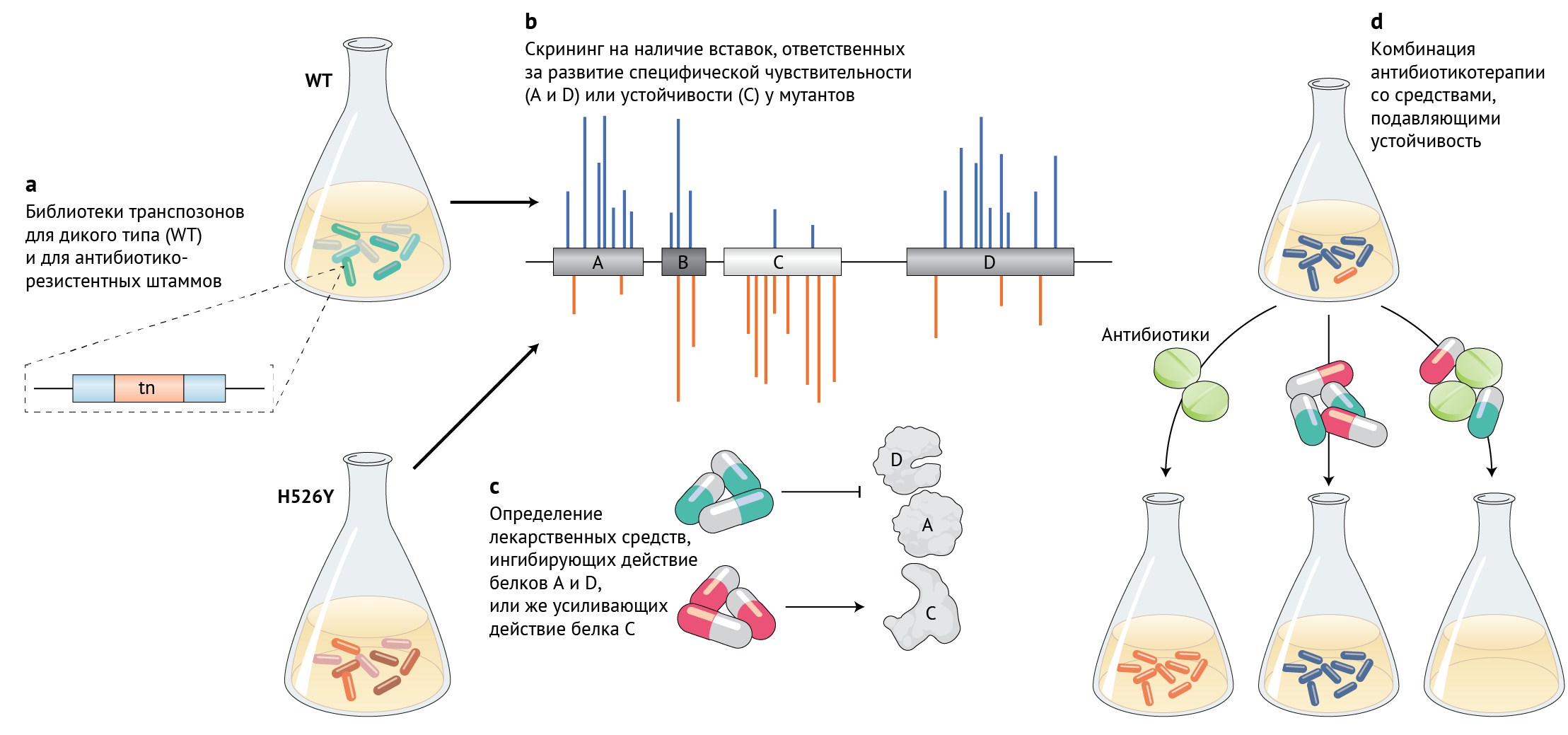
b. Полногеномное картирование сайтов вставок используется для идентификации генов, обогащенных вставками или же без таковых, в устойчивом штамме по сравнению с контрольными штаммами.
c. Лекарства, которые усиливают выявленную чувствительность, могут специфически воздействовать на устойчивые штаммы.
d. Комбинирование этих препаратов с антибиотиками (в данном случае рифампицином) для лечения может тем самым противодействовать устойчивости к антибиотикам.
Секвенирование вставок транспозонов — это удобный и чувствительный метод выявления генов, влияющих на адаптационные возможности организма в разнообразных условиях окружающей среды или в различном генетическиом окружении; благодаря нему можно обнаружить даже незначительное влияние на адаптивные возможности [5]. Авторы создали обширные библиотеки транспозонов для геномов WT и мутантов по H526Y и определили адаптивность всех мутантов для обоих генетических состояний (рис. 1). Вставки транспозонов в гены синтеза клеточной стенки и деления клеток оказались недостаточны при наличии H526Y (затраты синтетической адаптивности) по сравнению с WТ, вследствие чего, как предполагается, мутанты H526Y гиперчувствительны к внешнему физическому воздействию, оказываемому на клеточную стенку. Синтетическая летальность между мутантами, чувствительными к воздействиям на клеточную стенку, и мутацией H526Y, а также повышенная чувствительность мутантов H526Y к ингибиторам синтеза клеточной стенки подтверждают эти выводы. Авторы также обнаружили, что вставки транспозонов в ген фермента спасения (повторного использования) урацила, оказались в значительной степени выраженными H526Y при наличии H526Y по сравнению с WТ, что указывает на измененный путь спасения урацила в мутантах H526Y, в которых присутствовала повышенная чувствительность к аналогам этого нуклеотида. Дальнейшие исследования показали, что измененные реакции на сигнал бактериального стресса ppGpp, а также нарушение регуляции пути спасения урацила способствуют высокой скорости элонгации транскрипции у мутантов H526Y, что приводит к развитию их чувствительности к ингибиторам синтеза клеточной стенки и аналогам урацила. Однако эти результаты ограничивались лишь генотипами, устойчивыми к рифампицину, что привело к увеличению скорости транскрипции, а антибиотикорезистентные мутанты, у которых транскрипция была затронута иначе, не имели таких же паттернов синтетической адаптивности.
Важно отметить, что, как обнаружили авторы, эти результаты могут быть использованы для специфического воздействия на распространение и типы резистентных мутантных штаммов, возникающих после воздействия рифампицина. Добавление ингибиторов клеточной стенки и аналогов урацила в субингибиорных концентрациях в момент воздействия рифампицина снижало рост устойчивых к этому антибиотику мутантов и приводило к изменению генотипов отобранных мутантов. Количество самых распространенных мутантов с устойчивостью к рифампицину снизилось, и мутационный спектр сдвинулся в пользу другой мутации, приводящей к серьезному нарушению роста. Кроме того, на мышиной модели перитонита после лечения ингибитором клеточной стенки бактериальная нагрузка мутантов по H526Y оказалось меньше по сравнению с WТ. Это позволяет предположить, что такие препараты можно комбинировать с рифампицином для более эффективного лечения инфекций. Таким образом, фокусировка внимания на генах, не являющихся жизненно важными для бактерий позволит значительно расширить спектр молекул, который можно рассматривать для комбинированной терапии с антибиотиками.
Результаты этого исследования сводятся к тому, что разные мутанты, устойчивые к одному и тому же антибиотику, могут иметь сильно различающиеся адаптивные профили, и поэтому затраты на приспособленность зависят от генотипа. В то время как устойчивость к антибиотикам в клинике все еще в значительной степени определяется традиционными методами, основанными на выращивании бактериальных культур, в последнее время все более прочную позицию приобретают молекулярные технологии. Они применяются как для диагностики туберкулеза, так и для определения устойчивости к рифампицину на молекулярном уровне [6]. В соответствии с этим, специфичные методы лечения от конкретных устойчивых генотипов бактерий становятся все более реальными. Одним из вариантов является составление каталогов наиболее часто встречающихся мутаций устойчивости к антибиотикам, обнаруживаемых у тех микробов, для которых антибиотикорезистентность является критической проблемой, а также определение затрат на приспособленность и комбинаций препаратов воздействия на устойчивые генотипы. Проблема заключается в том, что бактерии печально известны своей способностью к быстрой эволюции, и возможно, что лечение неким «коктейлем лекарств» может изменить адаптивную траекторию микробной популяции в сторону развития еще более устойчивого генотипа, что в большей степени сузит возможности терапии. Даже в настоящем исследовании лечение ингибиторами клеточной стенки и аналогами урацила в сочетании с рифампицином привело к увеличению распространенности медленно растущих резистентных к рифампицину мутантов, у которых может быть высокая толерантность и к другим антибиотикам, что, таким образом, затруднит лечение. Следует также учесть, что, хотя авторы используют стандартные лабораторные условия и штаммы для определения затрат на приспособленность устойчивых мутантов, на рост и адаптацию таких мутантов способна влиять экологическая ниша инфекции, а также фон клинического штамма. Таким образом, для определения затрат на приспособляемость и клинической значимости может быть необходима имитация инфекционной ниши [7]. Тем не менее, очевидно, что геномный подход полезен для качественно нового понимания чувствительности устойчивых к антибиотикам штаммов. В сочетании с достижениями в области молекулярной диагностики инфекционных заболеваний это может открыть новые возможности для эффективных методов лечения инфекций, основу которых составляют антибиотикорезистентные штаммы.
