Как нарушение кишечного барьера влияет на биологию микроглии
С течением времени открываются все новые функции микробиома в организме человека и его роль в патогенезе болезней. В новых исследованиях выводится связь функционирования микробиома с процессом старения. Моссад с соавт. демонстрируют, что связанное со старением нарушение целостности тканевого барьера в кишечнике, опосредованное микробиомом, может способствовать дисфункции микроглии у мышей.
По мере увеличения продолжительности жизни человека возрастные заболевания становятся все большим бременем для общества и экономики по всему миру. Тем не менее, многие особенности процесса старения остаются плохо изученными. В их число входит и то, как на него воздействуют факторы окружающей среды и образ жизни. В последнее время исследования влияния кишечных бактерий на здоровье человека и их роль в патогенезе различных заболеваний стали предметом особого интереса. В нескольких фундаментальных исследованиях была показана роль микробиома в развитии возрастных заболеваний, таких как болезнь Альцгеймера и болезнь Паркинсона [1, 2], а также выявлены некоторые клеточные и молекулярные признаки старения и снижения когнитивных функций [3, 4]. Однако остается неясной взаимосвязь между состоянием кишечника и микроглии.
В новом исследовании, проведенном Моссадом с соавт. [5] и опубликованном в Nature Neuroscience, демонстрируется, что опосредованные микробиомом изменения проницаемости кишечника во время старения могут способствовать перемещению промежуточных продуктов обмена веществ из кишечника, в кровоток и, возможно, в мозг. Эти метаболиты, в свою очередь, могут изменять функцию микроглии и нарушать ее гомеостаз в сторону патогенеза [5] (рис. 1). В частности, чтобы изучить влияние микробиома на дисфункцию микроглии при старении, Моссад с соавт. [5] исследовали экспрессию генов клетками микроглии у молодых (6–10 недель) и старых (96–104 недель) мышей. Животные пребывали в стерильных (GF, от англ. germ-free) или же свободных от специфической патогенной микрофлоры (SPF, от англ. specific-pathogen-free) условиях содержания. В процессе сравнения экспрессии генов у мышей из группы GF (т. е. тех, у которых отсутствовал микробиом) с мышами группы SPF авторы предположили, что наблюдаемые различия в функции микроглии обусловлены биологией кишечных бактерий, хотя использованный в исследовании подход не предполагает какое-либо влияние отдельных микроорганизмов. Авторы сообщают, что в клетках микроглии мышей обеих групп (и GF, и SPF) выявлена зависимая от возраста транскриптомная сигнатура, определенная с помощью секвенирования РНК. Однако степень различий в экспрессии генов, связанных со старением, оказалась более выраженной в микроглии мышей группы SPF по сравнению с животными из группы GF. Примечательно, при сравнении старых мышей обеих групп самые большие различия были обнаружены в экспрессии тех генов, которые вовлечены в организацию цитоскелета, реализацию иммунных функций и регуляцию работы митохондрий. Митохондрии — крайне важные клеточные органеллы, ответственные за в процесс выработки энергии, которые участвуют в старении клеток благодаря модуляции выработки активных форм кислорода (АФК) и реакций на окислительный стресс. Удивительные изменения в экспрессии генов, связанных с функциями митохондрий, побудили авторов исследовать воздействие микробиома на эти органеллы.
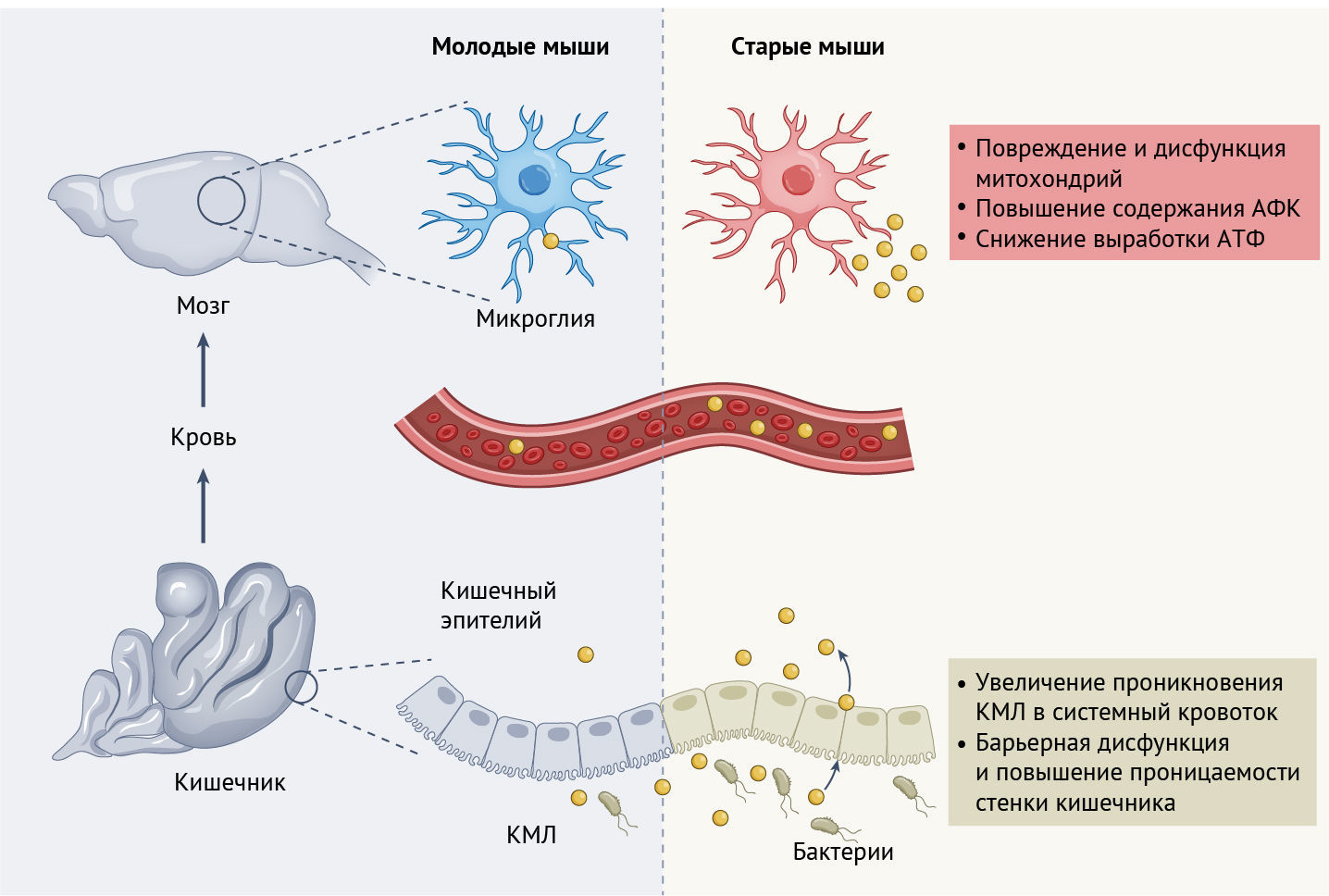
В ходе пристального изучения генов, участвующих в выработке АФК, повышенная экспрессия таких генов, а также генов, задействованных в ответе на накопление кислородных радикалов, была обнаружена только в клетках микроглии у старых мышей группы SPF. Это указывает на то, что содержание АФК в микроглии зависит и от процесса старения, и от присутствия микробиоты. Действительно, при старении мышей группы SPF концентрация АФК в микроглии повышалась по сравнению с более низкими аналогичными значениями у мышей группы GF. Помимо этого, в микроглии старых мышей из группы SPF авторы обнаружили признаки повреждения и дисфункции митохондрий (в них была снижена выработка АТФ), что указывает на то, что обильная микробиота влияет на функцию микроглии у старых мышей. Хотя сравнение с мышами, лишенными кишечных бактерий, приводит к бинарным результатам, которые нельзя назвать естественными (т. е. в природе не существует животных или людей со стерильным кишечником), данный метод формирует базу для дальнейшего изучения влияния микроорганизмов в кишечнике на функцию митохондрий микроглии.
Кишечные микроорганизмы используют множество биосинтетических путей для преобразования и расщепления пищевых соединений до малых и крупных молекул, которые могут влиять на функции макроорганизма. В число последних входят короткоцепочечные жирные кислоты (КЦЖК), которые модулируют энергетический обмен в эпителиоцитах кишечника и играют роль в регуляции функционирования иммунной системы [6]. Эти молекулы могут попадать в кровоток и достигать тканей головного мозга. Согласно исследованиям, микробиом и метаболиты, связанные с его жизнедеятельностью (такие как КЦЖК), могут влиять на течение болезней Альцгеймера или Паркинсона (что было продемонстрировано на мышиных моделях) [1, 2, 7]. Моссад с соавт. [5] применили методики таргетной и нетаргетной метаболомики для изучения ряда метаболитов в сыворотке крови и мозге, содержание которых изменялось с возрастом. Метаболизм нескольких соединений как в сыворотке, так и в ткани мозга у старых мышей был в значительной степени усилен. В число этих веществ входят ацетат, пропионат, пальмитолеат (16:1n7), N-оксид триметиламина (ТМАО), 1-олеоил-2-242 докозагексеноил-ГФХ (18:1/22:6), стахидрин и N(6)-карбоксиметиллизин (КМЛ). С помощью нетаргетной метаболомики образцов крови человека удалось выявить, что с возрастом содержание двух метаболитов (TMAO и КМЛ) возрастает. КЦЖК (ацетат и пропионат) синтезируются микробиотой из пищевых волокон и могут влиять на активацию микроглии в мозге мыши [2]. ТМАО образуется в результате окисления микроорганизмами в кишечнике аминов пищи и последующих ферментативных реакций в печени; в более ранних работах на примере моделей инсульта у грызунов было показано, что данное соединение отрицательно влияет на исход заболевания [8]. КМЛ — представитель молекулярного класса, известного как конечные продукты глубокого гликирования, которые образуются в результате реакций окисления и гликирования белков (например, реакции Майяра). Возникновение конечных продуктов глубокого гликирования связывают с реакцией на стресс, и ранее предполагалось, что эти метаболиты вовлечены в патогенез болезни Альцгеймера [9]. Однако требуются дополнительные исследования, чтобы воспроизвести изначальные наблюдения и выявить потенциальное влияние на функции организма, оказываемое этими метаболитами.
В исследованиях для проверки этой концепции были использованы ацетат, пропионат, ТМАО и КМЛ. В ходе эксперимента путем внутрибрюшинной инъекции у молодых мышей повышали концентрации этих соединений (такой способ введения облегчает распространение вещества по системному кровотоку). Из четырех анализируемых метаболитов только введение КМЛ частично воспроизводило усиление окислительного стресса, снижение функционирования митохондрий и повреждение их структуры, которые наблюдались в микроглии мозга у старых мышей. Это побудило ученых искать причину повышения концентрации КМЛ в головном мозге; изначально была выдвинута соответствующая гипотеза, согласно которой на повышение содержания КМЛ в головном мозге может влиять микробиота. Поразительно, но у мышей из группы GF содержание КМЛ в фекалиях оказалось выше, чем у мышей группы SPF. Это свидетельствует о том, что метаболизм бактерий не является причиной повышения содержания КМЛ.
Кишечный эпителий служит системой защиты между организмом животного и его кишечным микробиомом, и, согласно предыдущим исследованиям, бактерии микробиома также представляют собой ключевые регуляторы кишечной проницаемости (т. е. нарушения функции кишечника как биологического барьера), вследствие чего могут изменяться системные концентрации кишечных метаболитов [10]. Авторы оценивали кишечную проницаемость путем определения перехода молекул с флуоресцентной меткой из кишечника в кровоток после перорального приема. Было обнаружено, что у старых мышей группы SPF повысилась проницаемость кишечника, чего не наблюдалось у старых мышей группы GF. Кроме того, у молодых мышей группы GF, кишечник которых путем фекального переноса от старых мышей был колонизирован микроорганизмами, выявлена более высокая степень утечки флуоресцентного красителя из кишечника по сравнению с молодыми мышами группы GF, кишечник которых был колонизирован микроорганизмами от молодых мышей-доноров. Лучшим объяснением этих наблюдений служат изменения микробиома с возрастом, которые в большей степени влияют на транслокацию КМЛ, чем непосредственно на содержание метаболитов, сопровождающиеся накоплением КМЛ в системном кровотоке и ткани мозга мышей (по крайней мере, такое наблюдалось в настоящем эксперименте). Как старение изменяет влияние микробиоты на проницаемость кишечника, остается неизвестным.
Соответственно, авторы изучили, как способ введения КМЛ влияет на его накопление в микроглии. У молодых мышей группы SPF концентрация КМЛ в микроглии повышалась только после внутрибрюшинной инъекции (по сравнению с пероральным введением, после которого достигались лишь низкие значения). Напротив, у старых мышей группы SPF после системного и перорального введения метаболита наблюдалось усиление накопления КМЛ. Это указывает на то, что повышенная проницаемость кишечника может способствовать облегчению перемещения метаболита из кишечника в мозг. Наконец, чтобы проверить, влияет ли кишечная проницаемость на концентрацию КМЛ в периферическом и системном кровотоке, авторы перорально вводили мышам вещества, которые либо предотвращают накопление КМЛ (эллаговая кислота), либо усиливают барьерную функцию кишечника (кишечная щелочная фосфатаза) [11, 12]. Оба соединения привели к снижению накопления КМЛ в головном мозге. Хотя эллаговая кислота не оказывала влияния на проницаемость кишечника, введение ее снижало накопление КМЛ в головном мозге, что указывает на кишечник как ключевой источник этого метаболита. Повышение барьерной функции кишечника посредством введения кишечной щелочной фосфатазы показало, что путь от кишечника к системному кровотоку, по-видимому, влияет на возрастное накопление КМЛ в головном мозге.
Моссад с соавт. [5] определили важный опосредованный микробиотой процесс в ходе старения, при котором потенциально патогенные молекулы в кишечнике, по-видимому, влияют на клеточные реакции в мозге мышей. Многие аспекты остаются нераскрытыми; например, каким образом КМЛ изменяет функцию микроглии и является ли его воздействие на эти клетки прямым или опосредованным другими клеткам; существуют ли другие метаболиты кишечного происхождения с аналогичными, синергическими или антагонистическими функциями, как микробиота стареющего организма влияет на проницаемость кишечника и можно ли обратить данный процесс вспять (возможно, путем применения фекальных трансплантатов от молодых мышей или пробиотиков). Взаимное влияние стареющего макроорганизма и микробиома может влиять на проницаемость кишечника. Барьерная функция кишечника опосредуется физическими, химическими и клеточными компонентами, такими как кишечный эпителий, иммунокомпетентные клетки, слой слизи и секретируемые молекулы. Нарушение функции любого из этих важных компонентов может привести к повышению проницаемости кишечника. Имеющиеся данные говорят о том, что функция этих компонентов регулируется кишечными микроорганизмами; однако влияние старения на этот процесс было изучено лишь недавно. В будущем необходимы дальнейшие исследования для выявления клеточных и молекулярных изменений, связанных со старением, которые могут изменять барьерную функцию кишечника.
Если эти результаты получится воспроизвести у человека, они могут открыть новые перспективы влияния старения и факторов окружающей среды на функцию мозга, а также потенциально связанные с возрастом патологии и аспекты поведения. Ранее уже проводили связь между повышенной кишечной проницаемостью («дырявым кишечником») и некоторыми патологиями нервной системы (такими как болезнь Альцгеймера, болезнь Паркинсона, депрессия и расстройства аутистического спектра), хотя роль первой не удалось точно подтвердить. Кроме того, появились свидетельства накопления других нейроактивных кишечных метаболитов в мозге мышей. Все эти данные показывают, что химические соединения из пищи, микроорганизмы и/или кометаболизм между микробиомом и организмом хозяина могут влиять на определенные функции мозга. Примерами последнего взаимодействия служат кишечные метаболиты (КЦЖК обладает протективным действием, а КМЛ — патогенным). Обеспечение целостности кишечного барьера для регуляции проникновения метаболитов из кишечника в системный кровоток представляет собой новый подход к укреплению здорового функционирования тканей мозга.
