«Ремонтируя» глаза

Различные компании заняты разработкой технологий редактирования, регенерации и генетического перепрограммирования тканей глаза для восстановления зрения.
В ближайшие несколько недель французская компания SparingVision, занимающаяся разработкой генной терапии, готова начать первое клиническое испытание устойчивой к мутациям генной терапии для лечения пигментной дистрофии сетчатки (ПДС). В случае успеха эта методика поможет преодолеть «бутылочное горлышко», которое сдерживает прогресс в лечении прогрессирующей потери зрения. Будь то коррекция работы поврежденных генов при наследственных заболеваниях глаз или регенерация фоторецепторов или ганглиозных клеток при лечении таких заболеваний, как ПДС, глаукома и возрастная дегенерация желтого пятна, основополагающие теоретические исследования, проведенные в течение нескольких десятилетий, в настоящее время находят практическое применение в ряде методов лечения дегенеративных заболеваний глаз (Таблица 1).
Таблица 1 | Селективные методы регенерационной терапии для лечения нарушений зрения, находящиеся в разработке
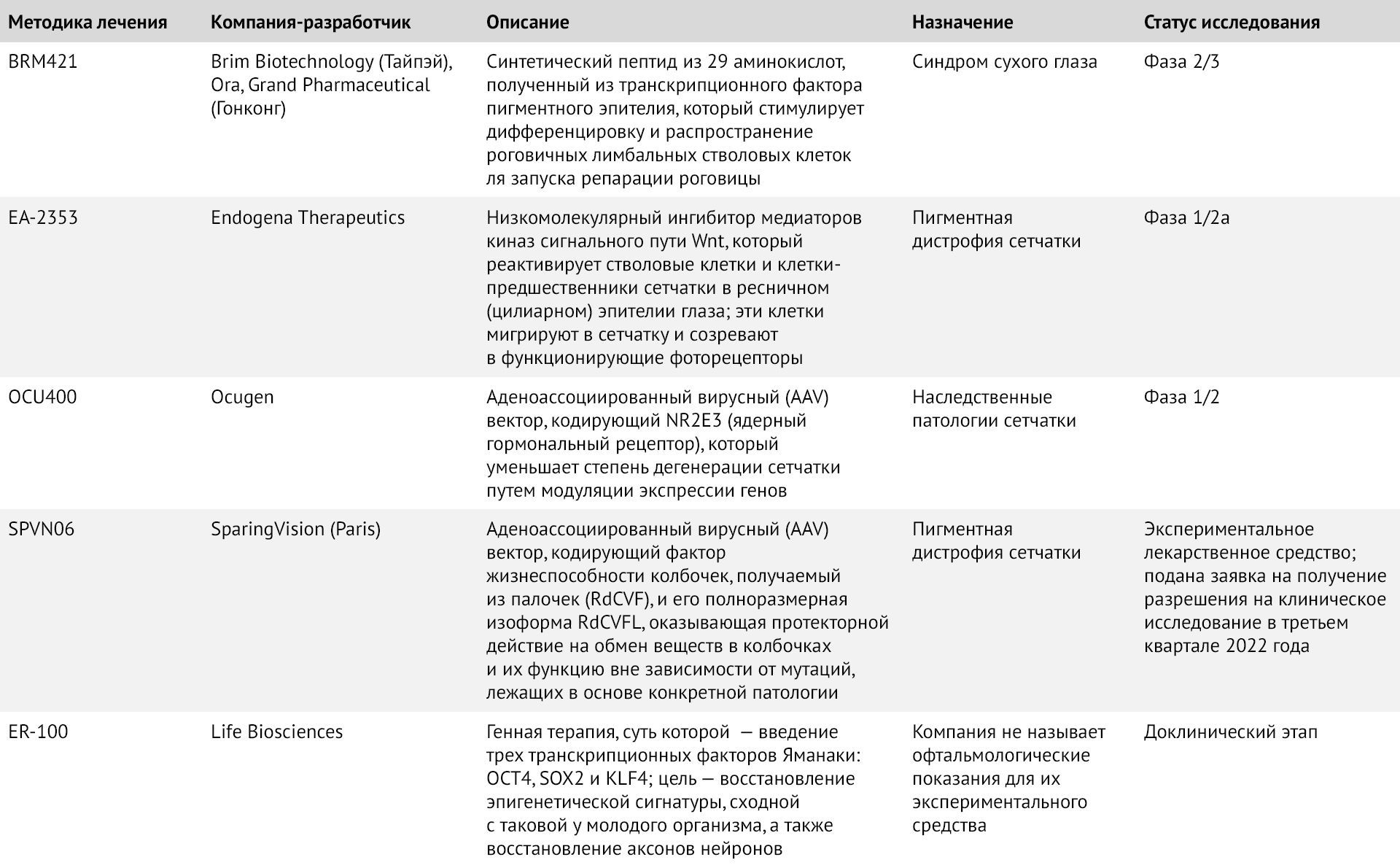
У рыб, рептилий и птиц в ответ на повреждение ткань сетчатки регенерирует. Однако сетчатка млекопитающих, состоящая из миллионов светочувствительных фоторецепторов, не способна реагировать на повреждения. При некоторых генетически обусловленных заболеваниях глаз неизбежная потеря клеток сетчатки приводит к прогрессирующей потере зрения. Существует более 20 наследственных заболеваний сетчатки, в том числе ПДС, врожденный амавроз Лебера, ахроматопсия, болезнь Баттена, болезнь Штаргардта и несколько видов дистрофии сетчатки. На сегодняшний день удалось идентифицировать более 260 различных генов, подверженных каузативным мутациям, однако регулирующими органами для клинического применения допущена лишь одна методика заместительной генной терапии.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) выдало разрешение компании Spark Therapeutics на применение средства Luxturna (voretigene neparvovec); и это одобрение стало важной вехой в данной сфере. В основе Luxturna лежит вектор аденоассоциированного вируса серотипа 2 (AAV2); средство показано пациентам с дистрофией сетчатки, вызываемой мутациями гена фермента RPE65. В клинической разработке находится целая плеяда средств для лечения ряда патологических состояний.
Но разработка более 200 различных средств заместительной генной терапии для лечения каждого наследственного заболевания сетчатки в настоящее время невозможна ни с экономической, ни с технической точки зрения. Общие подходы, не учитывающие лежащую в основе патологии генетическую мутацию, предлагают потенциальный способ помочь подавляющему большинству пациентов, которые лишены возможности выбора метода лечения.
Средство генной терапии ПДС парижской компании SparingVision, SPVN06, предлагает критическое испытание вышеуказанной идеи. Гарантия полного излечения отсутствует, поскольку мутация, лежащая в основе заболевания, сохраняется. Цель состоит в том, чтобы сохранить зрение пациентов как можно дольше — или, в худшем случае, замедлить прогрессирование заболевания — защищая функцию колбочек.
Патологический процесс ПДС протекает постепенно и характеризуется двумя четко различимыми стадиями. Палочки — фоторецепторные клетки, обеспечивающие зрение при слабом освещении, — обычно отмирают первыми. Фоторецепторные клетки отвечают за захват квантов света и запуск каскада фототрансдукции, что стоит за формированием зрения, а большинство мутаций, приводящих к ПДС, происходят в генах, экспрессируемых палочками. Колбочки, ответственные за цветовосприятие и острое зрение, также впоследствии отмирают или же по крайней мере утрачивают функциональную активность либо из-за избыточного воздействия света, либо из-за токсичной окружающей среды, формируемой гибнущими палочками.
Соучредители компании SparingVision Хосе-Ален Сахель и Тьерри Левейяр выявили белок — фактор жизнеспособности колбочек, выделенный из палочек (RdCVF), — который способствует выживанию колбочек, усиливая захват ими молекул глюкозы. Генная терапия SPVN06 представляет собой вектор AAV, экспрессирующий ген Nxnl1, который кодирует RdCVF под контролем специфичного для колбочек промотора, а также его полноразмерную изоформу RdCVFL, формируемую путем альтернативного сплайсинга. Экспрессия RdCVFL контролируется промотором, который активен во всех клетках сетчатки, и этот белок палочек способствует защите колбочек от нарастающего окислительного стресса, вызванного усиленным воздействием света. По словам Стефана Буасселя, генерального директора SparingVision, когда палочек не остается, вся мощь светового потока попадает на колбочки. Он продолжает, что, согласно недавно опубликованным результатам доклинических исследований на мышиных и свиных моделях ПДС, применение SPVN06 привело к «поразительным различиям» в остроте зрения между глазами отдельных животных, которые подвергали или не подвергали терапии соответственно. Приматы в исследованиях хорошо переносили SPVN06; также это средство обеспечивало повышенную экспрессию обоих трансгенов в фоторецепторных клетках и в пигментном эпителии сетчатки. Возможно, первые данные о безопасности для человека станут доступны уже в течение 2023 года, однако для получения данных об эффективности этого метода лечения потребуется больше времени. Как заявляет Буассель, поскольку это медленно прогрессирующее заболевание, исследователи не могут строить каких-то конкретных ожиданий до начала 2025 года.
Одна из главных программ компании Brim Biotechnology (Тайбэй, Тайвань), направлена на лечение синдрома сухого глаза, являющегося менее серьезным, однако не менее широко распространенным заболеванием, вызываемым нарушением слезопродукции. В глазу млекопитающих эпителий роговицы, в отличие от сетчатки, постоянно пополняется лимбальными стволовыми клетками. В методике, разработанной компанией Brim, используется способность роговицы к самовосстановлению под управлением фактора пигментного эпителия (PEDF) — секретируемого гликопротеина, который выполняет множество функций и обладает нейротрофическими и противовоспалительными свойствами, а также способен стимулировать дифференцировку стволовых клеток. Полноразмерный нативный PEDF содержит 418 аминокислотных остатков, однако исследователи компании Brim получили пептид из 29 аминокислот BRM421, сохраняющий способность вызывать дифференцировку стволовых клеток. По словам Марии Чен, вице-президента по развитию бизнеса компании Brim, гипотеза заключается в том, что процесс репарации может быть ускорен. Родственный, хотя и более крупный пептид способствует пролиферации лимбальных клеток через сигнальный путь hedgehog. Хотя в своем пресс-релизе в прошлом году представители компании заявляли, что испытания фазы 2/3 экспериментального средства BRM421 в США не достигли своей основной конечной точки — восстановления роговицы, — тем не менее, было выявлено статистически значимое влияние на сухость глаза, жжение, покалывание и светобоязнь (светочувствительность). По словам Чена, поскольку матрица-носитель, используемая в группе плацебо, обладает антиоксидантным действием, это могло привести к более высокой, чем ожидалось, реакции в контрольной группе, а также к некоторому влиянию на ощущение жжения. Компания планирует перейти к третьей фазе испытаний в начале следующего года, и в ней планируется использовать введение меньших объемов молекул-носителей. Синдром сухого глаза может стать первым из возможных показаний к назначению этого пептида. В перечень показаний также может быть включен нейротрофический кератит — заболевание роговицы, вызванное повреждением тройничного нерва.
Исследователи компании Endogena Therapeutics из Шлирена (Швейцария), также стремятся использовать биологическую пластичность роговицы, в данном случае — для регенерации фоторецепторов сетчатки. Недавно ученые этой компании перевели свою главную разработку, препарат EA-2353, в фазу 1/2a испытаний по ПДС. Молекулу удалось выявить с помощью фенотипического скрининга стволовых клеток сетчатки и клеток-предшественников, которые обычно находятся в ресничном (цилиарном) эпителии. Цель терапии — индуцировать эти покоящиеся клетки, первоначально идентифицированные Дереком ван дер Коем из Университета Торонто, к миграции в поврежденную сетчатку и дифференцировке в функциональные фоторецепторы. Представителям компании еще только предстоит опубликовать доклинические данные о препарате EA-2353, которые сделали возможным это исследование — они собираются представить статью для рецензии, — однако в кратком описании FDA это средство было описано как «низкомолекулярный ингибитор ингибиторов киназы сигнального пути Wnt».
Сигнальный путь Wnt крайне важен в периоде эмбрионального развития для клеточной миграции и для определения судьбы отдельных клеток. Ученые из Endogena заметили, что небольшая молекула, участвующая в этом пути, вызывает структурные и функциональные улучшения в мышиных моделях ПДС. Соучредитель и генеральный директор Endogena Маттиас Стегер сообщает, что исследователям удалось добиться улучшения зрения даже через три месяца. Если программа окажется успешной, компания предусмотрит режим периодического дозирования для того, чтобы время от времени пополнять популяции фоторецепторов. По словам Стегера, нет необходимости заменять тысячи этих фоторецепторов каждый день. Дегенерация — более медленный процесс, чем регенерация, которую ученые и стремятся стимулировать.
Малые молекулы явно привлекают внимание; они дешевы в производстве и просты в плане введения испытуемым (пациентам), однако будут ли они достаточно специфичны и эффективны, чтобы стимулировать значительное улучшение зрения пациентов, вопрос пока открытый. По словам Луизы Модис, директора по безопасности британской компании Mogrify в Оксфорде, ученые проводят эти [исходные клетки] через довольно напряженный процесс. Сами клетки такой путь проходить «не хотят». По ее мнению, для достижения эффекта нынешних усилий недостаточно. Томас Рех из Вашингтонского университета солидарен с этим мнением. Он экспериментирует с различными комбинациями транскрипционных факторов для перепрограммирования исходных клеток в клетки, полезные для достижения клинического эффекта. Как он сообщает, вполне возможно, что удастся вызвать подобное перепрограммирование, либо изменяя последовательность этих факторов транскрипции, либо находя правильные комбинации. По крайней мере, его команде не удалось добиться аналогичного эффекта путем воздействия комбинации малых молекул. По его словам, основным недостатком является то, что эмбриональные пути, активируемые малыми молекулами, работают как у эмбрионов, так и во взрослом организме. Он заявляет, что путей, являющихся специфичными сугубо для эмбриона, нет. Напротив, разные транскрипционные факторы, которые составляют значительную часть протеома человека, активны на разных стадиях процесса эмбрионального развития и могут обеспечить более прицельное перепрограммирование.
Однако определение правильных комбинаций транскрипционных факторов и правильного порядка, в котором они совместно работают, чтобы образовались необходимые исследователям клетки, находится еще в стадии разработки. Рех с соавт. несколько лет назад совершили важное открытие: путем сверхэкспрессии транскрипционного фактора Ascl1 и одновременного введения ингибитора деацетилазы гистонов им удалось превратить мюллеровскую глию (специализированные глиальные клетки сетчатки) у взрослых мышей в функционирующие нейроны сетчатки внутреннего ядерного слоя. В результате этого эксперимента были получены биполярные клетки — нейроны-передатчики, которые связывают светочувствительные фоторецепторы с ганглиозными клетками, затем направляющими визуальную информацию в мозг. Возможности применения такого открытия ограничены, поскольку это не тот тип клеток, который чаще всего подвержен повреждениям, однако это важное доказательство того, что клеточное перепрограммирование возможно. Рех поясняет, что при превращении глии в нейроны во взрослой сетчатке они соединяются с уже существующими нейронами. Они формируют синапсы. Они реагируют на свет. У них есть все электрические характеристики, присущие нейронам. «Это действительно круто, если подумать. Мы вообще не ожидали, что подобное может произойти», — добавляет Рех.
Впоследствии исследователи из его команды сообщили, что они могут отказаться от ингибитора деацетилазы гистонов, добавив в эксперимент второй фактор транскрипции, Atoh1. Такая комбинация привела к образованию нескольких типов нейронов сетчатки даже при отсутствии ее повреждения. Наиболее распространенные клетки, полученные по данной методике, напоминали ганглиозные клетки сетчатки, хотя процесс дифференцировки оказался неполным, и их аксоны не доходили до головного мозга. Другое направление исследований включает подавление экспрессии транскрипционных факторов NRL и NR2e3, которые необходимы для развития и поддержания палочек. В отсутствие NRL и NR2e3 клетки становятся более похожими на колбочки и больше не гибнут от болезнетворных мутаций, поражающих палочки. Более того, соседние колбочки также больше не погибают, благодаря чему возникает потенциальный механизм для продления выживания колбочек при ПДС. Эта работа была проведена на мышах, и теперь группа Реха пытается воспроизвести ее результаты на более крупных животных. Команда работает со стартапом, который все еще находится в неразглашаемом режиме, суть которого — практическое переложение этой работы в методы лечения.
Исследования компании Mogrify также находится на ранней стадии разработки одноименной прогностической системы клеточного перепрограммирования. Их метод основан на применении обширных вычислительных мощностей для картирования регуляторных сетей, связанных с большим количеством факторов транскрипции, активных в различных типах клеток. Это позволяет выявлять возможные комбинации транскрипционных факторов, которые управляли бы «трансдифференцировкой» или преобразованием одного типа клеток в другой без необходимости возврата в плюрипотентное состояние. Подход может найти широкое применение — у компании есть программы по метаболическим заболеваниям, глухоте и фиброзу, а также по офтальмологии. «Любая исходная клетка может стать клеткой, которая будет нам полезна», — заявляет Модис. Система не ограничена лишь транскрипционными факторами: она также способна определять виды некодирующих РНК, которые модулируют экспрессию генов, — такие как микроРНК. Пока компания не раскрывает подробностей своих проектов, однако в сфере офтальмологии основное внимание сосредоточено на регенерации фоторецепторов и ганглиозных клеток сетчатки. Два других подхода к стимуляции регенерации, которые находятся в активной разработке учеными компании (хотя результаты первоначальных испытаний довольно скромны) — это оптогенетика — введение в клетки сетчатки генов, экспрессирующих светочувствительные белки опсины, и клеточная трансплантация.
Полностью восстановить или хотя бы сохранить зрение — крайне труднодостижимая цель. Однако первая партия испытаний, которая сейчас проводятся, предоставит ценные данные, которые послужат основой для будущих исследований.
«Вполне возможно, что в ходе работы с последовательностями транскрипционных факторов или же обнаружением правильных комбинаций этих факторов путем проб и ошибок мы сможем добиться запуска системы перепрограммирования клеток».
