Клик-реакции в создании радиофармпрепаратов
Стремление лучше разобраться в живых системах и поиск более эффективных методов лечения вызвали всплеск исследований на стыке химии, биологии и медицины. Общая направленность такой работы состоит в модификации биологически активных молекул, чтобы получить зонды для более глубокого изучения биологических систем и создания диагностических средств и медикаментов для клинического применения. Однако химические манипуляции с биомолекулами — будь то небольшие молекулы или нуклеиновые кислоты, углеводы, липиды, белки (в частности, например, антитела) — осложнены тремя проблемами. Во-первых, в природе встречается лишь несколько функциональных химических групп (к примеру, амины и карбоновые кислоты), каждой из которых требуются свои условия для реализации реакционной активности. Во-вторых, биомолекула часто может содержать несколько копий одной и той же функциональной группы. И что еще хуже, некоторые из них могут быть расположены в области, ответственной за биологическую активность соединения. В результате модификация биомолекулы в каком-то одном месте без нарушения ее функции может оказаться непростой задачей. В-третьих, многие биомолекулы очень чувствительны к температуре, растворителю и рН, и поэтому ими можно манипулировать только в биологически совместимых условиях. Исторически сложилось так, что эти внутренне обусловленные препятствия наложились друг на друга, что превратило синтез эффективных биомолекулярных средств в лучшем случае в трудный процесс, а в худшем — в невозможный.
▶ Читайте также: Нобелевская премия по химии 2022
Нобелевская премия по химии за 2022 год была присуждена докторам Кэролин Бертоцци, Мортен Мелдал и К. Барри Шарплесс за создание комплекса новых химических превращений — «клик-химии». Это произвело революцию в исследованиях на стыке химии и биологии. Клик-реакции быстрые, эффективные, модульные, чистые, селективные и совместимы с водными условиями. Название, придуманное Шарплессом, наводит на мысли о кусочках молекулярной головоломки, которые соединяются друг с другом (и только друг с другом) просто и легко. Одновременно и независимо друг от друга Мелдал и Шарплесс разработали то, что сегодня известно как каноническая клик-реакция. В этом превращении азид и алкин вступают в реакцию циклоприсоединения с помощью меди в роли катализатора с образованием триазольного кольца, тем самым связывая вместе любые соединения-«грузы», присоединенные к компонентам этого молекулярного дуэта (рис. 1А) [1, 2]. Легко представить, как катализируемое медью азид-алкиновое циклоприсоединение (CuAAC, от англ. copper(Cu)-catalyzed azide–alkyne cycloaddition) позволит обойти вышеупомянутые трудности: биомолекулу, содержащую один азид, можно легко «защелкнуть» с алкинсодержащим компонентом в мягких условиях водной среды без образования нежелательных побочных продуктов. Помимо сугубо теоретической научной значимости для биохимии, лигирование при помощи CuAAC оказалось незаменимым в различных областях: от разработки лекарств и химии материалов до биомедицинской инженерии и нанонауки.
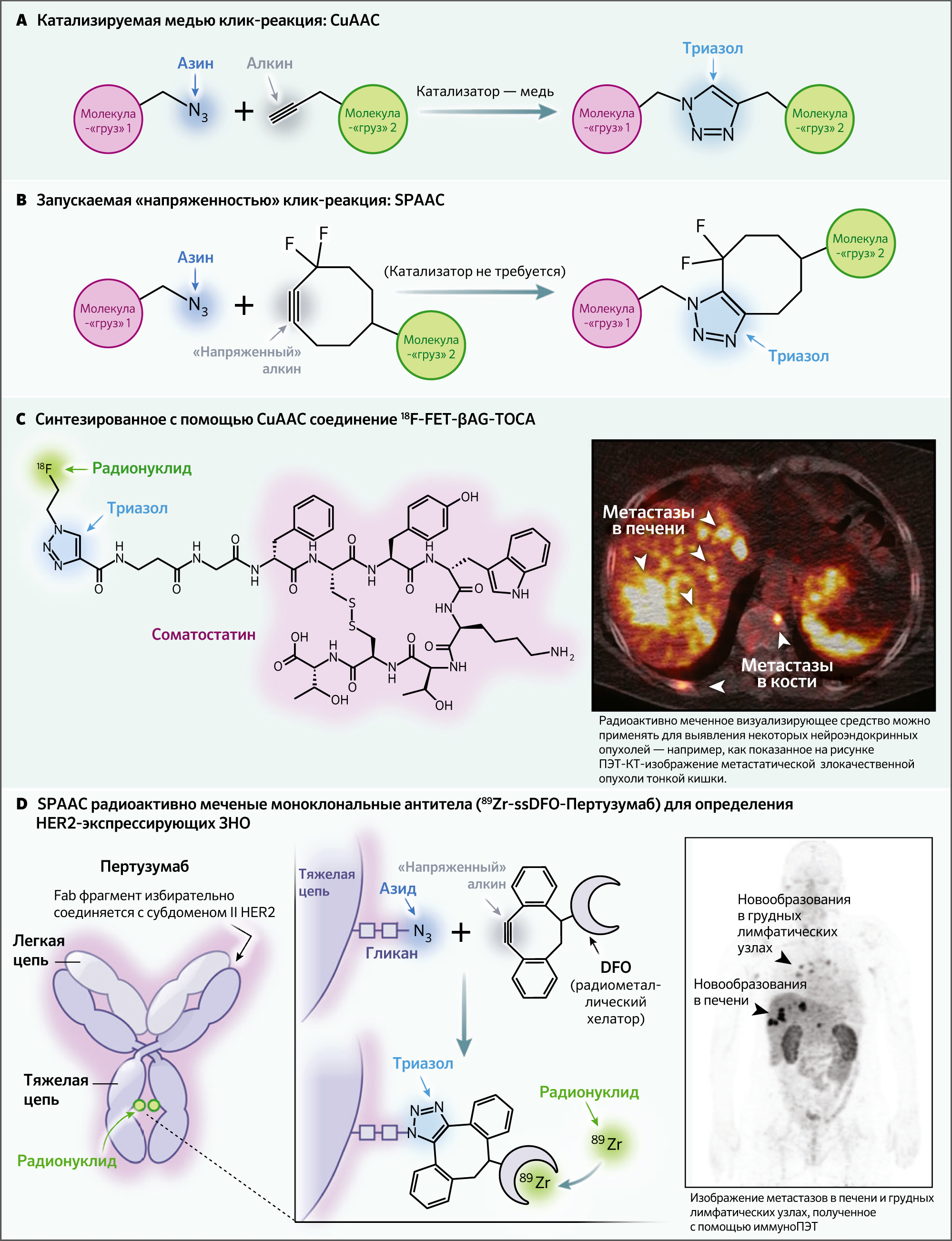
После открытия реакции CuAAC она мгновенно стала своего рода научным хитом, однако некоторые условия оказались непригодны для осуществления лигирования. В сложных биологических системах, таких как живые организмы, слишком непросто собрать в одном месте азид, алкин и катализатор. Требовался более простой вариант реакции, включающий лишь два компонента; таковой был разработан Шарплессом и Мелдалом. И здесь на помощь приходит работа Бертоцци. В ее варианте циклоприсоединения по-прежнему используется азид, но он сочетается с циклическим алкином, который подпружинен с тем, что химики называют «напряжением цикла» (рис. 1Б) [3]. Высвобождение этого «напряжения цикла», когда алкин реагирует с азидом, придает импульс реакции циклоприсоединения, необходимый для ее протекания без медного катализатора. Такое превращение было названо азид-алкиновым циклоприсоединением, запускаемым напряжением (SPAAC). В качестве биоортогональной клик-реакции — преобразования, которое может происходить в биологических системах, не нарушая их, — реакция SPAAC позволила использовать клик-химию в ранее недоступных биологических средах. Бертоцци и ее коллеги продемонстрировали это в экспериментах с живыми эмбрионами рыбок данио: ученые проводили обработку их азид-модифицированными сахарами [4]. По мере развития эмбрионов эти азидсодержащие сахара в ходе метаболизма включались в гликаны клеточной поверхности различных тканей. Там впоследствии они могли подвергаться SPAAC-реакции с напряженными алкинами, помеченными флуорофорами, чтобы подсветить появляющийся [в ходе эмбриогенеза] гликом рыбок данио.
Появление клик-химии стало поистине сейсмическим событием почти для всех областей химической науки. Радиофармацевтическая химия — не исключение. Клик-химия — чрезвычайно мощный инструмент для радиохимии: распад радионуклидов выводит в приоритет скорость синтеза, а селективность и совместимость с водными условиями протекания реакции имеют решающее значение, поскольку биомолекулы часто используются в качестве платформ для радиофармпрепаратов и радиотерапевтических лекарственных средств. За последние 15 лет реакции CuAAC и SPAAC использовались для создания радиофармпрепаратов, меченных всем: от короткоживущих нуклидов (например, углерода-11 и фтора-18 [18F]) для позитронно-эмиссионной томографии (ПЭТ) до долгоживущих изотопов (например, лютеций-177 и актиний-225) для таргетной радионуклидной терапии. Некоторые из этих средств нашли применение в клинических условиях. В 2016 году была проведена трансляция меченого 18F фторэтилтриазол-Tyr3-октреотата (радиофармпрепарат, селективно связывающийся с рецептором соматостатина), синтез которого стал возможен благодаря реакции CuAAC, для получения ПЭТ-изображений нейроэндокринных опухолей у пациентов (рис. 1C) [5]. Совсем недавно авторы применили SPAAC-реакцию для создания версии препарата пертузумаба, меченного радиоактивным цирконием-89 на гликанах тяжелой цепи (рис. 1D). В настоящее время проводится испытание на пациентах этого зонда для ПЭТ на основе антител (т. н. иммуноПЭТ) с целью визуализации злокачественных поражений, экспрессирующих рецептор человеческого эпидермального фактора роста 2 (Clinical-Trials.gov, NCT04692831).
Нобелевская премия знаменует захватывающий и важный момент для клик-химии. Своей лабораторной деятельностью трио лауреатов удалось вдохновить других ученых на разработку множества новых биоортогональных клик-реакций, каждая из которых находит применение в химии, биологии и медицине. Важно отметить, что технологии, основанные на клик-химии, все чаще находят путь в клиническую практику. От химических открытий до медицинского применения может пройти немало времени, однако технология, возникшая в результате открытий Бертоцци, Мелдаля и Шарплесса, на верном пути.
