Аутоиммунитет в патогенезе атеросклероза как основа для новых методов лечения
В ходе экспериментальных исследований на животных подчеркивалась роль аутоиммунитета в развитии атеросклероза. Теперь и работы с секвенированием отдельных клеток подтверждают верность теории о развитии атеросклеротических бляшек уже у людей.
Воспаление интимы артерий — ключевой процесс как в развитии атеросклероза, так и в деградации ткани бляшки и ее разрыва [1]. Изначально считалось, что это воспаление — всецело результат накопления и окисления липопротеинов в интиме внеклеточного матрикса. Это приводило к активации провоспалительных врожденных иммунных реакций. В поддержку этой идеи приводится следующее: генетическая делеция важных компонентов врожденного иммунитета, таких как Toll-подобные рецепторы, приводит к значительно менее выраженному развитию атеросклероза у мышей с гиперхолестеринемией [2]. Более того, согласно результатам клинических исследований, статины в значительной степени уменьшают воспаление и улучшают стабильность тканей при «запущенных» бляшках [3]. На данный момент хорошо известно, что эффективное воздействие на факторы риска, например, на снижение уровня холестерина с помощью статинов, способно на 50 % снизить риск сердечно-сосудистой катастрофы. Тем не менее еще остается множество пациентов без достаточной степени «защиты». Факторы, ответственные за этот остаточный риск — объект пристального внимания. Лица с признаками воспаления во время лечения статинами относятся к категории повышенного риска [4], и, как показывают результаты исследования CANTOS, этот риск можно снизить посредством терапии, направленной против цитокина IL-1β [5].
Что же тогда является причиной этого остаточного воспаления у пациентов на статинах? Одним из объяснений (что ученые и стремились проверить на животных моделях в ходе экспериментов) стала активация аутоиммунных реакций против модифицированных аутоантигенов в стенке артерии. Первые доказательства появились в конце 1980-х годов, когда удалось показать, что в атеросклеротических бляшках человека содержатся активированные Т-клетки [6]. Несколько лет спустя было обнаружено, что многие из них специфичны для окисленных липопротеинов низкой плотности (ЛПНП) [7]. Факт присутствия аутоантител к окисленным ЛПНП стимулировал изучение роли адаптивного иммунитета в патогенезе атеросклероза [8]. Исследования на мышах показали, что Т-хелперы 1 типа (TH1), а также TH2 играют проатерогенную роль, тогда как регуляторные Т-клетки (T-reg) — защитную [9]. Эти наблюдения дали надежду на разработку иммуномодулирующей терапии для предотвращения развития сердечно-сосудистых заболеваний путем подавления проатерогенных и/или усиления протективных иммунных реакций. Благодаря недавним методологическим достижениям удалось прояснить значение адаптивного иммунитета в патогенезе атеросклероза. Стало ясно, что число лимфоцитов явно превосходит число макрофагов в бляшках сонных артерий у человека [10]. Несколько вакцинных препаратов, в составе которых преобладают пептидные последовательности аполипопротеина B-100, уже продемонстрировали обнадеживающие результаты на животных моделях атеросклероза [11], однако их перевод в плоскость клинических испытаний оказался затруднен. Причиной стало плохое понимание того, насколько качественно эти модели способны отражать роль адаптивных аутоиммунных реакций в развитии атеросклероза у человека. Две статьи, опубликованные в двух выпусках Nature Cardiovascular Research [12, 13], дают важные ответы на этот вопрос (рис. 1).
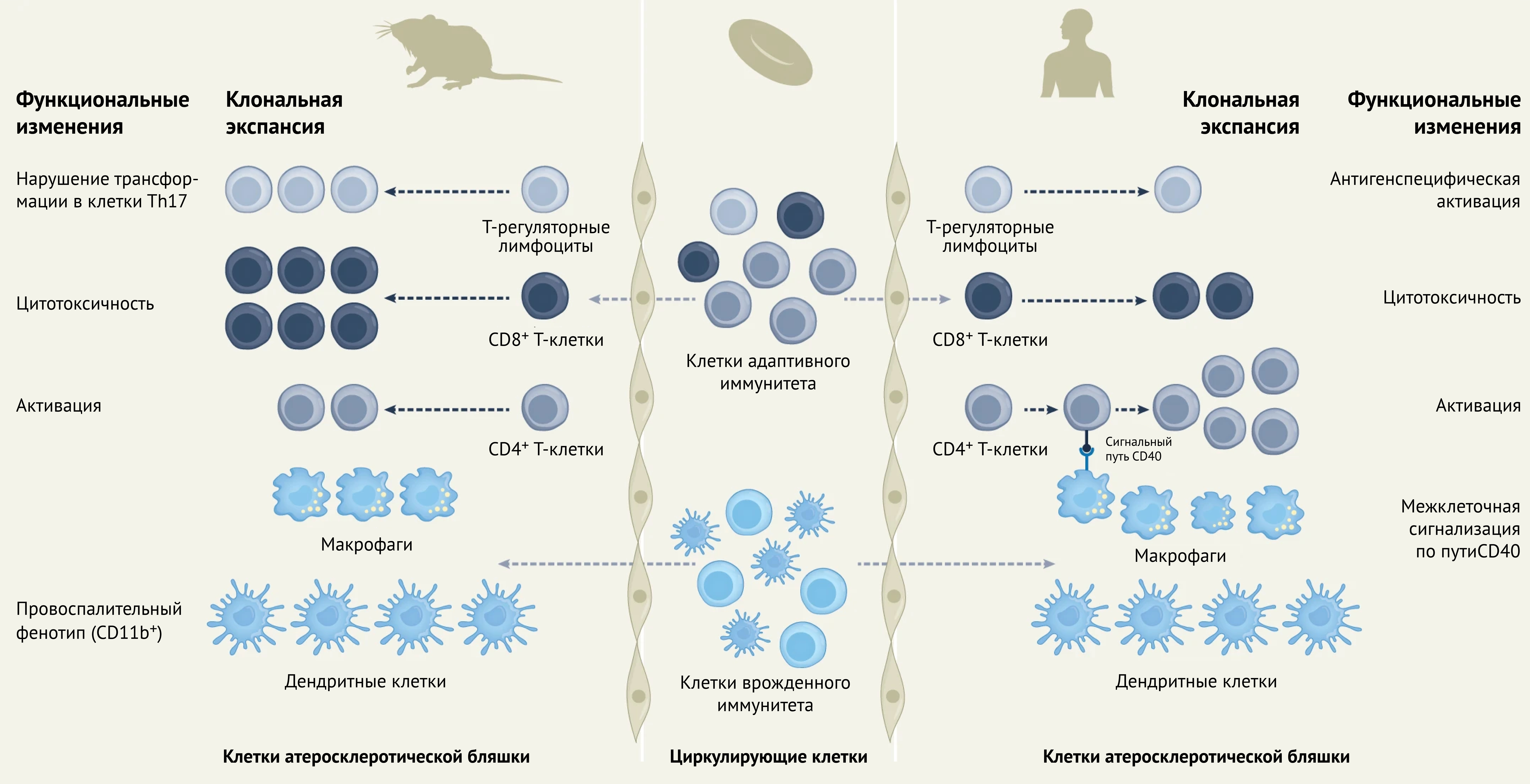
В одной из статей сообщается, что Ван с соавт. [12] применили секвенирование транскриптома единичной клетки наряду с секвенированием [последовательности] Т-клеточного рецептора (TCR) для изучения чекпоинтов иммунологической толерантности в атеросклеротических бляшках и третичных лимфоидных органах артерий (прим.перев. — ATLO (artery tertiary lymphoid organs) — это скопления лимфоидных клеток в адвентиции пораженных артерий; развитие таких структур связано с атеросклерозом) и лимфатических узлах, дренирующих кровь из аорты у старых мышей с делецией гена Apoe (Apoe–/–). Авторы использовали для сравнения лимфатические узлы и кровь мышей дикого типа, чтобы понять толерантность Т-клетки и механизмы их активации. Различий по количеству циркулирующих субпопуляций Т-клеток или миелоидных клеток между мышами Apoe–/– и грызунами дикого типа обнаружено не было. Однако в ATLO и в дренирующих лимфоузлах у мышей Apoe–/– оказалось больше CD4+ и CD8+ эффекторных Т-клеток памяти, чем в лимфоузлах мышей дикого типа. Клетки в бляшках демонстрировали и иные признаки иммунологической активации и утраты толерантности, например, снижение количества T-reg-клеток и еще большее увеличение числа CD8+ T-эффекторных клеток памяти. Также в бляшках был выявлен больший процент содержания миелоидных клеток, и тогда как дендритные клетки в лимфатических узлах характеризовались толерогенным (CD11c-) фенотипом, клетки в ATLO и бляшках — преимущественно провоспалительным (CD11b+). Кроме того, благодаря секвенированию TCR удалось выявить клональную экспансию CD4+ T-клеток, T-reg-клеток и, что особенно важно, CD8+ T-клеток в ATLO и бляшках. Последние два типа клеток характеризовались сниженной экспрессией генов, кодирующих молекулы эгрессии, а также повышенной экспрессией генов, кодирующих молекулы истощения. Предполагается, что клетки с такими характеристиками в основном утратили свой функционал. Клетки T-reg в бляшках имели признаки дисфункции и превращения в провоспалительный фенотип TH17. Наконец, авторы сравнили свои результаты с опубликованными наборами данных об атеросклеротических бляшках и обнаружили, что количество CD8+ Т-клеток и макрофагов, а также профили транскриптов в бляшках человека и мыши во многом сходны.
В другой статье описывалось, как Depuydt с соавт. [13] применили аналогичные технологии для сравнения лимфоцитов из атеросклеротических бляшек сонных артерий человека и соответствующих клеток из образцов периферической крови. Процент недавно активированных Т-клеток оказался заметно выше в бляшках, чем в крови. Клональная экспансия CD8+ Т-клеток была выявлена как в крови, так и в бляшках, однако только CD8+ Т-клетки в последних демонстрировали признаки недавней активации (т.е. экспрессии генов, кодирующих молекулы цитотоксичности). Хотя клональная экспансия была меньше среди CD4+ Т-клеток, оказалось, что она более специфична в бляшках для этих лимфоцитов по сравнению с CD8+ Т-клетками. Также CD4+ Т-клетки, подвергнутые клональной экспансии, демонстрировали признаки недавней активации. Это позволяет предположить, что эти клетки вовлечены в антиген-специфические взаимодействия в самой бляшке. Интересно, что отсутствие признаков локальной клональной экспансии Treg-клеток, которые экспрессировали гены, подобные тем, что функционировали при недавней антиген-специфической активации. Т-хелперы 17 чаще встречались в цельной крови, чем в образцах из бляшек, а признаки трансформации T-reg-клеток в Т-хелперы 17 не наблюдались. Используя современные наработки в программном обеспечении, которое может помочь в предсказании сигнальной активности между лигандом и рецептором, авторы смогли обнаружить признаки презентации антигена клонам CD4+ Т-клеток в бляшках макрофагами TREM2, причем сигнальный путь CD40 является особенно важным. Макрофаги TREM2 представляют собой нагруженные липидами клетки с нарушенной способностью экстракции холестерина вовне (их относят к М2-фенотипу — репарирующие макрофаги). Наконец, используя уже опубликованные данные, авторы продемонстрировали существование выраженного перекреста в паттернах экспрессии генов между Т-клетками в бляшках и клетками в синовиальной жидкости у людей с аутоиммунным заболеванием — псориатическим артритом.
Эти две статьи проливают свет на сложное клеточное взаимодействие, которое происходит в локальном окружении атеросклеротической бляшки. Они также показывают, как методы секвенирования могут ускорить научный прогресс в этой сфере, хотя важно знать, что методы выделения клеток могут исказить результаты (т.е. может произойти утрата определенных клеточных фенотипов или исчезнет влияние на сложные пути клеточной активации).
Эти исследования подтверждают идею о том, что воздействие на аутоиммунные реакции при атеросклерозе — вполне возможная стратегия разработки новых методов лечения по снижению остаточного риска у пациентов с сердечно-сосудистыми заболеваниями, которые сегодня уже получают наилучшую медикаментозную терапию. Целенаправленное воздействие на воспаление в атеросклеротической бляшке является перспективным методом, поскольку риск развития серьезных инфекций минимален, что отметили в исследовании CANTOS при применении системной противовоспалительной терапии. Это мнение также подтверждают другие клинические испытания иммуномодуляторов. Они показывают, что для достижения кардиопротекторного эффекта требуется воздействия на определенные иммунные процессы. А в настоящих статьях сообщается, что процессы активации адаптивных иммунных ответов в атеросклеротических бляшках как мышей, так и людей обладают как сходствами, так и различиями. Реакции CD8+ Т-клеток очень сходны у людей и грызунов, однако еще предстоит разобраться, какие конкретно антигены распознают эти клетки. Недавно Чаудхури с соавт. [15] сообщили, что изначально некоторые из этих клеток были специфичны для гриппа и других вирусов, в том числе и SARS-CoV-2, однако впоследствии они начали проявлять признаки перекрестных реакций с белками сосудов. Хотя это открывает интересные терапевтические возможности посредством применения противовирусной вакцинации, данная гипотеза еще должна пройти проверку. Оба исследования в Nature Cardiovascular Research сообщают о болеей специфичной экспании бляшек CD4+ T-клетками, чем CD8+ [12,13], что указывает на участие внеклеточных аутоантигенов. Это согласуется с идеей об окисленных ЛПНП и других поврежденных структурах бляшек как ключевых мишенях аутоиммунных реакций. Таким образом, исследователи надеются, что вакцина против толерантности к атеросклеротическим бляшкам станет клинической реальностью.
