Новый препарат в лечении фибрилляции предсердий

Фибрилляция предсердий (ФП) — наиболее распространенная форма стойкой аритмии, являющаяся серьезной проблемой как для пациентов, так и для медработников. Согласно клиническим данным, применение антиаритмической терапии, восстанавливающей и поддерживающей синусовый ритм, способна уменьшить риск неблагоприятных исходов у пациентов с впервые выявленной фибрилляцией предсердий. В результате, происходит сдвиг парадигмы от контроля частоты сердечных сокращений в сторону контроля ритма сердца, вследствие чего существует необходимость применения эффективных и безопасных антиаритмических препаратов.
Общим ограничением современных антиаритмических средств является их довольно умеренная эффективность, что не соответствует прогрессирующей природе проаритмического субстрата, лежащего в основе кардиомиопатии предсердий (что выражается в виде ФП) (рис.1). Большинство антиаритмических препаратов, используемых для контроля ритма, изначально разрабатывались не для лечения ФП, а их механизмы действия не являются специфичными [1, 2]. Такая неспецифичность действия резко контрастирует с тем количеством молекулярных механизмов, лежащих в основе ФП, которые были открыты за последние 30 лет [3]. При этом необходимо отметить, что фарм-индустрия сталкивается с экономическим давлением, которое не лучшим образом влияет на возможность проведения дорогостоящих и длительных этапов разработки препаратов. А для внедрения лекарств в клиническую практику требуются соответствующие результаты крупных клинических испытаний [1, 2]. Более того, получение разрешения на применение препаратов в клинике требует соответствия целому ряду требований структур-регуляторов (например, для внедрения в практику устройств для катетерной аблации при ФП необходимо куда меньше разрешений от регулирующих структур). Последний фактор объясняет значительной прогресс в направлении катетерной аблации при ФП за последние 25 лет. По части достижения контроля над сердечным ритмом, считается, что катетерная аблация является более эффективным подходом, в сравнении с медикаментозной терапией [3]. Несмотря на то, что не все пациенты с ФП подлежат катетерной аблации, в некоторых случаях комбинация аблации и антиаритмиков является обязательной для обеспечения эффективного контроля сердечного ритма. Следовательно, проблема разработки новых антиаритмических препаратов для лечения ФП вполне актуальна.
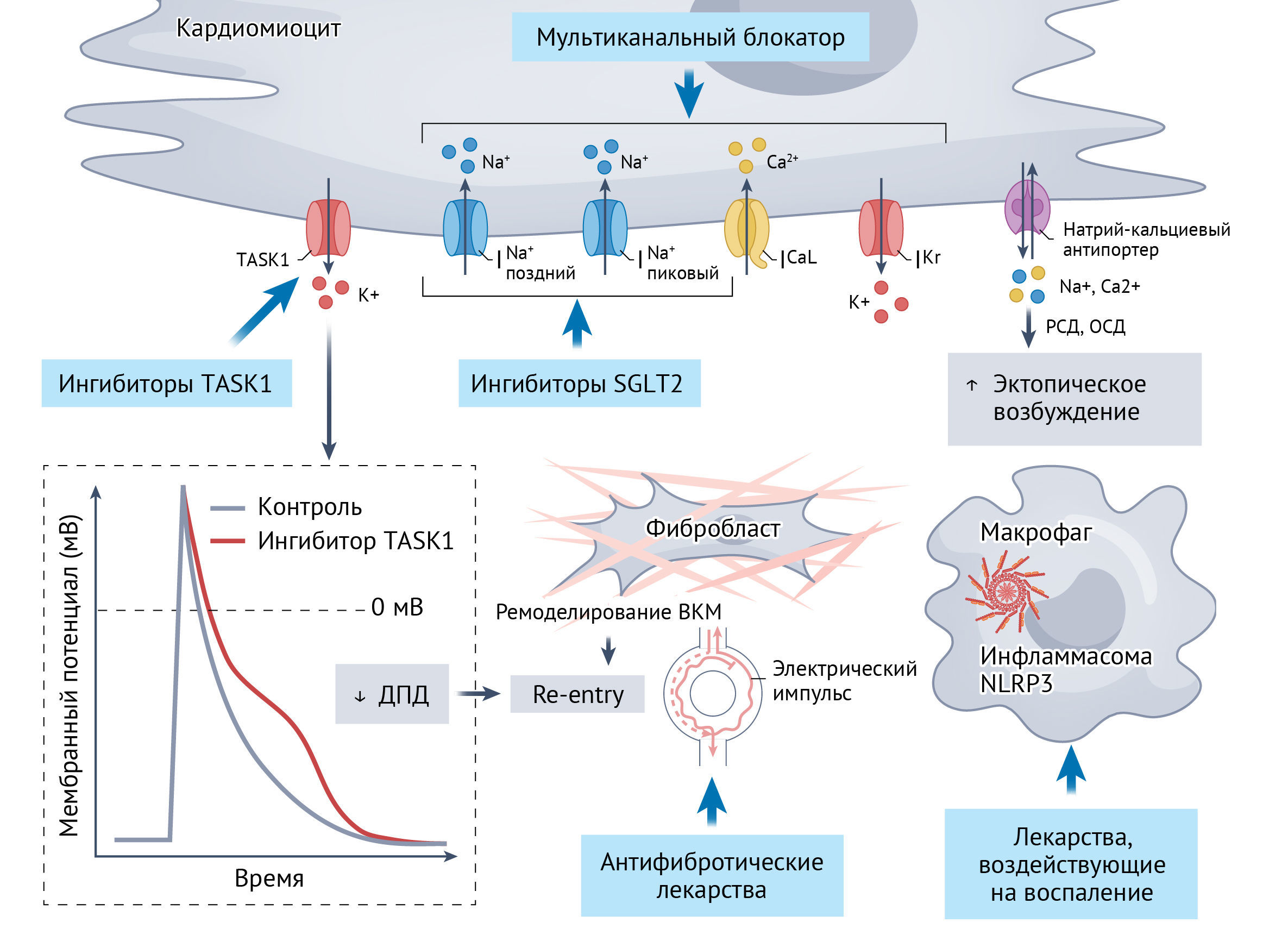
ДПД — длительность потенциала действия
ОСД — отсроченная следовая деполяризация
РСД — ранняя следовая деполяризация
ВКМ — внеклеточный матрикс
ICaL — поздний ток кальция
INa,late — поздний ток натрия
IKur — сверхбыстрый ток калия замедленного выпрямления
INa,peak — пиковый ток калия
NCX — натрий-кальциевый антипортер
SGLT2 — натрий-глюкозный котранспортер 2
TASK1 — член подсемейства калиевых каналов 3
Принимая во внимание тот факт, что ФП — это обычно не смертельно опасная форма аритмий, самым важным аспектом антиаритмической медикаментозной терапии является профиль безопасности. К сожалению, риск развития желудочковой проаритмии (аритмия, развивающаяся на фоне приема лекарственных препаратов — прим. перев.) является главным отрицательным фактором в профиле безопасности любых антиаритмиков. Избежать этого побочного эффекта можно путем воздействия на специфичные для предсердий анатомические структуры. В качестве потенциально эффективного метода воздействия предлагается блокада специфичного для кардиомиоцитов предсердий сверхбыстрого тока калия замедленного выпрямления (IKur). Предполагается, что такая блокада увеличит продолжительность потенциала действия в предсердиях и, следовательно, нарушит механизм re-entry [2]. Однако, исследования II фазы, в которых проводилась оценка применения ингибиторов IKur, таких как BMS-394136, BMS-919373, MK-0448, S66913, XEN D0101 и XEN D0103, у пациентов с ФП, продемонстрировали недостаточную антиаритмическую эффективность. Последнее связывают с подавлением IKur токов или парадоксальным укорочением потенциала действия (в процессе генерации синусового ритма), что благоприятствует запуску ФП вновь и вновь [1].
Подобные результаты сообщались и применительно к ингибиторам тока ионов К+, активируемого ацетилхолином (IK,ACh). Этот ток специфичен для предсердий и играет важную роль в аритмогенезе, являясь, таким образом, патогенетическим фактором ФП. Мощный антиаритмический эффект блокаторов IK,ACh , наблюдаемый в ходе доклинических исследований, не подтвердился в клинических испытаниях, а экспериментальный препарат-ингибитор IK,ACh BMS-914392 не обеспечивает должный контроль сердечного ритма при употреблении в дозировках, позволяющих избегать развития неврологических побочных эффектов [1].
Калиевый канал TASK1 (кодируется геном KCNK3), в структуре которого имеется домен из двух пор, экспрессируется исключительно в предсердиях, а его активность повышена в кардиомиоцитах у пациентов с ФП [4]. Ток по каналам ITASK1 играет важную роль в укорочении длительности потенциала действия в патогенезе ФП. Ингибирование каналов TASK1 приводит к специфическому антиаритмическому воздействию, без влияния на желудочки [1, 4]. Блокада канала TASK1 посредством одноименных препаратов-ингибиторов или генной терапии, в основе которой вектор адено-ассоциированного вируса 9, мишенью которой является ген KCNK3, демонстрирует мощный антиаритмический эффект в доклинических испытаниях [5]. В ходе исследования DOCTOS оценивалось использование блокатора TASK1 доксопрама при фармакологической кардиоверсии у пациентов с пароксизмальной или постоянной формой ФП [5].
Калиевые каналы малой проводимости, активируемые ионами кальция (SK, от англ. small conductance Ca2+-dependent K+ channels), экспрессируются по всей ткани сердца, селективно регулируя реполяризацию потенциала действия в предсердиях [2]. Блокатор SK-каналов АР30663 продемонстрировал безопасность в испытании I фазы, хотя одним из его эффектов стала пролонгация интервала QTc [1]. Исследование II фазы этого же препарата показало эффективность и безопасность во всех конечных точках кардиоверсии в течение 90 минут (испытание проводилось на пациентах с недавним дебютом ФП). Однако клиническая эффективность SK-каналов в контроле ритма неизвестна. Считается, что эти каналы способны индуцировать триггерную активность и укорачивать потенциал действия. Экспрессия белков этих каналов снижена у некоторых пациентов с ФП [1,2]. В данный момент проходит испытание I фазы ингибитора SK-каналов 2го поколения (для перорального приема) АР 31969 [2]. Также готовится исследование оценки ондансетрона для лечения ФП. Ондансетрон, препарат, обычно применяемый в качестве противорвотного средства, ингибирует рецептор 5-гидрокситриптамина; есть сообщения о том, что одним из его побочных эффектов является влияние на SK-каналы [1].
Мультиканальные ингибиторы находятся на стадии клинических испытаний. Новый блокатор мульти-ионных каналов HBI-3000 (сулькардина сульфат), который воздействует на натриевый (пиковый и поздний), кальциевый (поздний) и калиевый ток, проходит испытание для лечения недавно манифестирующей ФП. Этот препарат хорошо переносился пациентами в I фазе испытаний и был лишен проаритмического эффекта, несмотря на то, что приводил к развитию дозо-зависимых изменений на ЭКГ (удлинение Р-волны и интервалов QRS и PR). Готовится испытание II фазы по оценке эффективности внутривенного (болюсного) введения HBI-3000 в целях кардиоверсии у пациентов с недавним дебютом ФП [2]. В испытании II фазы проводилась оценка эффективности антиаритмика HSY244 для кардиоверсии при ФП (механизм действия препарата до конца не ясен; испытание было остановлено по финансовым причинам) [7]. Ни у одного из семи испытуемых, кому вводился HSY244, в течение 90 минут не было зафиксировано кардиоверсии.
Иной стратегией терапевтических инноваций является альтернативный способ введения традиционных антиаритмиков, сходный с путями введения таргетной терапии. В перечень тестируемых способов введения входят: инъекции ботулотоксина в эпикардиальную жировую ткань во время кардиохирургических операций с целью воздействия на ганглионарное сплетение, внутриперикардиальное введение антиаритмиков, интраназальное введение флекаинида [1,2]. Еще одной новой разработкой является интраназальный ингибитор Ca2+-каналов этрипамил [1,2]. Наконец, исследование II фазы HARMONY [8] подтверждает синергическое действие ранолазина (блокатор позднего тока натрия) и низких доз дронедарона (мультиканальный блокатор) в контексте снижения тяжести ФП с положительным профилем безопасности. Это открытие показывает потенциал комбинированной антиаритмической лекарственной терапии.
Терапевтические средства, влияющие на сигнализацию посредством трансформирующего фактора роста β или инфламмасом NLRP3, способны устранять такие особенности предсердной кардиомиопатии, как фиброзное ремоделирование и воспаление. Однако устранение сложных механизмов воспаления при ФП остается серьезной проблемой. В исследовании CONVERT-AF [9] изучалось то, как влияют активация инфламмасомы NLRP3, а также моноклональные антитела к IL-1β (канакинумаб) на контроль ритма после электрической кардиоверсии у пациентов с ФП. Согласно результатам, наблюдалось уменьшение тяжести ФП, однако оно не оказалось статистически значимым, по сравнению с плацебо, что указывает на необходимость дальнейших исследований [2,9]. Метформин оказывает сильное антифибротическое действие при экстракардиальных состояниях за счет активации сигнального пути AMPK, который, в свою очередь, ингибирует путь TGF-β1/SMAD и предотвращает дифференцировку фибробластов в миофибробласты [1]. Обсервационные исследования показывают, что метформин снижает риск ФП по сравнению с другими пероральными противодиабетическими препаратами, а в трех клинических исследованиях изучается его использование в качестве антифиброзной терапии для лечения ФП [1,2]. Наконец, колхицин может быть перспективным средством лечения ФП благодаря его противовоспалительным свойствам (он опосредованно ингибирует сборку микротрубочек и активацию инфламмасомы NLRP3 [1]. Согласно данным некоторых клинических исследований, терапия колхицином смягчает течение послеоперационной ФП, тогда как результаты других исследований были более нейтральными [1].
Различные способы модификации образа жизни и факторов риска весьма эффективны в снижении тяжести ФП. В ходе клинических исследований предпринимаются следующие попытки воздействия на факторы риска с помощью фармакотерапии: использование антигипертензивных препаратов (моксонидина) у пациентов с риском ФП; использование средств для снижения веса (глутидов), омега-3 жирных кислот или препаратов традиционной китайской медицины (например, Шэньсун Янсинь) [1,2]. Особые надежды возлагают на ингибиторы натрий-глюкозного котранспортера 2 (SGLT2), которые, как уже показано в клинических испытаниях, снижают частоту развития ФП. Согласно доклиническим данным, наблюдаются зависимые от концентрации применяемых препаратов прямые электрофизиологические эффекты на токи натрия (поздний и пиковый) [10]. Поэтому в нескольких клинических исследованиях изучается использование ингибиторов SGLT2 для контроля ритма [1,2].
В конечном счете, более точная дифференциация отдельных подтипов ФП может помочь определить области применения потенциальных антиаритмиков, прошедших II или III фазу исследований, но в клинических условиях не продемонстрировавших достаточной эффективности. Вполне оправдан расчет на появление ряда многообещающих фармакологических средств для контроля ритма. Ожидается, что такие препараты станут серьезной вехой на пути перехода лечения ФП с нынешнего универсального подхода к прецизионной медицине, адаптированной под каждого пациента.
Антиаритмические препараты также обеспечат доступность контроля ритма для всех пациентов во всем мире, даже в тех социально-экономических условиях, где катетерная абляция широко не применяется.
