Когнитивные нарушения при приеме антипсихотиков: как минимизировать ущерб

В 1950-е было открыто, что антипсихотические препараты способны успешно купировать продуктивную (а в некоторых случаях и негативную) симптоматику тяжелых психотических расстройств. Это привело к тому, что антипсихотики стали препаратами первой линии для быстрого купирования симптомов, а при рецидиве рекомендовалось поддерживающее лечение в течение, как минимум, 1–2 лет в качестве профилактики. Тем не менее антипсихотические препараты обычно не влияют на течение симптомов, которые лежат в основе клинически плохого исхода заболевания, как например, когнитивных нарушений. Клинически значимые когнитивные нарушения являются признаком психического заболевания и фиксировались уже до внедрения антипсихотиков [1]. Хотя степень влияния на течение симптомов вариабельна, бОльшая часть данных показывает, что влияние антипсихотиков на когнитивные функции в общем умеренно положительное. А такое положительное влияние преимущественно объясняется эффектами применения когнитивных тестов или тем, что атипичные антипсихотики в меньшей степени нарушают когнитивные функции, по сравнению с типичными [2, 3].
Все больше новых публикаций показывают, что антипсихотические препараты могут фактически приводить к ухудшению когнитивных функций, включая определенные сферы, как например, вербальное научение и память [4, 5]. Люди, принимающие антипсихотики, обычно отмечают субъективные когнитивные нарушения, а именно — замедление когнитивных функций. Натуралистические исследования показали, что более высокое кумулятивное воздействие антипсихотиков связано с ухудшением когнитивных функций [4], хотя эти результаты могут отражать противоречия при показаниях.
В недавно проведенном тройном слепом рандомизированном контролируемом исследовании сравнивалось влияние рисперидона/палиперидона и плацебо на когнитивные функции в течение первых шести месяцев лечения первого эпизода психоза [5]. Также была набрана контрольная группа из здоровых лиц, не принимавших плацебо или препараты. Авторы обнаружили, что в нескольких когнитивных сферах наблюдаемые стабильность или улучшение течения симптоматики оказались одинаковыми во всех трех группах. Это позволяет предположить, что улучшения на самом деле были типичными и не были связаны с самой патологией или приемом препаратов [5]. Тем не менее значительное влияние наблюдалось применительно к вербальному обучению и памяти: данные показатели в здоровой контрольной группе и группе плацебо улучшились, а в группе рисперидона/палиперидона снизились. Выраженность эффекта была от умеренной до большой [5].
В то же время наблюдается рост числа рандомизированных контролируемых исследований, где проводилось сравнение снижения дозы антипсихотиков и поддерживающей терапии для оценки риска: каков профиль пользы по ряду исходов, не ограничивающихся рецидивом. Определение влияния на когнитивные способности — это тот исход, который чаще всего оценивается в таких исследованиях, предварительные данные которых свидетельствуют о том, что снижение дозы под медицинским контролем может быть связано с более благотворным влиянием на такие когнитивные способности, как скорость обработки информации и глобальной когнитивной функцией.
В перечень антипсихотиков входит целый ряд веществ, обладающих общим механизмом — антагонизмом к дофаминовому D2-рецептору. Помимо этого, атипичные антипсихотики второго поколения также являются антагонистами к серотониновым 5-НТ2-рецепторам, а вещества из третьего поколения преимущественно связываются с D3-рецепторами и частично антагонистичны к D2-рецепторам. Общепринято мнение, что модуляция работы этих нейротрансмиттерных систем отражает исходный механизм, лежащий в основе развития продуктивной симптоматики, что подтверждает дофаминовую гипотезу. Однако, влияние такой модуляции на когнитивные способности и вариабельность ее, в зависимости от принимаемых антипсихотиков, остается недостаточно изученной. Помимо этого, гипотетическими механизмами антипсихотического воздействия на когнитивные функции также является нейромодуляция возбуждающей (доминирующий медиатор — глутамат), тормозной (γ-аминомасляная кислота) и антихолинергической систем, которые влияют на процессы воспаления и могут быть связаны с побочными эффектами, такими как антихолинергическая нагрузка, моторные нарушения и седация. С целью оптимизации выбора антипсихотиков и реакции на лечение, а также минимизации ятрогенных когнитивных эффектов и улучшения полезных эффектов и прогноза, существует острая необходимость в углубленном понимании механизма влияния антипсихотиков на когнитивные функции, посредством проведения систематических исследований.
Влияние дофаминергической модуляции на когнитивную функцию
Модуляция дофамина поддерживает множество когнитивных аспектов, особенно посредством регуляции нейронных цепей, соединяющих префронтальную кору и полосатое тело, формируя, среди прочего, дофаминергические мезокортикальные и мезолимбические пути. В своей предыдущей работе авторы показали, что даже кратковременное применение антипсихотиков может вызвать заметные изменения как в структуре, так и в функционировании кортико-стриарных областей [6]. Исследования с использованием позитронно-эмиссионной томографии (ПЭТ) демонстрируют гиперболическую связь между дозой антипсихотика и занятостью D2-рецепторов, согласно чему повышение дозы препарата связано с постепенно уменьшающимся воздействием на занятость D2-рецепторов. Однако выраженность побочных эффектов, включая когнитивные проявления, по-видимому, усиливается [7]. Аналогичным образом, концентрации антипсихотиков в плазме, соответствующие занятости D2-рецепторов головного мозга выше 70 %, связаны с непропорционально худшими исходами для человека в когнитивном плане [8]. Открытые исследования, где испытуемыми были лица, не принимавшие антипсихотики во время своего первого эпизода, показали, что прием рисперидона (сильного антагониста дофамина) был связан со снижением когнитивных функций в течение 12 недель, при этом наблюдалась значительная отрицательная корреляция между экстрастриарной занятостью D2/3-рецепторов и когнитивными характеристиками [9]. Таким образом, влияние нейролептиков на обучение, память и другие когнитивные функции может возникать вследствие длительного антагонизма к D2-рецепторам [8]. При этом постепенное снижение дозы может привести к нормализации дофамин-опосредованных функциональных нейронных цепей, лежащих в основе когнитивных процессов более высокого порядка.
Влияние антихолинергической модуляции на когнитивную функцию
Хотя уже получены убедительные свидетельства того, что усиленный синтез дофамина [в пресинапсах] в полосатом теле лежит в основе механизма заболеваний, проявляющихся в форме психоза, нейронные изменения, связанные с применением антипсихотиков, не локализованы исключительно в дофаминергических путях, а, скорее, отражают широко распространенные функциональные изменения в таламо-кортикальных цепях, обеспечивающих работу когнитивных процессов более высокого порядка [6]. Антипсихотики (и другие психотропные препараты) различаются по степени антагонизма к рецепторам ацетилхолина; существует такой фактор риска, как антихолинергическая нагрузка. Основные холинергические пути головного мозга берут начало в базальных отделах переднего мозга, стволе мозга и полосатом теле, иннервируя все корковые и подкорковые области. Антихолинергическая нагрузка от психотропных (и непсихотропных) препаратов часто связана с когнитивными нарушениями, при этом воздействие антихолинергических препаратов, включая антипсихотики, связано со значительно повышенным риском развития деменции [10]. У лиц, страдающих психозом, более высокая антихолинергическая нагрузка связана с ухудшением многих когнитивных показателей, таких как внимание, вербальное научение и память (в т.ч. кратковременная), что наблюдается даже после учета таких факторов, как доза лекарства и тяжесть заболевания [11]. Блокада мускариновых холинергических рецепторов антипсихотиками второго поколения может способствовать такому когнитивному нарушению. И наоборот, селективный мускариновый агонизм M1/M4 связан с купированием негативной (и потенциально когнитивной) симптоматики у некоторых пациентов [12].
Эффекты глутаматергической модуляции и нейровоспаления на когнитивные функции
Фиксируются доказательства комплексного взаимодействия между процессами воспаления, оксидативного стресса, дофаминовой передачи, синаптической пластичности и глутаматергической передачи, в том числе и гипофункции рецепторов N-метил-D-аспартата (NMDA-рецепторов). Все перечисленное лежит в основе патогенеза шизофрении [13] и сопутствующей когнитивной дисфункции. У лиц с диагностированной шизофренией и с не первым эпизодом психоза прием рисперидона, по-видимому, снижает уровни провоспалительных цитокинов (ИЛ-6, ФНО-α, ИЛ-2 и ИЛ-1β), однако не оказывает существенного влияния на ИФН-γ [14]. Напротив, провоспалительные эффекты клозапина могут наблюдаться на ранних стадиях лечения, но существенного влияния на ИЛ-6 и ФНО-α, в целом, не обнаружено [14]. Однако имеются и противоречивые данные, поэтому в этой области необходимо проведение дальнейших исследований. Воспаление также может быть связано со сниженными уровнями антиоксидантов в крови и повышенными маркерами оксидативного стресса у лиц с высоким риском психоза и при нелеченном первом эпизоде психоза, однако эти уровни нормализуются при длительном лечении антипсихотиками [15]. Цитокины, такие как ИФН-γ или ФНО-α, также могут вызывать гипофункцию NMDA-рецепторов за счет увеличения синтеза кинуреновой кислоты, которая блокирует сайт связывания глицина на NMDA-рецепторе, но клозапин восстанавливает работу этих рецепторов [13]. Таким образом, необходимо строго взвешивать положительное и отрицательное влияние антипсихотической нейромодуляции на когнитивные функции. Авторы призывают к дальнейшим исследованиям сложного влияния антипсихотиков на нейровоспаление и, как следствие, на когнитивные функции, с учетом того, что наблюдается вариабельность последних в зависимости от препарата, от стадии и продолжительности заболевания и лечения.
Как влияют побочные эффекты антипсихотиков на когнитивные функции
Влияние антипсихотиков на нейротрансмиттерную модуляцию работы нейронных цепей, отвечающих за когнитивные функции, может также проявляться в виде побочных эффектов, как например, седация, двигательные нарушения (т.е. экстрапирамидные эффекты), отсутствие мотивации и затуманивание зрения, что относительно распространено среди пациентов [16]. Такие побочные эффекты могут заметно ухудшать когнитивные функции, затруднять выполнение задач, а также иметь дальнейшее негативное влияние на функционал человека, восстановление его личности [после перенесенных эпизодов психоза] и качество жизни. Еще одним распространенным следствием побочных эффектов антипсихотиков, помимо влияния на когнитивные функции, является то, что люди прекращают прием лекарств без согласования с врачом и без его присмотра. Потенциально это ведет к непредвиденным неблагоприятным последствиям, таким как рецидивы и госпитализация. Побочные эффекты, связанные с приемом антипсихотиков, редко рассматриваются как механизм когнитивных нарушений при психотических расстройствах и требуют более систематического исследования для оптимизации ответа на лечение.
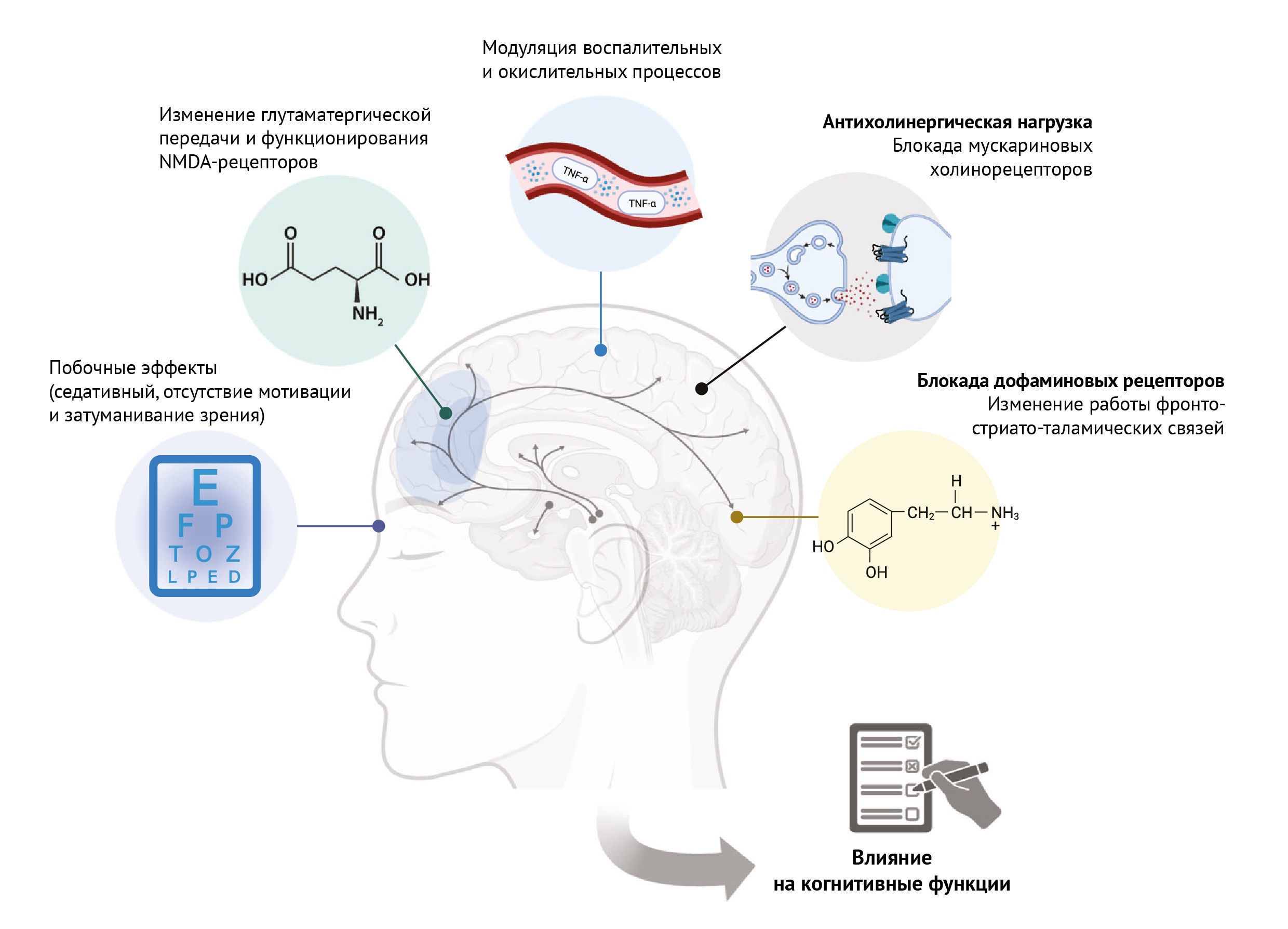
Рис. 1 | Потенциальные механизмы влияния антипсихотиков на когнитивные функции
Перспективы
Авторы предлагают несколько потенциальных механизмов, лежащих в основе влияния антипсихотиков на когнитивные нарушения (см. рис. 1), однако вклад каждого из этих механизмов, вероятно, будет варьироваться в зависимости от класса антипсихотических препаратов, дозы и продолжительности приема, что требует тщательного изучения для информирования медицинских работников, осуществляющих персонализированный уход в клинических условиях. Авторы призывают конкретизировать цели и меры в испытаниях по снижению дозы, а также в продольных, обсервационных и экспериментальных исследованиях, чтобы составить «дорожную карту» и разобраться во влиянии этих различных механизмов. Эти конкретные цели также должны быть включены в рандомизированные контролируемые исследования, в которых сравнивается снижение дозы антипсихотиков с поддерживающей терапией. Например, в исследования необходимо включать данные ПЭТ или магнитно-резонансной спектроскопии для количественной оценки уровней нейромедиаторов и нейрометаболитов, определение возможностей синтеза и занятости рецепторов или связей между показателями нейровизуализации и этими молекулярными показателями. Функциональная нейровизуализация (например, фМРТ и ЭЭГ) все чаще используется для мониторинга продольных изменений в нейронных связях мозга, возбуждения/торможения и косвенного влияния на баланс последних.
Аналогичным образом, следует рассмотреть возможность включения анализов крови или слюны для индексации воспалительной реакции и оценки маркеров занятости рецепторов, а также использования достоверной повторной антихолинергической нагрузки и определения побочных эффектов. Большие наборы данных или клинические регистры также могут дать возможность понять закономерности назначения лекарств и их связь с когнитивными и функциональными нарушениями. Благодаря конкретизации исследований в этой области появится возможность качественнее моделировать точные механизмы, лежащие в основе связи между приемом антипсихотиков и когнитивными функциями. Это будет способствовать развитию персонализированной медицины и оптимизации результатов лечения людей с психозом.
