Бремя народов: влияние этноса на метаболический эффект излишнего веса

Исследование на с участием добровольцев подтверждает более высокую подверженность выходцев из Южной Азии неблагоприятным метаболическим последствиям при увеличении веса по сравнению с белыми европейцами, что объясняется различиями в биологии мышечной и жировой ткани. Его провели с целью определения этнических отличий в целевых показателях ИМТ (индекса массы тела) для профилактики сердечно-сосудистых заболеваний.
В группу участников включили 21-го белого европейца и 14 жителей Южной Азии, все они были здоровы, имели средний ИМТ 22 и предварительно прошли пятичасовой тест на переносимость пищи, использованной в исследовании. В ходе исследования они избыточно потребляли пищу на протяжении 4–6 недель, в среднем набрав 4,5 кг веса, повысив средний ИМТ на 1,4. До начала и после завершения исследования у участников провели биопсию жировой ткани, измерили уровень глюкозы натощак и после приема пищи, а также инсулинорезистентность по индексу Matsuda и индекс HOMA-IR. По сравнению с европейцами, азиаты изначально имели одинаковый индекс Matsuda и HOMA-IR, однако жировая ткань азиатов содержала больше крупных адипоцитов (26,2 % против 9,1 %) и меньше малых адипоцитов (37,1 % против 60 %), а также доля мышечной ткани была снижена у азиатов в пользу жировой.
По сравнению с европейцами, после набора массы у азиатов наблюдалась гораздо более значительное изменение индекса Matsuda (–38 % против –7 %) и HOMA-IR (+160 % против +4 %). К потенциальным причинам предрасположенности к инсулинорезистентности южноазитов ученые отнесли повышенную анаболическую резистентность (сниженный рост мышечной ткани), а также изменением в биологии жировой ткани, в том числе переход адипоцитов из малых в крупные, ассоциирующихся с ростом инсулинорезистентности при наборе веса. Дополнительно, при увеличении веса у южноазитов наблюдалась пропорционально более низкая скорость появления малых и сверхмалых адипоцитов, что в сумме с предыдущими факторами свидетельствует о снижении способности южноазитов к буферизации триглицеридов в малые и сверхмалые адипоциты.
Анализ выявил различия по уровню экспрессии среди 11 ответственных за липидный обмен генов у европейцев и южноазиатов, а в ходе набора веса статистически значимое различие в увеличении экспрессии наблюдалось лишь в гене SREBF1 (sterol regulatory element binding transcription factor 1 / Фактор транскрипции 1, связывающий регуляторный элемент стерола), выросший у южноазитов на 54 % против 11 % у европейцев.
По словам авторов, исследование позволило выявить межэтнические различия в изменении тканей, метаболических процессах и генах при принудительное кормлении, а их доля влияния может поменяться с учетом возраста, пола и доли жировой ткани участников, а механизмы, лежащие в основе буферной анаболической способности тканей, еще предстоит изучить. Трудность дальнейших экспериментов связана со сложной взаимосвязью метаболизма и экспрессии генов жировой ткани, мышц, печени и поджелудочной железы.
Авторы отметили значительную индивидуальную вариабельность по содержанию жира в мышцах и печени, а также разное распределение и размер подкожных адипоцитов при увеличении веса. Также важно учитывать индивидуальный диапазон ИМТ, при выходе из которого начинаются метаболические нарушения и развитие сердечно-сосудистых заболеваний (ССЗ), называемый концептом “индивидуального жирового порога”. Этот концепт должен учитывать не только вариабельность буферной емкости подкожной жировой клетчатки, но и биологию мышц, и поджелудочной железы, включая функциональный резерв бета-клеток. На фоне старения и развития ожирения ограниченный резерв бета-клеток не может компенсировать необходимый уровень инсулина, что приводит нарушению контроля гликемии и развитию диабета. Это двойное бремя и обусловливает более “раннее” развитие сахарного диабета (СД) у южноазиатов по сравнению с европейцами.
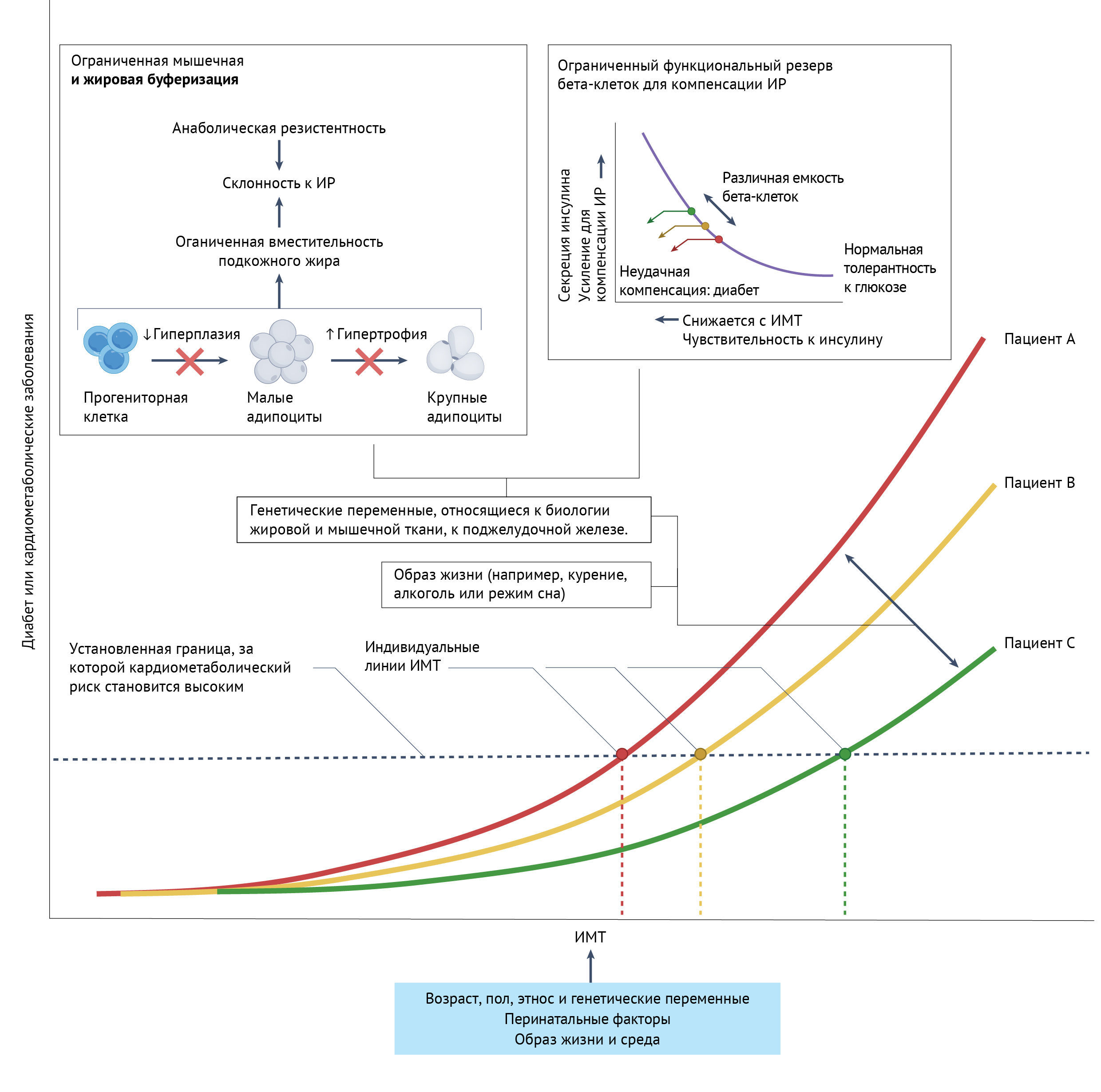
Таким образом, генетические варианты, имеющие значение для биологии мышц, жировой ткани и поджелудочной железы, могут моделировать связь ИМТ с СД или каридометаболичсекими заболеваниями, наряду с дальнейшим факторами образа жизни и внешней среды.
Некоторые эпидемиологические исследования сообщают о взаимодействии ИМТ и полигенных баллов риска развития СД 2 типа при увеличении ИМТ. Влияние ИМТ на развитие кардиометаболические заболеваний также модулируется вредными факторами жизни (нарушения сна, курение, алкоголь и пр.). У пациентов с ожирением и СД 2 типа снижение массы тела на 15 кг способно вызвать ремиссию до 2 лет, аналогично верно и для части пациентов с СД 2 типа без ожирения, имеющих «нормальную» ИМТ. Авторы говорят о важности понимания различия между «метаболически здоровым ожирением» и «метаболически нездоровым нормальным весом», хоть второе и остается без четкого определения, а имеющиеся данные говорят о временности данного фенотипа (то есть ожирение станет нездоровым) и необходимости оценки пользы от снижения веса для таких пациентов.
Таким образом, вместо использования этнической принадлежности для определения оптимального ИМТ стоит оценить геномные и персональные особенности пациента для персонализации оптимального ИМТ, аналогично и для окружности талии или соотношения окружности талии к бедрам. Использование персонализированного подхода поможет приоритизировать ресурсы с учетом «пороговых уровней» для каждого пациента, например, в определении назначения агонистов рецепторов глюкагон-подобного пептида 1, а также для составления генетического отчета и рекомендации по образу жизни, оценке рисков развития метаболических, сердечно-сосудистых заболеваний и патологий почек.
