Необычные функции микроРНК
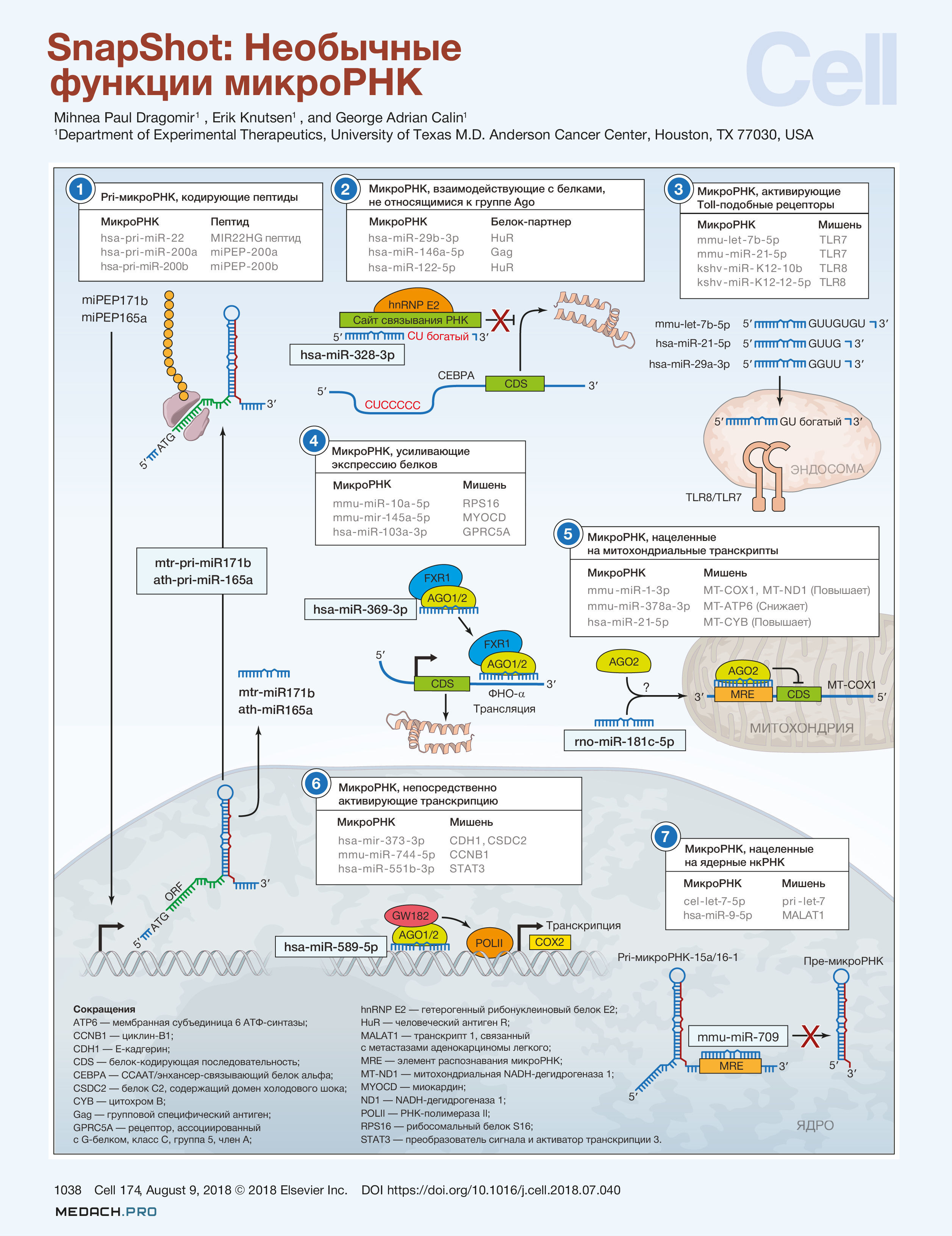
За четверть века, прошедшую с открытия микроРНК, интерес к ним резко возрос, о чем свидетельствует более 80 000 публикаций, посвященных микроРНК, в PubMed. Подавляющее их большинство посвящено изучению того, как эти малые некодирующие РНК (нкРНК) посттранскрипционно снижают уровень экспрессии специфических генов, кодирующих белки-мишени, либо способствуя распаду матричной РНК (мРНК), либо подавляя трансляцию (Bartel, 2018). Однако в ряде исследований сообщалось о функционировании микроРНК вне этой парадигмы, и в этом коротком обзоре описываются необычные способы, посредством которых микроРНК выполняют регуляторные функции. Были выделены наиболее яркие примеры, однако в ходе последующих исследований было показано, что эти механизмы используются и другими микроРНК (см. таблицы на рисунке). По всей видимости,этот список механизмов не является исчерпывающим и может расширяться по мере всё более глубокого изучения многогранности этих малых нкРНК.
Читайте также: Об открытии микроРНК и их роли в посттранскрипционной регуляции работы генов и Некодирующие РНК и заболевания: тёмная материя генома
Pri-микроРНК, кодирующие пептиды
С генов микроРНК считываются длинные pri-микроРНК (primary, первичные), которые подвергаются процессингу с последующим образованием зрелых микроРНК длиной ~22 нуклеотида. Обнаружено, что эти pri-микроРНК могут кодировать регуляторные пептиды, получившие название «пептиды, кодируемые микроРНК (miPEPs)». Первоначально, Lauressergues с соавт. (2015) выяснили, что у растений несколько pri-микроРНК, такие как pri-miR-171b у Medicago truncatula и pri-miR-165a у Arabidopsis thaliana, производят короткие пептиды. Синтез этих коротких пептидов запускается стартовыми кодонами ATG в pri-микроРНК. Длина miPEP-171b составляет всего 9 аминокислот, а miPEP-165a лишь немного длиннее — 18 аминокислот. Любопытно, что функция этих miPEP в конечном итоге заключается в усилении транскрипции их собственных pri-микроРНК, что впоследствии увеличивает накопление соответствующих зрелых миРНК (Lauressergues с соавт., 2015).
МикроРНК, взаимодействующие с белками, не относящимися к группе Ago
Для запуска классических механизмов подавления трансляции, микроРНК загружаются в комплексы, содержащие белок Argonaute (AGO). Однако Eiring с соавт. (2010) сообщили о микроРНК, способной выступать в качестве приманки для другого РНК-связывающего белка и, таким образом, нарушать его функцию. В частности, miR-328 содержит участок поли-U/C, который очень похож на сайт связывания hnRNP E2 в мРНК CEBPA. Связывание miR-328 не дает мРНК CEBPA ингибировать трансляцию,что опосредовано hnRNP E2.
Интересно, что CEBPA является гемопоэтическим транскрипционным фактором, а miR-328, действуя как каноническая микроРНК, подавляет протоонкоген PIM1. Таким образом, благодаря двойной способности miR-328 восстанавливается дифференцировка и снижается выживаемость лейкозных бластов при хроническом миелолейкозе, что было показано на мышиных моделях при дополнительном введении miR-328 (Eiring et al., 2010).
МикроРНК, активирующие Toll-подобные рецепторы
Хотя прямое физическое взаимодействие еще не доказано, удивительная нестандартная роль микроРНК с большим терапевтическим потенциалом заключается в активации Toll-подобных рецепторов (TLRs). Fabbri с соавт. (2012) обнаружили, что miR-21 и miR-29a активируют TLR7 (у человека) и TLR8 (у мышей). Этот агонистический эффект вызывает прометастатический воспалительный ответ при раке легкого (Fabbri с соавт., 2012). Lehmann с соавт. (2012) обнаружили, что микроРНК let-7 активирует TLR7 и вызывает нейродегенерацию (Lehmann et al., 2012). Блокирование этих эффектов может иметь значение в терапии пациентов с кахексией (микровезикулярные miR-21) и сепсисом (микроРНК вируса герпеса, ассоциированного с саркомой Капоши).
МикроРНК, усиливающие экспрессию белков
Vasudevan с соавт. (2007) установили, что направление влияния микроРНК на экспрессию белка может зависеть от стадии клеточного цикла, поскольку определенные микроРНК индуцируют трансляцию мРНК-мишеней при остановке клеточного цикла, но подавляют трансляцию в пролиферирующих клетках. В частности, miR-369 человека направляет AGO2, ассоциированный с белком FXR1, к AU-богатым элементам (AREs) на мРНК ФНО-a для активации трансляции (Vasudevan et al., 2007).
МикроРНК, нацеленные на митохондриальные транскрипты
Хотя в геноме митохондрий не было обнаружено ни одного гена микроРНК, Das с соавт. (2012) показали, что miR-181c перемещается в митохондрии и подавляет экспрессию кодируемого митохондриями белка субъединицы 1 цитохром с-оксидазы (MT-COX1), но в то же время увеличивает экспрессию мРНК и содержание белка MT-COX2 (Das et al., 2012). МикроРНК в митохондриях (mitomiRs), такие как miR-181c, могут стать терапевтической мишенью для восстановления нормальной функции митохондрий или использоваться в качестве лекарственных препаратов.
МикроРНК, непосредственно активирующие транскрипцию
Hwang с соавт. (2007) показали, что отличительный гексануклеотидный концевой мотив miR-29b действует как переносимый элемент ядерной локализации, который способствует накоплению микроРНК в ядре (Hwang с соавт., 2007). Дальнейшие исследования показали, что микроРНК вместе с AGO1 или AGO2 могут импортироваться в ядро с помощью импортина 8. Matsui с соавт. (2013) обнаружили, что miR-589 в комплексе с AGO2 и GW182 связывает промоторную РНК циклооксигеназы-2 (COX2), что приводит к индукции транскрипции COX2, а также фосфолипазы PLA2G4A путём образования петли между промотором и областью, в которой происходит терминация транскрипции (Matsui et al., 2013).
МикроРНК, нацеленные на ядерные нкРНК
Tang с соавт. (2012) установили, что локализованная в ядре miR-709 ингибирует созревание miR-15a и miR-16-1 посредством прямого взаимодействия с первичным транскриптом. Важно отметить, что miR-15a и miR-16-1 входят в кластер микроРНК, индуцирующих апоптоз. Таким образом, ингибируя созревание miR-15a и miR-16-1, miR-709 препятствует запуску апоптоза клеток (Tang с соавт., 2012).
