Одиннадцать клинических испытаний, которые определят развитие медицины в 2026 году

Nature Medicine предложили ведущим ученым назвать главные клинические испытания на 2026 год: от долгожданных вакцин против инфекционных заболеваний до новых методов лечения прогрессирующих форм рака и длительного COVID.
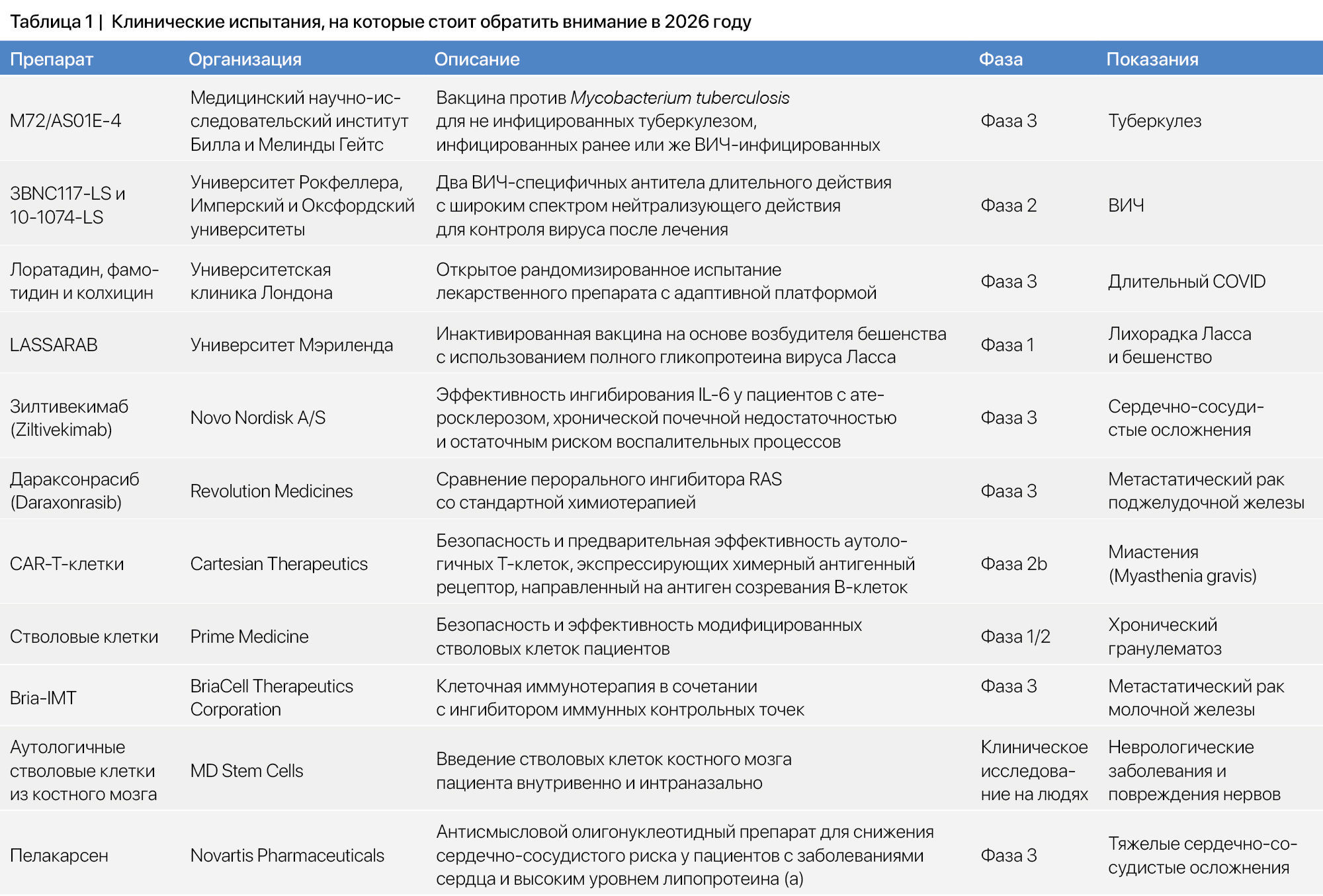
От вакцин нового поколения до редактирования генов и терапии стволовыми клетками — ученые проверяют новые смелые подходы к лечению самых сложных заболеваний, с которыми сталкивается человечество. Эти клинические испытания препаратов от туберкулеза, лихорадки Ласса, рака и аутоиммунных заболеваний позволяют заглянуть в будущее, где точная медицина, инновации и настойчивость могут изменить глобальную систему здравоохранения (табл. 1).
Вакцина длительного действия против туберкулеза
Ли Фэрли (Lee Fairlie): «испытание этой вакцины против туберкулеза было начато из-за того, что существующая вакцина БЦЖ (от “бацилла Кальметта–Герена”) эффективна только у маленьких детей, а с возрастом ее защитное действие довольно быстро ослабевает, особенно в подростковом и взрослом возрасте. Поскольку риску заражения и распространения туберкулеза более подвержено взрослое население, необходима более эффективная профилактика. Туберкулез по-прежнему остается серьезной проблемой во всем мире — в 2023 году около 10,8 миллиона человек заболели туберкулезом и около 1,25 миллиона погибли — поэтому существует огромная потребность в новой вакцине.
Исследуемая вакцина (под названием M72/ AS01E) показала очень многообещающие результаты в ходе раннего исследования фазы 2b. При симптоматической туберкулезной инфекции вакцина замедлила прогрессирование туберкулеза легких примерно на 50 %. Крупное исследование фазы 3 включает около 20 000 участников из Южной Африки, Кении, Малави, Замбии и Индонезии. У большинства из них (18 000) выявлен положительный результат теста на высвобождение IFN-γ (IGRA, IFN-γ release assay), что означает инфицирование возбудителем туберкулеза. Также в числе участников — пациенты с ВИЧ (1000), и с отрицательным результатом теста IGRA (1000).
Исследование было начато на 11 месяцев раньше ожидаемого, в основном из-за очень высокого уровня заболеваемости туберкулезом (и высокой осведомленность о заболевании) в сообществах, с которыми мы работаем, а также благодаря отличной работе исследовательских центров. Основная цель — проверить, насколько эффективно вакцина предотвращает развитие лабораторно подтверждаемого туберкулеза. Мы ожидаем получить данные примерно через три года. Исследование спонсирует Медицинский научно-исследовательский институт Билла и Мелинды Гейтс при финансовой поддержке Фонда Билла и Мелинды Гейтс и Фонда Wellcome. Это длительный процесс, но, честно говоря, это самая многообещающая вакцина против туберкулеза, которую мы видели почти за столетие».
Ли Фэрли — заведующий отделом охраны здоровья матери и ребенка в Университете Витватерсранда, Йоханнесбург, ЮАР
Исследование антител длительного действия против ВИЧ
Сара Фидлер (Sarah Fidler): «В рамках исследования RIO проводится изучение нового способа лечения ВИЧ-инфекции, при котором вместо таблеток, принимаемых ежедневно, используются антитела длительного действия. Существующие препараты от ВИЧ, называемые антиретровирусной терапией, работают невероятно эффективно, останавливая размножение вируса, но они не устраняют скрытый в организме крошечный пул инфицированных клеток. Поэтому, когда ВИЧ-инфицированный пациент прекращает принимать лекарства, вирус почти всегда возвращается.
Наш вопрос заключался в следующем: могут ли эти специальные антитела держать вирус под контролем, даже после прекращения регулярного лечения? Исследование получило название RIO, поскольку оно проводится совместно тремя университетами: Рокфеллеровским, Имперским и Оксфордским, при финансовой поддержке Фонда Билла и Мелинды Гейтс. Мы взяли в исследование пациентов, начавших противовирусную терапию в кратчайшие сроки после заражения ВИЧ-инфекцией, поскольку их иммунная система была еще сильна. Они получили однократную инъекцию плацебо или антител длительного действия, которые сохраняются в организме около шести месяцев.
Участники проявили огромную самоотверженность, поскольку перестали принимать ежедневные лекарства и каждую неделю приходили сдавать анализ крови, чтобы проверить, вернулся ли вирус. Основной результат был воодушевляющим: через пять месяцев 75% участников, которым вводили антитела, по-прежнему не нуждались в возобновлении приема лекарств от ВИЧ, по сравнению всего с 11 % в группе плацебо. Некоторые даже не принимали лекарства в течение почти двух лет.
На данный момент антитела показали безопасность, и мы проводим дальнейшие исследования, чтобы выяснить, может ли их сочетание с вакцинами или другими методами лечения дать еще больший эффект. Большие надежды возлагаются на то, что в конечном итоге пациенты смогут делать длительные перерывы в ежедневном приеме препаратов против ВИЧ — и, возможно, даже помочь собственной иммунной системе взять на себя функцию постоянного контроля над вирусом».
Сара Фидлер — профессор медицины в области ВИЧ и инфекционных заболеваний в Имперском колледже Лондона, Великобритания.
Научиться лечить длительный COVID
Эмма Уолл (Emma Wall): «Я врач-инфекционист и научный сотрудник Университетской клиники Лондона и Института Фрэнсиса Крика. Во время пандемии я работала как в отделении интенсивной терапии острых случаев COVID, так и в клинике по лечению длительного COVID вместе с коллегами-пульмонологами. Мы наблюдали много пациентов с сильной усталостью и обсуждали, какие лекарства следует (и следует ли) применять в таких случаях, но вместо обсуждений решили провести исследование. Мы объединили усилия с другими специалистами и получили финансирование в размере 6,8 миллиона фунтов стерлингов от Национального института исследований в области здравоохранения и медицинского обслуживания, который является аналогом Национального института здравоохранения (NIH) в Великобритании, для проведения масштабного исследования препаратов и других методов лечения длительного COVID [1].
Мы разработали протокол исследования в 2021 году, когда еще очень мало знали о длительном COVID. Большинство наших пациентов страдали от изнурительной усталости, особенно от недомогания после физической нагрузки — когда при любом усилии у человека возникает ощущение, что он пробежал марафон. Мы обнаружили аномальные изменения в крови даже после коротких прогулок, что указывало на проблемы в мелких кровеносных сосудах. Поэтому в ходе исследования мы изучали препараты, которые могли бы уменьшить воспаление или улучшить кровоток, в том числе антикоагулянты и противовоспалительные препараты.
Это было очень тяжело — многие пациенты, которые ранее были здоровыми молодыми специалистами, болели в течение многих лет. Мы непосредственно привлекли пациентов к разработке и проведению исследования, в том числе к выбору лекарств и разработке дизайна исследования, сделав его открытым, потому что пациенты хотели прозрачности. Сейчас исследование завершено, анализ проведен, рукопись отправлена в печать — мы планируем представить результаты в конце 2025 года в Бостоне и опубликовать их в 2026 году».
Эмма Уолл — руководитель группы клинических исследований в Институте Фрэнсиса Крика и консультант по инфекционным заболеваниям в Университетской клинике Лондона (University College London Hospitals), Лондон, Великобритания.
Разработка двойной вакцины против лихорадки Ласса и бешенства
Джастин Ортис (Justin Ortiz): «Лихорадка Ласса — это геморрагическое заболевание, вызываемое вирусом Ласса и сходное по тяжести с лихорадкой Эбола и лихорадкой Марбург. Она эндемична для Западной Африки и чаще всего передается при контакте с экскрементами грызунов или инфицированными людьми, особенно в медицинских учреждениях. Всемирная организация здравоохранения (ВОЗ) считает лихорадку Ласса серьезной угрозой для общественного здоровья и приоритетным заболеванием для научных исследований и разработки вакцин, учитывая ее эпидемический потенциал, отсутствие эффективных методов лечения и высокую смертность.
По оценкам ВОЗ, ежегодно регистрируют от 100 000 до 300 000 случаев заражения и около 5000 случаев смерти, хотя фактические цифры, вероятно, намного выше из-за ограниченности эпидемиологического надзора. Это заболевание особенно опасно во время беременности: более 80 % случаев заражения на поздних сроках приводят к гибели матери или плода.
Исследование Lassa Fever CVD 1000 было разработано для удовлетворения этой неотложной потребности мирового здравоохранения. Лихорадку Ласса трудно искоренить из-за бедности, ограниченных возможностей здравоохранения и недостаточного финансирования медицинских систем, которые не могут эффективно выявлять заболевания животных, людей и болезни, вызванные загрязнением окружающей среды, и своевременно реагировать на них. Вакцина может спасти жизни немедленно, пока накапливается эффект долгосрочных улучшений. Помимо гуманитарных соображений, в США лихорадку Ласса относят к возбудителям категории А, представляющим серьезную угрозу биотерроризма, поскольку, как было уже сказано, для нее нет одобренных вакцин и методов лечения.
В исследовании Lassa Fever CVD 1000 используется вакцина-кандидат LASSARAB, разработанная Матиасом Шнеллом из Центра вакцин и готовности к пандемии Джефферсона (Jefferson Center for Vaccines and Pandemic Preparedness) в Филадельфии. Эта вакцина отличается сочетанием защиты как от лихорадки Ласса, так и от бешенства — двух обделенных вниманием, но смертельно опасных заболеваний, распространенных в Западной Африке. Предварительные данные показывают, что вакцина хорошо переносится и вызывает сильный иммунный ответ: у всех участников после введения двух доз выработались антитела. Последние данные о пациентах в рамках этого первого исследования препарата с участием человека, проводимого в соответствии с требованиями ВОЗ, будут собраны примерно в мае 2026 года».
Джастин Ортис — врач-исследователь в Центре разработки вакцин и глобального здравоохранения Университета Мэриленда, Балтимор, Мэриленд, США.
Три греческих бога сражаются с заболеваниями сердца
Пол Ридкер (Paul Ridker): «Подавление воспаления является новой важной мишенью для борьбы с атеросклерозом. Более ранние исследования моей группы показали, что блокирование интерлейкина-1 (IL-1) значительно снижает частоту инфарктов и инсультов. Это доказывает, что воспаление вызывает сердечно-сосудистые заболевания независимо от уровня холестерина. Но мы заметили, что наибольший эффект от ингибирования IL-1 наблюдался у участников с наиболее значительным снижением уровня IL-6. Поэтому следующим логичным шагом было нацеливание непосредственно на IL-6, и здесь на помощь пришел зилтивекимаб — полностью человеческое моноклональное антитело, нацеленное на IL-6.
В настоящее время в мире проводится три крупных исследования зилтивекимаба. Первое, ZEUS, направлено на изучение того, может ли ингибирование IL-6 снизить частоту сердечно-сосудистых осложнений у пациентов с атеросклерозом, хронической почечной недостаточностью и остаточным риском воспалительных процессов, который определяют как повышенный уровень высокочувствительного С-реактивного белка (hsCRP). В настоящее время в исследовании ZEUS принимают участие около 6300 пациентов по всему миру, и оно должно завершиться в конце 2026 года. Второе исследование — HERMES [2], в котором рассматривают ингибирование IL-6 у пациентов с сердечной недостаточностью с сохраненной фракцией выброса — ещё одной группы, для которой остаточный риск воспаления способствует прогрессированию заболевания. Третье исследование зилтивекимаба – ARTEMIS, в рамках которого лечение начинается сразу после поступления в больницу пациента с острым инфарктом миокарда. Идея заключается в проверке того, может ли немедленное устранение воспаления улучшить восстановление и уменьшить вероятность осложнений в будущем у пациентов с острыми коронарными синдромами.
Врачи не будут лечить то, что они не могут измерить. Как только что было описано в Научном заявлении Американского колледжа кардиологов от 2025 года, нам необходимо проводить скрининг на биомаркер воспаления hsCRP одновременно со скринингом на уровень холестерина ЛПНП. Пришло время для совместного действия комбинированной гиполипидемической и противовоспалительной терапии. Мы должны отойти от стереотипного представления о том, что единственным вмешательством должно быть снижение уровня холестерина».
Пол Ридкер — эпидемиолог в области сердечно-сосудистых заболеваний и биомедицинский исследователь в Гарвардском университете и больнице Mass General Brigham, Бостон, Массачусетс, США.
Вмешательство в процесс развития рака поджелудочной железы
Брайан Волпин (Brian Wolpin): «Рак поджелудочной железы — один из самых тяжелых видов рака: возможности его лечения ограничены, он очень агрессивен, а время жизни больных с этим диагнозом удручающе мало. В настоящее время стандартом лечения пациентов с метастазами является многокомпонентная химиотерапия. Она может быть эффективной, но при этом весьма токсична и зачастую оказывает лишь умеренный эффект. Большим прорывом стало выявление единичной мутации, вызывающей развитие почти 95 % случаев рака поджелудочной железы. На эту мутацию в гене KRAS ученые пытались воздействовать в течение 40 лет.
В рамках этого нового глобального исследования проводится изучение ингибитора всех основных форм онкогенных белков RAS, под названием RMC-6236 или дараксонрасиб. В отличие от более ранних препаратов, которые действовали только на редкую мутацию G12C в гене KRAS, этот препарат воздействует на наиболее распространенные мутации — G12D, G12R и G12V — охватывая почти всех пациентов с раком поджелудочной железы. Это пероральный препарат, который принимается один раз в день, что значительно проще внутривенной химиотерапии. В исследовании принимают участие 460 пациентов со всего мира, рандомно разделенных на 2 равные группы, одна из которых получает стандартную химиотерапию, а другая — ингибитор RAS. В качестве двух конечных точек исследования установлены выживаемость без прогрессирования заболевания и общая выживаемость. Результаты ожидаются примерно в 2026 году.
Наблюдаемые на данный момент побочные эффекты поддаются коррекции — в основном это сыпь, воспаление в полости рта, тошнота и диарея — и зачастую выражены слабее, чем при химиотерапии. Препарат также имеет интересный механизм действия, выступая как молекулярный клей. Вместо того, чтобы напрямую блокировать KRAS, он связывает вспомогательный белок под названием циклофилин А, и, по сути, приклеивает его к RAS, заглушая сигналы роста раковых клеток (это немного напоминает принцип действия циклоспорина – прим. ред.).
Если это сработает, то наконец-то почти каждому пациенту с прогрессирующим раком поджелудочной железы можно будет предоставить таргетную терапию — то, что раньше было невозможно. Это тот волнующий и обнадеживающий шаг вперед в борьбе с болезнью, в котором мы отчаянно нуждаемся».
Брайан Волпин — врач-онколог и директор Центра исследования рака поджелудочной железы Hale Family Center при Институте рака Дана-Фарбер и Гарвардской медицинской школе, Бостон, Массачусетс, США.
Лечение миастении с помощью мРНК
Джеймс Ховард (James Howard): «Миастения (Myasthenia gravis) — это хроническое аутоиммунное заболевание, при котором нарушается связь между нервами и мышцами, что приводит к слабости и переутомлению. На протяжении десятилетий лечение было заимствовано из трансплантологии — использовались иммунодепрессанты широкого спектра действия, которые начинают действовать только через несколько месяцев и (особенно стероиды) вызывают серьезные побочные эффекты. Затем в 2017 году, наконец произошел прорыв в области иммунотерапии, которая действует быстро, имеет более благоприятный профиль в отношении побочных эффектов, но требует постоянного приема для контроля симптомов.
В исследовании Decartes-08, которое проводит компания Cartesian Therapeutics, используется совершенно другой подход, основанный на терапии Т-клетками с мРНК химерных антигенных рецепторов (CAR). Вместо редактирования ДНК, как у CAR-Т-клеток при раке, этот метод временно программирует клетки, снижая долгосрочные риски, такие как синдром высвобождения цитокинов. Ранние исследования были многообещающими, а текущее испытание 3 фазы направлено на подтверждение их результатов. Лечение включает шесть коротких еженедельных инфузий, после которых у отдельных пациентов в течение года или более не наблюдалось никаких симптомов.
В ходе исследования фазы 2b около 57 % пациентов достигли минимальной выраженности симптомов — практически полного отсутствия проявлений заболевания — к 6-му месяцу и этот результат сохранялся до 12-го месяца. По сравнению с более старыми вариантами лечения это замечательная стойкость эффекта. Терапия нацелена на плазмоциты, экспрессирующие BCMA (B-cell maturation antigen, антиген созревания B-клеток) — узкую группу клеток, ответственную за производство вредных антител. Благодаря своей высокой специфичности она позволяет избегать значительного подавления иммунитета, вызывающего побочные эффекты.
Если стоимость такой терапии снизится, она может стать даже амбулаторным лечением первой линии. Последствия этого не ограничиваются миастенией, поскольку применение мРНК CAR-Т-клеток может в конечном итоге распространиться на другие аутоиммунные заболевания, такие как волчанка или ревматоидный артрит. Это настоящий следующий шаг в области долгосрочной и точной иммунотерапии».
Джеймс Ховард – руководитель программы разработки и внедрения клинических исследований миастении в Университете Северной Каролины в Чапел-Хилле, Северная Каролина, США.
Коммерческие проблемы лечения чрезвычайно редкого заболевания
Аллан Рейн (Allan Reine): «Хроническая гранулематозная болезнь (ХГБ) — это редкое наследственное поражение иммунной системы, при котором определенный тип лейкоцитов, а именно фагоциты, не могут эффективно уничтожать определенные бактерии и грибки. Пациенты страдают от рецидивирующих, часто тяжелых инфекций и воспалительных осложнений, таких как заболевания кишечника, которые могут привести к инвалидности. Средняя продолжительность жизни таких пациентов составляет около 40 лет. Хотя в качестве лечения может рассматриваться аллогенная трансплантация костного мозга, она сопряжена со значительными рисками. Пациентам, которым данный метод не подходит, необходима пожизненная профилактическая терапия антибиотиками и противогрибковыми препаратами.
Компания Prime Medicine выбрала ХГБ для одной из первых программ, демонстрирующих потенциал технологии праймированного редактирования (prime-editing), которая считается наиболее универсальным и точным подходом к редактированию генома. Команда искала заболевания, с которыми не могли эффективно справляться существующие технологии редактирования генов и ХГБ явно соответствовала этому критерию.
Разработанный компанией Prime метод ex vivo исправляет дефектный ген в собственных гемопоэтических стволовых клетках пациента перед реинфузией. В отличие от аллогенной трансплантации, этот аутологичный подход исключает отторжение трансплантата и реакцию «трансплантат против хозяина».
Результаты продолжающегося клинического исследования фазы 1/2 оказались чрезвычайно многообещающими. У первых двух пациентов, получивших лечение, компания Prime наблюдала так называемое функциональное излечение — нормализацию активности нейтрофилов выше уровня, необходимого для предотвращения инфекций. Первые результаты свидетельствуют о положительном эффекте у обоих пациентов с воспалительным заболеванием кишечника.
Поскольку ХГБ является редким заболеванием — в США им страдают около 1000 человек, и только 250 из них с подходящим для лечения подтипом — коммерческие возможности ограничены. Тем не менее, учитывая убедительность первых данных, компания Prime активно сотрудничает с FDA с целью предоставить эту потенциально революционную терапию пациентам, которые в ней нуждаются».
Аллан Рейн — генеральный директор Prime Medicine, Кембридж, Массачусетс, США.
Иммунотерапия метастатического рака молочной железы
Сара Гурвиц (Sara Hurvitz): «Исследование BRIA-ABC — это захватывающий проект, посвященный людям, живущим с метастатическим раком молочной железы. Несмотря на то, что лечение рака прошло долгий путь, метастатический рак молочной железы по-прежнему редко поддается излечению, и лишь небольшая часть пациентов получает устойчивый эффект от современной иммунотерапии или таргетной терапии. Именно поэтому и было разработано это исследование — чтобы проверить, может ли новая клеточная иммунотерапия под названием Bria-IMT действительно улучшить результаты лечения у пациентов, уже прошедших множество предыдущих курсов терапии.
В настоящее время исследование открыто и проводится примерно в 40 центрах. Его основная цель — выяснить, может ли сочетание Bria-IMT с ингибитором иммунных контрольных точек увеличить общую выживаемость по сравнению со стандартной химиотерапией, которую обычно назначают врачи. Исследователи также отслеживают другие ключевые показатели, такие как выживаемость без прогрессирования заболевания, процент пациентов, положительно отвечающих на лечение, безопасность, качество жизни и даже продолжительность периода без метастазов в головной мозг или позвоночник. Кроме того, они изучают биомаркеры и другие признаки, которые могут помочь в определении пациентов, получающих наибольшую пользу от лечения.
Что действительно отличает BRIA-ABC, так это инклюзивность исследования. В качестве участников принимают пациентов со всеми подтипами рака молочной железы, включая пациентов, которые не могут работать, но способны ухаживать за собой, а также пациентов с метастазами в мозг и ранее проходивших широкомасштабное лечение, в том числе с использованием конъюгатов антител с лекарственными препаратами или ингибиторов контрольных точек. Кроме того, в нем используется «группа сравнения в реальном мире» (контрольная группа, состоящая из пациентов, получающих стандартное лечение в повседневной клинической практике, а не специально подобранная контрольная группа — прим. перевод.), что делает результаты намного более значимыми для повседневной клинической практики».
Сара Гурвиц возглавляет отдел женского здоровья, финансируемый семьей Смит, в онкологическом центре Фреда Хатчинсона, Сиэтл, Вашингтон, США.
Вдохните улучшение работы мозга
Джеффри Вайс (Jeffrey Weiss): «Исследование NEST (сокращение от Neurologic Stem Cell Treatment Study, Исследование лечения нервных заболеваний стволовыми клетками) — это клиническое испытание на людях, в ходе которого изучается, могут ли стволовые клетки, взятые из собственного костного мозга пациента, улучшить работу его нервной системы. Клетки выделяют, а затем вводят обратно в организм через кровоток и носовые ходы, что позволяет им потенциально достичь мозга и способствовать его восстановлению.
Эта идея возникла на основе более ранних работ по лечению заболеваний глаз стволовыми клетками. В 2010 году я провел первую операцию по пересадке стволовых клеток сетчатки, и по мере лечения все большего числа пациентов с заболеваниями глаз мы также заметили неожиданное улучшение неврологических симптомов — у пациентов восстанавливались движения или речь, они даже вставали с инвалидных колясок. Именно это привело к созданию NEST около девяти лет назад, и я являюсь главным исследователем, в сотрудничестве со Стивеном Леви, генеральным директором MD Stem Cells.
С тех пор мы провели лечение примерно 200 пациентов со всего мира. Сама процедура занимает менее часа и проводится с применением седативных средств. Костный мозг извлекается из бедра, обрабатывается, а затем вводится внутривенно и через нос, откуда клетки могут мигрировать в головной мозг.
Многие пациенты отмечают улучшение состояния в течение нескольких недель, а иногда даже на следующий день. Хотя этот метод и не является лекарством, результаты оказались замечательными при таких заболеваниях, как боковой амиотрофический склероз, болезнь Альцгеймера, инсульт, болезнь Паркинсона, черепно-мозговая травма и хронический рассеянный склероз, что дает надежду на улучшение качества жизни там, где раньше не существовало никаких методов лечения. Работа команды продолжается как в США, так и в Дубае».
Джеффри Вайс — основатель и генеральный директор компании Micron Ophthalmic, Паркленд, Флорида, США.
Новый целевой показатель холестерина дает надежду пациентам с сердечными заболеваниями
Стивен Николс (Stephen Nicholls): «Исследование Lp(a)HORIZON — это глобальный проект, посвященный изучению липопротеина (а) (Лп(а)), который представляет собой частицы, содержащие холестерин, связанный с белком под названием аполипопротеин (а).
В генетических и эпидемиологических исследованиях доказана связь высокого уровня Лп(а) с атеросклерозом, инфарктами и инсультами. Однако до сих пор нет метода лечения, который был бы действительно нацелен на Лп(а) и значимо снижал его уровень.
Именно здесь и приходит на помощь этот проект. Это первое крупное исследование сердечно-сосудистых исходов после применения нового препарата под названием пелакарсен, разработанного специально для снижения уровня Лп(а). Цель исследования состоит в том, чтобы выяснить, может ли снижение уровня Лп(а) действительно привести к уменьшению числа инфарктов, инсультов и смертей. В исследовании под руководством международной команды принимают участие около 7000 человек по всему миру. Результаты ожидаются примерно в 2026 году.
Первичная конечная точка учитывает такие основные сердечно-сосудистые осложнения, как смерть от сердечных заболеваний, инфаркт миокарда, инсульт и коронарная реваскуляризация. Исследователи также измеряют смертность от всех причин и проводят подробные биохимические анализы, чтобы определить связь уровня Лп(а) с наблюдаемыми исходами — например, приносит ли препарат наибольшую пользу пациентам с самыми высокими исходными уровнями Лп(а).
Безопасность и переносимость также являются ключевыми факторами. Пелакарсен обычно снижает уровень Лп(а) примерно на 80 %, а у большинства здоровых людей этот уровень и так низок, поэтому ожидается, что препарат будет хорошо переноситься. В случае успеха это исследование может открыть совершенно новые горизонты в профилактике сердечно-сосудистых заболеваний.
Стивен Николлс — директор Викторианского института сердца при Университете Монаша, Мельбурн, Виктория, Австралия.
