Лекарственные препараты, одобренные FDA в 2025 году

FDA одобрило к использованию 46 новых лекарственных препаратов, несмотря на напряженный год в регуляторном органе.
Разработчики лекарственных препаратов получили одобрения на 46 новых терапевтических агентов от Центра оценки и исследований лекарственных средств (Center for Drug Evaluation and Research, CDER), структурного подразделения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в 2025 году. Настоящая когорта незначительно снизила среднегодовой показатель за 5-летний период до 48 новых лекарственных препаратов в год (Рисунок 1, Таблица 1). Тем не менее количество одобрений по-прежнему существенно превышает исторический среднегодовой показатель, составляющий 36 новых лекарственных препаратов с 1993 года.
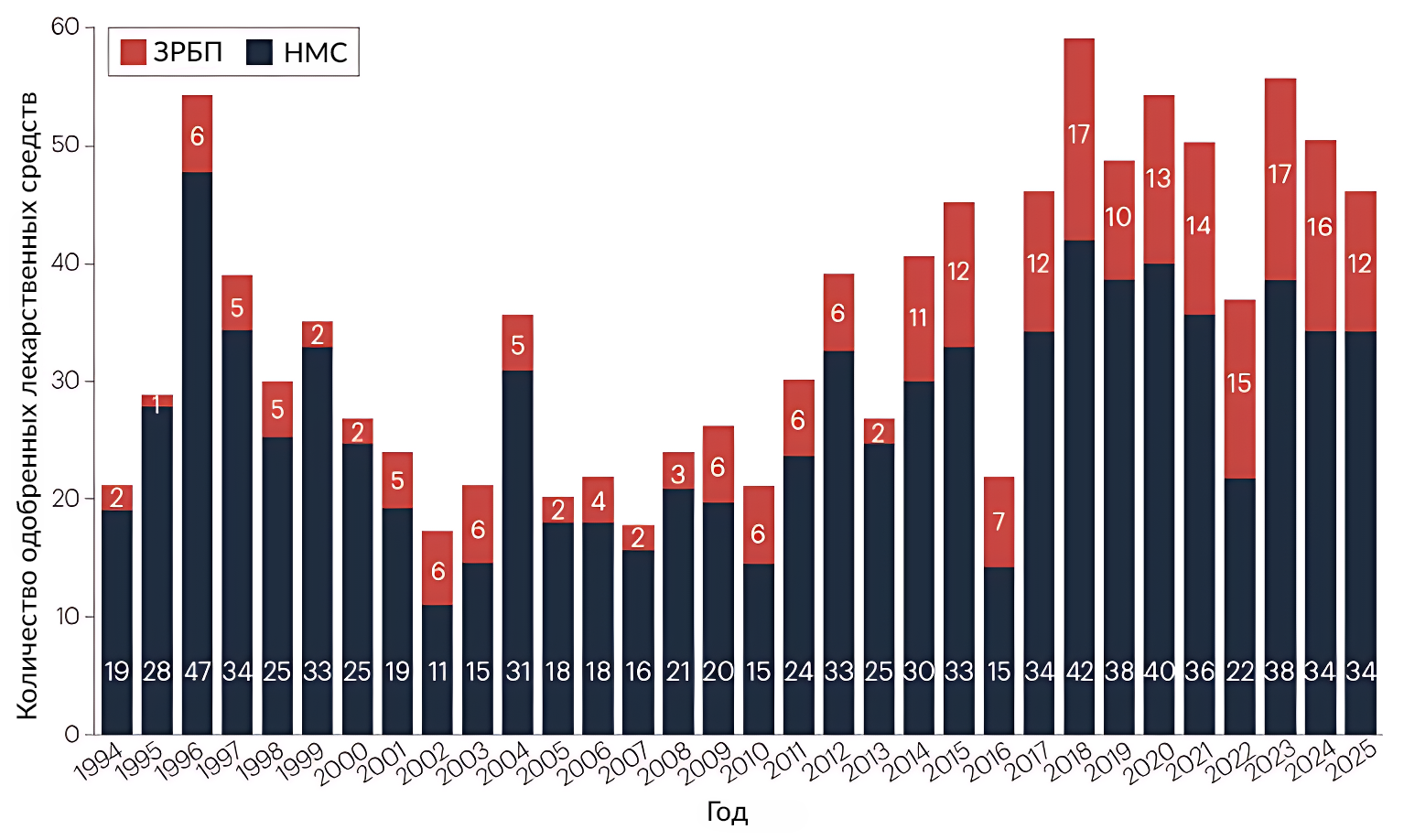
Таблица 1 | Препараты, одобренные CDER в 2025 году
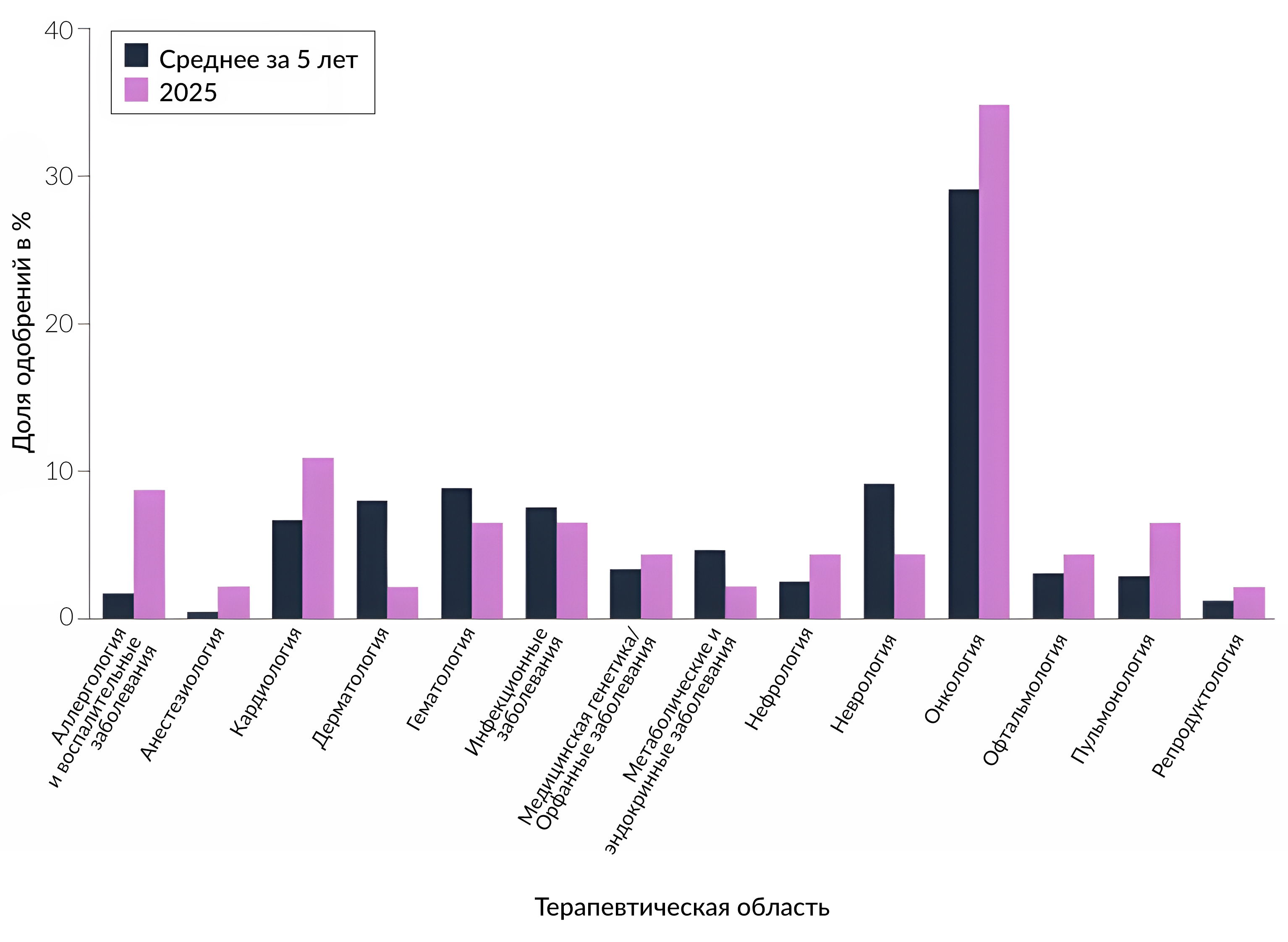
Онкология остается одной из самой распространенных терапевтических областей среди новых лекарственных препаратов, одобренных к применению (Рисунок 2). CDER одобрило к применению 16 новых лекарственных препаратов (35 %) для терапии онкологических заболеваний, что выше среднего показателя за 5-летний период, составляющего 29 %. Другими наиболее активными областями были кардиология с 5 новыми одобрениями (11 %), а также аллергические и воспалительные заболевания с 4 новыми одобрениями (9 %).
Разработчики лекарственных препаратов продолжают продвигать разнообразный спектр модальностей терапии, включая первую биологическую терапию на основе аднектина (Рисунок 3).
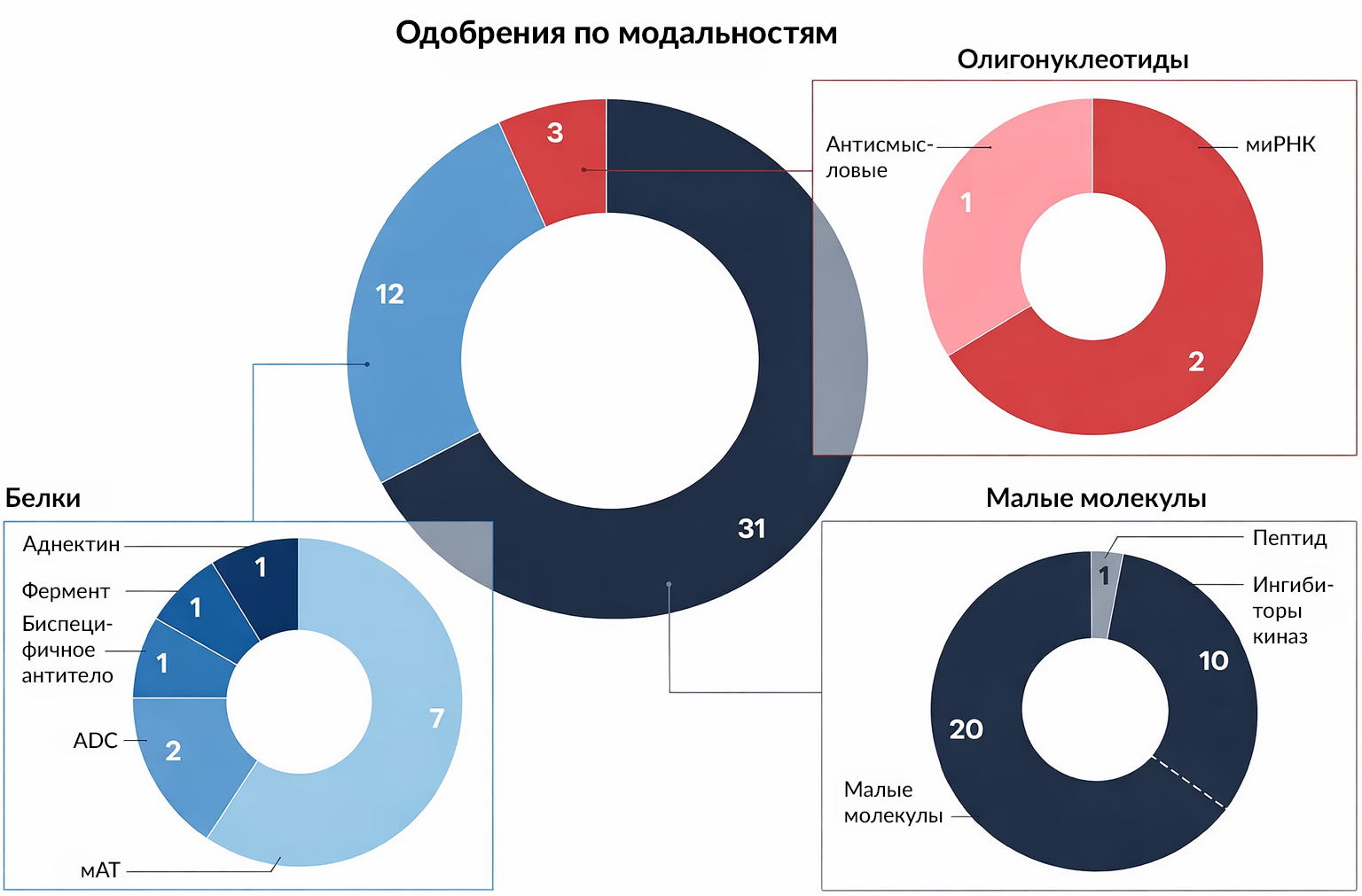
Этот год также стал рекордным по количеству одобрений ингибиторов киназ, составляющих около трети от всех новых одобренных малых молекул. Ремибрутиниб (remibrutinib) под торговым наименованием Rhapsido компании Novartis стал сотым ингибитором киназы, получившим одобрение FDA, что свидетельствует о продолжении расширения спектра применения этого типа препаратов за пределами онкологии. «Эта область еще не исчерпала себя», — заявил Nature Reviews Drug Discovery Филип Коэн из Университета Данди. FDA пока не опубликовало данные о распределении этих новых одобрений по их регуляторным обозначениям. CBER одобрил к применению 8 значимых новых продуктов (Таблица 2), включая первый препарат генной терапии от некоммерческой организации.
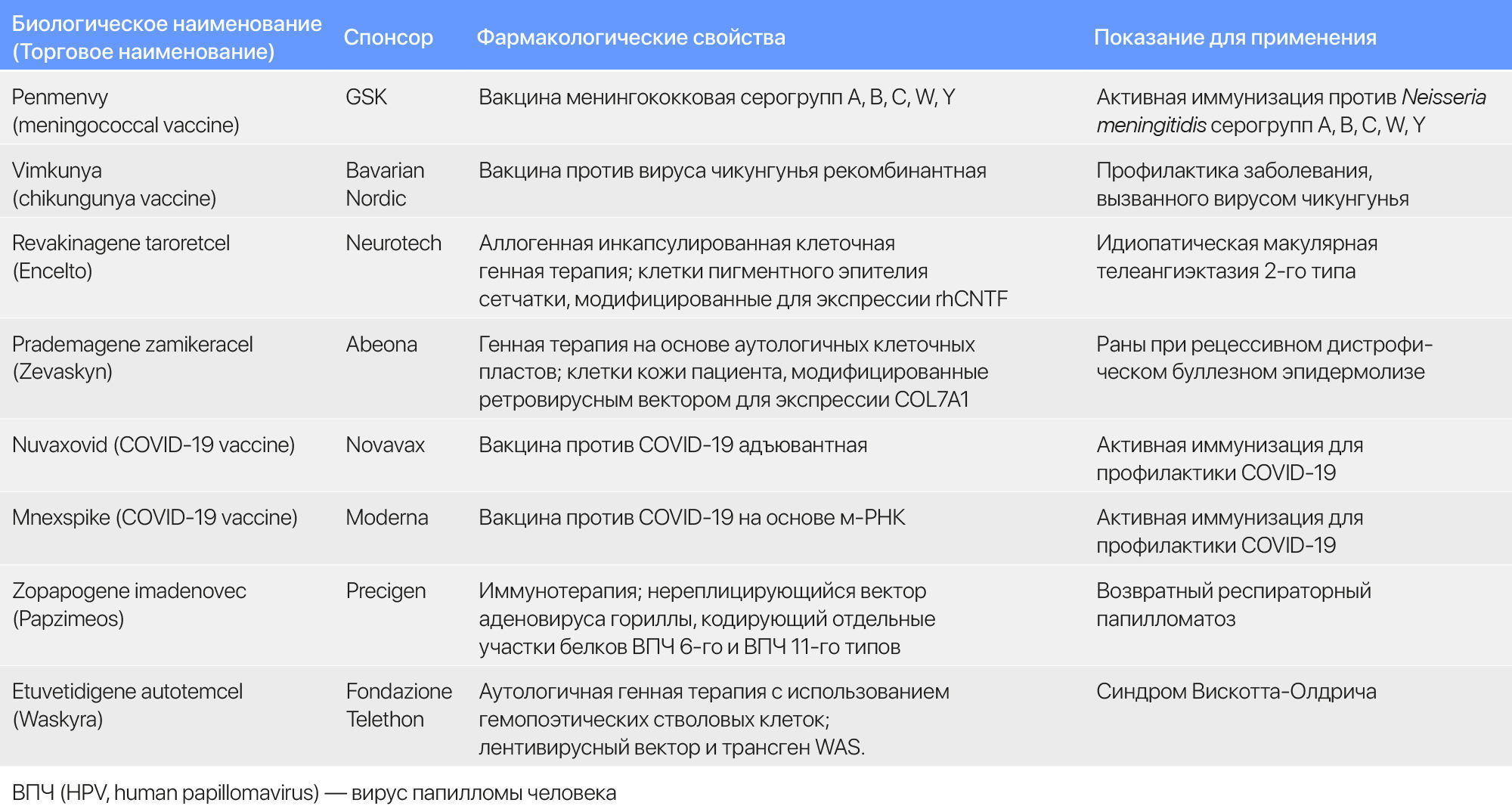
Таблица 2 | Избранные одобрения CBER в 2025 году
Согласно предстоящему анализу Boston Consulting Group, средний прогнозируемый пик продаж новых лекарственных препаратов, одобренных CDER и CBER, составляет около 1,2 млрд долларов США. Среднее значение — 600 млн долларов. Однако 2025 год стал непростым годом для FDA в связи с резкими кадровыми и политическими изменениями, вызванными назначением Роберта Ф. Кеннеди-младшего главой Министерства здравоохранения и социальных служб США (US Department of Health and Human Services) президентом Дональдом Трампом. За первые 9 месяцев года более 18 % сотрудников CDER и CBER FDA были уволены или уволились по собственному желанию. В CDER в течение года сменилось пять директоров. Тем не менее регуляторный орган представил новые программы одобрений и подходов. FDA запустило пилотную программу Commissioner’s National Priority Voucher (CNPV), направленную на сокращение сроков рассмотрения заявок с обычных 10–12 месяцев до 2 месяцев. Некоторые сотрудники FDA и представители надзорных органов предупреждают, что спорная программа рискует политизировать процесс экспертизы лекарств и подорвать регуляторные стандарты. FDA также предложило правдоподобный механизм для ситуаций, когда рандомизированные клинические исследования невозможны, в том числе для индивидуальных терапий для одного пациента (n-of-1). Кроме того, были объявлены планы по прекращению проведения токсикологических испытаний на животных.
Изменения возможны и в будущем. Обычно FDA требует от разработчиков лекарственных препаратов проведение двух опорных клинических исследований для полного одобрения своих продуктов, но, как сообщается, регуляторный орган движется к требованию проведения одного клинического исследования по умолчанию.
Онкология в лидерах
Онкологические заболевания продолжают доминировать в портфелях разработок индустрии. Несмотря на то, что онкологические препараты составляют большую часть новых одобрений, на их долю приходится всего два препарата с потенциалом продаж более 2 млрд долларов в год, согласно прогнозам Evaluate. Самым продаваемым новым одобренным лекарственным препаратом станет, вероятно, комбинация пембролизумаб+берагиалуронидаза альфа (pembrolizumab plus berahyaluronidase alfa) для подкожного введения под торговым наименованием Keytruda Qlex компании Merck & Co. для различных солидных опухолей.
Пембролизумаб (pembrolizumab) — знаковый ингибитор PD1, впервые одобренный в 2014 году, активирует иммунные клетки против раковых клеток. Берагиалуронидаза альфа (berahyaluronidase alfa) — фермент эндоглюкозидаза, облегчающий инъекцию антитела, временно разрушая подкожный внеклеточный матрикс, что улучшает проникновение и абсорбцию антитела. Разработчики лекарственных препаратов используют фермент гиалуронидазу в качестве вспомогательного вещества на протяжении десятилетий, но это стало первым одобрением для данной разновидности белка. Прогнозируется, что в 2025 году пембролизумаб принесет около 32 млрд долларов, что сделает его самым продаваемым онкологическим препаратом (и третьим продаваемым препаратом в рейтинге продаж в целом). Аналитики Evaluate ожидают, что продукт для подкожного введения достигнет пика продаж в 9,3 млрд долларов. Akeso Biopharma получила одобрение на применение для пенпулимаба (Penpulimab), блокатора PD1 своего производства, увеличив количество доступных антител к PD1/PDL1 до 12.
2025 год также ознаменовался одобрением двух новых конъюгатов «антитело-лекарство» (ADC) — терапевтического подхода с использованием тканеспецифических антител в комбинации с сильнодействующими цитотоксическими препаратами. ADC датотумаб дерукстекан под торговым наименованием Datroway производства Daiichi Sankyo, нацеленный на TROP2, был одобрен для лечения HR-положительного, HER2-отрицательного рака молочной железы после гормональной терапии и химиотерапии. Evaluate прогнозируют, что пик продаж ADC составит 5,4 млрд долларов, включая продажи для терапии немелкоклеточного рака легких (НМРЛ), что и произошло позже в этом году. Сацитизумаб говитекон (sacituzumab govitecan), первый представитель нового класса препаратов ADC, нацеленных на TROP2, под торговым наименованием Trodelvy производства Gilead and Immunomedics, впервые получивший ускоренное одобрение в 2020 году, по прогнозам заработает 1,4 млрд долларов в 2025 году. FDA также одобрило элисотузумаб ведотин (elisotuzumab vedotin) под торговым наименованием Emrelis — первый в классе ADC, нацеленный на c-Met. Антитело-носитель ингибитора микротрубочек был одобрен для терапии неплоскоклеточного НМРЛ с высоким уровнем экспрессии белка c-Met.
Линвосельтамаб (linvoseltamab) под торговым наименованием Lynozyfic компании Regeneron представляет собой новый биспецифичный активатор Т-клеток. Линвосельтамаб связывается с BCMA на В-клетках и CD3 на Т-клетках, вызывая истощение В-клеток, для лечения множественной миеломы. Это третий BCMA × CD3 биспецифичный препарат на рынке и 10-ый биспецифичный активатор Т-клеток. В области ингибиторов киназ FDA одобрило редкую новую комбинацию двух ранее экспериментальных препаратов. Авутометиниб+дефактиниб (avutometinib plus defactinib) под торговым наименованием Avmapki Fakzynja Co-Pack от Verastem сочетает в себе ингибитор MEK и ингибитор FAK в качестве препарата для терапии рецидивирующего серозного рака яичников низкой степени злокачественности с мутацией KRAS.
Дефактиниб (defactinib) — первый ингибитор FAK, получивший одобрение. Регуляторный орган также одобрил несколько других ингибиторов MEK. FDA засчитало эти два новых ингибитора киназ как одно новое одобрение препарата. «Больше людей должны быть открыты к новым комбинациям лекарственных препаратов», — заявил главный научный сотрудник компании Verastem Джонатон Пахтер в интервью Nature Reviews Drug Discovery. Дордавипрон (dordaviprone) под торговым наименованием Modeyso — первый препарат в классе активаторов митохондриальной казеинолитической протеазы Р (ClpP) от Jazz Pharmaceuticals, получил ускоренное одобрение для пациентов с диффузной срединной глиомой с мутацией в гене H3 K27M, у которых заболевание прогрессировало после предшествующей терапии. ClpP расщепляет митохондриальные белки; предполагается, что при этой разновидности рака его активация вызывает интегрированный стрессовый ответ, апоптоз и высвобождение метаболитов, обращающий вспять пролиферативный эффект мутаций H3 K27M.
Первые в своем классе
Одобрения CDER вне онкологии также добавили двух претендентов на статус мега-блокбастера с механизмами первыми в новом классе для новых показаний. Бренсокатиб (brensocatib) под торговым наименованием Brinsupri от Insmed стал первым ингибитором DPP1, вышедшим на рынок, для лечения бронхоэктатической болезни, демонстрируя потенциал препаратов, нацеленных на нейтрофилы, при воспалительных заболеваниях легких. Бронхоэктатическая болезнь – хроническое заболевание легких, приводящее к избыточной продукции слизи, постоянному кашлю и расширению дыхательных путей. В США этим заболеванием страдают от 350 000 до 500 000 человек, и до этого года единственными вариантами лечения были физиотерапия для улучшения отхождения мокроты и антибиотики для борьбы с сопутствующими респираторными инфекциями. Заболевание связывают с гиперактивностью нейтрофилов — клеток врожденного иммунитета, которые высвобождают антимикробные пептиды, называемые нейтрофильными сериновыми протеазами (НСП, англ. NSPs) для уничтожения инвазивных патогенов. Ингибитор DPP1 бренсокатиб (brensocatib) подавляют выработку NSP, обезвреживая противовоспалительные протеазы, при этом не затрагивая другие эффекторные функции нейтрофилов.
«Это время надежды — возможность сказать пациентам, что на горизонте есть вещи, которые действительно могут им помочь», — сказала Nature Reviews Drug Discovery Дорин Аддриццо-Харрис, пульмонолог из NYU Langone Health, участвовавшая в клинических испытаниях бренсокатиба (brensocatib). Аналитики прогнозируют пик продаж препарата в размере 6,3 млрд долларов при условии дальнейших одобрений для других заболеваний, опосредованных нейтрофилами. Однако в декабре компания прекратила разработку препарата для лечения хронического риносинусита после того, как препарат не продемонстрировал эффективность в уменьшении воспаления слизистой носа.
Ингибитор Nav1.8-натриевых каналов сузетригин (suzetrigine) под торговым наименованием Journavx от Vertex предоставляет крайне необходимый вариант неопиоидного обезболивающего для купирования острой боли. Разработчики препаратов работали над ингибитором натриевых каналов с 2000-х годов, когда исследователи обнаружили, что мутации, усиливающие функции Nav1.7-натриевых каналов у человека, могут приводить к появлению стойких болей, а мутации, снижающие функции, могут препятствовать восприятию боли. Ингибиторы Nav1.7 не оправдали ожиданий в клинических испытаниях, но Vertex продолжила работу с Nav1.8-каналами. «Это первый препарат, специально разработанный для воздействия только на боль», — заявил Пол Негулиску Nature Reviews Drug Discovery, старший вице-президент по клиническим исследованиям в Vertex. «Сузетригин — это лишь начало. Отличный первый шаг в этом новом классе препаратов».
Аналитики прогнозируют препарату пик продаж в 3,7 млрд долларов, ссылаясь на потребность в ненаркотических обезболивающих и его более широкие возможности при хронических болях. Но есть и препятствия. Сузетригин был одобрен благодаря его не меньшей эффективности по сравнению с комбинациями ацетаминофена и опиоидов для купирования острых болей после хирургических вмешательств, но его сопоставимость в других условиях возникновения острой боли остается неясной. Он также имеет более высокую цену по сравнению с препаратами, используемыми десятилетиями, доступными в виде дженериков. Эффективность препарата для купирования хронических болей еще только предстоит увидеть. Продолжается III фаза разработки сузетригина для лечения болей при диабетической периферической нейропатии, однако препарат не продемонстрировал эффективности в клинических испытаниях при пояснично-крестцовой радикулопатии. Vertex решил не продолжать разработку VX-993, ингибитора Nav1.8-каналов, для купирования острых болей после того, как препарат провалился в испытаниях II фазы позднее в том же году.
Другие первые в своем классе препараты также предоставляют важные дополнения к арсеналу фармацевтических средств, хотя и имеют более низкие ожидания по продажам. Например, гепотидацин (gepotidacin) под торговым наименованием Blujepa от GSK предоставляет столь необходимый новый вариант перорального антибиотика. Гепотидацин, как и другие антибиотики на основе хинолонов, используемые с 1960-х годов, ингибируют бактериальные топоизомеразы IIA типа. Но он использует другую структуру и связывается с мишенью в другом месте, что и дало ему право называться первым в своем классе подобным антибиотиком. FDA впервые одобрило его применение в мае для терапии неосложненных инфекций мочевыводящих путей (нИМП) у взрослых женщин и педиатрических пациентов от 12 лет и старше. В декабре FDA одобрило его применение для лечения гонореи.
Золифлодацин (zoliflodacin) под торговым наименованием Nozolvence от Innoviva Specialty Therapeutics, еще один структурно отличающийся ингибитор бактериальных топоизомераз II типа, также получил одобрение FDA для лечения гонореи. Фаза III клинических исследований золифлодацина профинансированы и проведены Global Antibiotic Research & Development Partnership (GARDP) — публичной некоммерческой организацией, планирующей обеспечить глобальную доступность этого препарата. Innoviva приобрела препарат, купив Entasis Therapeutics, бывшее подразделение AstraZeneca.
Проверенные мишени, новые показания
Ингибиторы киназ продолжают набирать популярность в лечении воспалительных и иммунных заболеваний, причем, в первую очередь препараты, воздействующие на BTK. Ингибиторы BTK были впервые одобрены для терапии онкогематологических заболеваний благодаря их способности уничтожать злокачественные В-клетки, но они также могут быть использованы для модуляции активности иммунных клеток. В этом году Sanofi получила первое одобрение для рилзабрутиниба (rilzabrutinib) под торговым наименованием Wayrilz для терапии иммунной тромбоцитопении — аутоиммунного заболевания крови. Novartis получила одобрение для ремибрутиниба (remibrutinib) под торговым наименованием Rhapsido для лечения хронической спонтанной крапивницы, также известной как хроническая крапивница.
Аналитики прогнозируют пик продаж в размере 2,1 млрд долларов для ремибрутиниба, все еще находящегося в клинической разработке для лечения рассеянного склероза, миастении гравис, гидраденита и пищевой аллергии. Они ожидают пика продаж рилзабрутиниба производства Sanofi в размере 900 млн долларов. В то же время, регуляторный орган не одобрил ингибитор ВТК толебрутиниб (tolebrutinib) от Sanofi для терапии рассеянного склероза.
Нерандомиласт (nerandomilast) под торговым наименованием Jascayd от Boehringer Ingelheim стал первым ингибитором PDE4 для лечения идиопатического легочного фиброза (ИЛФ). Противовоспалительные и иммуномодулирующие ингибиторы PDE4 были одобрены для других показаний, включая хроническую обструктивную болезнь легких и псориаз. Теперь Boehringer добавила одобрение для ИЛФ, хронического и смертельного заболевания легких, которым страдают до 3,6 млн людей по всему миру. Нерандомиласт ингибируют преимущественно представителя семейства PDE4B, подавляя профибротические процессы и воспаление в легких. Это первый новый лекарственный препарат для лечения ИЛФ, вышедший на рынок более чем за 10 лет после одобрения FDA мультикиназного ингибитора нинтеданиба (nintedanib) под торговым наименованием Ofev от Boehringer и антифибротического пирфенидона (pirfenidone) под торговым наименованием Esbriet в 2014 году, который сейчас продается компанией Legacy Pharma.
Новая модальность
LIB Therapeutics получила первое одобрение для терапии на основе аднектина — леродалципеб (lerodalcibep) под торговым наименованием Lerochol, блокатор PCSK9. Аднектины – биологические агенты, состоящие из доменов фибронектина III типа, каркасные белки, облегчающие межклеточные взаимодействия и связывающие различные лиганды. Десятилетиями исследователи считали, что аднектины могут выступать миметиками антител, обеспечивая исключительную селективность к внеклеточным и клеточным мишеням, а также предлагая более мелкие, простые и стабильные структуры, чем обычные моноклональные антитела. LIB внедрили данную технологию для разработки новейшего блокатора PCSK9, хорошо изученной мишени для снижения липидов. Антитела, нацеленные на PCSK9, обращаются на рынке уже 10 лет. Их применение пока не оправдало первоначально высоких ожиданий, отчасти из-за стоимости антител и неудобства их подкожного введения по сравнению с дженериком для снижения уровня липидов в форме таблеток. LIB продолжает надеяться, что их леродалципеб — препарат для подкожного самостоятельного введения 1 раз в месяц с длительной стабильностью при комнатной температуре — будет иметь преимущество в удобстве. Однако вскоре могут появиться пероральные ингибиторы PCSK9 на основе малых молекул. Ожидается, что Merck & Co. подаст заявку на одобрение FDA для своего принимаемого 1 раз в день энлицитида (enlicitide) в апреле. FDA предоставило препарату CNPV, поэтому его рассмотрение может быть ускорено. В случае одобрения, компания заявляет о планах сделать препарат «широкодоступным и недорогим вариантом для американских пациентов».
2025 FDA approvals
Тем временем, пациенты с наследственным ангионевротическим отеком (НАО) получили доступ к трем новым препаратам. НАО — редкое генетическое заболевание, характеризующееся отеками, вызванное дефицитом или дисфункцией ингибитора С1, белка, регулирующего активность множества сериновых протеаз. Недостаток ингибитора С1 приводит к повышению активности протеаз комплемента, плазматического калликреина и протеаз и коагуляционных протеаз фактора XIa, XIIa и XIII.
Профилактическое антитело гарадацимаб (garadacimab) под торговым наименованием Andembry от CSL Behring нацелено на активированный фактор XII для предотвращения приступов болезни. Антисмысловой нуклеотид донидалорсен (donidalorsen) под торговым наименованием Dawnzera от Ionis нацелен на прекалликреин также для предотвращения приступов заболевания. Ингибитор плазменного калликреина малой молекулы себетралстат (sebetralstat) под торговым наименованием Ekterly от Kalvista, напротив, одобрен для купирования острых приступов. Однако вышеупомянутые новые препараты выходят на уже переполненный рынок препаратов для терапии НАО, и им предстоит конкурировать с уже устоявшимися средствами для профилактики и лечения острых приступов, воздействующими на различные звенья патологического процесса.
Пациенты, страдающие от иммуноглобулин А нефропатии (IgA-нефропатия) с риском прогрессирования заболевания, получили доступ к двум новым методам лечения. IgA-нефропатия - это иммуноопосредованное заболевание почек, при котором иммунные комплексы, содержащие иммуноглобулин A (IgA), накапливаются в почках. Это вызывает прогрессирующую потерю функции почек и может привести к почечной недостаточности. Сибепренлимаб (sibeprenlimab) под торговым наименованием Voyxact от Otsuka является первым в своем классе терапевтическим антителом, нацеленным на APRIL и подавляющим выработку IgA, таким образом снижаая протеинурию у пациентов. Новый одобренный атрасентан (atrasentan) под торговым наименованием Vanrafia от Novartis является антагонистом рецепторов эндотелина, снижающим клубочкое давление и воспаление в почках. Атацицепт (atacicept) от Vera Therapeutic, гибридный белок, ингибирующий BlyS и APRIL, в настоящее время находится на рассмотрении в FDA в качестве препарата для терапии IgA-нефропатии. Решение по препарату ожидается в 2026 году.
Некоммерческая генная терапия
CBER продолжает регистрировать новые одобрения генной терапии. В частности, впервые разрешение было получено некоммерческой организацией: фонд Fondazione Telethon ETS получил одобрение на этуветидиген аутотемцел (etuvetidigene autotemcel) под торговым наименованием Waskyra для лечения синдрома Вискотта-Олдрича (СВО). СВО — редкое генетическое заболевание, вызываемое мутацией в гене WAS, которое приводит к аномальному образованию тромбоцитов. Этуветидиген аутотемцел — ex vivo генная терапия, использующая лентивирусный вектор для добавления последовательности гена WAS в полученные от пациента гемопоэтические стволовые клетки, восстанавливая функцию тромбоцитов. Генетическая терапия возникла в 2010 году в результате партнерства между некоммерческой организацией Fondazione Telethon, Институтом генной терапии San Raffaele Telethon и GSK, и продемонстрировала устойчивую эффективность. Когда у GSK возникли затруднения с коммерциализацией генетической терапии, она передала лицензию экспериментального этуветидиген аутотемцел компании Orchard Therapeutics. Orchard передала лицензию Fondazione Telethon в 2022 году.
Fondazione Telethon будет работать с Orphan Therapeutics Accelerator, некоммерческой биотехнологической организацией, для обеспечения пациентов США доступом к генной терапии. Партнеры ожидают лечение менее 10 пациентов в год с помощью генной терапии в США. Переговоры о ценообразовании продолжаются. Сообщество генной терапии внимательно наблюдает за тем, как будет работать некоммерческая модель. «Как научный исследователь, я бы сказал, что недооценил бремя регистрации и поддержания препарата на рынке», — заявил Алессандро Айути, заместитель директора по клиническим исследованиям в Институте генной терапии San Raffaele Telethon Nature Reviews Drug Discovery. А.Айути сопровождал процесс регистрации генной терапии до получения одобрения.
Также FDA одобрило прадемаген замикерацел (prademagene zamikeracel) под торговым наименование Zevaskyn от Abeona Therapeutics, первый препарат генетической терапии на основе клеточных пластов для лечения тяжелого кожного заболевания. Прадемаген замикерацел создается из клеток кожи, взятых у пациентов путем биопсии, трансдуцированных ex vivo для переноса гена, кодирующего коллаген VII типа, а затем выращивается слой клеток размером с банковскую карту, который пересаживается на рану. Он одобрен для лечения рецессивного дистрофического буллезного эпидермолиза (ДБЭ), редкого генетического заболевания кожи, вызванного мутацией в гене, кодирующем коллаген VII типа. Пациенты, страдающие от данного заболевания, имеют хрупкую кожу, которая легко рвется и покрывается волдырями.
В 2023 году FDA одобрило беремаген геперпавек (beremagene geperpavec) под торговым наименованием Vyjuvek от Krystal Biotech – топическую, многократно вводимую генетическую терапию коллагеном VII типа, которая ускоряет заживление ран у пациентов с ДБЭ. Зопапоген имаденовек (zopapogene imadenovec) под торговым наименованием Papzimeos от Precigen является первым иммунотерапевтическим препаратом для редкого вирусного заболевания — рецидивирующего респираторного папилломатоза (РРП). РРП вызывается вирусом папилломы человека (ВПЧ) и приводит к появлению доброкачественных разрастаний в дыхательных путях. Зопапоген имаденовек состоит из нереплицирующегося вектора аденовируса гориллы, содержащего гены ВПЧ 6-го и ВПЧ 11-го типов, который запускает Т-клеточный ответ против ВПЧ для устранения разрастаний.
CBER также одобрил к применению две новых вакцины против COVID-19. Современная вакцина mNexspike, мРНК-вакцина нового поколения, использует в пять раз меньше мРНК на одну дозу по сравнению с Spikevax той же компании и кодирует только часть шиповидного белка. Аналитики прочат вакцине продажи свыше 3,2 млрд долларов.
Прозрачность в отношении отказов
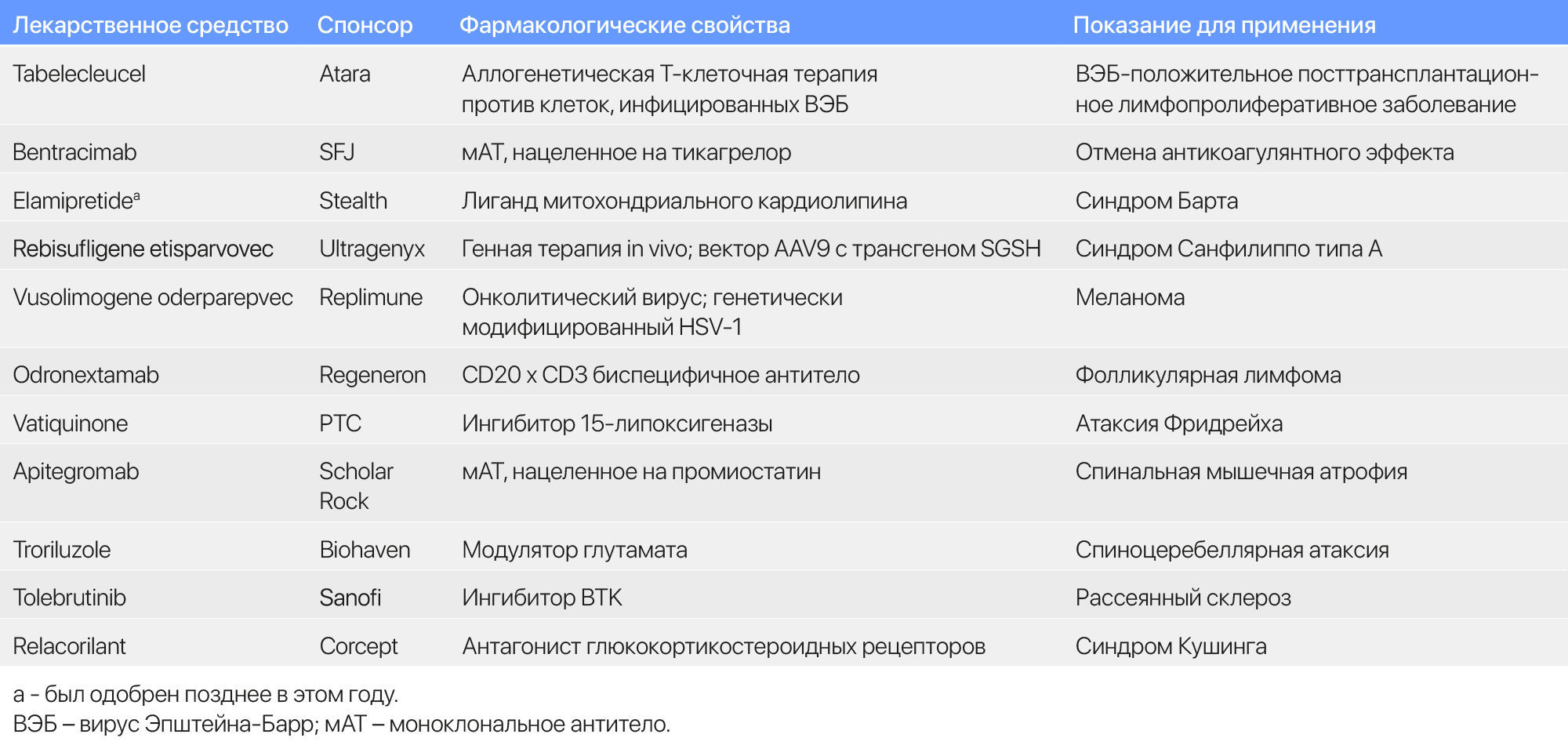
В рамках еще одного изменения политики FDA начало публиковать частично отредактированные завершающие ответные письма для отклоненных препаратов. По состоянию на 31 декабря, насчитывается 43 заявления, отклоненных в 2025 году, включая новые препараты (Таблица 3), дополнительные заявки, дженерики и биосимиляры, поданные на одобрение в CDER или CBER.
Таблица 3 | Избранные отклоненные препараты в 2025 году
Следующий год
В следующем году ожидается одобрение ряда новых лекарственных препаратов (Таблица 4).
Таблица 4 | Избранные одобрения, запланированные на 2026 год.
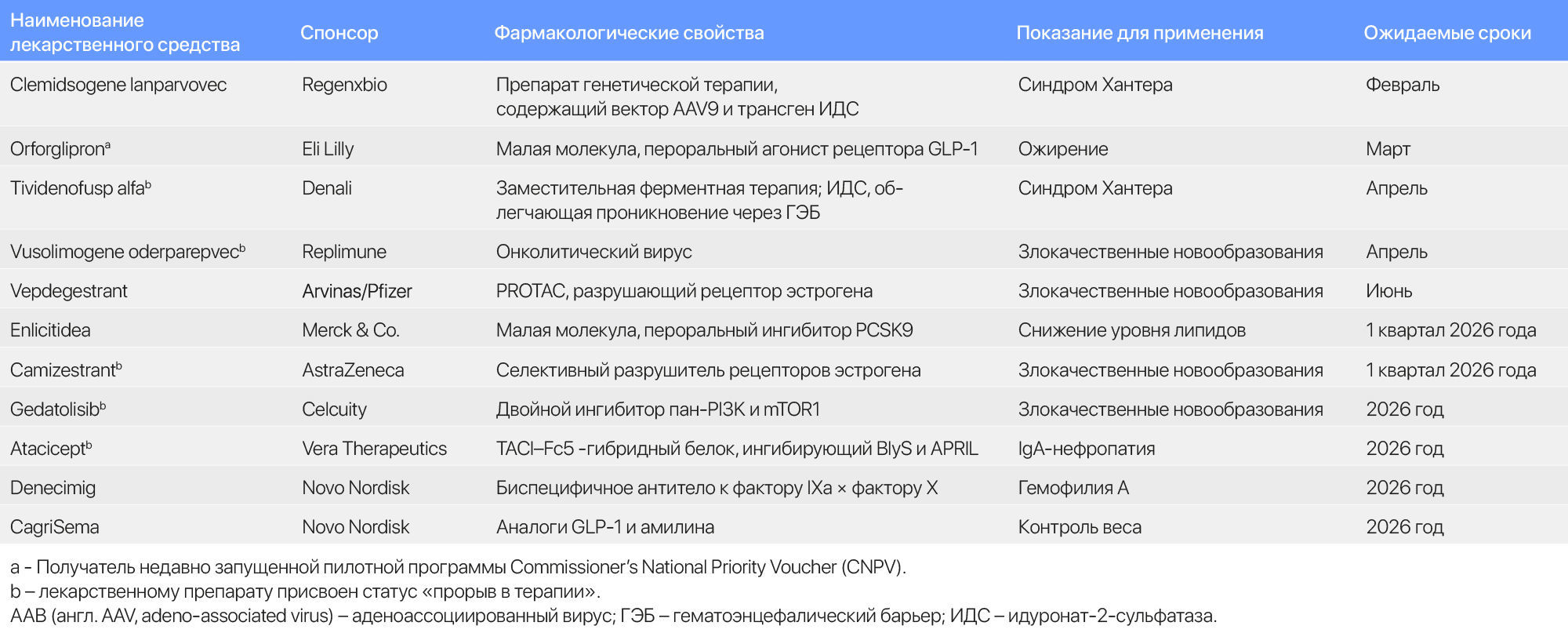
Вепдегестрант (vepdegestrant) от Arvinas и Pfizer – препарат, воздействующий направленно на эстрогеновые рецепторы, может стать первым таргетным белковым разрушителем, получившим одобрение FDA. FDA одобрило несколько селективных разрушителей эстрогеновых рецепторов (SERDs), которые вызывают конформационные изменения в рецепторе эстрогена, приводящие к его деструкции. Вепдегестрант представляет собой двухкомпонентную малую молекулу PROTAC, которая связывается с рецептором одной частью и с фрагментом протеосомного комплекса – другой частью, что запускает механизм разрушения. Однако в ходе клинических исследованиях было затруднительно дифференцировать эффект препарата от эффекта одобренного исследуемого SERD-препарата. Компании Arvinas и Pfizer стремятся получить регистрационное удостоверение на этот препарат, являющийся первым в новом направлении. В случае одобрения, вепдегестрант определенно подтвердит эффективность метода таргетного разрушения. Разработчики лекарственного препарата ожидают, что данный терапевтический метод и связанные с ним разрушители молекулярного клея помогут воздействовать на ранее «недоступные для лекарств» мишени.
Denali Therapeutics ожидает получение одобрение для своего тивиденофусп альфа (tividenofusp alfa) – препарата заместительной ферментной терапии для лечения синдрома Хантера. Идурсульфаза (idursulfase) (торговое наименование: Elaprase) от Takeda, заместительная ферментная терапия идуронат-2-сульфатазой (ИДС), была одобрена для терапии данного заболевания в 2006 году, но плохо проникала в мозг и не могла устранить неврологические симптомы, вызываемые заболеванием. Тивиденофусп альфа состоит из белка ИДС, слитого с Fc-фрагментом, который связывается с рецептором трансферрина и доставляет биологический препарат в ЦНС. Компания Regenxbio также может получить одобрение для своего клемидсогена ланпарвовека (clemidsogene lanparvovec) – препарата генной терапии для инъекционного введения в ЦНС для терапии синдрома Хантера.
Коррекция от 06 января 2026 года:
Торговые наименования Nuvaxovid и Mnexspike были скорректированы в Таблице 2.
Обновление от 08 января 2026 года:
Позднее в 2025 году датопотамаб дерукстекан получил дополнительное одобрение для терапии по показанию НМРЛ с наличием мутации EGFR. В связи с этим, текст был обновлен.
