Удивительные взаимодействия между мозгом и микробами кишечника
Почти год прошел с тех пор, как Ребекка Кникмайер впервые встретилась с участниками своего последнего исследования, посвященного развитию мозга. Кникмайер, нейробиолог из школы медицины в Чапел-Хилл Университета Северной Каролины, ожидает увидеть, как 30 новорожденных выросли в ползающих, любознательных годовалых деток, используя набор поведенческих испытаний и тестов на темперамент. В одном из испытаний мать ребенка может исчезнуть из комнаты, где проводится эксперимент, а затем снова появиться - с незнакомцем. Еще более усиливает его странность использование трещотки и некоторых хэллоуиновских масок, которые они надевают. Затем, если все пойдет хорошо, ребенок мирно засыпает, в то время как шумный аппарат МРТ сканирует его мозг.
"Мы стараемся быть готовы ко всему", говорит Кникмайер. "Мы точно знаем, что делать, если дети захотят прервать эксперимент".
Кникмайер рада рассмотреть в детях и кое-что еще - фекальную микрофлору: массив бактерий, вирусов и других микробов, населяющих их кишечник. Ее проект (в шутку называемый «исследование какашек») является частью малых, но постоянно растущих усилий неврологов, приложенных, чтобы увидеть, могут ли микробы, которые колонизируют кишечник в младенчестве, изменить развитие мозга.
Проект переходит в решающую стадию. Растущий объем данных, в основном полученных от животных, выращенных в условиях стерильности, показывает, что микробы в кишечнике влияют на поведение и могут изменить физиологию и нейрохимию мозга.
Данных, полученных от людей, меньше. Исследователи подметили связь между желудочно-кишечной патологией и психическими, а также неврологическими заболеваниями, такими как тревожность, депрессия, аутизм, шизофрения и нейродегенеративные расстройства, - но пока они ничем не подкреплены.
"Проблема причинности существенна в исследованиях микробиома в целом," говорит Роб Кнайт, микробиолог из Университета Калифорнии, Сан-Диего. "Очень трудно сказать, являются ли наблюдаемые вами микробные различия, связанные с заболеваниями, их причинами или последствиями." Есть много до сих пор не разрешенных вопросов. Начинают появляться догадки о механизмах, с помощью которых бактерии кишечника могут взаимодействовать с мозгом, но никто не знает, как важны эти процессы в развитии и здоровье человека.
Это не помешало некоторым компаниям в отрасли пищевых добавок утверждать, что пробиотики - бактерии, которые якобы помогают при проблемах с пищеварением, могут поддерживать эмоциональное благополучие. Фармацевтические фирмы, жаждущие новых путей в лечении неврологических расстройств, начинают вкладывать средства в исследования, связанные с кишечными микробами и молекулами веществ, которые они производят.
Ученые и спонсоры жаждут ясности. За последние два года Национальный институт психического здоровья (NiMH) в Bethesda, штат Мэриленд, профинансировал семь пилотных исследований бюджетом до $ 1 млн, чтобы изучить то, что назвали осью “микробиом-кишечник-мозг” (термин, введенный Кникмайер в одном из таких исследований). В этом году Управление военно-морских исследований США в Арлингтоне, штат Вирджиния, согласился выделить примерно US $ 14,5 млн в течение ближайших 6-7 лет на исследование, изучающее роль кишечника в когнитивных функциях и ответе организма на стресс. А Евросоюз вложил 9 миллионов € (US $ 10,1 млн) в пятилетний проект под названием MyNewGut (Мой Новый Кишечник), две основные цели которого - развитие мозга и расстройства его деятельности.
Последние разработки направлены выйти за рамки стандартных наблюдений и корреляций - но предварительные их результаты наводят на размышления. Исследователи начинают раскрывать огромную, разнообразную систему, в которой кишечные микробы влияют на мозг посредством гормонов, иммунных молекул и специализированных метаболитов, которые они производят.
"На данный момент у нас больше догадок, чем достоверных сведений," говорит Кникмайер. "Например, открыт вопрос о золотом стандарте методов, которые должны применяться. Это очень пристально исследуется сейчас».
Нутром чую
Микробы и мозг редко подозреваются во взаимодействии, за исключением случаев, когда патогены проникают через гематоэнцефалический барьер головного мозга - ячеистую крепость, защищающую мозг от инфекции и воспаления. Когда это происходит, возбудители могут оказывать очень сильное воздействие: например, вирус бешенства вызывает агрессию, возбуждение и даже боязнь воды. Но на протяжении десятилетий, свойства подавляющего большинства представителей естественного человеческого микробиома оставались в значительной степени неизвестными, и мысль, что они могут повлиять на нейробиологии едва ли считалась основной. Но ситуация постепенно меняется.
Исследования вспышек заболеваемости среди городских сообществ были одним из ключей к пониманию возможных связей. В 2000 году наводнение в канадском городе Уолкертон загрязнило городские источники питьевой воды такими патогенами, как кишечная палочка и Campylobacter jejuni. Около 2300 человек пострадали от тяжелой желудочно-кишечной инфекции, у многих из них в результате развился хронический синдром раздраженного кишечника (СРК).
Во время восьмилетнего исследования среди жителей Уолкертона, возглавляемого гастроэнтерологом Стивеном Коллинзом из Университета Мак-Мастер в Гамильтоне, Канада, исследователи заметили, что психологические проблемы, такие как депрессия и тревожность, казалось, были фактором риска развития хронического СРК. Пржемысл Берчик, другой гастроэнтеролог из Мак-Мастер, говорит, что такая взаимосвязь провоцирует интригующие вопросы. Могут ли психиатрические симптомы быть вызваны затяжным воспалением, или же мозг оказывается под ударом из-за инфицирования микробиомом?
Источник: журнал Nature
Группа из Мак-Мастерского университета стал искать ответы, исследуя мышей. В исследовании 2011 года команда пересаживала образцы микрофлоры кишечника между различными штаммами мышей и показала, что поведенческие черты, характерные для определенного штамма, передаются вместе с ней. Берчик рассказывает, например, что "относительно застенчивые" мыши будет демонстрировать более “исследовательское” поведение при пересадке им микробиоты стремящихся к приключениям мышей. "Мне кажется, это удивительно. Микробиота действительно определяет фенотип поведения хозяина. Разница очевидна," говорит Берчик. Неопубликованные исследования показывают, что выделенные от человека с СРК и тревожностью фекальные бактерии при пересадке мышам вызывает беспокойное поведение и у них, в то время как пересадка бактерий здоровых людей такого эффекта не дает.
Такие результаты могут быть встречены со скептицизмом. По мере развития данного поля деятельности, говорит Кнайт, микробиологам пришлось учиться у бихевиористов и узнавать, как содержание животных в неволе может повлиять на такие вещи, как социальная иерархия, стресс и даже микробиом.
Подобные эксперименты начинают с довольно неестественной модели: стерильных, освобожденных от бактерий - или "гнотобиотических" - мышей. Эти животные рождаются путем кесарева сечения, чтобы предотвратить обсеменение микробами при прохождении по родовым путям. Они выхаживаются внутри стерильных изоляторов, питаясь пищей, простерилизованной в автоклаве и дыша отфильтрованным воздухом. Животные, таким образом, избавлены от многих микробов, с которыми их виды развивались с самого зарождения.
В 2011 году, иммунолог Свен Петерсон и невролог Рошеллис Диас Хейтц, сотрудники Каролинского института в Стокгольме, показали, что в лабораторных тестах, “гнотобиотические” мышей демонстрировали менее тревожное поведение, чем мыши, колонизированные естественно присущими их виду бактериями. (Однако, меньшая тревожность в эволюционном аспекте не всегда хороша для мелких млекопитающих в среде со множеством хищников.)
Когда команда Каролинского университета изучила мозг животных, то обнаружила, что в одной из его областей, полосатом теле, у стерильных мышей происходил более высокий оборот основных нейрохимических соединений, ассоциированных с тревожным поведением, в том числе нейромедиатора серотонина. Исследование также показало, что помещением взрослых гнотобиотических мышей в обычные, нестерильные условия нормализовать их поведение не удалось, однако потомство таких “подопытных" мышей показало некоторое возвращение к нормальному поведению, что наводит на предположение о существовании временного критического окна, в течение которого микробы оказывают наиболее сильный эффект.
К этому времени многие исследователи были заинтригованы накапливающимися свидетельствами, но результаты эти были в основном получены из других областей, а не неврологии. "Группы, работающие над этим - прежде всего, группы исследователей кишечника при сотрудничестве с несколькими людьми, ориентированными на психологию" говорит Мелани Гаро, физиолог из университета Калифорнии в Дэвисе. "Поэтому их результаты, как правило, описывают периферийные и поведенческие изменения, а не изменения в центральной нервной системе."
Но Петерсон и работы Диаса Хайтца буквально наэлектризовали общественность, предположив, что исследователи могли пройти мимо наблюдательной феноменологии на пути изучения механизмов, влияющих на мозг. Нэнси Десмонд, член комитета по распределению грантов NIMH, говорит, что документ вызвал интерес у финансирующей организации вскоре после его публикации, а в 2013 году NIMH сформировал секцию исследований, посвященных нейронаукам, которая направлена на расшифровку механизмов функционирования и разработку лекарств или неинвазивных методов лечения психических расстройств.
Джудит Эйзен, нейробиолог из Университета штата Орегон в городе Юджин, получила грант на изучение гнотобиотических рыбок данио, прозрачность эмбрионов которых позволяет исследователям легко визуализировать развивающийся мозг. "Конечно, гнотобиотичность - полностью неестественная ситуация ", говорит Эйзен. "Но она дает возможность узнать, какие функции микробов важны для развития любого конкретного органа или типа клеток."
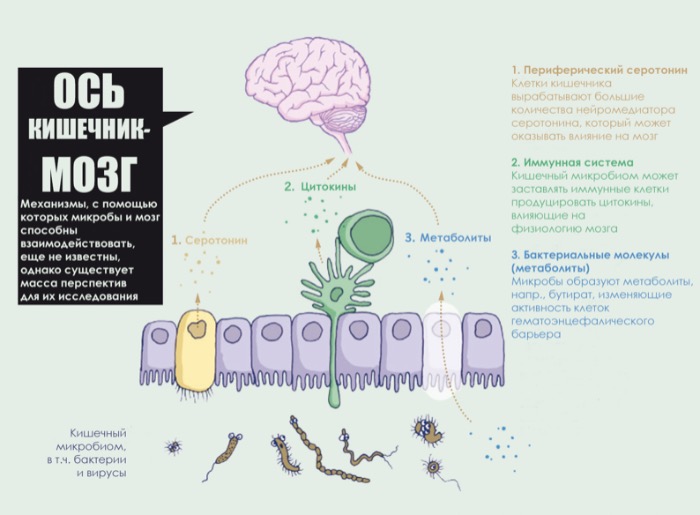
Между тем, исследователи начали расшифровывать способы, которыми бактерии кишечника могут подавать сигналы мозгу. Петерсон и другие показали, что у взрослых мышей микробные метаболиты влияют на основную физиологию гематоэнцефалического барьера. Кишечные микробы расщепляют сложные углеводы до короткоцепочечных жирных кислот с образованием массы эффектов: бутираты жирных кислот, например, укрепляют гематоэнцефалический барьер, “затягивая” соединения между клетками (см “Ось кишечник-мозг”).
Недавние исследования также показывают, что непосредственно кишечные микробы способны изменять уровни нейромедиаторов, которые могут позволить им взаимодействовать с нейронами. Например, Элейн Сяо, биолог, в настоящее время работающая в университете Калифорнии, в Лос-Анджелесе, в этом году опубликовала исследования того, как некоторые метаболиты, образуемые кишечным микробиомом, способствуют выработке серотонина в клетках, выстилающих толстую кишку - интригующий вывод, учитывая, что некоторые антидепрессанты работают, увеличивая высвобождение серотонина в нейрональных синапсах. Доля этих клеток в выработке периферического серотонина составляет 60% у мышей и более 90% в организме человека.
Как и группа Каролинского университета, Сяо обнаружила, что у гнотобиотических мышей уровень серотонина, циркулирующего в крови, значительно меньше, а также доказала, что уровни могут быть восстановлены путем введения в кишечник мышей спорообразующих (анаэробных) бактерий (преимущественно клостридий, расщепляющих короткоцепочечные жирные кислоты). И наоборот, у мышей с естественной микрофлорой после приема антибиотиков естественная выработка серотонина снизилась. "По крайней мере, после этих манипуляций стало совершенно точно понятно, что причинно-следственная связь есть", говорит Сяо.
Но остается неясным, вызваны ли эти изменения уровней серотонина в кишечнике каскадом молекулярных событий, которые в свою очередь влияют на мозговую деятельность, а также - происходят ли подобные вещи с людьми. "Это открытие будет иметь важное значение для повторения предыдущих выводов и перенесения этих данных на людей, чтобы действительно зафиксировать их в учебниках," говорит Сяо.
У Джона Крайана, невролога из Университетского колледжа Корка в Ирландии, уже мало сомнений в том, что это произойдет. Его лаборатория продемонстрировала, что у взрослых гнотобиотических мышей в определенной области мозга формируется больше нейронов, чем у обычных мышей. Он “рекламирует” ось “кишечник-мозг” среди неврологов, разработчиков психоактивных лекарств и общественности. "Если вы посмотрите с точки зрения отрасли неврологии, возникшей всего лишь год назад, все основные процессы, на изучение которых неврологи тратят жизнь, регулируются микробами, и теперь это доказано," говорит он, ссылаясь на исследования регуляции гематоэнцефалического барьера, нейрогенеза у мышей и активации микроглии, иммуноподобных клеток, находящихся в головном и спинном мозге.
На заседании Неврологического Общества-2015 в Чикаго, штат Иллинойс, в этом месяце, Крайан и его коллеги планируют представить исследования, показывающие, что миелинизация - формирование жировой оболочки, которая изолирует нервные волокна - также может происходить под влиянием кишечных микробов, по крайней мере, в конкретных областях мозга. Несвязанная работа показала, что мыши-гнотобиоты защищены от экспериментально индуцированных состояний, имитирующих рассеянный склероз, который характеризуется демиелинизацией нервных волокон. По крайней мере одна компания, Symbiotix Biotherapies в Бостоне, штат Массачусетс, уже иссследует, продуцируется ли каким-либо видом бактерий кишечника некий метаболит, способный однажды остановить развитие нарушений у людей с рассеянным склерозом.
Трейси Бейл, невролог из Университета Пенсильвании в Филадельфии, полагает, что простые эксперименты на людях могут уже быть оправданы. Бэйл наслышана о работе Крайана на радио над передачей Radiolab три года назад.
В то время она исследовала плаценту, но заинтересовалась, как влияние микробов может вписаться в ее теорию о том, что стресс матери затрагивает и потомство.
В исследовании, опубликованном в этом году, Бэйл подвергала беременных мышей стрессовой стимуляции. Она обнаружила, что стресс заметно уменьшает уровень присутствующих во влагалище мышей лактобактерий, которые, в свою очередь - основной источник микробов, колонизирующих кишечник потомства. Эти микробные сдвиги переносятся на потомство, произведенное через естественные родовые пути. Также Бэйл были обнаружены признаки того, что микрофлора может повлиять на развитие нервной системы, особенно у особей мужского пола.
В работе, которую ее группа планирует представить на заседании Неврологического Общества, Бэйл показывает, что путем занесения вагинальной микрофлоры от подвергнутых стрессу мышей новорожденным (путем кесарева сечения) мышкам можно вызвать те же эффекты влияния на развитие нервной системы, что имела находящаяся в напряжении мышь-мать. Теперь Бэйл и ее коллеги пытаются выяснить, можно ли лечить мышей, рожденных от подвергнутых стрессу матерей, пересаживая им вагинальную микрофлору особей, находившихся в покое.
Эта работа, говорит Бэйл, имеет “непрерывно нарастающие эффекты". Она ссылается на проект во главе с Марией Белло Домингес - микробиологом Медицинского факультета Нью-Йоркского университета, в котором детям, рожденным с помощью кесарева сечения, наносят марлей в рот и на кожу флору, взятую из влагалища матерей. Ее команда хочет узнать, аналогична ли будет микробиота этих детей той, что присутствует у детей, рожденных естественным путем. "Пока такая манипуляция не входит в стандарт медицинской помощи", рассказывает Бэйл, "но, уверяю вас, однажды она станет таковой."
Многие до сих пор скептически относятся к связи между микроорганизмами и поведением, а также не уверены в том, что она важна для здоровья человека - но теперь ученые, кажется, более склонны к развитию этой идей, чем раньше. Например, в 2007 году, Фрэнсис Коллинз, в настоящее время директор американского Национального института здоровья, предположил, что проект “Микробиом Человека”, масштабное исследование микробов, которые колонизируют наш организм, может помочь разгадать причину расстройств психического здоровья. "Это удивило несколько человек, с которыми мы говорили о вещах, имеющих отношение более к кишечнику, чем к мозгу", говорит Коллинз. "Эта идея была немного сенсационной, но тем не менее, предварительно получила поддержку."
Финансирующие учреждения поддерживают новую область, которая охватывает иммунологию, микробиологию и неврологию, более других дисциплин. NiMH предложил предоставить начальное финансирование работ на моделях, а также на добровольцах, чтобы понять, стоит ли исследовать эту область далее, внося значительные инвестиции. Это шаг, который уже привлек в лоно данной дисциплины массу исследователей. Проект MyNewGut в Европе еще более оптимистично оценивает значение таких исследований, в частности, ищет конкретные диетические рекомендации, которые могли бы облегчить симптомы расстройств, связанных с деятельностью мозга.
Сегодня проект Кникмайер с участием детей представляет то, что она называет "беспорядочным исследованием при участии любого желающего". Среди областей мозга, которые сканирует Кникмайер, наибольший интерес вызывают миндалина и префронтальная кора; обе они были затронуты проведением манипуляций с микрофлорой в эксперименте на грызунах. Но равнять эти данные вместе с десятками других, полученных от детей, будет проблематично, полагает она. "Большой вопрос состоит в том, как вы справляетесь со всеми побочными факторами." Диеты детей, домашние, живущие рядом, и другие экологические риски - все может повлиять на их микрофлору и неврологическое развитие, и должны быть устранены.
Кникмайер предполагает, что попытки использовать микробиом кишечника человека для лечения расстройств психического здоровья могут провалиться по другим причинам. Рассмотрим, к примеру, как микробы могут взаимодействовать с геномом человека. Даже если ученые найдут терапевтический вариант «золотого стандарта микробиоты", замечает она, «может быть, ваш организм отторгнет его и вернется к базовой версии, потому что ваши собственные гены благоволят определенным видам бактерий". Еще слишком многое не разгадано, считает Кникмайер. "Я всегда удивляюсь. Это большие открытия. Нечто похожее на Дикий Запад, столь же необычное и неизведанное."
